Method Article
Toksin İndüksiyon ve Protein Ekstraksiyonu Fusarium Spp. Kültürler
Özet
Protein ekstraksiyonu mantar türlerinde proteomik analizleri için en az bir proteomik deney (MIAPE) kuralları hakkında bilgi göre, başarılı olmak için standardizasyon yüksek düzeyde gerektirir. Biz toksin indüksiyon ve protein izolasyonu sırasında deneysel önyargı en aza indirmek için bir prosedür içeren bir video protokol mevcut Fusarium spp.
Özet
Fusaria farklı toksinler üretebiliriz ipliksi mantarlar. Fusarium mikotoksinler deoksinivalenol, nivalenol, T2, zearelenone, fusaric asit, moniliformin, vb gibi .. insan hem de hayvan sağlığı üzerindeki olumsuz etkileri ve bazı patojenite faktörleri olarak kabul edilmektedir. Proteomik çalışmalar Fusaria potansiyel patojenik faktörler (Kağıt ve diğerleri, 2007, Houterman ve ark, 2007) tanımlamak için toksin üretimi mekanizmaları (Taylor ve ark, 2008) yanı sıra çözmekte etkili olduğunu gösterdi. Bu nedenle, protein ekspresyonu deneyler, zorlama ve laboratuarlar arasındaki gerçek farklar bulundu güvenmek için proteomik çalışmalar arasında bir karşılaştırma için güvenilir yöntemler kurmak için temel haline gelir. Açıklanacaktır işlemi iki şekilde proteomik prosedürlerin standartlaştırılması artan bir düzeyde katkıda bulunmalıdır. Filme protokol tam olarak tarif edilebilir ayrıntıları seviyesini artırmak için kullanılır. Ayrıca, biyolojik bir süreç standart prosedürlerin mevcut ekstraksiyon prosedürü teknik tekrarlanabilirlik içinde insan faktörü de dikkate alınarak, daha yüksek bir veri sağlamlığı garanti çoğaltır.
Kültürler ve protein ekstraksiyonu (Şekil 1) için iki gün için ondört gün açıklanan protokol, onun tamamlanması için 16 gün gerektirir.
Kısaca, Fusarium suşları 4 gün boyunca katı ortam üzerinde yetişen, daha sonra el ile parçalanmış ve 10 gün boyunca, modifiye edilmiş bir toksin indükleyici medya (Jiao ve ark, 2008). aktarılır. Miselyum Miracloth bir katmanı sayesinde filtrasyon ile toplanır. Taşlama soğuk bir odasında yapılır. Farklı operatörler çıkarma yapılan teknik farklılıkları (Şekil 2) nedeniyle önyargı dikkate almak için (n = 3) çoğaltır. Ekstraksiyon Taylor ve ark açıklandığı gibi bir SDS / DTT tampon dayalı. (2008) hafif değişiklikler. Toplam protein izolasyonu Aseton / TCA / DTT tampon gecelik ve DTT / Aseton yıkama (Şekil 3a, 3b) kullanarak proteinlerin bir yağış süreci gerektiriyordu. Proteinler sonunda, protein etiketleme tampon resolubilized ve ölçüldü. Ekstraksiyon Sonuçları 2D jeller (IEF / SDS-PAGE) geçmeden önce, bir 1D jel (Şekil 4, SDS-PAGE) görüntülendi. Aynı prosedür, büyüyen diğer medya ve diğer ipliksi mantarlar (Miles ve ark, 2007) proteomik analizler için uygulanabilir .
Protokol
Protokol, tamamlanması için 16 gün gereklidir. Zaman diliminde Şekil 1'de ayrıntılı olarak verilmiştir.
Ayrıntılar tampon hazırlık
- Lizis tamponu (örnek başına 3ml) hazırlanması.
- Yıkama tamponu (örnek başına 50ml) hazırlanması. Bu tampon önceden soğutulmuş ve saklanan derin dondurucuda -20 ° C'de daha fazla analiz kadar ve tüm prosedürü sırasında buz üzerinde tutulmalıdır olmalıdır.
- Yağış tamponu (örnek başına 20ml) hazırlanması. Bu tampon, bütün prosedür sırasında gerekli ve buz üzerinde tutulmalıdır kadar derin dondurucuda -20 ° C'de önceden soğutulmuş ve saklanan olmalıdır.
- 4 iş tercihen soğuk odasına yürütülen olmalıdır ° C
Mantar türlerinin
Proteomik analizleri için kullanılan üç tür morfolojik özellikleri ve Çeviri uzama faktörü Alpha-1 analizi temelinde Fusarium graminearum sınıflandırıldı (O'Donnell ve ark, 1998)
Bu suşlar CRP-Gabriel Lippmann koleksiyonuna aitti ve korunur ve muhafaza edildi - 80 ° C 15% gliserol.
Miseller, hazırlanması
Mantarlar V8 25 ° C ışık ve karanlık bir dönem değişen her 12 saat, 4 gün boyunca yetiştirildi. Kültürler, steril bir bıçak ve bu kültürlerin adet 100 ml toksin tetikleyen medya içeren 250 ml Erlenmeyer şişeler aşılamak için kullanılmıştır kullanarak parçalandı. Miçel 10 gün sonra hasat edildi ve steril bir filtre ile kültür filtre ederek ortamdan ayrıldı. Miçel orta artıkları ve diğer bileşikler kaldırmak için steril su ile 3 kez yıkandı. Daha sonra hücrelerin sıvı azot ekleyerek hemen dondu ve -80 örnekleri tuttu ° C
Protein ekstraksiyon Genel açıklama
Protein örnekleri rakam 3A ve 3B açıklanan yöntem kullanılarak çıkarıldı. Fusarium örnekleri, sıvı azot zemin ve, toz, 10 ml teflon tüpler toplandı. Örnekler daha sonra lizis tamponu ile 30 dakika inkübe 10 dakika kaynatılır ve oda sıcaklığında (15 dakika için 12000g) 2 kez santrifüj edildi. Süpernatantlar -20 ° C'de bir gece yağış tamponu ile toplanır ve inkübe edildi. 4 ° C 30000g santrifüj sonrasında 45 dakika, çöktürülmüş proteinlerin pelet DTT içeren soğuk aseton ile 3 kez yıkandı. Son olarak, pelet hava kuru ve proteinlerin pH 8 'e ayarlayarak, etiketleme tampon resolubilized edildi. 30 ml'lik bir alt-örneklem total protein ölçümü için çıkarıldı ve kalan süpernatant protein elektroforezi kadar -20 ° C'de saklanır.

Şekil 1 prosedürü Timeline.
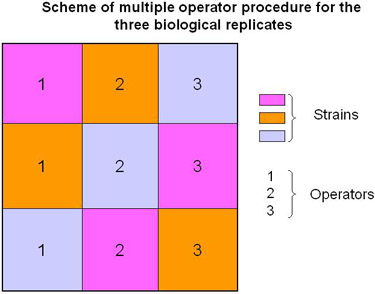
Şekil 2 birden fazla operatör örnek işleme Programı.

Şekil 3a. 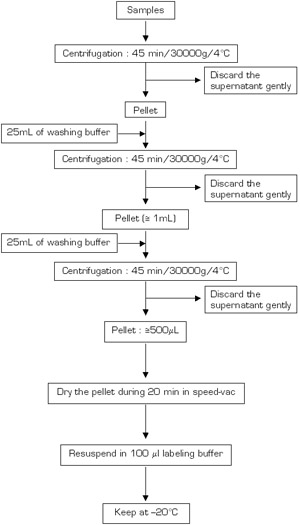
Şekil 3b. Lütfen buraya tıklayın daha büyük bir rakam 3a sürümünü ya da görmek için buraya , daha büyük bir rakam 3b versiyonu için .
Şekil 3a-b protein ekstraksiyon prosedürü Akış şemaları (A: ilk gün; B: ikinci gününde).
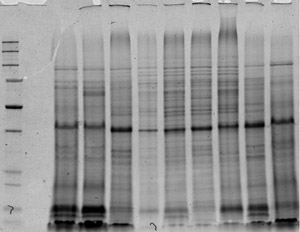
Şekil 4 protein özleri 1D resim. Proteinler lav Purple ile boyandı jel sonuna kadar mavi tam göç kadar çalıştırmak. Lütfen Şekil 4 büyük halini görmek için buraya tıklayın .
Tartışmalar
Mantar biyoloji etki alanı içinde proteomik yaklaşımlar son zamanlarda ilgi, bu tekniği kullanarak (as Kim ve ark, 2007 gözden) yayınların sayısının artmasına yol açtı . Protein ekstraksiyon yöntemleri çıkarma prosedürlerinin kombinasyonu güveniyor; genellikle pek metodolojik bölümlerde açıklanan ve potansiyel sorun giderme yöntemleri ile ilgili uzmanlık gerektirir.
, Örnek ve veri işleme için standartları belirleyen diğer "omics" yaklaşımlar, güvenilir bilimsel bilgi üretmek için esastır. Ayrıca manipülasyon örnekleri ve prosedürleri farklı "omics" deneyler sonucu yorumlama arasında paylaşılan izin vermek için yeterince tarif edilmelidir. Bu tamamen genomik, proteomik, metabolomik, çapraz veri madenciliği potansiyellik istismar için gerekli olacaktır ... (Morrison ve ark, 2006). Proteomik bir denemeyle ilgili asgari bilgileri bir denemenin bütün yönleriyle (Jel elektroforezi, Kütle Spektroskopisi, Moleküler Etkileşimler, Protein Değişiklikler, Proteomik Bilişim, Örnek İşleme) mücadele amacıyla hazırlanmıştır ve çalışma grupları kurulmuştur. Şu anda herhangi bir tanımlı bilgilerle örnek işleme prosedürleri mevcuttur. (Taylor ve ark, 2007) MIAPE kurallar çerçevesinde standardizasyon artırabilir prosedürleri uygulamak için, proteomik çalışmalar son kalitesini belirleyen protein çıkarma prosedürlerinin önemi göz önüne alındığında, biz örnek ayrıntılı bir video protokol önerdi işleme. Deneylerin video tanımı "omics" deneyler (Pasquali 2007) daha iyi tekrarlanabilirlik neden olabilir numune işleme hakkında bilgi sayısını artırmak için önemli ölçüde katkıda bulunabilir.
Gerçekten de, laboratuvarlar boyunca tekrarlanabilirliği proteomik sonuçları (http://www.fixingproteomics.org) geçerliliğini garanti altına almak için temel bir gerekliliktir. Farklı instrumentations ve farklı operatörler örnekleri manipüle: çapraz laboratuvar tekrarlanabilirliği iki faktör tarafından etkilenmektedir.
Açıklanan protokol, biz gerçekleştirmek için teklif biyolojik veriler (yani sonuçların teknik değişimi dikkate alınır) güvenilirliğini artırmak için birden fazla operatörleri (Şekil 2 ve video) içeren çoğaltır.
Protein ekstraksiyonu için açıklanan prosedür SDS ve ısıtma dayanmaktadır. Bu proteinlerin iyi bir saflık ve miktar (Bridge 1996), daha önce garanti gösterildi. SDS kaynatılarak ile birleştiğinde hücre duvarları, hidrofobik proteinler çözünür ve proteinlerin iptal yağış oligomerler oluşumunu önler. Kaynama proteazların inaktivasyonu da sağlar. Aynı etki, EDTA, PMSF ve tam mini proteaz inhibitörü tarafından da üretilir. DTT ve protein çözünmüş kolaylaştırılması proteinler arasındaki disülfit köprüleri kaldırır.
IEF önce SDS kaldırmak için, proteinler, aseton / TCA / DTT çöktürülür. Ayrıca, bu bileşiklerin mevcut olduğunda, yağlar, nükleik asitler, tuzlar veya / ve fenolik bileşikler gibi bazı yabancı maddelerden kaldırarak aseton / TCA / DTT yağış sağlar. SDS gibi, bu molekülleri IEF sırasında iyi bir göçü önlemek. Bu yağış sonrasında, IEF ile müdahale gibi TCA kaldırmak için aseton / DTT, çöktürülmüş proteinleri yıkamak için gereklidir.
İyi bir numune hazırlama, iyi sonuçlar için bir anahtardır. Bunun için, çevre proteinlerin toz ücretsiz eldiven ile çalışan ve iyi laboratuvar uygulamalarına saygı kirlenmesini önlemek için de gereklidir. Teknik açıdan, açıklanan protokol dahilinde, iki aşamada proteinlerin yeterli miktarda ve saflık elde etmek için en kritik adımlar. İlk olarak, öğütme hücrenin tam imha proteinler serbest bırakmak için temel aşaması ve ikinci, toplam proteinlerin saflaştırılması, lipid, DNA ve proteinlerin göç ile parazite neden olabilecek diğer kirleticiler çoğunluğu kaldırılması kapsayan bir faz.
Teşekkürler
Servane Contal ve Boris Untereiner Biz kendi teknik katkılarından dolayı teşekkür ederim. Biz FNR "FUTOX" projesi destek kabul etmiş sayılırsınız.
Malzemeler
Medya ve çözümler
PDA: 39 g Patates Dekstroz Agar (Difco), 1 L distile su.
V8 Agar: 200 ml V8 (Campbell, ABD), 2g CaCO3 (Sigma), 16g Agar (Difco), 800 ml distile su
Toksin indükleyici medya: 1g K 2 HPO 4, KCl 0.5g, 0.5g MgSO 4 7H 2 O, 10 mg FeEDTA, 2g L glutamik asit, distile su 1L 10g sakaroz.
Lizis Tampon:
| 100 mL | Final konsantrasyonu | ||
| Tris-HCL pH8 | 5ml | 50mm | 1M |
| SDS | 2G veya 10ml | % 2 | % 20 |
| DTT | 500ml | 10mM | 2M |
| EDTA | 20ml | 0.1mm | 0.5M |
| PMSF | 200ml | ||
| Komple mini proteaz inhibitörü | 1 tablet | ||
| Su | QSP |
Yağış Tampon:
| 100 mL | Final konsantrasyonu | |
| TCA | 20ml | % 20 |
| DTT | 0.1ml | % 0.1 |
| Aseton | QSP |
Tampon Yıkama:
| 100 mL | Final konsantrasyonu | |
| DTT | 0.1ml | % 0.1 |
| Aseton | 100 mL |
Etiketleme Tampon (-18 ° C küçük alikotları mağaza):
| 1mL | Final konsantrasyonu | |
| Üre | 140 mg | 7M |
| Tiyoüre | 50 mg | 2M |
| Chaps | 40 mg | % 4 |
| Tris | 30 mcL | 30 mm |
| Su | 1 ml |
Referanslar
- Bridge, P. Protein Extraction from Fungi. Protein Purification Protocols. , 39-48 (1996).
- Jiao, F. Effects of different carbon sources on trichothecene production and Tri gene expression by Fusarium graminearum in liquid culture. FEMS Microbiol Lett. 285, 212-219 (2008).
- Kim, Y. Proteomics of filamentous fungi. Trends in Biotechnology. 25, 395-400 (2007).
- Milles, J. Development of a proteomic approach to monitor protein synthesis in mycotoxin producing moulds. Mycotoxin Res. 23, 161-165 (2007).
- Morrison, N., Field, D. Concept of sample in OMICS technology. OMICS. 10, 127-137 (2006).
- O'Donnell, K., Kistler, H. C., Cigelnik, E., Ploetz, R. C. Multiple evolutionary origins of the fungus causing Panama disease of banana: Concordant evidence from nuclear and mitochondrial gene genealogies. PNAS. 95, 2044-2049 (1998).
- Paper, J. M. Comparative proteomics of extracellular proteins in vitro and in planta from the pathogenic fungus Fusarium graminearum. Proteomics. 7, 3171-3183 (2007).
- Pasquali, M. Video in science. Protocol videos: the implications for research and society. EMBO Rep. 8, 712-716 (2007).
- Taylor, C. F. The minimum information about a proteomics experiment (MIAPE). Nat Biotechnol. 25, 887-893 (2007).
- Taylor, R. D. Proteomic analyses of Fusarium graminearum grown under mycotoxin-inducing conditions. Proteomics. 8, 2256-2265 (2008).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır