需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
酶标菜生物膜形成实验
摘要
实验描述了一个迅速的手段来衡量早期形成生物膜的细菌和真菌。此方法使用一个微孔板,微生物形成生物膜的基质和生物膜是可视化,使用龙胆紫应变。检测提供了一个定性或定量检测早期生物膜的形成。
摘要
生物膜是微生物附着在表面的社区,可以在医疗,工业和自然设置。事实上,在生物膜的生活可能是占主导地位的增长模式在大多数环境中的微生物。成熟的生物膜有几个鲜明的特点。生物膜的微生物通常是由细胞外基质结构和保护社会包围。生长在生物膜的微生物也有一个特点,体系结构,一般周围充满液体的渠道macrocolonies(包含数千个细胞)组成。生物膜生长的微生物也臭名昭著的临床相关抗生素的抗菌药物,包括他们的抵抗。
酶标盘实验是一种生物膜形成的早期阶段研究的重要工具,并已应用于主要为细菌生物膜的研究,虽然这个实验也已用于研究真菌生物膜的形成。因为这个实验中使用静态的,批量的生长条件,它不允许通常与流通池系统的成熟生物膜的形成。然而,法已查明生物膜形成的启动(即鞭毛,纤毛,黏附,参与循环DI - GMP约束力和代谢酶)所需因素很多的有效和胞外多糖生产有关的基因。此外,已发表的作品表明,酶标菜生长的生物膜发展成熟的生物膜的一些性质,这种抗生素的耐受性和抗免疫系统效应。
这个简单的酶标菜分析允许在墙壁上和/或一个微量滴定盘的底部形成生物膜。检测的高通量的性质使得它有用的遗传筛选,以及测试在不同生长条件下的多株生物膜的形成。这个实验的变种已被用于评估早期形成生物膜的微生物种类繁多,包括但不限于, 霍乱弧菌 ,假单胞菌,大肠杆菌,staphylocci,肠球菌, 分枝杆菌和真菌。
在这里描述的协议,我们将重点对使用这种检测研究的模式生物绿脓杆菌生物膜形成。在这个实验中,生物膜形成的程度是衡量使用的染料结晶紫(CV)的。然而,一些其他的色度和代谢污渍已报告使用微孔板检测的形成生物膜的量化。微孔板分析的方便,成本低和灵活性,它为研究生物膜的重要工具。
研究方案
1。种植生物膜
- 增长的野生型绿脓杆菌或在夜间(即LB)突变株,在丰富的媒体文化
- 在夜间文化1:100稀释成生物膜检测的新鲜培养基。一个标准的生物膜 P.检测介质绿脓杆菌是M63培养基用硫酸镁,葡萄糖和casamino氨基酸(见表)为辅。作为一种替代生物膜促进中等刺激浮游增长和更强大的生物膜,葡萄糖和casamino氨基酸,可取代精氨酸作为唯一的碳源和能源。
- 在96孔盘添加稀释,每孔100μL。对于定量分析,我们通常使用每次治疗4-8复制井。
- 微孔板孵育4-24小时,在37 ° C。
2。染色的生物膜
- 孵化后,转储,车削板,摇出液体中的细胞。
- 轻轻淹没在小脚盆的水(即板,使用P1000的浴缸pipetmen枪头盒的底部)。摇出的水。第二次重复这一过程。此步骤有助于消除独立的细胞和媒体组件,可以在下一步染色,并显着降低背景染色。
- 加入125μL的0.1%的溶液结晶紫水,每孔微孔板。使解决方案的同时,戴上手套和白大褂。称量时的CV粉吸湿性和容易污渍的衣物,皮肤,等使用注意事项
- 微孔板在室温下孵育10-15分钟。
- 正如上文所述,在浴缸的水淹没冲洗水盘的3-4倍,摇出大力印迹上的一摞纸巾,摆脱所有多余的细胞和染料的板。
- 关闭微孔板倒挂干几个小时或过夜。
- 进行定性检测,井干燥时,可以拍到。
3。生物膜的量化
- 每孔微孔板,加入125μL30%乙酸在水中溶解的CV。
- 微孔板在室温下孵育10-15分钟。
- 125μL溶解的简历转移到一个新的平底微量滴定盘。
- 量化酶标仪在550纳米,使用30%醋酸水作为空白吸光度。
4。代表性的成果:
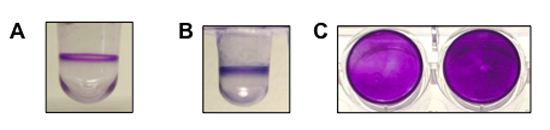
图1显示了一个代表性的结果,形成生物膜铜绿假单胞菌,荧光假单胞菌和金黄色葡萄球菌进行检测。 (A)以及绿脓杆菌的生物膜(8小时,37℃)的侧视图。 (B)以及一个体育生物膜侧视图荧光 (6小时,30℃)。 (三)一个自上而下的生物膜形成由S.体育在一个平底的微孔板黄色葡萄球菌(两口井,24小时,37℃ )。 假单胞菌和页荧光都是能动的有机体,并形成生物膜在气-液界面。金黄色葡萄球菌是不活动和井底形成生物膜。
讨论
这种方法可以修改使用各种各样的微生物物种。运动型微生物通常坚持的墙壁和/或井底部,同时非能动的微生物通常坚持井底部。形成生物膜(即生长介质,温度,培养时间)的最佳条件,必须为每个微生物凭经验确定。我建议执行多个复制每一株或条件(4-8),包括阳性对照,如果可能的话,每块板的阴性对照。
披露声明
致谢
我要感谢雪利酒库奇马,皮特 - 纽厄尔和罗伯特提供的图像如图1小腿。这项工作是支持由美国国立卫生研究院授予R01AI083256高
材料
| Name | Company | Catalog Number | Comments |
| 1 X M63 | Prepare as a 5X M63 stock by dissolving 15g KH2PO4, 35g K2HPO4 and 10g (NH4)2SO4 in 1 L of water. This stock d–s not need to be autoclaved and can be stored at room temperature. Dilute 5X stock 1:5, autoclave, cool, then add the desired components. | ||
| KH2PO4 | Fisher Scientific | P285-500 | |
| K2HPO4 | Fisher Scientific | P288-500 | |
| (NH4)2SO4 | Sigma-Aldrich | A5132 | |
| Magnesium sulfate | Fisher Scientific | M63-500 | Add to 1 mM final concentration. Prepare as a 1 M stock in water and autoclave. |
| Glucose | Fisher Scientific | D16-3 | Add to 0.2% final concentration. Prepare as a 20% stock in water and autoclave. |
| Casamino acids | BD Biosciences | 223050 | Add to 0.5% final concentration. Prepare as a 20% stock in water and autoclave. |
| Arginine | Sigma-Aldrich | A5131 | Add to 0.4% final concentration. Prepare as a 20% stock in water and filter sterilize. This alternative carbon/energy source can replace glucose and casamino acids |
| Microtiter plates | BD Biosciences | 353911 | Falcon 3911, Microtest III, Flexible assay plates, 96 well, U-bottom, non-sterile, non-tissue-culture treated. |
| Microtiter plate lids | BD Biosciences | 353913 | The lids can be reused by cleaning with 95% ethanol in water. |
| Crystal violet | Sigma-Aldrich | 229641000 | Prepare as a 0.1% solution in water. |
参考文献
- O'Toole, G. A., Kolter, R. Initiation of biofilm formation in Pseudomonas fluorescens WCS365 proceeds via multiple, convergent signalling pathways: a genetic analysis. Mol. Microbiol. 28, 449-461 (1998).
- O'Toole, G. A., Doyle, R. J. . Methods in Enzymology. , 91-109 (1999).
- Mah, T. F. A genetic basis for Pseudomonas aeruginosa biofilm antibiotic resistance. Nature. 426, 306-310 (2003).
- Kuchma, S. L., Connolly, J. P., O'Toole, G. A. A three-component regulatory system regulates biofilm maturation and type III secretion in Pseudomonas aeruginosa. J Bacteriol. 187, 1441-1454 (2005).
- Caiazza, N. C., O'Toole, G. A. SadB is required for the transition from reversible to irreversible attachment during biofilm formation by Pseudomonas aeruginosa PA14. J Bacteriol. 186, 4476-4485 (2004).
- Shanks, R. M., Sargent, J. L., Martinez, R. M., Graber, M. L., O'Toole, G. A. Catheter lock solutions influence staphylococcal biofilm formation on abiotic surfaces. Nephrol Dial Transplant. 21, 2247-2255 (2006).
- Caiazza, N. C., Merritt, J. H., Brothers, K. M., O'Toole, G. A. Inverse regulation of biofilm formation and swarming motility by Pseudomonas aeruginosa PA14. J. Bacteriol. 189, 3603-3612 (2007).
- Hinsa, S. M., Espinosa-Urgel, M., Ramos, J. L., O'Toole, G. A. Transition from reversible to irreversible attachment during biofilm formation by Pseudomonas fluorescens WCS365 requires an ABC transporter and a large secreted protein. Mol Microbiol. 49, 905-918 (2003).
- Mack, D. Characterization of transposon mutants of biofilm-producing Staphylococcus epidermidis impaired in the accumulative phase of biofilm production: genetic identification of a hexosamine-containing polysaccharide intracellular adhesin. Infect. Immun. 62, 3244-3253 (1994).
- Vidal, O. Isolation of an Escherichia coli K-12 mutant strain able to form biofilms on inert surfaces: involvement of a new ompR allele that increases curli expression. J. Bacteriol. 180, 2442-2449 (1998).
- Junker, L. M., Clardy, J. High-throughput screens for small-molecule inhibitors of Pseudomonas aeruginosa biofilm development. Antimicrob Agents Chemother. 51, 3582-3590 (2007).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。