A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
Biofilm microtiter תבשיל גיבוש Assay
In This Article
Summary
Assay מתאר אמצעי מהיר למדוד היווצרות biofilm מוקדם חיידקים ופטריות. שיטה זו משתמשת צלחת microtiter כמו לתשתית להיווצרות חיידקים biofilm ו biofilm היא דמיינו באמצעות סגול זן קריסטל. Assay מספק גם assay איכותי או כמותי ליצירת biofilm מוקדם.
Abstract
Biofilms הן הקהילות של חיידקים המצורפת משטחים, אשר ניתן למצוא הגדרות רפואה, תעשייה טבעי. למעשה, החיים biofilm כנראה מייצג את הרוב במצב של צמיחה עבור חיידקים ברוב הסביבות. Biofilms בוגר יש כמה מאפיינים ברורים. חיידקים biofilm מוקפים בדרך כלל על ידי מטריצה תאיים המספק מבנה והגנה לקהילה. חיידקים הגדלים biofilm גם ארכיטקטורה מורכבת בדרך כלל מאפיין של macrocolonies (המכיל אלפי תאים) מוקפת תעלות מלאות נוזל. Biofilm מבוגר חיידקים גם ידוע לשמצה בשל התנגדותם מגוון של סוכני מיקרוביאלית כולל אנטיביוטיקה רלוונטיות קלינית.
Assay צלחת microtiter הוא כלי חשוב ללימוד בשלבים המוקדמים של היווצרות biofilm, וכן הוחל בעיקר ללימוד biofilms חיידקי, אם כי זה assay שימש גם ללמוד היווצרות biofilm פטרייתי. מכיוון assay זה משתמש סטטי, אצווה צמיחה התנאים, זה לא לאפשר היווצרות של biofilms בוגרת הקשורות בדרך כלל עם מערכות התא זרימה. עם זאת, assay כבר יעילה בזיהוי גורמים רבים נדרש ייזום של היווצרות biofilm (כלומר, שוטונים, פילי, adhesins, אנזימים המעורבים מחייב מחזורית-di-GMP ו מטבוליזם) ו גם גנים המעורבים בייצור פוליסכריד תאיים. יתר על כן, העבודה שפורסם עולה כי biofilms גדל מנות microtiter לעשות לפתח כמה מאפיינים של biofilms בוגרים, כגון סובלנות עמידות לאנטיביוטיקה כדי effectors המערכת החיסונית.
זו מנה פשוטה assay microtiter מאפשר היווצרות של biofilm על קיר / או התחתון של צלחת microtiter. אופי תפוקה גבוהה של assay עושה את זה שימושי עבור מסכי גנטי, כמו גם בדיקות biofilm היווצרות של זנים רבים בתנאים צמיחה שונים. גרסאות של assay זה שימשו כדי להעריך היווצרות biofilm מוקדם עבור מגוון רחב של חיידקים, כולל אך לא מוגבל, pseudomonads, Vibrio cholerae, Escherichia coli, staphylocci, enterococci, mycobacteria ופטריות.
בפרוטוקול המתואר כאן, נתמקד השימוש assay זה ללמוד היווצרות biofilm על ידי Pseudomonas aeruginosa אורגניזם מודל. ב assay זה, בהיקף של היווצרות biofilm נמדדת באמצעות גביש צבע סגול (CV). עם זאת, מספר כתמי colorimetric ו מטבוליות אחרות דווחו על כימות של היווצרות biofilm באמצעות assay צלחת microtiter. , להקל על העלות הנמוכה והגמישות של assay צלחת microtiter עשה את זה כלי חיוני ללימוד biofilms.
Protocol
1. גידול biofilm
- לגדול תרבות של Pseudomonas aeruginosa wild-type או זן מוטנטי על הלילה בינוני עשיר (LB כלומר)
- לדלל את 1:100 על תרבות הלילה לתוך מדיום חדש עבור מבחני biofilm. Biofilm תקן assay בינונית פ aeruginosa M63 הוא מדיום מינימלי בתוספת מגנזיום סולפט, גלוקוז וחומצות casamino (ראו טבלה). כפי biofilm קידום חלופה בינונית מגרה צמיחה planktonic פחות biofilm חזקים יותר, גלוקוז וחומצות casamino ניתן להחליף ארגינין כמו פחמן הבלעדי מקור אנרגיה.
- הוספת 100 μL של דילול לכל היטב בקערה 96 באר. עבור מבחני כמותי, אנו משתמשים בדרך כלל 4-8 בארות לשכפל עבור כל טיפול.
- דגירה את הצלחת microtiter במשך 4-24 שעות על 37 ° C.
2. מכתים את biofilm
- לאחר דגירה, לזרוק את התאים על ידי סיבוב הצלחת שוב רועדת את הנוזלים החוצה.
- בעדינות את הצלחת להטביע באמבטיה קטנה של מים (כלומר, להשתמש בתחתית תיבות פיפטה טיפ P1000 pipetmen כמו באמבטיה). לנער את המים. חזור על תהליך זה פעם שנייה. צעד זה מסייע להסיר תאים פנויים ורכיבים התקשורת שניתן מוכתם בשלב הבא, מורידה באופן משמעותי מכתים רקע.
- הוספת 125 μL של פתרון 0.1% סגול קריסטל במים היטב כל הצלחת microtiter. לבשו כפפות וחלוק מעבדה תוך ביצוע הפתרון. היזהר בעת שקילת את קורות החיים כאבקה הוא hydroscopic ו בקלות כתמים ביגוד, עור וכו '
- דגירה את הצלחת microtiter בטמפרטורת החדר למשך 10-15 דקות.
- שוטפים את צלחת 3-4 פעמים במים על ידי השריית באמבט של מים כפי שתואר לעיל, לנער החוצה כתם במרץ על ערימה של מגבות נייר כדי לפטור את הצלחת של כל התאים עודפי צבע.
- הפעל את הצלחת microtiter הפוך ויבש למשך כמה שעות או למשך הלילה.
- עבור מבחני איכותי, בארות יכול להצטלם כשהוא יבש.
3. כימות biofilm
- הוספת 125 μL של חומצה אצטית 30% מים היטב כל הצלחת microtiter כדי solubilize קורות חיים.
- דגירה את הצלחת microtiter בטמפרטורת החדר למשך 10-15 דקות.
- העברת 125 μL של קורות חיים solubilized לצלחת שטוחה microtiter תחתית חדשה.
- לכמת ספיגת בקורא צלחת ב 550 ננומטר באמצעות חומצה אצטית 30% מים ריק.
4. נציג תוצאות:
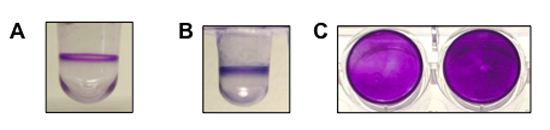
באיור 1. מראה תוצאה נציג ליצירת מבחני biofilm שבוצעו עבור Pseudomonas aeruginosa, Pseudomonas fluorescens ו סטפילוקוקוס. (א) להציג צד של הבאר עם biofilm של P. aeruginosa (8 שעות, 37 ° C). (ב) להציג צד של הבאר עם biofilm של פ fluorescens (6 שעות, 30 ° C). (ג) מבט מלמעלה למטה של biofilm נוצר על ידי ס aureus בצלחת שטוחה תחתית microtiter (שתי בארות, 24 שעות, 37 ° C). פ aeruginosa ו פ fluorescens הן אורגניזמים ניעתי וליצור biofilm בממשק אוויר הנוזל. Aureus ש 'אי - ניעתי וצורות biofilm בתחתית הבאר.
Discussion
שיטה זו יכולה להיות שונה לשימוש עם מגוון רחב של מינים של חיידקים. חיידקים ניעתי בדרך כלל לדבוק קירות ו / או תחתית של בארות, בעוד שאינם ניעתי חיידקים בדרך כלל לדבוק התחתון של בארות. תנאים אופטימליים ליצירת biofilm (כלומר, מדיום גידול, טמפרטורה, זמן הדגירה) צריכה להיקבע באופן...
Disclosures
Acknowledgements
תודתי שרי קוצ'מה, פיט ניואל ורוברט שאנקס למתן את התמונות באיור 1. עבודה זו נתמכה על ידי NIH כדי להעניק R01AI083256 GAO
Materials
| Name | Company | Catalog Number | Comments |
| 1 X M63 | Prepare as a 5X M63 stock by dissolving 15g KH2PO4, 35g K2HPO4 and 10g (NH4)2SO4 in 1 L of water. This stock d–s not need to be autoclaved and can be stored at room temperature. Dilute 5X stock 1:5, autoclave, cool, then add the desired components. | ||
| KH2PO4 | Fisher Scientific | P285-500 | |
| K2HPO4 | Fisher Scientific | P288-500 | |
| (NH4)2SO4 | Sigma-Aldrich | A5132 | |
| Magnesium sulfate | Fisher Scientific | M63-500 | Add to 1 mM final concentration. Prepare as a 1 M stock in water and autoclave. |
| Glucose | Fisher Scientific | D16-3 | Add to 0.2% final concentration. Prepare as a 20% stock in water and autoclave. |
| Casamino acids | BD Biosciences | 223050 | Add to 0.5% final concentration. Prepare as a 20% stock in water and autoclave. |
| Arginine | Sigma-Aldrich | A5131 | Add to 0.4% final concentration. Prepare as a 20% stock in water and filter sterilize. This alternative carbon/energy source can replace glucose and casamino acids |
| Microtiter plates | BD Biosciences | 353911 | Falcon 3911, Microtest III, Flexible assay plates, 96 well, U-bottom, non-sterile, non-tissue-culture treated. |
| Microtiter plate lids | BD Biosciences | 353913 | The lids can be reused by cleaning with 95% ethanol in water. |
| Crystal violet | Sigma-Aldrich | 229641000 | Prepare as a 0.1% solution in water. |
References
- O'Toole, G. A., Kolter, R. Initiation of biofilm formation in Pseudomonas fluorescens WCS365 proceeds via multiple, convergent signalling pathways: a genetic analysis. Mol. Microbiol. 28, 449-461 (1998).
- O'Toole, G. A., Doyle, R. J. . Methods in Enzymology. , 91-109 (1999).
- Mah, T. F. A genetic basis for Pseudomonas aeruginosa biofilm antibiotic resistance. Nature. 426, 306-310 (2003).
- Kuchma, S. L., Connolly, J. P., O'Toole, G. A. A three-component regulatory system regulates biofilm maturation and type III secretion in Pseudomonas aeruginosa. J Bacteriol. 187, 1441-1454 (2005).
- Caiazza, N. C., O'Toole, G. A. SadB is required for the transition from reversible to irreversible attachment during biofilm formation by Pseudomonas aeruginosa PA14. J Bacteriol. 186, 4476-4485 (2004).
- Shanks, R. M., Sargent, J. L., Martinez, R. M., Graber, M. L., O'Toole, G. A. Catheter lock solutions influence staphylococcal biofilm formation on abiotic surfaces. Nephrol Dial Transplant. 21, 2247-2255 (2006).
- Caiazza, N. C., Merritt, J. H., Brothers, K. M., O'Toole, G. A. Inverse regulation of biofilm formation and swarming motility by Pseudomonas aeruginosa PA14. J. Bacteriol. 189, 3603-3612 (2007).
- Hinsa, S. M., Espinosa-Urgel, M., Ramos, J. L., O'Toole, G. A. Transition from reversible to irreversible attachment during biofilm formation by Pseudomonas fluorescens WCS365 requires an ABC transporter and a large secreted protein. Mol Microbiol. 49, 905-918 (2003).
- Mack, D. Characterization of transposon mutants of biofilm-producing Staphylococcus epidermidis impaired in the accumulative phase of biofilm production: genetic identification of a hexosamine-containing polysaccharide intracellular adhesin. Infect. Immun. 62, 3244-3253 (1994).
- Vidal, O. Isolation of an Escherichia coli K-12 mutant strain able to form biofilms on inert surfaces: involvement of a new ompR allele that increases curli expression. J. Bacteriol. 180, 2442-2449 (1998).
- Junker, L. M., Clardy, J. High-throughput screens for small-molecule inhibitors of Pseudomonas aeruginosa biofilm development. Antimicrob Agents Chemother. 51, 3582-3590 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved