Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Mikrotiterschale Biofilmbildung Assay
In diesem Artikel
Zusammenfassung
Der Test beschreibt ein schnelles Mittel zur frühen Bildung von Biofilmen in Bakterien und Pilzen zu messen. Diese Methode verwendet eine Mikrotiterplatte als Substrat für die mikrobielle Bildung von Biofilmen und der Biofilm wird visualisiert Kristallviolett Belastung. Der Test liefert entweder eine qualitative oder quantitative Assay für die frühe Bildung von Biofilmen.
Zusammenfassung
Biofilme sind Gemeinschaften von Mikroben an Oberflächen, die in medizinischen, industriellen und natürlichen Umgebung gefunden werden kann. In der Tat, das Leben in einem Biofilm stellt wahrscheinlich die vorherrschende Art des Wachstums für die Mikroben in den meisten Umgebungen. Ältere Biofilme haben ein paar besondere Eigenschaften. Biofilm Mikroben sind in der Regel durch eine extrazelluläre Matrix, die Struktur und den Schutz der Gemeinschaft stellt umgeben. Mikroben wachsen in einem Biofilm auch eine charakteristische Architektur der Regel aus macrocolonies (mit Tausenden von Zellen) von mit Flüssigkeit gefüllten Kanälen umgeben zusammen. Biofilm-grown Mikroben sind auch berüchtigt für ihren Widerstand gegen eine Reihe von antimikrobiellen Wirkstoffen, einschließlich klinisch relevante Antibiotika.
Die Mikrotiterplatte Assay ist ein wichtiges Instrument für die Erforschung der frühen Stadien der Biofilmbildung und wurde in erster Linie für die Untersuchung von bakteriellen Biofilmen eingesetzt, obwohl dieser Test wurde auch verwendet, um Pilz-Biofilmbildung zu studieren. Da dieser Test mit statischen-, Chargen-Wachstumsbedingungen, ist es nicht für die Bildung der reifen Biofilme in der Regel mit Durchflusszelle Systeme ausreichen. Allerdings hat der Test wurde auf die Identifizierung von vielen Faktoren für die Initiation der Biofilmbildung (dh Flagellen, Pili, Adhäsine, Enzyme in zyklischen-di-GMP verbindlich und Stoffwechsel beteiligt sind) erforderlich wirksame und gut wie Gene in extrazellulären Polysaccharid Produktion beteiligt. Darüber hinaus zeigt veröffentlichten Arbeit, dass Biofilme in Mikrotiterplatten Gerichte gewachsen einige Eigenschaften der reifen Biofilme entwickeln, ein solches Antibiotikum Toleranz und Widerstand gegen das Immunsystem Effektoren.
Diese einfache Mikrotiterschale Assay ermöglicht die Bildung eines Biofilms auf der Wand und / oder am Ende einer Mikrotiterplatte. Der hohe Durchsatz der Natur des Assays ist es nützlich für genetische Screens, sowie Test Biofilmbildung durch mehrere Stämme unter verschiedenen Wachstumsbedingungen. Varianten dieses Tests wurden verwendet, um frühe Bildung von Biofilmen für eine Vielzahl von Mikroben, einschließlich Beurteilung aber nicht, Pseudomonaden, Vibrio cholerae, Escherichia coli, Staphylokokken, Enterokokken, Mykobakterien und Pilze beschränkt.
In der hier beschriebene Protokoll, werden wir über die Verwendung dieses Assays zur Bildung von Biofilmen durch die Modell-Organismus Pseudomonas aeruginosa-Studie konzentrieren. In diesem Test wird das Ausmaß der Bildung von Biofilmen gemessen mit dem Farbstoff Kristallviolett (CV). Allerdings haben eine Reihe von anderen kolorimetrischen und metabolische Flecken für die Quantifizierung der Biofilmbildung mit der Mikrotiterplatte Assay berichtet worden. Die einfache, niedrige Kosten und Flexibilität der Mikrotiterplatte Test hat es ein wichtiges Werkzeug für die Untersuchung von Biofilmen.
Protokoll
1. Growing a Biofilm
- Wachsen einer Kultur des Wildtyp Pseudomonas aeruginosa oder mutierten Stamm über Nacht in einem Vollmedium (dh LB)
- Verdünnen Sie die über Nacht Kultur 1:100 in frisches Medium für Biofilm-Assays. Ein Standard-Biofilm Assay-Medium für P. aeruginosa ist M63 Minimalmedium mit Magnesiumsulfat, Glucose und Casaminosäuren (siehe Tabelle) ergänzt. Als Alternative Biofilm-Förderung Medium, das weniger Plankton Wachstum und eine robustere Biofilm, der Glucose-und Casaminosäuren stimuliert mit Arginin als alleinige Kohlenstoff-und Energiequelle ersetzt werden.
- 100 l der Verdünnung pro Well in einer 96-well Schale. Für die quantitative Assays, wir verwenden in der Regel 4-8 replizieren Vertiefungen für jede Behandlung.
- Inkubieren Sie die Mikrotiterplatte für 4-24 h bei 37 ° C.
2. Die Färbung der Biofilm
- Nach der Inkubation auskippen Zellen durch Drehen der Platte über und Ausschütteln der Flüssigkeit.
- Sanft tauchen die Platte in eine kleine Wanne mit Wasser (dh die Böden der Pipettenspitze Boxen für P1000 pipetmen als die Wanne). Schütteln Sie Wasser. Wiederholen Sie diesen Vorgang ein zweites Mal. Dieser Schritt hilft bei der Entfernung ungebundenen Zellen und Medien-Komponenten, die im nächsten Schritt gefärbt werden können, und senkt Hintergrundfärbung.
- Add 125 ul einer 0,1% igen Kristallviolett-Lösung in Wasser in jede Vertiefung der Mikrotiterplatte. Handschuhe und Laborkittel und gleichzeitig die Lösung. Vorsicht beim Abwiegen der CV als das Pulver ist hygroskopisch und leicht Flecken Kleidung, Haut, etc.
- Inkubieren Sie die Mikrotiterplatte bei Raumtemperatur für 10-15 min.
- Spülen Sie die Platte 3-4 mal mit Wasser durch Eintauchen in eine Wanne mit Wasser wie oben beschrieben, schütteln und klopfen Sie kräftig auf einem Stapel von Papiertüchern, um die Platte aller überschüssigen Zellen und Farbstoff zu befreien.
- Schalten Sie die Mikrotiterplatte auf den Kopf und trocken für ein paar Stunden oder über Nacht.
- Für qualitative Untersuchungen, kann der Brunnen fotografieren, wenn sie trocken werden.
3. Die Quantifizierung der Biofilm
- Add 125 ul 30% Essigsäure in Wasser in jede Vertiefung der Mikrotiterplatte auf die CV lösen.
- Inkubieren Sie die Mikrotiterplatte bei Raumtemperatur für 10-15 min.
- Transfer-125 ul des solubilisierten CV eine neue flachem Boden Mikrotiterplatte.
- Quantify Absorption in einem Platten-Lesegerät bei 550 nm mit 30% Essigsäure in Wasser als leer.
4. Repräsentative Ergebnisse:
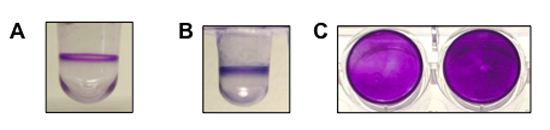
Abbildung 1. Zeigt ein repräsentatives Ergebnis für die Bildung von Biofilmen Assays für Pseudomonas aeruginosa, Pseudomonas fluorescens und Staphylococcus aureus durchgeführt. (A) eine Seitenansicht des Brunnens mit einem Biofilm von P. aeruginosa (8 Stunden, 37 ° C). (B) eine Seitenansicht des Brunnens mit einem Biofilm von P. fluorescens (6 Stunden, 30 ° C). (C) Ein Top-Down-Sicht auf den Biofilm gebildet durch S. aureus in einer flachen-Mikrotiterplatte (zwei Brunnen, 24 Uhr, 37 ° C). P. aeruginosa und P. fluorescens sind sowohl bewegliche Organismen und bilden einen Biofilm an der Luft-Flüssigkeit-Grenzfläche. S. aureus ist unbeweglich und bildet sich ein Biofilm auf der Unterseite des Brunnens.
Diskussion
Diese Methode kann für den Einsatz mit einer Vielzahl von Mikroben-Spezies modifiziert werden. Motile Mikroben typischerweise an den Wänden und / oder Boden der Wells haften, während unbeweglichen Mikroben typischerweise an den Boden der Vertiefungen haften. Die optimalen Bedingungen für die Bildung von Biofilmen (dh Nährmedium, Temperatur, Zeit der Inkubation) muss empirisch für jede Mikrobe bestimmt werden. Ich empfehle die Durchführung mehrerer Wiederholungen für jede Belastung oder Bedingung (4-8), und auch ...
Offenlegungen
Danksagungen
Mein Dank geht an Sherry Kutschma, Pete Newell und Robert Shanks für die Bereitstellung der Bilder in Abbildung 1. Diese Arbeit wurde vom NIH R01AI083256 zu GAO unterstützt
Materialien
| Name | Company | Catalog Number | Comments |
| 1 X M63 | Prepare as a 5X M63 stock by dissolving 15g KH2PO4, 35g K2HPO4 and 10g (NH4)2SO4 in 1 L of water. This stock d–s not need to be autoclaved and can be stored at room temperature. Dilute 5X stock 1:5, autoclave, cool, then add the desired components. | ||
| KH2PO4 | Fisher Scientific | P285-500 | |
| K2HPO4 | Fisher Scientific | P288-500 | |
| (NH4)2SO4 | Sigma-Aldrich | A5132 | |
| Magnesium sulfate | Fisher Scientific | M63-500 | Add to 1 mM final concentration. Prepare as a 1 M stock in water and autoclave. |
| Glucose | Fisher Scientific | D16-3 | Add to 0.2% final concentration. Prepare as a 20% stock in water and autoclave. |
| Casamino acids | BD Biosciences | 223050 | Add to 0.5% final concentration. Prepare as a 20% stock in water and autoclave. |
| Arginine | Sigma-Aldrich | A5131 | Add to 0.4% final concentration. Prepare as a 20% stock in water and filter sterilize. This alternative carbon/energy source can replace glucose and casamino acids |
| Microtiter plates | BD Biosciences | 353911 | Falcon 3911, Microtest III, Flexible assay plates, 96 well, U-bottom, non-sterile, non-tissue-culture treated. |
| Microtiter plate lids | BD Biosciences | 353913 | The lids can be reused by cleaning with 95% ethanol in water. |
| Crystal violet | Sigma-Aldrich | 229641000 | Prepare as a 0.1% solution in water. |
Referenzen
- O'Toole, G. A., Kolter, R. Initiation of biofilm formation in Pseudomonas fluorescens WCS365 proceeds via multiple, convergent signalling pathways: a genetic analysis. Mol. Microbiol. 28, 449-461 (1998).
- O'Toole, G. A., Doyle, R. J. . Methods in Enzymology. , 91-109 (1999).
- Mah, T. F. A genetic basis for Pseudomonas aeruginosa biofilm antibiotic resistance. Nature. 426, 306-310 (2003).
- Kuchma, S. L., Connolly, J. P., O'Toole, G. A. A three-component regulatory system regulates biofilm maturation and type III secretion in Pseudomonas aeruginosa. J Bacteriol. 187, 1441-1454 (2005).
- Caiazza, N. C., O'Toole, G. A. SadB is required for the transition from reversible to irreversible attachment during biofilm formation by Pseudomonas aeruginosa PA14. J Bacteriol. 186, 4476-4485 (2004).
- Shanks, R. M., Sargent, J. L., Martinez, R. M., Graber, M. L., O'Toole, G. A. Catheter lock solutions influence staphylococcal biofilm formation on abiotic surfaces. Nephrol Dial Transplant. 21, 2247-2255 (2006).
- Caiazza, N. C., Merritt, J. H., Brothers, K. M., O'Toole, G. A. Inverse regulation of biofilm formation and swarming motility by Pseudomonas aeruginosa PA14. J. Bacteriol. 189, 3603-3612 (2007).
- Hinsa, S. M., Espinosa-Urgel, M., Ramos, J. L., O'Toole, G. A. Transition from reversible to irreversible attachment during biofilm formation by Pseudomonas fluorescens WCS365 requires an ABC transporter and a large secreted protein. Mol Microbiol. 49, 905-918 (2003).
- Mack, D. Characterization of transposon mutants of biofilm-producing Staphylococcus epidermidis impaired in the accumulative phase of biofilm production: genetic identification of a hexosamine-containing polysaccharide intracellular adhesin. Infect. Immun. 62, 3244-3253 (1994).
- Vidal, O. Isolation of an Escherichia coli K-12 mutant strain able to form biofilms on inert surfaces: involvement of a new ompR allele that increases curli expression. J. Bacteriol. 180, 2442-2449 (1998).
- Junker, L. M., Clardy, J. High-throughput screens for small-molecule inhibitors of Pseudomonas aeruginosa biofilm development. Antimicrob Agents Chemother. 51, 3582-3590 (2007).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten