Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Микротитровальные Блюдо образование биопленки Пробирной
В этой статье
Резюме
Анализ описывает быстрый способ для измерения раннего образования биопленки у бактерий и грибков. Этот метод использует планшет в качестве субстрата для микробной образование биопленки и биопленки визуализируется использованием штамма кристаллический фиолетовый. Препарат обеспечивает либо качественных или количественных тест для раннего образования биопленки.
Аннотация
Biofilms are communities of microbes attached to surfaces, which can be found in medical, industrial and natural settings. In fact, life in a biofilm probably represents the predominate mode of growth for microbes in most environments. Mature biofilms have a few distinct characteristics. Biofilm microbes are typically surrounded by an extracellular matrix that provides structure and protection to the community. Microbes growing in a biofilm also have a characteristic architecture generally comprised of macrocolonies (containing thousands of cells) surrounded by fluid-filled channels. Biofilm-grown microbes are also notorious for their resistance to a range of antimicrobial agents including clinically relevant antibiotics.
The microtiter dish assay is an important tool for the study of the early stages in biofilm formation, and has been applied primarily for the study of bacterial biofilms, although this assay has also been used to study fungal biofilm formation. Because this assay uses static, batch-growth conditions, it does not allow for the formation of the mature biofilms typically associated with flow cell systems. However, the assay has been effective at identifying many factors required for initiation of biofilm formation (i.e, flagella, pili, adhesins, enzymes involved in cyclic-di-GMP binding and metabolism) and well as genes involved in extracellular polysaccharide production. Furthermore, published work indicates that biofilms grown in microtiter dishes do develop some properties of mature biofilms, such a antibiotic tolerance and resistance to immune system effectors.
This simple microtiter dish assay allows for the formation of a biofilm on the wall and/or bottom of a microtiter dish. The high throughput nature of the assay makes it useful for genetic screens, as well as testing biofilm formation by multiple strains under various growth conditions. Variants of this assay have been used to assess early biofilm formation for a wide variety of microbes, including but not limited to, pseudomonads, Vibrio cholerae, Escherichia coli, staphylocci, enterococci, mycobacteria and fungi.
In the protocol described here, we will focus on the use of this assay to study biofilm formation by the model organism Pseudomonas aeruginosa. In this assay, the extent of biofilm formation is measured using the dye crystal violet (CV). However, a number of other colorimetric and metabolic stains have been reported for the quantification of biofilm formation using the microtiter plate assay. The ease, low cost and flexibility of the microtiter plate assay has made it a critical tool for the study of biofilms.
протокол
1. Рост биопленки
- Рост культуры дикого типа синегнойной палочки или мутантный штамм в течение ночи в богатой среде (т.е. LB)
- Развести более 1:100 культуры ночь в свежую среду для биопленки анализов. Стандартной среде анализа биопленки для P. палочки М63 является минимальным среде, дополненной сульфата магния, глюкозы и casamino кислот (см. таблицу). В качестве альтернативы биопленки способствующих среда, которая стимулирует рост менее планктонных и более надежные биопленки, глюкозу и кислоты casamino может быть заменен на аргинин в качестве единственного источником углерода и энергии.
- Добавить 100 мкл разведения на лунку в 96-блюдо. Для количественного анализов, мы обычно используем 4-8 повторить скважин для каждой процедуры.
- Инкубируйте планшет в течение 4-24 часов при 37 ° C.
2. Окрашивание биопленки
- После инкубации дампа клетки, поворачивая пластину снова и вытряхивая жидкости.
- Осторожно погрузите пластину в небольшой ванной воды (то есть использование дне пипетки коробки наконечник для P1000 pipetmen как ванна). Вытряхните воды. Повторите эту процедуру второй раз. Этот шаг поможет удалить одиноких клеток и СМИ компоненты, которые могут быть окрашены в следующем шаге, а также значительно снижает фоновый окрашивания.
- Добавить 125 мкл 0,1% раствора кристаллического фиолетового в воде в каждую лунку планшета. Надевайте перчатки и халат, делая решение. Соблюдайте осторожность при взвешивания резюме в порошок гигроскопичны и легко пятна одежды, кожи и т.д.
- Инкубируйте планшет при комнатной температуре в течение 10-15 мин.
- Промыть пластины 3-4 раза водой путем погружения в ванну с водой, как указано выше, вытряхнуть и промокните энергично на стопку бумажных полотенцах, чтобы избавиться пластина все лишние клетки и красителя.
- Включите планшет с ног на голову и высушить в течение нескольких часов или на ночь.
- Для качественного анализов, скважин можно сфотографироваться в сухом состоянии.
3. Количественная биопленки
- Добавить 125 мкл 30% уксусной кислоты в воде в каждую лунку планшета для растворения резюме.
- Инкубируйте планшет при комнатной температуре в течение 10-15 мин.
- Передача 125 мкл солюбилизированного резюме на новое блюдо с плоским дном микротитровальных.
- Количественная поглощения в ридер при 550 нм с использованием 30% уксусной кислоты в воде, как пустой.
4. Представитель Результаты:
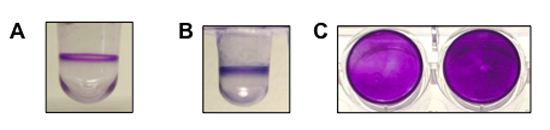
Рисунок 1. Показывает, представитель результат для образования биопленки анализов проводится для синегнойной палочки, Pseudomonas флуоресцирующей и золотистый стафилококк. (А) вид сбоку и с биопленки П. палочки (8 часов, 37 ° С). (B), вид сбоку и с биопленки П. Циогезсепз (6 часов, 30 ° С). (C) сверху вниз из биопленки образуются С. золотистый в плоскодонных планшет (две скважины, 24 часа, 37 ° С). P. палочки и P. Циогезсепз оба подвижных организмов и форме биопленки на поверхности раздела воздух-жидкость. Золотистого стафилококка является неподвижные и формы биопленки на дне колодца.
Обсуждение
Этот метод может быть модифицирована для использования в самых разнообразных видов микроорганизмов. Подвижные микробы обычно придерживаются стен и / или днища колодцев, в то время как неподвижные микроорганизмы обычно придерживаются на дно скважины. Оптимальные условия для образова?...
Раскрытие информации
Благодарности
Спасибо Шерри Кучма, Пит Ньюэлл и Роберт Шанкс для обеспечения изображения на рисунке 1. Эта работа была поддержана NIH грант R01AI083256 в ГАО
Материалы
| Name | Company | Catalog Number | Comments |
| 1 X M63 | Prepare as a 5X M63 stock by dissolving 15g KH2PO4, 35g K2HPO4 and 10g (NH4)2SO4 in 1 L of water. This stock d–s not need to be autoclaved and can be stored at room temperature. Dilute 5X stock 1:5, autoclave, cool, then add the desired components. | ||
| KH2PO4 | Fisher Scientific | P285-500 | |
| K2HPO4 | Fisher Scientific | P288-500 | |
| (NH4)2SO4 | Sigma-Aldrich | A5132 | |
| Magnesium sulfate | Fisher Scientific | M63-500 | Add to 1 mM final concentration. Prepare as a 1 M stock in water and autoclave. |
| Glucose | Fisher Scientific | D16-3 | Add to 0.2% final concentration. Prepare as a 20% stock in water and autoclave. |
| Casamino acids | BD Biosciences | 223050 | Add to 0.5% final concentration. Prepare as a 20% stock in water and autoclave. |
| Arginine | Sigma-Aldrich | A5131 | Add to 0.4% final concentration. Prepare as a 20% stock in water and filter sterilize. This alternative carbon/energy source can replace glucose and casamino acids |
| Microtiter plates | BD Biosciences | 353911 | Falcon 3911, Microtest III, Flexible assay plates, 96 well, U-bottom, non-sterile, non-tissue-culture treated. |
| Microtiter plate lids | BD Biosciences | 353913 | The lids can be reused by cleaning with 95% ethanol in water. |
| Crystal violet | Sigma-Aldrich | 229641000 | Prepare as a 0.1% solution in water. |
Ссылки
- O'Toole, G. A., Kolter, R. Initiation of biofilm formation in Pseudomonas fluorescens WCS365 proceeds via multiple, convergent signalling pathways: a genetic analysis. Mol. Microbiol. 28, 449-461 (1998).
- O'Toole, G. A., Doyle, R. J. . Methods in Enzymology. , 91-109 (1999).
- Mah, T. F. A genetic basis for Pseudomonas aeruginosa biofilm antibiotic resistance. Nature. 426, 306-310 (2003).
- Kuchma, S. L., Connolly, J. P., O'Toole, G. A. A three-component regulatory system regulates biofilm maturation and type III secretion in Pseudomonas aeruginosa. J Bacteriol. 187, 1441-1454 (2005).
- Caiazza, N. C., O'Toole, G. A. SadB is required for the transition from reversible to irreversible attachment during biofilm formation by Pseudomonas aeruginosa PA14. J Bacteriol. 186, 4476-4485 (2004).
- Shanks, R. M., Sargent, J. L., Martinez, R. M., Graber, M. L., O'Toole, G. A. Catheter lock solutions influence staphylococcal biofilm formation on abiotic surfaces. Nephrol Dial Transplant. 21, 2247-2255 (2006).
- Caiazza, N. C., Merritt, J. H., Brothers, K. M., O'Toole, G. A. Inverse regulation of biofilm formation and swarming motility by Pseudomonas aeruginosa PA14. J. Bacteriol. 189, 3603-3612 (2007).
- Hinsa, S. M., Espinosa-Urgel, M., Ramos, J. L., O'Toole, G. A. Transition from reversible to irreversible attachment during biofilm formation by Pseudomonas fluorescens WCS365 requires an ABC transporter and a large secreted protein. Mol Microbiol. 49, 905-918 (2003).
- Mack, D. Characterization of transposon mutants of biofilm-producing Staphylococcus epidermidis impaired in the accumulative phase of biofilm production: genetic identification of a hexosamine-containing polysaccharide intracellular adhesin. Infect. Immun. 62, 3244-3253 (1994).
- Vidal, O. Isolation of an Escherichia coli K-12 mutant strain able to form biofilms on inert surfaces: involvement of a new ompR allele that increases curli expression. J. Bacteriol. 180, 2442-2449 (1998).
- Junker, L. M., Clardy, J. High-throughput screens for small-molecule inhibitors of Pseudomonas aeruginosa biofilm development. Antimicrob Agents Chemother. 51, 3582-3590 (2007).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены