需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
鸡脑干切片的制备及文化
摘要
鸡听性脑干是由原子核负责双耳进行无害化处理。一个单一的冠状切片制剂保持整个电路,而培养的方法,在分子,细胞和网络水平研究神经细胞结构和听觉功能的发展提供了一个独特的准备。
摘要
鸡听性脑干是一个完善的模型系统,已广泛应用于研究谨慎时期的发展1-4以及5-7在中枢神经系统的时空编码机制的解剖和生理听觉处理。
在这里,我们提出了一个方法来准备鸡听性脑干片可用于急性实验程序或长期的实验操作的器官切片文化。
鸡听性脑干是由原子核angularis,magnocellularis,laminaris和优越的橄榄油。这些原子核负责双耳进行无害化处理和单一的冠状片的准备工作,保持整个电路。最终,器官切片文化可以提供机会,如突触活动,前和突触后成分的表达,表达方面控制的兴奋性和差异表达基因操纵一些发展参数
这种方法可用于扩大对神经回路的发展,完善和成熟的一般知识。
研究方案
1。解剖区的制备
- 连续泡沫人工脑脊髓液(学联)的95%O 2 / 5%的CO 2的混合物(pH值在7.2-7.4之间,渗透压295-310 mOsm / L )。
- 学联是冒泡,清洁的工作区用70%乙醇。同时清洁vibratome和切片刀片。 (DH 2 O),用蒸馏水冲洗刀片。
- 清洁液体吸收垫放在解剖与适当的解剖工具面积。
- 胶琼脂块(琼脂糖40毫克/毫升,即4%,在卫生署2 O)的一个会议厅vibratome切片阶段*。
*提示:事先准备琼脂剥离。行前在冰箱的有盖培养皿内的琼脂。琼脂糖从EMD的化学品或Invitrogen公司购买。
2。 6孔板用培养液的制备
- 在无菌罩,填补每6孔板的动物1 1毫升培养基孵育35 ° C和5%的CO 2 。
- 许多文化膜插入需要准备和他们在以后使用的防护罩。
3。鸡脑干隔离
- 将蛋下一个明亮的光源,以确定胚胎(一般鸡蛋大的方面)的空气填充的空间无效。
- 破开的鸡蛋大的一面露出膜囊。在膜囊与手术刀片轻轻取出的鸡胚胎的头部。
- 快速斩首用剪刀头。
- 刀片和眼睛之间略有后的广场一角。通过应用只会有轻微的压力的头骨一个喙到尾鳍正中切口*.
*提示:施加的压力是依赖于胚胎的年龄(即,年轻的= =少,年纪较大的更多) - 轻轻推开,暴露颅骨,并确认中线切开皮肤和羽毛。
- 颅骨的延髓部分切片用刀片座。位置刀片后眼睛和整个颅骨和脑组织通过迅速削减*
*提示:强大压力,要求彻底清除延髓部分。 - 中线外侧切口,用小剪刀在头骨的尾部地区,稍前头部两侧可见颈部肌肉。拉开头骨和组织暴露小脑和大脑。
- 轻轻地清除颅底脑干,小剪刀切割附着组织。一旦所有组织被切断,脑干应自由移动,远离颅骨*
*提示:您可能需要翻转削减附着组织的头骨(大脑下来)。
4。脑干用于切片的制备
- 一旦从头骨取出,针脑干通过视神经tecta。
- 完全删除轻轻切割小剪刀脚,露出地板第四脑室小脑。
- 从表面用镊子脑干删除任何膜组织和血管,并通过视神经tecta横向削减隔离脑干。
- 将少量的超级胶水,在前面的琼脂块vibratome阶段(对vibratome刀片)。
- 使用镊子,轻轻地,迅速地解除脊髓和地方组织上的超级胶水的喙侧和背侧向vibratome刀片脑干*
*提示:吸收多余的胶水应与一个金擦拭,或过滤下一步前纸。 - 轻轻倒入vibratome阶段含氧学联*.
*注:本学联可连续冒泡与O 2 / CO 2。然而,在这样一个解决方案,结果体积小(和可能造成的损害)的不必要的运动脑干切片学联冒泡。如果执行迅速,已经含氧从解剖学联是足够的。 - Vibratome刀片应在20-22 °角。开始vibratome(振荡应在最大振幅)和移动阶段对刀片,使组织的顶部是与刀片平行前切片。
- 快速走向脑干组织的刀片。减慢大大前夕刀片与组织接触。
- 开始与最慢的可能向前运动的组织切片。一旦通过整个组织的冠状切面,轻轻移动从刀片切片,用刷子或碎玻璃,发射抛光的吸管,一端适合用橡胶球。
- 下阶段,在300-500微米的步骤再次切片。重复,直到解剖签名在脑干组织中可见。此时,片脑干组织包含在200-1000微米的听觉结构的厚度,取决于组织和实验需要的年龄。
- 仔细切片,即为了保持可用片,第一片代表电路的最尾端的区域(低频率的声音处理),最后切片代表最喙节(高频processiNG)*
*注:利用文化片的位置,去第6。 在体外生理存储,请参阅下一节。
5。 在体外生理切片存储
- 根据年龄的鸡胚胎和切片厚度,每只动物应提供1至6片。
- 轻轻地放置在个别切片室用火抛光的玻璃吸管的一端装有一个橡胶球。商会应编号。将每口井只有一个切片,为了保持一定tonotopic的特殊性(例如,最尾端片室1在过去腔最延髓切片)。商会应充满学联,不断冒泡的95%O 2 / 5%的CO 2(pH值7.4,渗透压295-310 mOsm / L)的混合物。
- 允许切片放入一个温水浴(36℃)约1小时的会议厅,以平衡。
- 删除从温暖的沐浴室,并允许在室温下休息约半小时。
- 片在室温下半小时后,可以从持有室被转移到了〜0.5毫升的录音室,安装了电生理实验显微镜。
- 切片可用于〜6小时后,从温水浴中取出。
6。器官型切片文化的制备 8
- 紧随切片过程(见第6章)转让片〜500μL用一个火抛光的玻璃吸管的一端装有一个橡胶球,48孔板冰学联。一个片,每孔*
*提示:切片需要至少300微米和微米厚可达1000。 - 已收集切片后,转让的48孔板引擎盖。
- 取出孵化器中的6孔板培养液出,传送到引擎盖。
- 之前把从单一的大脑切片上膜,放置准备膜插入到良好的培养基(见2.2节)。确保无气泡膜目前。
- 使用的玻璃吸管,转移的学联下降到文化膜切片和消除过剩与微学联。重复剩余片(膜片最大的4%)*
*提示:确保片不互相接触和地方片膜的中央,让他们不要触摸膜边缘。 - 根据需要尽可能多的脑切片重复*
*提示:如果文化是操纵在稍后的时间点,它可能是有利的,限制每6孔板膜量3,以减少时间的文化是从孵化器中删除。 - 改变培养基的3倍引擎盖下一个星期:旧介质膜插入解除以及一双镊子取出一个用无菌提示真空管。加入1毫升的新鲜培养液,而膜插入以及解除。当所有介质改变,放盘进入孵化器。
7。代表性的成果:
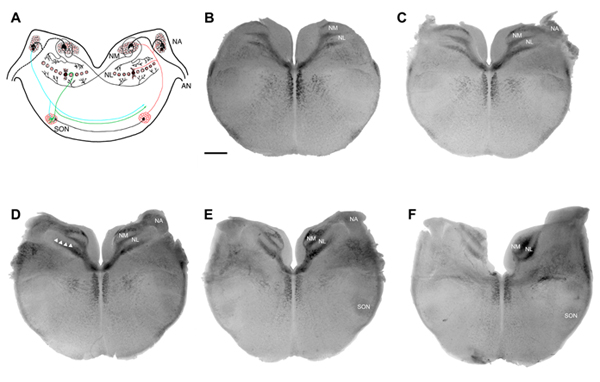
图1。鸡听性脑干双耳电路 (一)一个冠状断面示意图(BF)的体外鸡听性脑干切片图像。 (一)中的电路显示了从听觉神经(AN)的传入细胞核magnocellularis(nm)和核angularis(NA)的兴奋性输入。网管项目核laminaris(NL)的双边脑干双方的兴奋性输入。抑制输入NA,新墨西哥州和NL,从上橄榄核(SON)的项目。 在体外片(BF)的序列图像(200微米(二)从尾椎鸡听性脑干延髓(F)的每个),分别代表从低到高频率地区,。电路负责编码时间的声音,主要用于声音定位的属性。比例尺(二)= 500微米,适用于在图像(CF)。 (四)点箭头单细胞NL身体层。
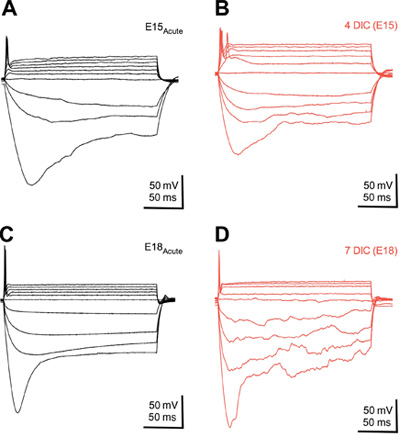
图2。培养的神经元发展正常的生理反应性能 。叠加膜电压变化的响应极化和去极化急性集团(A&C)和4(B)和7(四)文化日(DIC)的培养组织从当前步骤。在极化电压“凹陷”,在强烈的外向电流减少,以及单个AP发射发展相比,年龄相当于急性组织切片文化的方法同样注意变化。流动注射200毫秒,50-100 Pa的步骤。制冷剂管理计划是-55和-60 mV的之间。
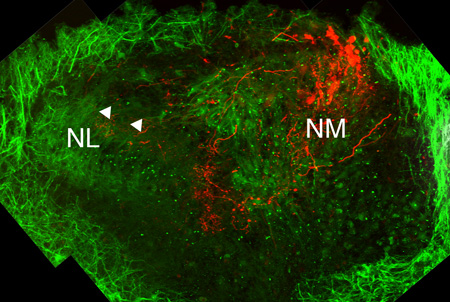
图3。在文化SLI的解剖结构CES E11鸡(DIC)的7天中文化后的听觉脑干的左半边。对微管相关蛋白2(MAP2),胞体和树突中发生的抗体,标记为绿色。通过一个Alexa右旋糖酐染料电核magnocellularis(NM)神经细胞和其轴突群集在红色标记。 NM和NL细胞系是可见的。同侧网管轴突终端可以看到投射到背NL树突(白色箭头)。
讨论
几十年来,鸡的脑干急性切片准备工作已用于研究听觉处理9,10 。这种方法提供了大量的体外生理双耳处理的数据,从发展和成熟的状态4,11 ,12。被知道关于这个高度专业化的电路和每个细胞核中的作用时间处理的声音13,14次。事实上,短期的实验操作和特点电路的结构和功能的影响已被证明有利 15 。但是从长远发展的角度,这样的操作不可能和技术?...
披露声明
致谢
现任和前任鲁贝尔的实验室成员。
材料
| Name | Company | Catalog Number | Comments | |
| Chicken ACSF | ||||
| NaCl | Fisher Scientific | M-11624 | 130 mM | |
| NaHCO3 | Fisher Scientific | M-10576 | 26 mM | |
| KCl | Sigma-Aldrich | P-9333 | 3 mM | |
| NaH2PO4 | Sigma-Aldrich | S-8282 | 1.25 mM | |
| Glucose | Sigma-Aldrich | G-7528 | 10 mM | |
| MgCl2 | Fisher Scientific | M33-500 | 1 mM | |
| CaCl2 | Acros Organics | 423525000 | 2 mM | |
| Chicken culture medium (store at 4°C) | ||||
| advanced minimum essential medium (with NEAA, sodium pyruvate at 110 mg/l, without L-glutamate) | GIBCO, by Life Technologies | 12492-013 | 48.00% | |
| Earl’s balanced salt solution | Sigma-Aldrich | E-2888 | 24.00% | |
| L-glutamine (200 mM) | Sigma-Aldrich | G-7513 | 1.00% | |
| Glucose solution (200 g/l, sterile filtered) | Sigma-Aldrich | G-7528 | 2.75% | |
| horse serum (heat inactivated, sterile filtered) | Sigma-Aldrich | H-1138 | 24.00% | |
| Penicillin-streptomycin* | Sigma-Aldrich | P-0781 | 1.00 ml * = Add to 100 ml culture medium if needed to prevent contamination | |
| Specific equipment | ||||
| Millicell-CM cell culture inserts | PICMORG50 | EMD Millipore | ||
| 6-well plate | 6 Well Cell Culture Cluster | Corning | ||
| Incubator | Forma Scientific CO2 Water Jacketed Incubator | Forma Scientific |
参考文献
- Howard, M. A., Burger, R. M., Rubel, E. W. A developmental switch to GABAergic inhibition dependent on increases in Kv1-type K+ currents. J Neurosci. 27, 2112-2123 (2007).
- Kuba, H., Koyano, K., Ohmori, H. Development of membrane conductance improves coincidence detection in the nucleus laminaris of the chicken. J Physiol. 540, 529-542 (2002).
- Gao, H., Lu, Y. Early development of intrinsic and synaptic properties of chicken nucleus laminaris neurons. Neuroscience. 153, 131-143 (2008).
- Sanchez, J. T., Wang, Y., Rubel, E. W., Barria, A. Development of glutamatergic synaptic transmission in binaural auditory neurons. J Neurophysiol. 104, 1774-1789 (2010).
- Jackson, H., Hackett, J. T., Rubel, E. W. Organization and development of brain stem auditory nuclei in the chick: ontogeny of postsynaptic responses. J Comp Neurol. 210, 80-86 (1982).
- Rubel, E. W., Parks, T. N. Organization and development of brain stem auditory nuclei of the chicken: tonotopic organization of n. magnocellularis and n. laminaris. J Comp Neurol. 164, 411-433 (1975).
- Rubel, E. W., Smith, D. J., Miller, L. C. Organization and development of brain stem auditory nuclei of the chicken: ontogeny of n. magnocellularis and n. laminaris. J Comp Neurol. 166, 469-489 (1976).
- Stoppini, L., Buchs, P. A., Muller, D. A simple method for organotypic cultures of nervous tissue. J Neurosci Methods. 37, 173-182 (1991).
- Reyes, A. D., Rubel, E. W., Spain, W. J. Membrane properties underlying the firing of neurons in the avian cochlear nucleus. J Neurosci. 14, 5352-5364 (1994).
- Monsivais, P., Rubel, E. W. Accommodation enhances depolarizing inhibition in central neurons. J Neurosci. 21, 7823-7830 (2001).
- Lu, T., Trussell, L. O. Development and elimination of endbulb synapses in the chick cochlear nucleus. J Neurosci. 27, 808-8017 (2007).
- Kuba, H., Yamada, R., Fukui, I., Ohmori, H. Tonotopic specialization of auditory coincidence detection in nucleus laminaris of the chick. J Neurosci. 25, 1924-1934 (2005).
- Trussell, L. O. Cellular mechanisms for preservation of timing in central auditory pathways. Curr Opin Neurobiol. 7, 487-492 (1997).
- Trussell, L. O. Synaptic mechanisms for coding timing in auditory neurons. Annu Rev Physiol. 61, 477-496 (1999).
- Sorensen, S. A., Rubel, E. W. The level and integrity of synaptic input regulates dendrite structure. J Neurosci. 26, 1539-1550 (2006).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。