Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Vorbereitung und Kultur von Chicken auditorischen Hirnstamm Slices
In diesem Artikel
Zusammenfassung
Das Huhn auditorischen Hirnstamm ist der Kerne verantwortlich für die binaurale Signalverarbeitung zusammen. Ein einziger koronare Schicht Vorbereitung unterhält die gesamte Schaltung, während die kultivierten Ansatz bietet eine einzigartige Vorbereitung auf die Entwicklung der neuronalen Struktur und auditiven Funktion auf molekularer, zellulärer und Netzebenen zu studieren.
Zusammenfassung
Das Huhn auditorischen Hirnstamm ist ein gut etabliertes Modell, das in großem Umfang verwendet wurde, um die Anatomie und Physiologie der auditiven Verarbeitung bei diskreten Perioden der Entwicklung 1-4 sowie Mechanismen für die zeitliche Kodierung in das zentrale Nervensystem 5-7 studieren.
Hier präsentieren wir eine Methode, um Hühner auditorischen Hirnstamm Scheiben, die für die akute experimentelle Verfahren oder zur Kultur organotypischen Schnitten für die langfristige experimentelle Manipulationen genutzt werden kann vorzubereiten.
Das Huhn auditorischen Hirnstamm ist der Kern angularis, magnocellularis, Laminaris und oberen Olive zusammen. Diese Kerne sind verantwortlich für die binaurale Signalverarbeitung und Single koronare Schicht Präparate erhalten die gesamte Schaltung. Letztlich kann organotypischen Kulturen die Möglichkeit bieten, mehrere Entwicklungs-Parameter wie synaptische Aktivität, Expression von Pre-und postsynaptischen Komponenten, Ausdruck von Aspekten Controlling Erregbarkeit und differenziellen Genexpression zu manipulieren
Dieser Ansatz kann verwendet werden, um die allgemeinen Kenntnisse über neuronale Schaltkreis Entwicklung, Verfeinerung und Reifung zu erweitern.
Protokoll
1. Vorbereitung der Dissecting Bereich
- Kontinuierlich Blase künstliche Rückenmarksflüssigkeit (ACSF) mit einer Mischung aus 95% O 2 / 5% CO 2 (pH-Wert zwischen 7,2 bis 7,4, Osmolarität 295-310 mOsm / l).
- Während ACSF brodelt, saubere Arbeitsfläche mit 70% EtOH. Reinigen Sie auch die Vibratom und Schneidscheibe. Spülen Klinge mit destilliertem Wasser (dH 2 O).
- Legen Sie saubere Flüssigkeitsaufnahme Pad auf Sezieren mit geeigneten Werkzeugen sezieren.
- Kleber Agarblock (40 mg Agarose / mL, dh 4%, in dH 2 O) auf die Bühne eines Vibratom-Slicing Kammer *.
* Tipp: Bereiten Agar vor Dissektion. Shop vorgefertigte Agar in einer Petrischale abgedeckt in den Kühlschrank. Agarose gekauft EMD Chemicals oder Invitrogen.
2. Herstellung von 6-well Platten mit Kulturmedium
- Unter einer sterilen Haube, füllen 1 gut pro Tier einer 6-well-Platte mit 1 ml Kulturmedium und Inkubation bei 35 ° C und 5% CO 2.
- Bereiten Sie so viele Kultur-Membran-Einsätze nach Bedarf und legen Sie sie in der Kapuze für die spätere Verwendung.
3. Isolation von Chicken auditorischen Hirnstamm
- Legen Ei unter eine helle Lichtquelle, um die Luft gefüllten Raum void des Embryos (in der Regel der großen Seite des Eies) zu bestimmen.
- Aufbrechen, große Seite Ei auszusetzen Membran sac. Machen Sie schneiden in der Membran sac mit Skalpell und entfernen Sie vorsichtig den Kopf des Hühnerembryo.
- Schnell enthaupten Kopf mit einer Schere.
- Platzieren Sie die Spitze der Rasierklinge leicht hinter und zwischen den Augen. Machen Sie eine rostral-to-caudal Mittellinienschnitt durch den Schädel Anwendung nur mit leichtem Druck *.
* Tipp: Druck ist abhängig von dem Alter des Embryos (dh jünger = weniger, älter = mehr) - Vorsichtig beiseite schieben Haut und Federn, um Schädel zu entlarven und zu überprüfen Mittellinie geschnitten.
- Block rostralen Teil des Schädels durch Schneiden mit einer Rasierklinge. Position Klinge hinter Augen und schnell durch das ganze Schädel-Hirn-Gewebe geschnitten *.
* Tipp: starker Druck erforderlich ist, um vollständig zu entfernen rostralen Abschnitt. - Machen Mittellinie zu seitliche Einschnitte mit einer kleinen Schere im kaudalen Bereich des Schädels, leicht anterior sichtbar Nackenmuskulatur auf beiden Seiten des Kopfes. Ziehen Sie sich Schädel und Gewebe des Kleinhirns und des Gehirns aufzudecken.
- Entfernen Sie vorsichtig Hirnstamm von Schädelbasis durch Schneiden angebracht Gewebe mit einer kleinen Schere. Sobald alle Gewebe geschnitten wird, sollte Hirnstamm frei weg von den Schädel *.
* Tipp: Sie müssen möglicherweise den Schädel (Gehirn nach unten) blättern, um befestigt Gewebe zu schneiden.
4. Vorbereitung der Hirnstamm für Slicing
- Einmal aus dem Schädel entfernt, pin Hirnstamm nach unten durch die Optik tecta.
- Vollständig zu entfernen das Kleinhirn durch vorsichtiges Schneiden der Stiele mit einer kleinen Schere, Freilegung der Boden des vierten Ventrikels.
- Entfernen Sie alle häutigen Gewebe und Blutgefäße von der Oberfläche des Hirnstamms mit einer Pinzette und machen seitliche Schnitte durch die Optik tecta zum Hirnstamm zu isolieren.
- Legen Sie eine kleine Menge Sekundenkleber auf der Vibratom Bühne vor dem Agar-Block (gegen Vibratom Klinge).
- Mit Pinzette, sanft und schnell heben Sie den Hirnstamm in das Rückenmark und Ort Gewebe auf den Superkleber mit der rostralen Seite nach unten und dorsal in Richtung auf Vibratom Klinge *.
* Tipp: überschüssigen Kleber sollte mit aufgenommen werden einen Kim-Wisch-oder Filterpapier vor dem nächsten Schritt. - Vorsichtig gießen Sauerstoff ACSF in die Vibratom Bühne *.
* Hinweis: dieser ACSF kann kontinuierlich mit O 2 / CO 2 perlen. Allerdings Sprudeln ACSF in einem so kleinen Volumen der Lösung ergibt sich unerwünschte Bewegungen (und mögliche Schäden) an Hirnstamm Scheiben schneiden. Wenn erfolgen schnell, bereits mit Sauerstoff ACSF aus der Zerlegung ist ausreichend. - Vibratom Klinge sollte bei 20-22 ° Winkel sein. Starten Vibratom (Schwingung bei maximaler Amplitude eingestellt werden) und bewegen Bühne bis zur Klinge, so dass die Spitze des Gewebes parallel mit der Klinge vor dem Schneiden.
- Schnell bewegen Klinge in Richtung Hirnstamm Gewebe. Slow down erheblich kurz vor Klinge Kontakt mit dem Gewebe.
- Begin Slicing Gewebe mit langsamsten Vorwärtsbewegung. Einmal durch die gesamte Frontalschnitt des Gewebes, sanft bewegen Stück weg von der Klinge mit einer Bürste oder ein zerbrochenes Glas, feuerte polierten Pipette, fit an einem Ende mit einem Gummiball.
- Untere Bühne in 300-500 um Schritte und in Scheiben schneiden erneut. Wiederholen, bis anatomischen Unterschriften sichtbar in Hirnstamm Gewebe. Zu diesem Zeitpunkt Dicken Scheibe Hirnstamm Gewebe mit auditiven Strukturen auf 200-1000 um, je nach Alter des Gewebes und experimentellen Anforderungen.
- Sorgfältig pflegen nutzbare Scheiben in der Reihenfolge des Schneidens, dh, stellt der 1. Scheibe den kaudalen Bereich der Schaltung (low-frequency-Sound Processing) und die letzte Scheibe repräsentiert die rostralen Abschnitt (Hochfrequenz-Processing) *.
* Hinweis: für die Platzierung von Scheiben für Kultur zu verwenden, mit Abschnitt 6 fort. Für in-vitro Physiologie Lagerung, siehe nächster Abschnitt.
5. Slice-Speicher für in-vitro Physiology
- Je nach Alter des Hühnerembryo und die Dicke der Scheibe, sollte jedes Tier bieten 1 bis 6 Scheiben schneiden.
- Sanft statt einzelne Segmente in der Kammer mit feuerpolierte Glaspipette an einem Ende mit einem Gummi-Glühlampe. Kammer sollten nummeriert werden. Legen Sie nur eine Scheibe pro Vertiefung, um einige tonotopen Spezifität (z. B. die meisten caudal Scheibe in der Kammer 1 und die meisten rostral Scheibe in die letzte Kammer) zu halten. Kammer sollte mit ACSF gefüllt werden und kontinuierlich mit einer Mischung aus 95% O 2 / 5% CO 2 (pH 7,4, Osmolarität 295-310 mOsm / l) geleitet.
- Lassen Sie Slices, indem die Kammer in ein warmes Bad (36 ° C) für ca. 1 Stunde ausgleichen.
- Entfernen Kammer vom warmen Bad und lassen Sie sie bei Raumtemperatur für ca. ½ Stunde ruhen lassen.
- Nach ½ Stunden bei Raumtemperatur, können Scheiben von der Aufnahmekammer eine ~ 0,5 mL Aufnahme Kammer an einem Mikroskop für elektrophysiologische Experimente montiert übertragen werden.
- Scheiben kann verwendet werden für bis zu ca. 6 Stunden nach der Entnahme aus der warmen Badewanne.
6. Vorbereitung der organotypischen Kulturen 8
- Unmittelbar nach dem Aufschneiden Verfahren (siehe Abschnitt 6) übertragen Scheiben mit ~ 500 ul ACSF mit einem feuerpolierte Glaspipette an einem Ende mit einem Gummiball auf eine 48-Well-Platte auf Eis ausgerüstet. Eine Scheibe pro Well *.
* Tipp: Scheiben müssen mindestens 300 um und bis 1000 um dick sein. - Nach Scheiben gesammelt worden sind, übertragen Sie die 48-Well-Platte an der Kapuze.
- Entfernen einer 6-well-Platte mit Kulturmedium aus dem Inkubator und überträgt es auf die Motorhaube.
- Kurz vor der Platzierung Scheiben aus einem einzigen Gehirn auf Membranen, eine der vorbereiteten Membran-Einsätze statt (siehe Abschnitt 2.2) in eine gut mit Kulturmedium. Achten Sie darauf, keine Luftblasen unter der Membran zu präsentieren.
- Mit einer Glaspipette, Übertragung einer Scheibe in einem Tropfen ACSF auf die Kultur-Membran und entfernen überschüssige ACSF mit der Pipette. Wiederholen Sie für die restlichen Scheiben (max 4 Scheiben pro Membran) *.
* Tipp: Achten Sie darauf, Scheiben nicht berühren einander und legen Scheiben zentral auf der Membran, so dass sie sich nicht berühren der Membran Felge. - Wiederholen Sie dies für so viele Hirnschnitten nach Bedarf *.
* Tipp: Wenn Kulturen zu einem späteren Zeitpunkt manipuliert werden, könnte es vorteilhaft sein, den Betrag von Membranen bis 3 Limit pro 6-Well-Platte als die Zeit, die Kulturen aus dem Brutschrank entnommen sind zu reduzieren. - Ändern Kulturmedium 3 mal pro Woche unter einer Haube: Entfernen Sie alte Medium mit einer Vakuum-Röhre mit einer sterilen Spitze, während Membran eingefügt wird aus dem Brunnen mit einer Pinzette angehoben. 1 ml frisches Kulturmedium in gut während die Membran eingefügt wird aus dem Brunnen gehoben. Wenn alle Medium gewechselt wird, setzen Platte zurück in den Inkubator.
7. Repräsentative Ergebnisse:
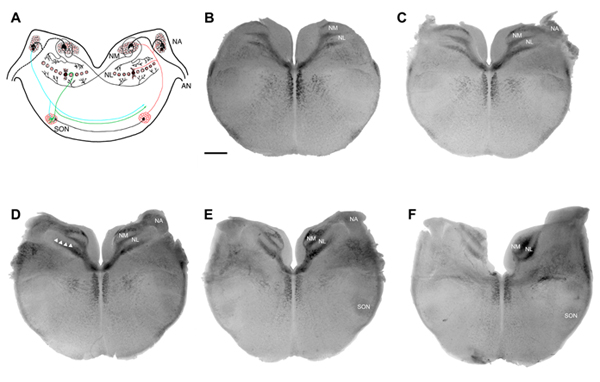
Abbildung 1. Binaural Schaltung des Huhns auditorischen Hirnstamm. (A) Schematische Darstellung eines koronalen Abschnitt und (BF) in-vitro Schnittbilder des Huhns auditorischen Hirnstamm. Die Schaltung in (A) zeigt afferenten erregenden Eingänge aus den Hörnerv (AN) zu Kern magnocellularis (NM) und Nucleus angularis (NA). NM Projekte bilateralen exzitatorischen Eingänge Kern Laminaris (NL) auf beiden Seiten des Hirnstamms. Eine inhibitorische Eingang von der oberen Olive Kern (SON) Projekte zur NA, NM und NL. Die in-vitro Scheiben in (BF) sind aufeinander folgenden Bildern (200 um jeweils) geht von kaudal (B) zu rostral (F) des Huhns auditorischen Hirnstamm, die die niedrig-bis hochfrequente Regionen bzw.. Circuitry ist verantwortlich für die Codierung von zeitlichen Eigenschaften von Ton in erster Linie für Sound-Lokalisierung verwendet. Balken in (B) = 500 um und gilt für Bilder in (CF). Arrows in (D) weisen auf die einzelne Zelle Körper Schicht aus NL.
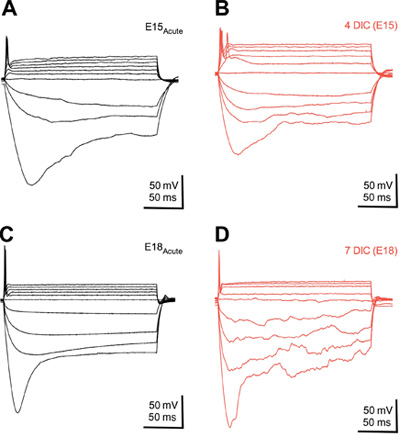
Abbildung 2. Kultivierten Neuronen entwickeln normale physiologische Reaktion Eigenschaften. Überlagert Membran Spannungsänderungen in Reaktion auf Hyperpolarisation und depolarisierende aktuellen Schritte von akuten (A & C) und gezüchtetes Gewebe in 4 (B) und 7 (D) Tagen in Kultur (DIC). Hinweis Änderungen in hyperpolarisierenden Spannung "sag", starke Reduktion der nach außen gerichteten Strom, und einzelne AP Feuern, die sich ähnlich entwickeln, die Scheibe Kultur-Ansatz im Vergleich zum Alter entspricht akuten Gewebe. Aktuelle Injektionen wurden 200 ms, nur wenige Schritte von 50-100 pA. RMP wurden zwischen -55 und -60 mV.
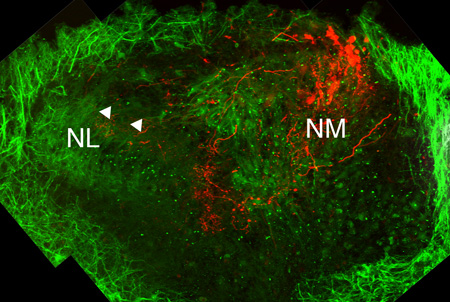
Abbildung 3. Anatomische Strukturen in Kultur slices. linken Hälfte des auditorischen Hirnstamm eines E11 Huhn nach 7 Tagen in Kultur (DIC). Ein Antikörper gegen das Mikrotubuli-assoziierten Protein 2 (MAP2), die im Soma und Dendriten auftritt, ist in grün gekennzeichnet. Eine Gruppe von Kern magnocellularis (NM) Neuronen und ihre Axone sind in rot über Elektroporation eines Alexa Dextran Farbstoff markiert. Beide NM und NL-Zelllinie sichtbar sind. Ipsilateral NM Axonterminalen sehen projizieren zum dorsalen NL Dendriten (weiße Pfeilspitzen) werden.
Diskussion
Seit mehreren Jahrzehnten hat sich die akuten Scheibe Vorbereitung des Huhns Hirnstamm verwendet worden, um Studie auditiven Verarbeitungs-9, 10. Dieser Ansatz hat eine enorme Menge von in-vitro physiologischen Daten auf binauralen Verarbeitung sowohl von Entwicklungs-und reifen Staaten 4, 11, 12 vorgesehen. Viel ist über diese hoch spezialisierten Schaltung und die Rolle jeder Kern spielt in der zeitlichen Verarbeitung von Ton 13, 14 bekannt. In der Tat haben kurzfristige expe...
Offenlegungen
Danksagungen
Aktuelle und ehemalige Rubel lab Mitglieder.
Materialien
| Name | Company | Catalog Number | Comments | |
| Chicken ACSF | ||||
| NaCl | Fisher Scientific | M-11624 | 130 mM | |
| NaHCO3 | Fisher Scientific | M-10576 | 26 mM | |
| KCl | Sigma-Aldrich | P-9333 | 3 mM | |
| NaH2PO4 | Sigma-Aldrich | S-8282 | 1.25 mM | |
| Glucose | Sigma-Aldrich | G-7528 | 10 mM | |
| MgCl2 | Fisher Scientific | M33-500 | 1 mM | |
| CaCl2 | Acros Organics | 423525000 | 2 mM | |
| Chicken culture medium (store at 4°C) | ||||
| advanced minimum essential medium (with NEAA, sodium pyruvate at 110 mg/l, without L-glutamate) | GIBCO, by Life Technologies | 12492-013 | 48.00% | |
| Earl’s balanced salt solution | Sigma-Aldrich | E-2888 | 24.00% | |
| L-glutamine (200 mM) | Sigma-Aldrich | G-7513 | 1.00% | |
| Glucose solution (200 g/l, sterile filtered) | Sigma-Aldrich | G-7528 | 2.75% | |
| horse serum (heat inactivated, sterile filtered) | Sigma-Aldrich | H-1138 | 24.00% | |
| Penicillin-streptomycin* | Sigma-Aldrich | P-0781 | 1.00 ml * = Add to 100 ml culture medium if needed to prevent contamination | |
| Specific equipment | ||||
| Millicell-CM cell culture inserts | PICMORG50 | EMD Millipore | ||
| 6-well plate | 6 Well Cell Culture Cluster | Corning | ||
| Incubator | Forma Scientific CO2 Water Jacketed Incubator | Forma Scientific |
Referenzen
- Howard, M. A., Burger, R. M., Rubel, E. W. A developmental switch to GABAergic inhibition dependent on increases in Kv1-type K+ currents. J Neurosci. 27, 2112-2123 (2007).
- Kuba, H., Koyano, K., Ohmori, H. Development of membrane conductance improves coincidence detection in the nucleus laminaris of the chicken. J Physiol. 540, 529-542 (2002).
- Gao, H., Lu, Y. Early development of intrinsic and synaptic properties of chicken nucleus laminaris neurons. Neuroscience. 153, 131-143 (2008).
- Sanchez, J. T., Wang, Y., Rubel, E. W., Barria, A. Development of glutamatergic synaptic transmission in binaural auditory neurons. J Neurophysiol. 104, 1774-1789 (2010).
- Jackson, H., Hackett, J. T., Rubel, E. W. Organization and development of brain stem auditory nuclei in the chick: ontogeny of postsynaptic responses. J Comp Neurol. 210, 80-86 (1982).
- Rubel, E. W., Parks, T. N. Organization and development of brain stem auditory nuclei of the chicken: tonotopic organization of n. magnocellularis and n. laminaris. J Comp Neurol. 164, 411-433 (1975).
- Rubel, E. W., Smith, D. J., Miller, L. C. Organization and development of brain stem auditory nuclei of the chicken: ontogeny of n. magnocellularis and n. laminaris. J Comp Neurol. 166, 469-489 (1976).
- Stoppini, L., Buchs, P. A., Muller, D. A simple method for organotypic cultures of nervous tissue. J Neurosci Methods. 37, 173-182 (1991).
- Reyes, A. D., Rubel, E. W., Spain, W. J. Membrane properties underlying the firing of neurons in the avian cochlear nucleus. J Neurosci. 14, 5352-5364 (1994).
- Monsivais, P., Rubel, E. W. Accommodation enhances depolarizing inhibition in central neurons. J Neurosci. 21, 7823-7830 (2001).
- Lu, T., Trussell, L. O. Development and elimination of endbulb synapses in the chick cochlear nucleus. J Neurosci. 27, 808-8017 (2007).
- Kuba, H., Yamada, R., Fukui, I., Ohmori, H. Tonotopic specialization of auditory coincidence detection in nucleus laminaris of the chick. J Neurosci. 25, 1924-1934 (2005).
- Trussell, L. O. Cellular mechanisms for preservation of timing in central auditory pathways. Curr Opin Neurobiol. 7, 487-492 (1997).
- Trussell, L. O. Synaptic mechanisms for coding timing in auditory neurons. Annu Rev Physiol. 61, 477-496 (1999).
- Sorensen, S. A., Rubel, E. W. The level and integrity of synaptic input regulates dendrite structure. J Neurosci. 26, 1539-1550 (2006).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten