Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Подготовка и культуры Куриные ломтики Слуховые мозга
В этой статье
Резюме
Ствола мозга куриного слуховой состоит из ядер, ответственных за бинауральные обработки звука. Одного корональных подготовки ломтик поддерживает все схемы в то время как культурный подход обеспечивает уникальный препарат для изучения развития нейронной структуры и слуховой функции на молекулярном, клеточном и сетевых уровнях.
Аннотация
Ствола мозга куриного слуховой устоявшихся модель системы, которая широко используется для изучения анатомии и физиологии слухового переработки на дискретные периоды развития 1-4, а также механизмы для временного кодирования в центральной нервной системе 5-7.
Здесь мы представляем метод подготовить куриные слухового ствола мозга ломтиками, которые могут быть использованы для острой экспериментальной процедуры или к культуре органотипической ломтиками для долгосрочных экспериментальных манипуляций.
Ствола мозга куриного слуховой состоит из ядра angularis, magnocellularis, laminaris и превосходное оливковое. Эти ядра несут ответственность за бинауральные обработки звука и одного корональных подготовки ломтик сохранения всей схемы. В конечном счете, органотипической культур срез может предоставить возможность манипулировать несколько развития таких параметров, как синаптической активности, выражение пре-и постсинаптических компонентов, выражение аспекты контроля возбудимости и дифференциальное выражение гена
Этот подход может быть использован для расширения общих знаний о нейронных развития цепи, изысканность и созревания.
протокол
1. Подготовка Пройдя площадь
- Постоянно пузырь искусственной спинномозговой жидкости (ACSF) смесью 95% O 2 / 5% СО 2 (рН между 7.2-7.4, осмолярность 295-310 мОсм / л).
- Хотя ACSF кипит, чистая рабочая зона с 70% этанола. Также очистите vibratome и нарезки лезвия. Промыть лезвие с дистиллированной водой (дН 2 O).
- Место чистую площадку поглощения жидкости на вскрытии области с соответствующими рассекающих инструментов.
- Клей агар блок (40 мг агарозы / мл, то есть 4%, в дН 2 O) до стадии vibratome нарезки камеры *.
* Совет: подготовить агар до вскрытия. Магазин готовых агар внутри покрыты Петри в холодильнике. Агарозном приобрести у EMD химических веществ или Invitrogen.
2. Подготовка 6-луночных культуральной средой
- Под капотом стерильные, заполнить 1 и одно животное из 6-луночный планшет с 1 мл культуральной среды и инкубировать при температуре 35 ° С и 5% СО 2.
- Подготовьтесь так много вставок мембраны культуры по мере необходимости и поместите их в капоте для дальнейшего использования.
3. Выделение Куриный слуховых
- Место яйцо под яркий источник света, чтобы определить воздух, наполненный пустота пространства эмбриона (как правило, большие сторону яйцо).
- Перерыв открытой большой стороне яйца подвергая мембраны мешка. Сделайте срез в мембранном мешка с скальпель и аккуратно удалить глава куриного эмбриона.
- Быстро обезглавить голову ножницами.
- Место кончик лезвия чуть сзади и между глаз. Сделать ростральной до хвостового средней линии разрез через череп применением только небольшое давление *.
* Совет: давление зависит от возраста эмбриона (т.е. младший = меньше, пожилые = больше) - Аккуратно отодвинуть кожу и перья, чтобы подвергать черепа и проверить средней линии разреза.
- Блок ростральной части черепа, нарезая с лезвия бритвы. Позиция лезвие задней глаза и быстро прорезать всего черепа и мозговая ткань *.
* Совет: сильное давление требуется, чтобы полностью удалить ростральной разделе. - Сделать средней линии к боковой разрез с небольшими ножницами в хвостовой области черепа, немного впереди видимых мышц шеи по обе стороны головы. Вырваться черепа и ткани подвергать мозжечка и мозга.
- Аккуратно снимите ствол мозга от основания черепа, сокращая прилагается ткани с небольшими ножницами. После того как все ткани вырезать, мозга должны свободно двигаться от черепа *.
* Совет: Вам может понадобиться, чтобы перевернуть черепа (мозг вниз), чтобы сократить прилагается ткани.
4. Подготовка ствола мозга для нарезки
- После извлечения из черепа, контактный мозга вниз через оптический tecta.
- Полное удаление мозжечка, осторожно резки цветоносы с небольшими ножницами, выставляя этаже четвертого желудочка.
- Удалите все мембранные ткани и кровеносных сосудов с поверхности ствола мозга с помощью пинцета и сделать боковые разрезы через зрительный tecta изолировать мозга.
- Нанесите небольшое количество супер клей на vibratome сцене перед агар блока (в сторону лезвия vibratome).
- С помощью пинцета аккуратно и быстро поднять ствол мозга в спинной мозг и ткани на месте супер клей с ростральной стороной вниз и спинной стороны навстречу лезвие vibratome *.
* Совет: избыток клея должны быть покрыты с Ким-стереть или фильтровальную бумагу до следующего шага. - Аккуратно влить кислородом ACSF в стадию vibratome *.
* Примечание: это ACSF можно непрерывно пропускают с O 2 / CO 2. Тем не менее, журчание ACSF в таком маленьком объеме раствора приводит к нежелательным движения (и возможного ущерба) в стволе мозга ломтиками. Если выполняются быстро, уже кислородом ACSF от вскрытия достаточно. - Vibratome лезвия должна быть 20-22 °. Начало vibratome (колебания должны быть установлены на максимальную амплитуду) и двигаться вверх, к стадии лезвие так, что верхняя часть ткани параллельно с лезвием до нарезки.
- Быстрое перемещение лезвия в направлении ствола мозга ткани. Замедление значительно непосредственно перед лезвием контакте с тканью.
- Начните нарезки ткани с минимально возможный движение вперед. Пройдя через весь корональной части ткани, мягко двигаться ломтик от лезвие с кистью или битое стекло, полированная уволен пипетки, подходят на одном конце с резиновой грушей.
- Нижняя ступень в 300-500 мкм и нарезать шаги снова. Повторяйте, пока анатомические подписи видны в стволе мозга ткани. В это время, кусочек мозга ткани, содержащей слуховых структур на 200-1000 мкм толщины, в зависимости от возраста ткани и экспериментальных потребностей.
- Тщательно поддерживать использовать ломтики в порядок нарезки, то есть 1-я часть представляет собой наиболее хвостовой части схемы (низкочастотной обработки звука), а последний срез представляет собой наиболее ростральной разделе (высокочастотные processiнг) *.
* Примечание: для размещения ломтиками культуры использования, перейдите в раздел 6. Ибо в лабораторных хранения физиологии, см. следующий раздел.
5. Фрагмент для хранения в лабораторных условиях физиологии
- В зависимости от возраста эмбриона цыпленка и толщина среза, каждое животное должно обеспечить с 1 по 6 ломтиков.
- Аккуратно отдельных ломтиков в камере с огнем полированные стеклянные пипетки установлены на одном конце с резиновой грушей. Палаты должны быть пронумерованы. Место только один кусочек на лунку, для того, чтобы сохранить некоторые tonotopic специфику (например, большинство хвостового среза в камере 1 и наиболее ростральной ломтик в последней камеры). Палаты должны быть заполнены ACSF и постоянно клокотало смесью 95% O 2 / 5% СО 2 (рН 7,4, осмолярность 295-310 мОсм / л).
- Разрешить ломтиками, чтобы уравновесить путем размещения камеры в теплой ванне (36 ° С) в течение около 1 часа.
- Удалите камеру из теплой ванны и позволит отдохнуть при комнатной температуре в течение примерно полчаса.
- После полутора часов при комнатной температуре, кусочки могут быть переданы от проведения камере ~ 0,5 мл записи камеры установлены на микроскоп для электрофизиологических экспериментов.
- Фрагменты могут быть использованы на срок до ~ 6 часов после удаления из теплой ванны.
6. Подготовка органотипической культур фрагмент 8
- Сразу же после нарезки процедуры (см. раздел 6) передача ломтики с ~ 500 мкл ACSF использованием огня полированного стекла пипеткой установлены на одном конце резиновой груши с 48 лунками на льду. Один кусочек на лунку *.
* Совет: Ломтики должны быть не менее 300 мкм и до 1000 мкм. - После ломтики были собраны, трансфер 48-луночного планшета на капот.
- Удалите 6-луночный планшет содержащие из культуральной среды инкубатора и перенести его на капот.
- Незадолго до размещения ломтики из одного мозга на мембранах, место одного из подготовленных вставки мембраны (см. раздел 2.2) в колодец с питательной среды. Убедитесь, что нет воздушных пузырьков настоящее время под мембраной.
- Использование стеклянной пипетки, передача ломтик в капле ACSF на культуру мембраны и удаления излишков ACSF с микропипетки. Повторите эти действия для оставшихся ломтиков (макс. 4 ломтика в мембрану) *.
* Совет: Убедитесь, что ломтики не соприкасались друг с другом и место ломтики централизованно на мембране так, чтобы они не касались мембраны обода. - Повторите столько ломтики мозга по мере необходимости *.
* Совет: Если культур манипулируют в более поздний момент времени, это может быть выгодно, чтобы ограничить количество мембран 3 на 6-луночный планшет, чтобы уменьшить время культур удаляют из инкубатора. - Изменение культуральной среде 3 раза в неделю под капотом: Удалить старые среде с вакуумной трубкой с наконечником в то время как стерильные мембраны вставить поднимается из скважины с парой щипцов. Добавить 1 мл свежей питательной среды в хорошо в то время как мембрана вставки поднял из колодца. Когда все среда изменилась, положите пластину обратно в инкубатор.
7. Представитель Результаты:
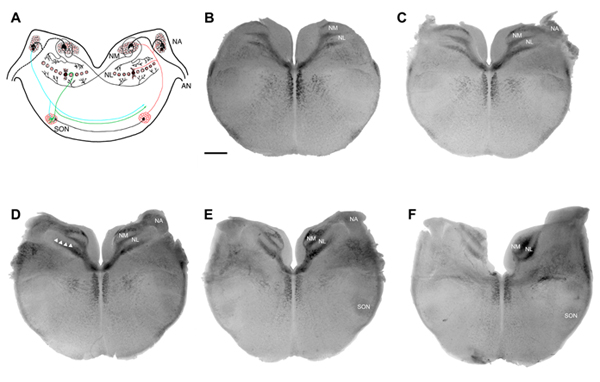
Рисунок 1. Двойные схема слуховых курицы. () Схема корональных раздел и (BF) в пробирке часть изображения слуховых курицы. Замыкания в () показывает, афферентных возбуждающих входов от слуховой нерв () к ядру magnocellularis (NM) и ядро angularis (NA). Н. М. проектов двусторонних возбуждающих входов к ядру laminaris (NL) по обе стороны ствола мозга. Тормозящий вход с превосходной овальный ядра (SON) проекты Н. А., Н. и NL. В пробирке ломтики в (BF) являются последовательных изображений (200 мкм каждый) идущий от хвостового (В) ростральной (F) из слуховых курица, представляющих низких и высокочастотных областей соответственно. Схема отвечает за кодирование временные свойства звука используется в основном для локализации звука. Шкала бар (B) = 500 мкм и применяется для изображений (CF). Стрелки (D) указывают на один слой клеток организма от NL.
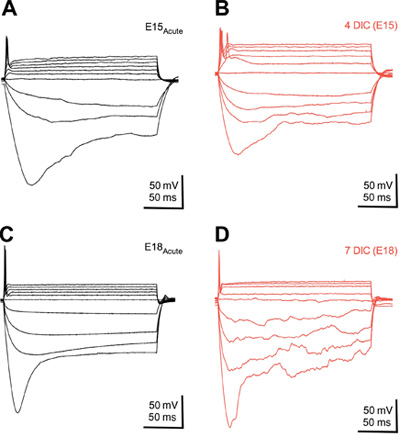
Рисунок 2. Искусственный нейронов развивать нормальные физиологические свойства ответ. Наложенные изменения мембранного напряжения в ответ на гиперполяризующих и деполяризующего тока шагах от острой (& C) и культурной ткани на 4 (B) и 7 (D) дней культуры (ОПК). Обратите внимание, изменения в гиперполяризующих напряжения "провисают", сильное сокращение наружу ток, и однократный обжиг AP, которые развиваются так же в подходе культура ломтик по сравнению с возрастом эквивалент острого ткани. Текущий инъекции 200 мс, шагами по 50-100 мкА. ПРХ были между -55 и -60 мВ.
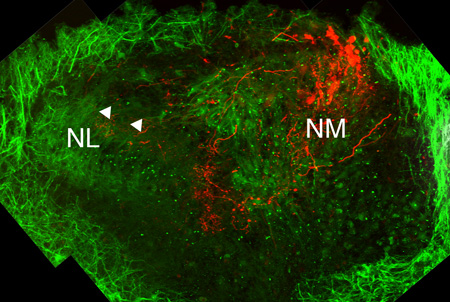
Рисунок 3. Анатомическое строение в культуре SLICES. Левая половина мозга слуховой из куриного E11 через 7 дней в культуре (DIC). Антитела против микротрубочек связанных белков 2 (MAP2), которое происходит в сомы и дендритов, помечена зеленым цветом. Кластера ядра magnocellularis (NM) нейроны и аксоны его помечены красным через электропорации Alexa декстран красителя. Оба Н. М. и Н. Л. линии ячейки, не видны. Ипсилатеральная терминалов аксона Н. М. можно увидеть проектирования до спинной дендритов NL (белые стрелки).
Обсуждение
В течение нескольких десятилетий острой подготовки ломтиком куриного мозга был использован для исследования слуховой обработки 9, 10. Такой подход обеспечил огромное количество в лабораторных условиях физиологические данные о бинауральных обработки с обеих развития и зрел...
Раскрытие информации
Благодарности
Нынешние и бывшие члены Рубель лаборатории.
Материалы
| Name | Company | Catalog Number | Comments | |
| Chicken ACSF | ||||
| NaCl | Fisher Scientific | M-11624 | 130 mM | |
| NaHCO3 | Fisher Scientific | M-10576 | 26 mM | |
| KCl | Sigma-Aldrich | P-9333 | 3 mM | |
| NaH2PO4 | Sigma-Aldrich | S-8282 | 1.25 mM | |
| Glucose | Sigma-Aldrich | G-7528 | 10 mM | |
| MgCl2 | Fisher Scientific | M33-500 | 1 mM | |
| CaCl2 | Acros Organics | 423525000 | 2 mM | |
| Chicken culture medium (store at 4°C) | ||||
| advanced minimum essential medium (with NEAA, sodium pyruvate at 110 mg/l, without L-glutamate) | GIBCO, by Life Technologies | 12492-013 | 48.00% | |
| Earl’s balanced salt solution | Sigma-Aldrich | E-2888 | 24.00% | |
| L-glutamine (200 mM) | Sigma-Aldrich | G-7513 | 1.00% | |
| Glucose solution (200 g/l, sterile filtered) | Sigma-Aldrich | G-7528 | 2.75% | |
| horse serum (heat inactivated, sterile filtered) | Sigma-Aldrich | H-1138 | 24.00% | |
| Penicillin-streptomycin* | Sigma-Aldrich | P-0781 | 1.00 ml * = Add to 100 ml culture medium if needed to prevent contamination | |
| Specific equipment | ||||
| Millicell-CM cell culture inserts | PICMORG50 | EMD Millipore | ||
| 6-well plate | 6 Well Cell Culture Cluster | Corning | ||
| Incubator | Forma Scientific CO2 Water Jacketed Incubator | Forma Scientific |
Ссылки
- Howard, M. A., Burger, R. M., Rubel, E. W. A developmental switch to GABAergic inhibition dependent on increases in Kv1-type K+ currents. J Neurosci. 27, 2112-2123 (2007).
- Kuba, H., Koyano, K., Ohmori, H. Development of membrane conductance improves coincidence detection in the nucleus laminaris of the chicken. J Physiol. 540, 529-542 (2002).
- Gao, H., Lu, Y. Early development of intrinsic and synaptic properties of chicken nucleus laminaris neurons. Neuroscience. 153, 131-143 (2008).
- Sanchez, J. T., Wang, Y., Rubel, E. W., Barria, A. Development of glutamatergic synaptic transmission in binaural auditory neurons. J Neurophysiol. 104, 1774-1789 (2010).
- Jackson, H., Hackett, J. T., Rubel, E. W. Organization and development of brain stem auditory nuclei in the chick: ontogeny of postsynaptic responses. J Comp Neurol. 210, 80-86 (1982).
- Rubel, E. W., Parks, T. N. Organization and development of brain stem auditory nuclei of the chicken: tonotopic organization of n. magnocellularis and n. laminaris. J Comp Neurol. 164, 411-433 (1975).
- Rubel, E. W., Smith, D. J., Miller, L. C. Organization and development of brain stem auditory nuclei of the chicken: ontogeny of n. magnocellularis and n. laminaris. J Comp Neurol. 166, 469-489 (1976).
- Stoppini, L., Buchs, P. A., Muller, D. A simple method for organotypic cultures of nervous tissue. J Neurosci Methods. 37, 173-182 (1991).
- Reyes, A. D., Rubel, E. W., Spain, W. J. Membrane properties underlying the firing of neurons in the avian cochlear nucleus. J Neurosci. 14, 5352-5364 (1994).
- Monsivais, P., Rubel, E. W. Accommodation enhances depolarizing inhibition in central neurons. J Neurosci. 21, 7823-7830 (2001).
- Lu, T., Trussell, L. O. Development and elimination of endbulb synapses in the chick cochlear nucleus. J Neurosci. 27, 808-8017 (2007).
- Kuba, H., Yamada, R., Fukui, I., Ohmori, H. Tonotopic specialization of auditory coincidence detection in nucleus laminaris of the chick. J Neurosci. 25, 1924-1934 (2005).
- Trussell, L. O. Cellular mechanisms for preservation of timing in central auditory pathways. Curr Opin Neurobiol. 7, 487-492 (1997).
- Trussell, L. O. Synaptic mechanisms for coding timing in auditory neurons. Annu Rev Physiol. 61, 477-496 (1999).
- Sorensen, S. A., Rubel, E. W. The level and integrity of synaptic input regulates dendrite structure. J Neurosci. 26, 1539-1550 (2006).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены