需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
用荧光素酶在小鼠细菌性感染的形象
摘要
生物发光细菌感染在动物活体成像的方法进行了阐述。病原体被修改,以表达荧光素酶,使光全身显像在活的动物感染。荧光素酶表达的病原体可感染动物模型和疾病过程中产生的生物发光成像在实时可视化。
摘要
成像是一种有价值的技术,可以用来监测生物过程。特别是肿瘤细胞,干细胞,特定的免疫细胞类型,病毒性病原体,寄生虫和细菌的存在可以实时在动物活体1-2遵循。应用生物发光成像研究的病原体相比,传统的战略分析感染动物模型3-4的优势。感染可可视范围内的动物个体随着时间的推移,不要求安乐死,以确定病原体的位置和数量。光学成像允许所有组织和器官进行全面检查,而不是以前已知的被感染的网站取样。此外,接种到特定组织中的准确性,可以直接决定之前进行,整个实验失败向前动物接种。控制动物之间的可变性,因为成像允许每个动物应遵循个别。成像有可能大大减少,因为能够获得大量的时间点的数据,而无需组织样本,以确定病原体负荷3-4动物数量需要。
该协议描述的方法来可视化重组菌株表达荧光素酶的细菌的生物发光成像在活的动物感染。单击甲虫(CBRLuc)和萤火虫荧光素酶(FFluc)利用荧光素作为基材5-6。 CBRluc和FFluc产生的光有一个宽的波长从500纳米到700纳米,使得这些荧光素酶在活的动物模型7-9的光学成像的优秀记者。这主要是因为波长大于600纳米的光,以避免被血红蛋白吸收,因此,通过有效旅行哺乳动物组织。荧光素酶基因引入细菌产生的光信号10。小鼠接种发光细菌气管允许监测实时感染肺。荧光素注射后,使用IVIS成像系统的图像采集。在成像过程中,小鼠与使用XGI - 8气体Anethesia系统异氟醚麻醉。可以将图像分析,本地化和量化的信号源,代表细菌感染的网站(S)和数量,分别。后成像,CFU决心进行匀浆组织,以确认细菌的存在。几个剂量的细菌用于关联发光细菌数量。可应用于成像的发病机制和抗菌化合物和疫苗的疗效评价研究。
研究方案
1。肺部感染气管插管
- 称取小鼠,并选择性地标记可易于识别的耳朵。
- 麻醉氯胺酮(100微克每克鼠标重量)和甲苯噻嗪(鼠标重量的10微克每克)的小鼠腹腔接种。
- 放置老鼠笼中,直到完全麻醉。他们的脚挤压垫,检查踏板反射。小鼠显示减少或无反射反应。
- 鼠标放在插管趴在它的后面的立场。
- 一个橡皮筋固定插管的立场,然后放置在鼠标上切牙。使用磁带来修复腿和手臂上的插管立场。
- 轻轻移动图盖使用钳嘴。
- octoscope口内插入窥器和口咽看,直到喉部开放可见。
- cathether直到catether枢纽覆盖到气管预先导丝在门齿。卸下导丝。放入cathether空气,观察胸部扩张,确认无误后插管。
- 注入细菌50μL(我们使用的卡介苗卡介苗(BCG)表示“甲虫红色荧光素酶”(CBRLuc),在我们的实验室建设,但可用于任何发光细菌菌株显示的图像)解决方案通过使用1 mL注射器cathether。
- 鼠标放置在一个笼子里,并观察它从麻醉中恢复期间。
2。动物麻醉及生物发光成像的制备
小鼠与使用XGI - 8气体Aneshesia系统异氟醚麻醉。
- 经营XGI - 8麻醉系统之前,权衡每个木炭滤筒,写它的重量和日期。如果体重超过初始重量为50克,更换一个新罐。
- 检查蒸发器在异氟醚的水平,并在必要时填写。
- 打开疏散泵XGI - 8麻醉系统的前端,并设置为8 LPM(每minuite公升)。
- 打开从高压气瓶的氧气供应,将它设置为55 PSIG。
- 打开氧气切换(绿色)XGI - 8麻醉系统的前端。
- 打开成像室的气体流量设置气体流量的水平。设置为0.25 LPM,然后关闭气流量。
- 打开麻醉诱导室的气体流量设置气体流量的水平。设置为1.5 LPM,然后关闭气流量。
- 打开异氟醚与蒸发器,并设置为2-2.5%。异氟醚的水平,可以调整取决于正在使用的动物和重量。
- 将小鼠到感应室,并盖上盖子。转到感应室的气体流量。 5室小鼠 - 10 minuites,直到它们被麻醉完全。
- 应用光学软膏对眼睛在成像过程中,以保护鼠标的眼睛,在成像室小鼠放置在麻醉歧管上的鼻锥。利用小鼠之间的光挡板,以防止光线反射到邻近的受试动物。
- 腹腔接种注入荧光素(150微克/克体重)。
3。生物发光成像
- 启动生活成像软件。
- 如果系统未初始化,初始化的IVIS成像系统。
- 设置IVIS收购控制面板中按一下序列设置成像参数。
选择发光成像模式和照片。如果需要的选项进行DLIT三维重建图像序列的一部分,选择摄影,荧光和结构光图像。
设置从0.5秒到10分钟的曝光时间。
设置分级和F /停止样品的亮度预计的基础上。
设置过滤器来阻止和排放过滤器打开的激发,除非计划收购只有特定波长的光。 DLIT 3D宪法的情况下,设置多个不同波长的排放过滤器,以允许源的准确定位。
设置从视场为D,根据小鼠或地区的动物进行成像。 4-5只选择一个为1个鼠标,C为2-3小鼠和D和B。 - 点击添加图像采集控制面板,添加的顺序设置向导。
- 通过点击收购启动成像序列。
DLIT 3D建筑的情况下,荧光图像,在不同波长的多个排放过滤器将被收购。摄影及结构光图像也将被收购。 - 在采集过程中的形象和编辑图像的水平面板将可见。填写尽可能详细的信息,实验的形象,以确保方便在稍后的时间图像跟踪和保存你的图像中的每个编辑。
- ReRemove小鼠IVIS成像室,并归还给他们的笼子。从观察的恢复感知,以确保小鼠没有显着影响的过程。应不断监测动物从麻醉中(通常是1-2分钟),直至他们完全恢复。
4。 前体内成像在肺部和CFU为细菌的定量分析
- 以同样的方式注入荧光素腹腔注射小鼠,为成像,只是之前安乐死。
- 安乐死的小鼠腹腔注射100毫克/公斤pentobarbitol荧光素注射后5分钟。
- 外植体在无菌培养皿,菜用无菌镊子和剪刀从小鼠和地方的肺部。
- 置于培养皿菜含有explanted在成像腔器官,并获得同样的方式在整个鼠标的生物发光图像。
- 成像后,取出培养皿用无菌镊子的菜explanted机关和同质化在1 mL PBS。
- 作出适当的选择性培养基稀释和板组织。均质组织可以存储为-80℃,如果有必要重新电镀。另外,组织匀浆可用于RNA或DNA的提取,量化的qPCR细菌数字。
5。发光成像分析
- 启动“生活成像软件”,和浏览图像文件。
- 使用“工具面板”调整图像。点击图片,调整修改校正/过滤设置和最小/最大个人色阶。
- 在下拉列表中使用的光的强度进行量化的投资回报率的工具。选择ROI的形状,数量和规模。拖动的投资回报率帧图像的兴趣区域。确保所有的投资回报率是相同的大小和形状。点击的投资回报率的测量和保存,复制和/或出口的定量数据。
- DLIT三维重建的情况下,包括结构光图像载入图像序列。点击在工具的表面形貌普拉特。在下拉列表中,单击“重建”选项卡产生的表面形貌。 A面很乱,然后将出现在窗口中。
- 选择DLIT三维重建中的工具普拉特。在下拉列表中,单击“属性”选项卡,设置组织的性质和来源的频谱。在大多数情况下肌肉建议。在下拉列表中,单击“分析”选项卡上选择的波长进行分析。单击“参数”选项卡,并确认默认值,或如果必要的调整DLIT参数。单击“重建”选项卡“启动3D分析。
- 当完成三维重建,三维视图将显示三维重建的结果。单击“结果”选项卡上看到的光子密度,体素和DLIT算法参数的分析数据。
- 保存和/或出口到数字和数据文件的三维重建分析的结果。
6。代表性的成果:
随着鼠标在未受感染的控制与发光细菌感染小鼠的生物发光图像如图1所示。发光细菌感染小鼠肺产生显着的信号从肺部(图1)。发光强度是量化的总光通量在ROI(感兴趣区域)(图2)。光照强度的量化数据是从肺部获得确认该信号是从发光细菌可以相比,阴性对照细菌菌落形成单位(CFU)的正常化。 DLIT三维重建基础上的鼠标表面11层析成像的发光源的位置和信号强度,可以进一步分析。这些分析使产生的发光信号的量化和本地化。在感染小鼠的荧光源的三维重建结果表明,光从鼠标肺部(图3)。确认发光造成的小鼠肺组织的体外图像是从肺部发出,而不是其他一些密切并列的组织或器官(图2C)。

图1。发光成像与CBRluc标签的发光细菌肺感染小鼠未感染控制鼠标在左边,在右边的两个感染小鼠。小鼠感染与表达CBRluc(N = 2)细菌通过气管内的路线。荧光素注射后10分钟,发光图像获得10分在4个位置:背,腹,左侧和右侧。
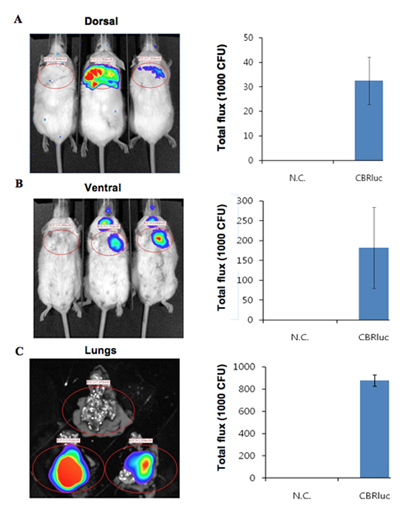
图2。表达CBRluc细菌感染小鼠的定量的光照强度(A,B)的投资回报率分析和量化光背,腹位置,从投资回报率的总流量的发光图像分别。未感染小鼠在左边,在右边两个感染小鼠。从肺部Ø发光图像被收购f小鼠未感染和感染与CBRlux(N = 2)。肺周围的光线强度,量化的投资回报率分析。三) 前未受感染者(上)和感染(上下两集肺部)小鼠肺的体内图像。荧光素注射5 miniuts前安乐死和图像,然后收购。量化值进行归一CFU。
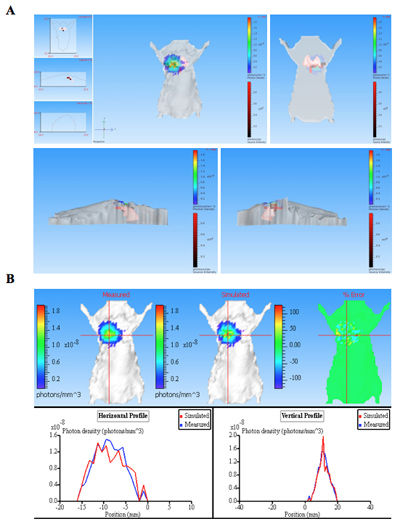
图3。生物发光源(S)从肺感染小鼠的三维重建 。,鼠标表达CBRluc气管内注射的细菌感染。使用不同的发射波长从540纳米到700纳米的串行过滤器获得的图像序列。用于三维重建在受试动物,包含了结构IMAG发光源图像序列。一)鼠标断层显示在不同的岗位:正面,背面,左,右。光源体素(3D鼠标内的红色框),位于内肺癌重建确定。二)光子densiy地图的测量和模拟数据。比较的测量和模拟的光子密度曲线重建质量提供了信息。质量好的重建结果在类似的测量和模拟光子密度。
讨论
尽管这些协议通常会导致在高品质的图像,重要的是要考虑的几个关键问题,以便获得准确和一致的数据,影像学检查。应收购,从600到60,000个计数,以确保信号是上述背景及相机不饱和发光图像。如果信号获得低于600,曝光条件下,应调整增加计数。如果信号获得超过60,000相机在一些地区已经饱和。当相机饱和,量化不应该尝试在饱和的地区,但它仍然有可能在非饱和的地区,有时必要。此外?...
披露声明
致谢
作者感谢整个研究的有价值的讨论和援助奇里洛实验室成员。我们感谢约书亚 - 希尔博士的詹姆斯博士的援助塞缪尔实验室,在本议定书的拍摄。这项工作是由比尔和梅林达盖茨基金会和来自美国国立卫生研究院授予AI47866授予48523。
材料
| Name | Company | Catalog Number | Comments |
| Isoflurane | VETONE | 501027 | |
| Ketamine | Butler Animal Health Supply | ||
| Xylazine | MP Biomedicals | 158307 | |
| Luciferin | GMT | LUCK-100 | |
| Fetal plus solution | Vortech Pharmaceutical Ls, Ltd | ||
| Cathether (22G x 1”) | Terumo Medical Corp. | OX2225CA | |
| Guide wire | Hallowell EMC | 210A3491 | |
| Octocope with speculum | Hallowell EMC | 000A3748 | |
| Xenogen IVIS system | Caliper Life Sciences | ||
| XGI-8-gas Anesthsia System | Caliper Life Sciences | ||
| Living Imaging Software | Caliper Life Sciences | ||
| Transparent nose cones | Caliper Life Sciences | ||
| Light baffle divider | Caliper Life Sciences |
参考文献
- Wilson, T., Hastings, J. W. Bioluminescence. Annu Rev Cell Dev Biol. 14, 197-230 (1998).
- Contag, C. H., Bachmann, M. H. Advances in in vivo bioluminescence imaging of gene expression. Annu Rev Biomed Eng. 4, 235-260 (2002).
- Hutchens, M., Luker, G. D. Applications of bioluminescence imaging to the study of infectious diseases. Cell Microbiol. 9, 2315-2322 (2007).
- Doyle, T. C., Burns, S. M., Contag, C. H. In vivo bioluminescence imaging for integrated studies of infection. Cell Microbiol. 6, 303-317 (2004).
- Wood, K. V., Lam, Y. A., Seliger, H. H., McElroy, W. D. Complementary DNA coding click beetle luciferases can elicit bioluminescence of different colors. Science. 244, 700-702 (1989).
- Wet, J. R. d. e., Wood, K. V., Helinski, D. R., DeLuca, M. Cloning of firefly luciferase cDNA and the expression of active luciferase in Escherichia coli. Proc Natl Acad Sci U S A. 82, 7870-7873 (1985).
- Hastings, J. W. Chemistries and colors of bioluminescent reactions: a review. Gene. 173, 5-11 (1996).
- Zhao, H. Emission spectra of bioluminescent reporters and interaction with mammalian tissue determine the sensitivity of detection in vivo. J Biomed Opt. 10, 41210-41210 (2005).
- Rice, B. W., Cable, M. D., Nelson, M. B. In vivo imaging of light-emitting probes. J Biomed Opt. 6, 432-440 (2001).
- Contag, C. H. Photonic detection of bacterial pathogens in living hosts. Mol Microbiol. 18, 593-603 (1995).
- Kuo, C., Coquoz, O., Troy, T. L., Xu, H., Rice, B. W. Three-dimensional reconstruction of in vivo bioluminescent sources based on multispectral imaging. J Biomed Opt. 12, 024007-024007 (2007).
- Weissleder, R. A clearer vision for in vivo imaging. Nat Biotechnol. 19, 316-317 (2001).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。