Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Mit Luciferase to Image Bakterielle Infektionen bei Mäusen
In diesem Artikel
Zusammenfassung
Methoden für die Biolumineszenz-Bildgebung von bakteriellen Infektionen in lebenden Tieren beschrieben. Krankheitserreger werden geändert, um auszudrücken Luciferase ermöglicht optische Ganzkörperbildgebungssysteme von Infektionen in lebenden Tieren. Tiermodelle können mit Luciferase exprimierenden Krankheitserreger infiziert werden und die daraus resultierende Verlauf der Erkrankung visualisiert in Echtzeit durch Biolumineszenz-Bildgebung.
Zusammenfassung
Imaging ist eine wertvolle Technik, die verwendet werden, um biologische Prozesse zu überwachen. Insbesondere kann das Vorhandensein von Krebs, Stammzellen, bestimmte Zelltypen, virale Krankheitserreger, Parasiten und Bakterien in Echtzeit innerhalb von lebenden Tieren 1-2 folgen. Die Anwendung des Biolumineszenz-Bildgebung zur Erforschung der Krankheitserreger hat Vorteile gegenüber herkömmlichen Strategien zur Analyse von Infektionen in Tiermodellen 3-4 verglichen. Infektionen können innerhalb der einzelnen Tiere visualisiert im Laufe der Zeit, ohne dass Euthanasie auf die Lage und Menge des Erregers zu bestimmen. Die optische Bildgebung ermöglicht eine umfassende Untersuchung aller Gewebe und Organe, anstatt Probenahme von Seiten bisher bekannten infiziert zu sein. Darüber hinaus kann die Genauigkeit der Impfung in bestimmten Geweben direkt bestimmt werden vor der Durchführung vor Tieren, die erfolglos während des gesamten Experiments wurden geimpft. Variabilität zwischen den Tieren kann kontrolliert werden, da Bildgebung ermöglicht jedes Tier einzeln verfolgt werden. Imaging hat das Potenzial, deutlich reduzieren Tierzahlen notwendig, weil der Fähigkeit, Daten aus zahlreichen Zeitpunkten ohne Probe Gewebe Erreger Last bestimmt 3-4 erhalten.
Dieses Protokoll beschreibt Methoden, um Infektionen in lebenden Tieren mit Biolumineszenz-Bildgebung für die rekombinante Bakterienstämme, die Luciferase zu visualisieren. Der Klick Käfer (CBRLuc) und Glühwürmchen-Luciferase (FFluc) nutzen Luciferin als Substrat 5-6. Das Licht von beiden CBRluc und FFluc hervorgebracht hat einen breiten Wellenlängenbereich von 500 nm bis 700 nm, so dass diese Luciferasen ausgezeichnete Reporter für die optische Bildgebung im lebenden Tier-Modellen 7-9. Dies ist vor allem, weil Wellenlängen des Lichts größer als 600 nm erforderlich sind, um die Absorption von Hämoglobin zu vermeiden und damit reisen durch Säugetiergewebe effizient. Luciferase ist genetisch in die Bakterien eingeführt werden, um Licht-Signal 10 zu produzieren. Mäuse sind pulmonale mit Biolumineszenz Bakterien intratracheal zur Überwachung von Infektionen in Echtzeit ermöglichen geimpft. Nach Luciferin Injektion, werden die Bilder aufgenommen mit der IVIS Imaging System. Während der Aufnahme werden die Mäuse mit Isofluran mit einem XGI-8 Gas Anethesia System. Bilder können analysiert zu lokalisieren und zu quantifizieren, die Signalquelle, die die bakterielle Infektion Website (s) und die Zahl repräsentiert, bzw. werden. Nach der Bebilderung wird CFU Bestimmung an homogenisiert Gewebe durchgeführt, um das Vorhandensein von Bakterien zu bestätigen. Mehrere Dosen von Bakterien benutzt, um bakterielle Zahlen mit Lumineszenz korreliert. Imaging können genutzt werden um der Pathogenese und Beurteilung der Wirksamkeit von antimikrobiellen Verbindungen und Impfstoffe studieren.
Protokoll
1. Pulmonale Infektionen durch intratracheale Intubation
- Wiegen Mäusen und, optional, Markierungen können an den Ohren zur einfachen Identifizierung vorgenommen werden.
- Anesthetize die Mäuse mit Ketamin (100 ug pro g Maus Gewicht) und Xylazin (10 ug pro g Maus Gewicht) durch intraperitoneale Impfung.
- Legen Mäuse in Käfigen, bis sie vollständig betäubt. Drücken Sie die Pads von den Füßen in die Pedale treten Reflex zu überprüfen. Mäuse sollte reduziert oder Display keine Reflex-Reaktion.
- Legen Sie die Maus auf die Intubation stehen Liegen auf dem Rücken.
- Fix ein Gummiband um eine Intubation zu stehen und sie dann unter die oberen Schneidezähne der Maus. Verwenden Sie Klebeband um Arme und Beine auf die Intubation stehen fix.
- Bewegen Sie tougue aus dem Mund mit einer Pinzette.
- Legen Sie speculum mit octoscope Innere des Mundes und schauen Sie in Oropharynx bis Kehlkopf Öffnung sichtbar ist.
- Advance-Führungsdraht mit cathether in Luftröhre abgedeckt, bis catether Hub ist bei den Schneidezähnen. Entfernen Führungsdraht. Put Luft in cathether zur Brust Expansion zu beobachten und zu bestätigen korrekte Intubation.
- Inject 50 ul bakterielle (in den Abbildungen verwendeten wir Bacillus Calmette Guerin (BCG) zum Ausdruck klicken Käfer rot Luciferase (CBRLuc), in unserem Labor aufgebaut, sondern alle lumineszierenden Bakterienstamm verwendet werden kann) Lösung durch cathether mit einer 1 ml-Spritze.
- Bewegen Sie die Maus in einen Käfig und beobachte sie während aus der Narkose.
2. Tierische Betäubung und Vorbereitung für die Biolumineszenz Imaging
Mäuse sind mit Isofluran mit der XGI-8 Gas Aneshesia System.
- Vor der Inbetriebnahme des XGI-8 Anästhesie-System, wiegen jeweils Aktivkohlefilter Kanister und schreiben das Gewicht und das Datum drauf. Wenn das Gewicht von 50 Gramm mehr als der ursprüngliche Gewicht, ersetzen Sie ihn durch einen neuen Behälter.
- Überprüfen Sie die Isofluran-Ebene in den Verdampfer und füllen Sie ihn, wenn nötig.
- Schalten Sie den Evakuierungspumpe in der Vorderseite des XGI-8 Anästhesie-System und auf 8 lpm (Liter pro minuite).
- Schalten Sie die Sauerstoffzufuhr aus dem Hochdruck-Zylinder und setzen Sie ihn auf 55 psig.
- Schalten Sie den Sauerstoff toggle (grün) auf der Vorderseite der XGI-8 Anästhesie-System.
- Schalten Sie den Gasstrom auf die Bildgebung Kammer auf das Niveau der Gasfluss eingestellt. Set auf 0,25 lpm und schalten Sie dann den Gasstrom.
- Schalten Sie den Gasstrom auf die Narkose Kammer auf das Niveau der Gasfluss eingestellt. Set bis 1,5 lpm und schalten Sie dann Gasstrom.
- Schalten Sie die Isofluran mit dem Verdampfer und setzen auf 2-2,5 Prozent. Die Isofluran Ebene kann je nach der Anzahl der Tiere verwendet und Gewicht sein.
- Legen Sie die Mäuse in der Induktion Kammer und den Deckel schließen. Schalten Sie den Gasstrom auf die Induktion Kammer. Legen Mäuse in der Kammer für 5 bis 10 minuites, bis sie vollständig zu betäuben.
- Bewerben optische Salbe auf die Augen, um die Maus Augen während der Bildgebung zu schützen und setzen die Mäuse in der Imaging-Kammer in eine der Bugspitze über die Betäubung vielfältig. Verwenden Sie leichte Trennwand zwischen Mäusen, um die Reflexion von Licht auf benachbarte Tier Themen zu verhindern.
- Inject Luciferin (150 pg / g Körpergewicht) durch intraperitoneale Impfung.
3. Biolumineszenz-Bildgebung
- Starten Sie das Leben Imaging Software.
- Wenn das System nicht initialisiert wird, initialisieren Sie die IVIS Imaging Systems.
- Stellen Sie die Parameter für die Bildgebung, indem Reihenfolge Setup in IVIS Erwerb Bedienfeld.
Wählen Lumineszenz und fotografieren in Imaging-Modus. Wenn die Option zur Durchführung DLIT 3D-Rekonstruktion erwünscht ist, wählen Sie Foto-, Lumineszenz-und Struktur-Licht Bilder als Teil der Bildsequenz.
Set Belichtungszeit von 0,5 sec bis 10 Minuten.
Set Binning und F / Stop auf der Grundlage erwarteter Helligkeit der Probe.
Set Anregungsfilter zu blockieren und Emissionsfilter zu öffnen, es sei denn, der Planung, dass nur bestimmte Wellenlängen des Lichts zu erwerben. Im Falle von DLIT 3D Verfassung, setzen mehrere Emissions-Filter verschiedener Wellenlängen, um genaue Lokalisierung der Quelle ermöglichen.
Set FOV von A bis D in Abhängigkeit von der Anzahl der Mäuse oder Region Tier abgebildet werden. Wählen Sie A und B für 1 Maus, C für 2-3 Mäuse und D für 4-5 Mäuse. - Klicken Sie auf Hinzufügen in der Image-Assistenten in der Übernahme der Systemsteuerung, um die Reihenfolge Setup hinzuzufügen.
- Starten Bildgebungssequenz indem erwerben.
Im Falle von DLIT 3D-Konstruktion, wird lumineszierenden Bilder für mehrere Emissionsfilter bei verschiedenen Wellenlängen erworben werden. Fotografische und strukturiertem Licht Bilder auch erworben werden. - Bei der Aufnahme des Bildes und bearbeiten Bildebenen Panels sichtbar sein wird. Füllen Sie so detailliert wie möglich für jedes Experiment in Bild ändern, um die einfache Verfolgung von Bildern zu späteren Zeitpunkten zu gewährleisten, und speichern Sie Ihre Bilder.
- ReRemove die Mäuse aus IVIS Bildgebung Kammer und bringt sie in ihre Käfige. Beachten Sie Genesung von einerESTHESIA Mäusen sicher nicht signifikant von den Verfahren betroffen. Die Tiere sollten ständig überwacht werden, bis sie aus der Narkose (in der Regel 1-2 min) vollständig erholen.
4. Ex vivo Imaging und CFU-Analyse für die Quantifizierung von Bakterien in der Lunge
- Inject Mäuse mit Luciferin intraperitoneal in der gleichen Weise wie für die Bildgebung, kurz vor der Euthanasie.
- Euthanize die Mäuse durch intraperitoneale Injektion von 100 mg / kg pentobarbitol 5 min nach dem Luciferin Injektion.
- Explantation der Lunge von Mäusen und in sterile Petrischalen mit einer sterilen Pinzette und Schere.
- Legen Sie Petrischale mit explantierten Organ in der Bildgebung Kammer und erwerben Biolumineszenz Bilder in der gleichen Weise wie für die ganze Maus.
- Nach der Belichtung, entfernen explantierten Orgel aus Petrischale mit einer sterilen Pinzette und homogenisieren in 1 ml PBS.
- Machen Verdünnungen und Platte Gewebe auf den entsprechenden selektiven Medien. Homogenisierte Gewebe -80 ° C für re-Beschichtung gelagert werden sollte es notwendig sein. Alternativ können homogenisiert Gewebe für RNA oder DNA-Extraktion der bakteriellen Zahlen, die durch qPCR Quantifizierung verwendet werden.
5. Die Analyse der Lumineszenz Imaging
- Starten Sie "Living Imaging Software" und durchsuchen Sie die Image-Dateien.
- Verwenden Sie "Tool-Palette", um Bilder einzustellen. Klickt auf das Bild anpassen, um Korrektur / Filter-Einstellungen und min / max für einzelne Farbskalen ändern.
- Verwenden Sie ROI-Tools in Pulldown-Liste für die Quantifizierung der Lichtintensität. Wählen ROI Form, Anzahl und Größe. Drag ROI Frame region of interest auf das Bild. Sicherstellen, dass alle ROI haben die gleiche Größe und Form. Klicken Sie auf ROI-Messung und speichern, kopieren und / oder Export quantitative Daten.
- Im Falle von DLIT 3D-Rekonstruktionen, laden Bildsequenz einschließlich der mit strukturiertem Licht Bild. Klicken Sie auf Oberflächentopographie in der Tool-Platte. In Pull-Down-Liste, klicken Sie rekonstruieren Registerkarte, um die Topographie zu erzeugen. Eine Oberfläche Durcheinander wird dann in dem Fenster angezeigt werden.
- Wählen DLIT 3D-Rekonstruktion in der Tool-Platte. In Pull-Down-Liste, klicken Sie auf die Registerkarte Eigenschaften, um Gewebe Eigenschaften und Source-Spektrum gesetzt. Der Muskel ist in den meisten Fällen empfohlen. Im Pulldown-Liste, klicken Sie auf die Registerkarte Analysieren der Wellenlänge für die Analyse auszuwählen. Klicken Sie auf die Registerkarte Parameter und bestätigen Sie die Standardwerte oder passen DLIT Parameter, wenn nötig. Klicken Sie rekonstruieren Registerkarte 3D-Analyse zu starten.
- Als 3D-Rekonstruktion abgeschlossen ist, wird die 3D-Ansicht zeigt die Ergebnisse der 3D-Rekonstruktion. Klicken Sie auf die Registerkarte Ergebnisse der Analyse von Daten für Photonen-Dichte, Voxel und DLIT Algorithmus Parameter zu sehen.
- Speichern und / oder exportieren Sie die Ergebnisse der 3D-Rekonstruktion Analysen in Zahlen und Daten.
6. Repräsentative Ergebnisse:
Die Biolumineszenz Bilder von Mäusen mit Biolumineszenz Bakterien zusammen mit einem nicht infizierten Maus-Steuerung infiziert sind in Abbildung 1 dargestellt. Die Mäuse Lungen mit Biolumineszenz-Bakterien infiziert produzieren signifikantes Signal aus der Lunge (Abbildung 1). Lumineszenzintensität ist als Gesamt-Lichtstrom innerhalb einer ROI (Region of interessiert) (Abbildung 2) quantifiziert. Die quantitativen Daten für die Lichtintensität ist für Kolonie-bildenden Einheiten (KBE) von Bakterien von der Lunge erhalten, um zu bestätigen, dass das Signal von der Biolumineszenz Bakterien produziert und können zu negativen Kontrolle verglichen werden normalisiert. Die Lage und Intensität des Signals kann durch DLIT 3D-Rekonstruktion der Lumineszenz Quelle-Tomographie der Maus Fläche 11 analysiert werden. Diese Analysen erlauben die Quantifizierung und Lokalisierung der Biolumineszenz-Signal erzeugt. Die Ergebnisse der 3D-Rekonstruktion eines lumineszierenden Quelle in infizierten Mäusen zeigt, dass Licht von Lungen der Maus (Abbildung 3) hergestellt wird. Die ex vivo Bilder des resultierenden Mauslungen bestätigen, dass Lumineszenz wird von den Lungen abgegeben, sondern als einige andere eng nebeneinanderliegenden Gewebe oder Organ (Abbildung 2C).

Abbildung 1. Lumineszenzbildgebung der pulmonalen infizierten Mäuse mit Biolumineszenz Bakterien mit CBRluc getaggt. Infizierte Kontroll-Maus ist auf der linken und zwei infizierte Mäuse sind auf der rechten Seite. Die Mäuse wurden mit Bakterien exprimiert CBRluc (n = 2) infiziert über die intratracheale Route. Dorsal, ventral, links und rechts: 10 Minuten nach dem Luciferin Injektion wurden Lumineszenz Bilder für 10 min bei 4 Positionen erworben.
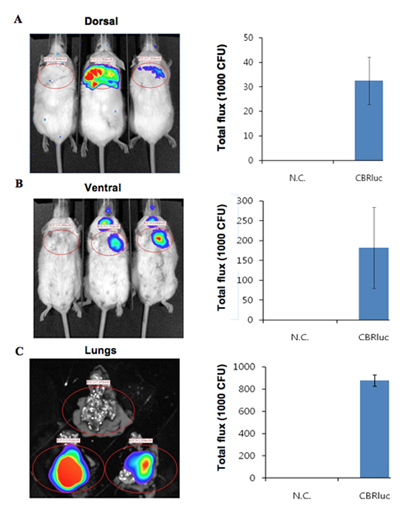
Abbildung 2. Die quantitative Lichtintensität von Mäusen, die mit Bakterien exprimiert CBRluc infiziert. (A, B) Lumineszenz Bilder von ROI-Analyse und der Quantifizierung insgesamt Lichtstrom von ROI in dorsalen und ventralen Positionen jeweils. Nicht infizierte Mäuse sind auf der linken und zwei infizierte Mäuse sind auf der rechten Seite. Lumineszenz Bilder wurden von der Lunge o erworbenf Mäusen infizierten und infizierten mit CBRlux (n = 2). Die Lichtintensität rund Lunge wurde durch ROI-Analyse quantifiziert. C) ex vivo Bilder der Lunge aus nicht infizierten (oben) und infizierten (unten zwei Sätze von Lunge) Mäusen. Luciferin war 5 miniuts injiziert, bevor der Euthanasie und Bilder dann erworben wurden. Die quantifizierten Werte sind CFU normalisiert.
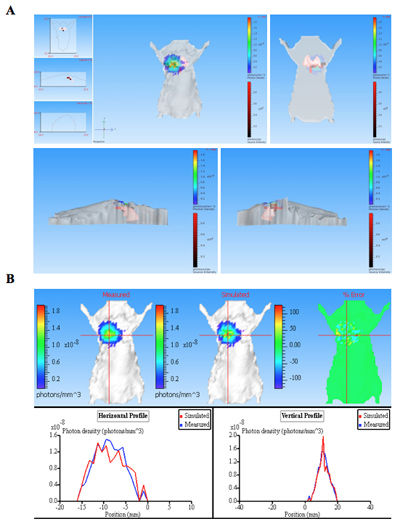
Abbildung 3. Die 3D-Rekonstruktion von Biolumineszenz Quelle (n) aus einer pulmonalen Infektion der Maus. Die Maus wurde mit Bakterien exprimiert CBRluc durch intratracheale Injektion infiziert. Die Bildsequenz wurde aufgenommen mit verschiedenen Emissions-Filter von seriellen Wellenlängen von 540 nm bis 700 nm. Ein Bild-Sequenz wurde für die 3D-Rekonstitution für Lumineszenz-Quelle in der Tier-Themen, die eine strukturierte imag enthalten sind, verwendet. A) Die Tomographie für die Maus ist in verschiedenen Positionen dargestellt: vorne, hinten, links und rechts. Lichtquellen werden als Voxel (rote Kästchen in 3D-Maus), die in Lunge befinden, werden als durch Rekonstruktion bestimmt gezeigt. B) Photon densiy Karte von gemessenen und simulierten Daten. Vergleicht man die gemessenen und simulierten Photonendichte Kurven stellen die Informationen der Qualität der Rekonstruktion. Gute Qualität Rekonstruktionen Ergebnis in ähnlicher gemessenen und simulierten Photonendichten.
Diskussion
Obwohl die folgenden Protokolle werden in der Regel in qualitativ hochwertige Bilder, ist es wichtig, ein paar wichtige Fragen zu erörtern, um genaue und konsistente Daten aus bildgebenden Verfahren zu erhalten. Lumineszenz Bilder sollten erworben, die haben zählt von 600 bis 60.000, um sicherzustellen, dass das Signal über dem Hintergrund liegt und die Kamera ist nicht gesättigt werden. Wenn das Signal erhalten weniger als 600 der Expositionsbedingungen sollte so eingestellt zählt zu erhöhen. Wenn das Signal erha...
Offenlegungen
Danksagungen
Die Autoren danken der Cirillo Labor Mitglieder für wertvolle Diskussionen und Unterstützung in dieser Studie. Wir danken Dr. Joshua Hill und dem Labor von Dr. James Samuel um Hilfe bei bei den Dreharbeiten zu diesem Protokoll. Diese Arbeit wurde durch Grant 48523 von der Bill & Melinda Gates Foundation und gewähren AI47866 von den National Institutes of Health gefördert.
Materialien
| Name | Company | Catalog Number | Comments |
| Isoflurane | VETONE | 501027 | |
| Ketamine | Butler Animal Health Supply | ||
| Xylazine | MP Biomedicals | 158307 | |
| Luciferin | GMT | LUCK-100 | |
| Fetal plus solution | Vortech Pharmaceutical Ls, Ltd | ||
| Cathether (22G x 1”) | Terumo Medical Corp. | OX2225CA | |
| Guide wire | Hallowell EMC | 210A3491 | |
| Octocope with speculum | Hallowell EMC | 000A3748 | |
| Xenogen IVIS system | Caliper Life Sciences | ||
| XGI-8-gas Anesthsia System | Caliper Life Sciences | ||
| Living Imaging Software | Caliper Life Sciences | ||
| Transparent nose cones | Caliper Life Sciences | ||
| Light baffle divider | Caliper Life Sciences |
Referenzen
- Wilson, T., Hastings, J. W. Bioluminescence. Annu Rev Cell Dev Biol. 14, 197-230 (1998).
- Contag, C. H., Bachmann, M. H. Advances in in vivo bioluminescence imaging of gene expression. Annu Rev Biomed Eng. 4, 235-260 (2002).
- Hutchens, M., Luker, G. D. Applications of bioluminescence imaging to the study of infectious diseases. Cell Microbiol. 9, 2315-2322 (2007).
- Doyle, T. C., Burns, S. M., Contag, C. H. In vivo bioluminescence imaging for integrated studies of infection. Cell Microbiol. 6, 303-317 (2004).
- Wood, K. V., Lam, Y. A., Seliger, H. H., McElroy, W. D. Complementary DNA coding click beetle luciferases can elicit bioluminescence of different colors. Science. 244, 700-702 (1989).
- Wet, J. R. d. e., Wood, K. V., Helinski, D. R., DeLuca, M. Cloning of firefly luciferase cDNA and the expression of active luciferase in Escherichia coli. Proc Natl Acad Sci U S A. 82, 7870-7873 (1985).
- Hastings, J. W. Chemistries and colors of bioluminescent reactions: a review. Gene. 173, 5-11 (1996).
- Zhao, H. Emission spectra of bioluminescent reporters and interaction with mammalian tissue determine the sensitivity of detection in vivo. J Biomed Opt. 10, 41210-41210 (2005).
- Rice, B. W., Cable, M. D., Nelson, M. B. In vivo imaging of light-emitting probes. J Biomed Opt. 6, 432-440 (2001).
- Contag, C. H. Photonic detection of bacterial pathogens in living hosts. Mol Microbiol. 18, 593-603 (1995).
- Kuo, C., Coquoz, O., Troy, T. L., Xu, H., Rice, B. W. Three-dimensional reconstruction of in vivo bioluminescent sources based on multispectral imaging. J Biomed Opt. 12, 024007-024007 (2007).
- Weissleder, R. A clearer vision for in vivo imaging. Nat Biotechnol. 19, 316-317 (2001).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten