Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
En utilisant la luciférase aux infections bactériennes chez les souris image
Dans cet article
Résumé
Méthodes pour l'imagerie par bioluminescence des infections bactériennes chez les animaux vivants sont décrits. Les agents pathogènes sont modifiées pour exprimer la luciférase permettant d'imagerie optique du corps entier des infections chez les animaux vivants. Les modèles animaux peuvent être infectés par des pathogènes exprimer la luciférase et le cours résultant de la maladie de visualiser en temps réel par imagerie par bioluminescence.
Résumé
L'imagerie est une technique intéressante qui peut être utilisé pour surveiller les processus biologiques. En particulier, la présence de cellules cancéreuses, cellules souches, des types spécifiques de cellules immunitaires, des agents pathogènes viraux, les parasites et les bactéries peuvent être suivies en temps réel au sein des animaux vivants, 1-2. Application de l'imagerie par bioluminescence à l'étude des agents pathogènes présente des avantages par rapport aux stratégies classiques en matière d'analyse des infections dans les modèles animaux 3-4. Les infections peuvent être visualisés dans les animaux individuels au fil du temps, sans exiger l'euthanasie afin de déterminer l'emplacement et la quantité de l'agent pathogène. L'imagerie optique permet un examen complet de tous les tissus et organes, plutôt que de l'échantillonnage de sites déjà connus pour être infectés. En outre, la précision de l'inoculation dans des tissus spécifiques peuvent être directement déterminés avant le transport des animaux vers l'avant qui ont été inoculés sans succès à travers toute l'expérience. La variabilité entre les animaux peuvent être contrôlés, puisque l'imagerie permet à chaque animal à être suivis individuellement. Imaging a le potentiel de réduire considérablement le nombre d'animaux nécessaires en raison de la capacité d'obtenir des données à partir de points de temps de nombreux tissus sans avoir à l'échantillon pour déterminer la charge pathogène 3-4.
Ce protocole décrit les méthodes pour visualiser les infections chez les animaux vivants en utilisant l'imagerie par bioluminescence pour les souches recombinantes de bactéries exprimant la luciférase. Le taupin (CBRLuc) et luciférases luciole (FFluc) utilisent comme substrat luciférine 5-6. La lumière produite par les deux CBRluc et FFluc a une longueur d'onde large de 500 nm à 700 nm, ce qui rend ces journalistes luciférases excellent pour l'imagerie optique dans des modèles animaux qui vivent 7-9. C'est principalement parce que les longueurs d'onde de la lumière est supérieure à 600 nm sont nécessaires pour éviter l'absorption par l'hémoglobine et, par conséquent, les voyages à travers les tissus des mammifères de façon efficace. Luciférase est génétiquement introduits dans les bactéries pour produire des signaux de lumière 10. Les souris sont inoculées avec pulmonaires bactéries bioluminescentes intratrachéale pour permettre la surveillance des infections en temps réel. Après l'injection luciférine, les images sont acquises à l'aide du système d'imagerie IVIS. Lors d'imagerie, les souris sont anesthésiés à l'isoflurane utilisant une XGI-8 Gaz Anethesia système. Les images peuvent être analysées pour localiser et quantifier la source du signal, ce qui représente le site de l'infection bactérienne (s) et le nombre, respectivement. Après l'imagerie, la détermination UFC est effectué sur le tissu homogénéisé afin de confirmer la présence de bactéries. Plusieurs doses de bactéries sont utilisées pour corréler le nombre de bactéries à luminescence. Imaging peut être appliquée à l'étude de la pathogenèse et l'évaluation de l'efficacité des composés antibactériens et des vaccins.
Protocole
1. L'infection pulmonaire par intubation intratrachéale
- Peser les souris et, éventuellement, des marques peuvent être faites sur les oreilles pour une identification facile.
- Anesthésier la souris avec la kétamine (100 pg par gramme de poids de la souris) et de xylazine (10 ug par g de poids de la souris) par inoculation intrapéritonéale.
- Placez la souris dans des cages jusqu'à totalement anesthésiée. Pressez les coussinets de leurs pieds pour vérifier la pédale réflexe. Souris devrait afficher réduite ou pas de réaction réflexe.
- Placez la souris sur le stand de l'intubation couché sur le dos.
- Fixer un élastique pour tenir l'intubation et ensuite le placer sous les incisives supérieures de la souris. Utilisez du ruban adhésif pour fixer les jambes et les bras sur le stand d'intubation.
- Déplacez doucement Tougué sort de la bouche en utilisant une pince.
- Insérez spéculum avec l'intérieur octoscope de la bouche et regarder dans l'oropharynx jusqu'à l'ouverture du larynx est visible.
- Fil-guide Advance couvertes de cathether dans la trachée jusqu'au catether hub est à l'incisives. Retirez le fil guide. Mettez de l'air dans cathether d'observer l'expansion thoracique et de confirmer l'intubation correcte.
- Injecter 50 ul de bactéries (dans les images présentées, nous avons utilisé le bacille de Calmette Guérin (BCG) exprimant taupin rouges luciférase (CBRLuc), construit dans notre laboratoire, mais toute souche bactérienne luminescente peut être utilisé) solution par cathether l'aide d'une seringue de 1 ml.
- Placez la souris dans une cage et l'observer lors de la récupération de l'anesthésie.
2. Anesthésie des animaux et de préparation pour l'imagerie par bioluminescence
Les souris sont anesthésiés à l'isoflurane utilisant la XGI-8 Gaz Aneshesia système.
- Avant de faire fonctionner le système de XGI-8 anesthésie, peser chaque cartouche de filtre à charbon et d'écrire le poids et la date. Si le poids est de 50 grammes de plus du poids initial, la remplacer par une nouvelle cartouche.
- Vérifier le niveau d'isoflurane dans le vaporisateur et remplissez-le si nécessaire.
- Tournez sur la pompe d'évacuation à l'avant de l'XGI-8 système d'anesthésie et de mettre à 8 LPM (litres par minuite).
- Ouvrez l'alimentation en oxygène de la bouteille haute pression et le mettre à 55 psig.
- Mettez de l'oxygène à bascule (en vert) sur la face avant du système de XGI-8 anesthésie.
- Allumez le débit de gaz de la chambre de l'imagerie pour régler le niveau du débit de gaz. Régler à 0,25 lpm puis éteignez le débit de gaz.
- Allumez le débit de gaz de la chambre de l'induction anesthésique pour régler le niveau du débit de gaz. Set à 1,5 lpm puis éteignez débit de gaz.
- Allumez l'isoflurane avec le vaporisateur et mis à 2-2,5 pour cent. Le niveau de l'isoflurane peut être ajusté en fonction du nombre d'animaux utilisés et le poids.
- Placez la souris dans la chambre de l'induction et fermer le couvercle. Allumez le débit du gaz à la chambre de l'induction. Souris Placer dans la chambre pendant 5 - 10 minuites jusqu'à ce qu'ils soient anesthésier complètement.
- Appliquer une pommade optiques pour les yeux afin de protéger les yeux de souris lors de l'imagerie et le lieu de la souris dans la chambre de l'imagerie dans l'un des cônes de nez sur le collecteur d'anesthésie. Utilisez déflecteur de lumière entre la souris pour empêcher la réflexion de la lumière sur des sujets animaux adjacents.
- Injecter luciférine (150 ug / g de poids corporel) par inoculation intrapéritonéale.
3. Imagerie par bioluminescence
- Démarrez le logiciel d'imagerie habitable.
- Si le système n'est pas initialisé, initialiser le système d'imagerie IVIS.
- Définissez les paramètres pour l'imagerie en cliquant dans le panneau de configuration séquence IVIS de contrôle d'acquisition.
Sélectionnez la luminescence et de photographier en mode imagerie. Si l'option d'effectuer DLit reconstruction 3D est souhaitée, sélectionnez photographique, luminescentes et structurelles des images en lumière dans le cadre de la séquence d'images.
Réglez le temps d'exposition de 0,5 sec à 10 minutes.
Réglez Binning et F / arrêt repose sur la luminosité attendue de l'échantillon.
Set filtre d'excitation et d'émission de bloquer filtre pour ouvrir, à moins d'acquérir la planification des longueurs d'onde spécifiques que de lumière. Dans le cas de DLit 3D constitution, de définir des filtres d'émission multiples longueurs d'onde différentes pour permettre une localisation précise des sources.
Réglez FOV de A à D selon le nombre de souris ou de la région de l'animal à imager. Sélectionnez A et B pour une souris, C pour 2-3 souris, et D pour 4-5 souris. - Cliquez sur Ajouter dans l'Assistant d'image dans le Panneau de configuration Acquisition d'ajouter la configuration séquence.
- Démarrer séquence d'imagerie en cliquant acquérir.
Dans le cas de la construction DLit 3D, images luminescentes seront acquises pour les filtres d'émission multiples à différentes longueurs d'onde. Photographiques et des images en lumière structurée sera également acquise. - Pendant l'acquisition de l'image et modifier les niveaux d'image des panneaux seront visibles. Remplissez informations aussi détaillées que possible pour chaque expérience dans l'édition d'image afin d'assurer le suivi facile des images à des moments plus tard, et enregistrer vos images.
- ReRemove les souris à partir d'imagerie IVIS de chambre et de les retourner dans leur cage. Observez la récupération à partir d'unesthesia pour assurer les souris n'ont pas été significativement affectés par la procédure. Les animaux doivent être surveillés en permanence jusqu'à ce qu'ils se remettre complètement de l'anesthésie (généralement 1-2 min).
4. Ex vivo d'imagerie et d'analyse UFC pour la quantification des bactéries dans les poumons
- Injecter des souris avec la luciférine par voie intrapéritonéale de la même manière que pour l'imagerie, juste avant l'euthanasie.
- Euthanasier les souris par injection intrapéritonéale de 100 mg / kg pentobarbital 5 min après l'injection luciférine.
- Explantation les poumons des souris et les placer dans Petri stérile-plats à l'aide des pinces stériles et des ciseaux.
- Placez boîte de Petri contenant organes explantés dans l'imagerie de chambre et d'acquérir des images de bioluminescence de la même manière que pour la souris tout entière.
- Après l'imagerie, enlever l'organe explanté de boîte de Pétri à l'aide des pinces stériles et homogénéiser dans 1 ml de PBS.
- Faire les dilutions et les tissus plaque sur le support approprié sélectif. Tissu homogénéisé peut être stocké à -80 ° C pour les re-placage devrait-il être nécessaire. Alternativement, tissu homogénéisé peut être utilisé pour l'extraction d'ADN ou d'ARN à quantifier le nombre de bactéries par qPCR.
5. L'analyse de l'imagerie de luminescence
- Démarrer "logiciel d'imagerie Vivre" et de parcourir les fichiers image.
- Utilisez la palette d'outils «d'ajuster les images. Cliquez sur l'image Régler la correction de modifier / paramètres de filtrage et min / max pour les échelles de couleurs individuelles.
- Utiliser des outils de ROI dans la liste déroulante pour la quantification de l'intensité lumineuse. Sélectionnez ROI forme, le nombre et la taille. Faites glisser le ROI cadre pour la région d'intérêt sur l'image. S'assurer que tous les ROI sont de la même taille et la forme. Cliquez ROI de mesure et d'enregistrer, copier et / ou exporter des données quantitatives.
- Dans le cas de reconstructions 3D DLit, charger une séquence d'images, y compris l'image de la lumière structurée. Cliquez topographie de surface dans l'outil Platte. Dans la liste déroulante, cliquez sur l'onglet Reconstruire pour générer la topographie de la surface. Un gâchis de surface apparaîtra alors dans la fenêtre.
- Sélectionnez DLit reconstruction 3D de la Platte outil. Dans la liste déroulante, cliquez sur l'onglet Propriétés pour définir les propriétés des tissus et de spectre de la source. Le muscle est recommandée dans la plupart des circonstances. Dans la liste déroulante, cliquez sur l'onglet Analyser pour sélectionner la longueur d'onde pour l'analyse. Cliquez sur l'onglet Paramètres et confirmer les valeurs par défaut ou ajuster les paramètres DLit si nécessaire. Cliquez Reconstruire onglet pour commencer l'analyse 3D.
- Lorsque la reconstruction 3D est terminé, la vue 3D affiche les résultats de la reconstruction 3D. Cliquez sur l'onglet pour voir les résultats d'analyse de données pour la densité de photons, voxels et paramètres de l'algorithme DLit.
- Enregistrer et / ou d'exporter les résultats des analyses de la reconstruction 3D dans les chiffres et les fichiers de données.
6. Les résultats représentatifs:
Les images de bioluminescence de souris infectées par des bactéries bioluminescentes long avec un contrôle de la souris non infectées sont présentés dans la figure 1. Le pulmonaires des souris infectées par des bactéries bioluminescentes produire un signal significatif dans les poumons (figure 1). L'intensité de luminescence est quantifiée comme flux total au sein d'un ROI (région d'intérêt) (figure 2). Les données quantitatives pour l'intensité lumineuse est normalisée pour les unités formant colonies (UFC) de bactéries obtenues à partir des poumons pour confirmer que le signal est produit à partir du bactéries bioluminescentes et peut être comparé au contrôle négatif. L'emplacement et l'intensité du signal peut être encore analysés par DLit reconstruction 3D de la source de luminescence basée sur la tomographie de la surface de 11 souris. Ces analyses permettent de quantifier et de la localisation du signal bioluminescent produite. Les résultats de la reconstruction 3D d'une source luminescente chez des souris infectées démontre que la lumière est produite à partir de poumons de souris (figure 3). Les images ex vivo des poumons de souris résultant de confirmer que la luminescence est émise par les poumons, plutôt que quelque autre tissu ou organe étroitement juxtaposés (figure 2C).

Figure 1. Imagerie de luminescence des pulmonaires des souris infectées par des bactéries bioluminescentes tagués avec CBRluc. Contrôle de la souris non infectées est sur la gauche et deux souris infectées sont sur la droite. Les souris ont été infectées par des bactéries exprimant CBRluc (n = 2) par voie intra-trachéale. 10 minutes après l'injection de luciférine, des images de luminescence ont été acquis pour 10 min à 4 positions: dorsale, ventrale, côté gauche et côté droit.
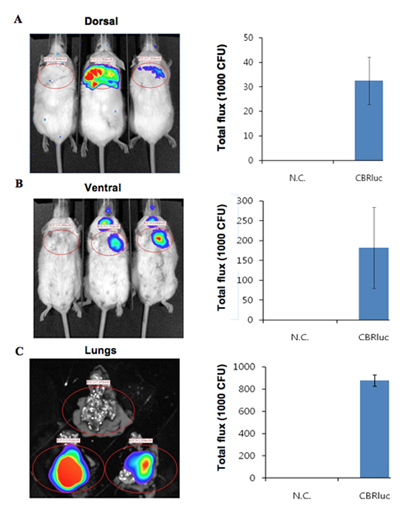
Figure 2. L'intensité de la lumière quantitative de souris infectées par des bactéries exprimant CBRluc. (A, B) des images de luminescence de l'analyse de ROI et de quantifier le flux total de lumière du retour sur investissement dans les positions dorsale et ventrale, respectivement. Souris non infectées sont à gauche et deux souris infectées sont sur la droite. Luminescence des images ont été acquises à partir de poumons of souris infectés ou non par CBRlux (n = 2). L'intensité de la lumière autour des poumons a été quantifiée par l'analyse du ROI. C) des images ex vivo de poumons de non infectés (en haut) et infectés (en bas deux ensembles de poumons) chez la souris. Luciférine a été injecté 5 miniuts avant de l'euthanasie et les images ont ensuite été acquises. Les valeurs quantifiées sont normalisés à UFC.
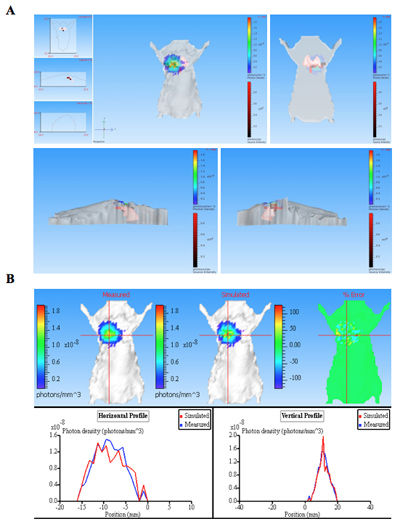
Figure 3. La reconstruction 3D de source de bioluminescence (s) à partir d'une souris infectée pulmonaires. La souris a été infectée par des bactéries exprimant CBRluc par injection intratrachéale. La séquence d'images a été acquise en utilisant des filtres d'émission de longueurs d'onde différentes de série à partir de 540 nm à 700 nm. Une séquence d'images a été utilisé pour la reconstitution en 3D de la source de luminescence dans les matières animales qui contenait une imagerie structurée. A) La tomographie pour la souris est montré dans différentes positions: avant, arrière, gauche et droite. Les sources lumineuses sont représentées par voxels (cases rouges dans les souris 3D) qui sont situés dans des poumons tel que déterminé par la reconstruction. B) Photon densiy carte de données mesurées et simulées. En comparant les courbes mesurées et simulées densité de photons de fournir les informations sur la qualité de la reconstruction. Bonne qualité des reconstructions entraîner similaires densités mesurées et simulées photon.
Discussion
Bien que suivant ces protocoles seront généralement lieu à des images de haute qualité, il est important de considérer quelques questions clés en vue d'obtenir des données précises et cohérentes à partir d'études d'imagerie. Luminescence des images doivent être acquises qui ont compte de 600 à 60 000 pour s'assurer que le signal est au-dessus de fond et la caméra n'est pas saturé. Si le signal obtenu est inférieur à 600 les conditions d'exposition devraient être ajustées pour a...
Déclarations de divulgation
Remerciements
Les auteurs remercient les membres du laboratoire pour les discussions Cirillo et une aide précieuse tout au long de cette étude. Nous remercions le Dr Joshua Hill et le laboratoire du Dr James Samuel de l'aide pour le tournage de ce protocole. Ce travail a été financé par la subvention 48 523 de la Bill & Melinda Gates Foundation et accorder AI47866 du National Institutes of Health.
matériels
| Name | Company | Catalog Number | Comments |
| Isoflurane | VETONE | 501027 | |
| Ketamine | Butler Animal Health Supply | ||
| Xylazine | MP Biomedicals | 158307 | |
| Luciferin | GMT | LUCK-100 | |
| Fetal plus solution | Vortech Pharmaceutical Ls, Ltd | ||
| Cathether (22G x 1”) | Terumo Medical Corp. | OX2225CA | |
| Guide wire | Hallowell EMC | 210A3491 | |
| Octocope with speculum | Hallowell EMC | 000A3748 | |
| Xenogen IVIS system | Caliper Life Sciences | ||
| XGI-8-gas Anesthsia System | Caliper Life Sciences | ||
| Living Imaging Software | Caliper Life Sciences | ||
| Transparent nose cones | Caliper Life Sciences | ||
| Light baffle divider | Caliper Life Sciences |
Références
- Wilson, T., Hastings, J. W. Bioluminescence. Annu Rev Cell Dev Biol. 14, 197-230 (1998).
- Contag, C. H., Bachmann, M. H. Advances in in vivo bioluminescence imaging of gene expression. Annu Rev Biomed Eng. 4, 235-260 (2002).
- Hutchens, M., Luker, G. D. Applications of bioluminescence imaging to the study of infectious diseases. Cell Microbiol. 9, 2315-2322 (2007).
- Doyle, T. C., Burns, S. M., Contag, C. H. In vivo bioluminescence imaging for integrated studies of infection. Cell Microbiol. 6, 303-317 (2004).
- Wood, K. V., Lam, Y. A., Seliger, H. H., McElroy, W. D. Complementary DNA coding click beetle luciferases can elicit bioluminescence of different colors. Science. 244, 700-702 (1989).
- Wet, J. R. d. e., Wood, K. V., Helinski, D. R., DeLuca, M. Cloning of firefly luciferase cDNA and the expression of active luciferase in Escherichia coli. Proc Natl Acad Sci U S A. 82, 7870-7873 (1985).
- Hastings, J. W. Chemistries and colors of bioluminescent reactions: a review. Gene. 173, 5-11 (1996).
- Zhao, H. Emission spectra of bioluminescent reporters and interaction with mammalian tissue determine the sensitivity of detection in vivo. J Biomed Opt. 10, 41210-41210 (2005).
- Rice, B. W., Cable, M. D., Nelson, M. B. In vivo imaging of light-emitting probes. J Biomed Opt. 6, 432-440 (2001).
- Contag, C. H. Photonic detection of bacterial pathogens in living hosts. Mol Microbiol. 18, 593-603 (1995).
- Kuo, C., Coquoz, O., Troy, T. L., Xu, H., Rice, B. W. Three-dimensional reconstruction of in vivo bioluminescent sources based on multispectral imaging. J Biomed Opt. 12, 024007-024007 (2007).
- Weissleder, R. A clearer vision for in vivo imaging. Nat Biotechnol. 19, 316-317 (2001).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon