É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Usando a luciferase Infecções bacterianas Imagem em camundongos
Neste Artigo
Resumo
Métodos de imagem de bioluminescência de infecções bacterianas em animais vivos são descritos. Patógenos são modificados para expressar luciferase permitindo que imagens de corpo inteiro óptico de infecções em animais vivos. Modelos animais podem ser infectados com patógenos luciferase expressar eo curso resultante de doença visualizadas em tempo real pela imagem de bioluminescência.
Resumo
Imagem é uma técnica valiosa que pode ser usado para monitorar processos biológicos. Em particular, a presença de células cancerosas, células-tronco, tipos específicos de célula imunológica, patógenos virais, parasitas e bactérias podem ser acompanhadas em tempo real dentro de animais vivos 1-2. Aplicação de imagem de bioluminescência para o estudo de patógenos tem vantagens em relação às estratégias convencionais para análise de infecções em modelos animais 3-4. Infecções podem ser visualizados dentro de animais individuais ao longo do tempo, sem a necessidade de eutanásia para determinar a localização ea quantidade do patógeno. Imageamento óptico permite o exame abrangente de todos os tecidos e órgãos, ao invés de amostragem de locais previamente conhecido por ser infectados. Além disso, a precisão da inoculação em tecidos específicos pode ser diretamente determinada antes do transporte de animais para a frente que foram inoculados sem sucesso durante todo o experimento. Variabilidade entre os animais podem ser controlados pela falta de imagens permite que cada animal a ser seguido individualmente. Imagem tem o potencial para reduzir significativamente o número de animais necessários por causa da capacidade de obter dados de numerosos pontos de tempo sem a necessidade de tecidos de amostra para determinar carga de patógenos 3-4.
Este protocolo descreve métodos para visualizar infecções em animais vivos usando imagens de bioluminescência de linhagens recombinantes de bactérias expressando luciferase. O besouro clique (CBRLuc) e luciferases firefly (FFluc) utilizam como substrato luciferina 5-6. A luz produzida por ambos os CBRluc FFluc e tem um comprimento de onda de 500 nm larga a 700 nm, tornando estes luciferases repórteres excelente para a imagem óptica em modelos animais de vida 7-9. Isso ocorre principalmente porque comprimentos de onda da luz é superior a 600 nm são necessárias para evitar a absorção pela hemoglobina e, assim, viajar através de tecidos de mamíferos, de forma eficiente. Luciferase é geneticamente introduzido na bactéria para produzir sinal de luz 10. Os ratos são pulmonar inoculada com bactérias bioluminescentes intratraqueal para permitir o monitoramento de infecções em tempo real. Após a injeção luciferina, as imagens são adquiridas usando o Sistema de Imagem IVIS. Durante a gravação, os ratos são anestesiados com isoflurano usando uma XGI-8 Gas Sistema Anethesia. As imagens podem ser analisados para localizar e quantificar a fonte do sinal, que representa o local da infecção bacteriana (s) e número, respectivamente. Depois de imagem, a determinação de UFC é realizada em tecido homogeneizado para confirmar a presença de bactérias. Várias doses de bactérias são usadas para correlacionar número de bactérias com luminescência. Imagem pode ser aplicada ao estudo da patogenia e avaliação da eficácia dos compostos antibacterianos e vacinas.
Protocolo
1. Infecção pulmonar por entubação endotraqueal
- Pesar ratos e, opcionalmente, as marcas podem ser feitas nas orelhas para fácil identificação.
- Anestesiar os ratos com cetamina (100 mg por g de peso do mouse) e xilazina (10 mg por g de peso do rato) por inoculação intraperitoneal.
- Camundongos lugar em gaiolas até totalmente anestesiado. Aperte as pontas dos seus pés para verificar pedal reflexo. Ratos deve exibir reduzida ou nenhuma reação reflexa.
- Posicione o mouse sobre o suporte intubação deitado de costas.
- Fix um elástico para ficar intubação e depois colocá-lo sob os incisivos superiores do mouse. Use fita adesiva para fixar as pernas e os braços no suporte intubação.
- Suavemente move tougue da boca com a pinça.
- Inserir espéculo com octoscope dentro da boca e orofaringe até olhar para a abertura da laringe é visível.
- Fio guia coberto com antecedência cathether em traquéia até cateter hub está no incisivos. Remova o fio guia. Coloque o ar para dentro cathether para observar a expansão torácica e confirmar a intubação correta.
- Injetar 50 mL de bactérias (nas imagens mostradas usamos bacilo Calmette Guerin (BCG) que expressa clique besouro vermelho luciferase (CBRLuc), construído no nosso laboratório, mas qualquer estirpe bacteriana luminescentes podem ser usados) solução através cathether usando uma seringa de 1 mL.
- Lugar do mouse em uma gaiola e observá-lo durante a recuperação da anestesia.
2. Anestesiados animais e preparação para o Imaging Bioluminescência
Os ratos são anestesiados com isoflurano usando a XGI-8 Gas Sistema Aneshesia.
- Antes de operar o XGI-8 sistema de anestesia, pesar cada canister filtro de carvão e escrever o peso ea data nele. Se o peso é 50 gramas mais do peso inicial, substituí-lo por uma lata nova.
- Verifique o nível de isoflurano no vaporizador e preenchê-lo se necessário.
- Ligue a bomba de evacuação em frente da XGI-8 sistema de anestesia e definir a 8 lpm (litros por minuite).
- Ligue o fornecimento de oxigênio a partir do cilindro de alta pressão e defini-la a 55 psig.
- Ligar o oxigênio de alternância (verde) na parte da frente do sistema de anestesia XGI-8.
- Ligar o fluxo de gás para a câmara de imagem para definir o nível de fluxo de gás. Ajustado para 0,25 lpm e depois desligar o fluxo de gás.
- Ligar o fluxo de gás para a câmara de indução da anestesia para definir o nível de fluxo de gás. Ajustado para 1,5 lpm e desligue o fluxo de gás.
- Ligue o isoflurano com o vaporizador e definido para 2-2,5 por cento. O nível de isoflurano pode ser ajustada dependendo do número de animais a ser utilizado e peso.
- Coloque os ratos dentro da câmara de indução e feche a tampa. Ligar o fluxo de gás para a câmara de indução. Camundongos lugar na câmara de 5-10 minuites até que sejam anestesiar completamente.
- Aplicar pomada óptica para os olhos para proteger os olhos do mouse durante o exame e colocar os ratos na câmara de imagem em um dos cones do nariz no colector de anestesia. Use defletor de luz entre os ratos para evitar o reflexo da luz sobre assuntos adjacentes animais.
- Injetar luciferina (150 mg / grama de peso corporal) por inoculação intraperitoneal.
3. Imagem bioluminescência
- Inicie o software de imagem Living.
- Se o sistema não é inicializado, inicializar o sistema de imagem IVIS.
- Definir os parâmetros para geração de imagens, clicando em configuração seqüência em IVIS painel de controle de aquisição.
Selecione luminescência e fotografar no modo de imagem. Se a opção de realizar DLIT reconstrução 3D é desejada, selecione fotográfico, luminescentes e estruturais imagens de luz como parte da seqüência de imagens.
Definir o tempo de exposição de 0,5 seg a 10 minutos.
Definir Binning e F / stop em função da luminosidade esperada da amostra.
Conjunto de excitação do filtro para bloquear e emissão de filtro para abrir, a menos que pretende adquirir comprimentos de onda específicos apenas da luz. No caso de DLIT 3D constituição, definir filtros de emissão múltiplos comprimentos de onda diferentes para permitir a localização exata da fonte.
Set FOV de A a D, dependendo do número de ratos ou região de origem animal a ser trabalhada. Selecione A e B para um mouse, C por 2-3 camundongos e ratos D por 4-5. - Clique em adicionar no Assistente de Imagem no Painel de Controle Aquisição de adicionar a configuração da seqüência.
- Comece seqüência de imagens, clicando em adquirir.
No caso de DLIT construção 3D, imagens luminescentes serão adquiridos para filtros de emissão múltiplos comprimentos de onda diferentes. Fotográficos e imagens de luz estruturada também será adquirido. - Durante a aquisição da imagem e editar painéis níveis imagem será visível. Preencha informações tão pormenorizadas quanto possível para cada experimento na edição de imagem para garantir fácil rastreamento de imagens em momentos posteriores e salvar suas imagens.
- ReRemove os ratos a partir de imagens IVIS câmara e devolvê-los às suas gaiolas. Observar a recuperação de umanestesia para garantir ratos não foram significativamente afetadas pelo procedimento. Os animais devem ser monitorados constantemente, até que se recuperar totalmente da anestesia (geralmente 1-2 min).
4. Ex vivo de Imagem e Análise de CFU para a quantificação de bactérias nos Pulmões
- Injetar camundongos com luciferina intraperitoneal da mesma maneira como para geração de imagens, pouco antes da eutanásia.
- Eutanásia os ratos por injeção intraperitoneal de 100 mg / kg 5 min após a injeção pentobarbitol luciferina.
- Explante os pulmões de camundongos e coloque em pratos de Petri estéreis usando uma pinça e tesouras estéreis.
- Coloque placa de Petri contendo órgão explantado em imagens de câmara e adquirir imagens bioluminescência da mesma maneira como para mouse todo.
- Depois de imagem, remoção de órgãos explantado de petri prato com a pinça estéril e homogeneizar em 1 mL de PBS.
- Fazer diluições e tecido placa na mídia apropriada seletivo. Tecido homogeneizado pode ser armazenado entre -80 ° C para a re-regulamentação, caso seja necessário. Alternativamente, o tecido homogeneizado pode ser utilizado para extração de DNA ou RNA para quantificar o número de bactérias por qPCR.
5. Análise de imagem Luminescência
- Start "Software Imaging Living" e procurar os arquivos de imagem.
- Use "Tool Palette" para ajustar as imagens. Clique na imagem Ajuste para modificar a correção / filtragem configurações e min / max para as escalas de cores individuais.
- Use ferramentas de ROI na lista suspenso para a quantificação da intensidade da luz. Selecione a forma ROI, número e tamanho. Arraste quadro ROI para região de interesse na imagem. Assegurar que todas as ROI são do mesmo tamanho e forma. Clique ROI de medição e salvar, copiar e / ou exportação de dados quantitativos.
- No caso de DLIT reconstruções 3D, carregar uma seqüência de imagens, incluindo a imagem de luz estruturada. Clique topografia de superfície na Ferramenta de Platte. Na lista suspensa, clique em Reconstruir guia para gerar a topografia da superfície. Uma confusão de superfície irá aparecer na janela.
- Selecione DLIT reconstrução 3D na ferramenta de Platte. Na lista de pulldown, clique na guia Propriedades para definir as propriedades dos tecidos e espectro da fonte. Muscular é recomendado na maioria das circunstâncias. Na lista pendente, clique na guia Analisar para selecionar o comprimento de onda para análise. Clique na guia Parâmetros e confirmar os valores padrão ou ajustar os parâmetros DLIT se necessário. Clique Reconstruir guia para começar a análise em 3D.
- Quando a reconstrução 3D é concluída, a visualização em 3D irá exibir os resultados da reconstrução 3D. Clique na guia para ver os resultados de análise de dados para a densidade de fótons, voxels e parâmetros do algoritmo DLIT.
- Salvar e / ou exportar os resultados das análises de reconstrução 3D em figuras e arquivos de dados.
6. Resultados representativos:
As imagens bioluminescência de camundongos infectados com bactérias bioluminescentes, juntamente com um controle do mouse não infectados são mostrados na Figura 1. O pulmonares camundongos infectados com bactérias bioluminescentes produzir sinal significativo dos pulmões (Figura 1). Intensidade da luminescência é quantificado como fluxo total dentro de um ROI (região de interesse) (Figura 2). Os dados quantitativos para a intensidade da luz é normalizado para as unidades formadoras de colônia (UFC) de bactérias obtidas de pulmões para confirmar que o sinal é produzido a partir de bactérias bioluminescentes e pode ser comparado ao controle negativo. A localização ea intensidade do sinal pode ser posteriormente analisado por DLIT reconstrução 3D da fonte de luminescência com base na tomografia da superfície do mouse 11. Essas análises permitem a quantificação e localização do sinal bioluminescente produzido. Os resultados da reconstrução 3D de uma fonte luminescente em camundongos infectados demonstra que a luz é produzida a partir de pulmões do mouse (Figura 3). As imagens ex vivo dos pulmões do rato resultando confirmar que a luminescência é emitido a partir dos pulmões, ao invés de algum outro tecido ou órgão estreitamente justapostas (Figura 2C).

Figura 1. Imagens da luminescência pulmonar camundongos infectados com bactérias bioluminescentes marcados com CBRluc. Rato controle não infectado é do lado esquerdo e dois camundongos infectados estão na direita. Camundongos foram infectados com bactérias expressando CBRluc (n = 2) por via intratraqueal. 10 minutos após a injeção de luciferina, imagens de luminescência foram adquiridas por 10 minutos a 4 posições: dorsal, lateral, ventral esquerdo e lado direito.
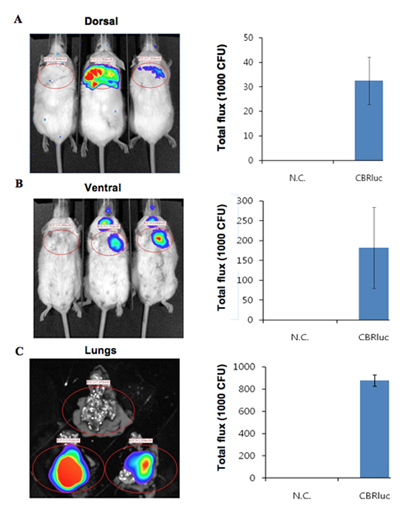
Figura 2. A intensidade da luz quantitativa de camundongos infectados com bactérias expressando CBRluc. (A, B) imagens Luminescência de ROI análise e quantificação do fluxo total de luz de ROI em posições dorsal e ventral, respectivamente. Camundongos não infectados estão na esquerda e dois camundongos infectados estão na direita. Luminescência imagens foram adquiridas a partir de pulmões of camundongos não infectados e infectados com CBRlux (n = 2). A intensidade da luz em torno dos pulmões foi quantificada por análise de ROI. C) imagens ex vivo de pulmões de não infectados (em cima) e infectadas (em baixo dois conjuntos de pulmões) camundongos. Luciferina foi injetado 5 miniuts antes da eutanásia e as imagens foram então adquiridos. Os valores quantificados são normalizados para CFU.
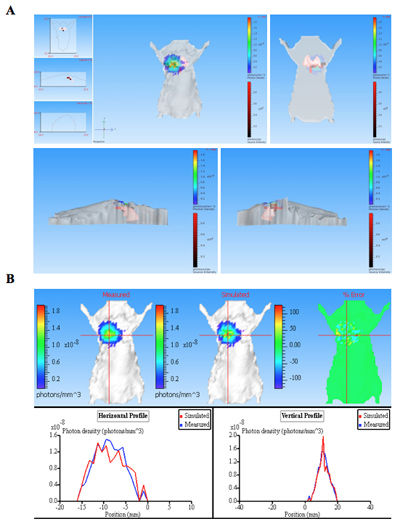
Figura 3. A reconstrução 3D da fonte de bioluminescência (s) de um rato pulmonar infectado. O rato foi infectado com bactérias expressando CBRluc por injeção intratraqueal. A seqüência de imagens foi adquirido usando filtros diferentes comprimentos de onda de emissão de série de 540 nm e 700 nm. Uma seqüência de imagens foi utilizada para a reconstituição em 3D para fonte de luminescência em indivíduos animais que continha uma imag estruturado. A) A tomografia para mouse é mostrado em diferentes posições: frente, trás, esquerda e direita. Fontes de luz são mostrados como voxels (caixas vermelhas dentro de mouse 3D) que estão localizados dentro do pulmão, conforme determinado pela reconstrução. B) Photon mapa densiy de dados medidos e simulados. Comparando as curvas de densidade medidos e simulados fóton fornecer as informações de qualidade de reconstrução. Boa qualidade no resultado reconstruções semelhante medidos e simulados densidades de fótons.
Discussão
Apesar de seguir estes protocolos normalmente irá resultar em imagens de alta qualidade, é importante considerar algumas questões-chave a fim de obter dados precisos e consistentes a partir de estudos de imagem. Luminescência imagens devem ser adquiridas que têm contagens de 600 a 60000 para garantir que o sinal está acima do fundo ea câmera não está saturado. Se o sinal obtido é inferior a 600 as condições de exposição deve ser ajustado para aumentar a contagem. Se o sinal obtido é mais de 60.000 a câme...
Divulgações
Agradecimentos
Os autores agradecem os membros Cirillo laboratório pelas valiosas discussões e assistência ao longo deste estudo. Agradecemos ao Dr. Joshua Hill e do laboratório do Dr. James Samuel para a assistência durante as filmagens com o do presente protocolo. Este trabalho foi financiado por bolsa 48523 da Fundação Bill & Melinda Gates Foundation e AI47866 concessão do National Institutes of Health.
Materiais
| Name | Company | Catalog Number | Comments |
| Isoflurane | VETONE | 501027 | |
| Ketamine | Butler Animal Health Supply | ||
| Xylazine | MP Biomedicals | 158307 | |
| Luciferin | GMT | LUCK-100 | |
| Fetal plus solution | Vortech Pharmaceutical Ls, Ltd | ||
| Cathether (22G x 1”) | Terumo Medical Corp. | OX2225CA | |
| Guide wire | Hallowell EMC | 210A3491 | |
| Octocope with speculum | Hallowell EMC | 000A3748 | |
| Xenogen IVIS system | Caliper Life Sciences | ||
| XGI-8-gas Anesthsia System | Caliper Life Sciences | ||
| Living Imaging Software | Caliper Life Sciences | ||
| Transparent nose cones | Caliper Life Sciences | ||
| Light baffle divider | Caliper Life Sciences |
Referências
- Wilson, T., Hastings, J. W. Bioluminescence. Annu Rev Cell Dev Biol. 14, 197-230 (1998).
- Contag, C. H., Bachmann, M. H. Advances in in vivo bioluminescence imaging of gene expression. Annu Rev Biomed Eng. 4, 235-260 (2002).
- Hutchens, M., Luker, G. D. Applications of bioluminescence imaging to the study of infectious diseases. Cell Microbiol. 9, 2315-2322 (2007).
- Doyle, T. C., Burns, S. M., Contag, C. H. In vivo bioluminescence imaging for integrated studies of infection. Cell Microbiol. 6, 303-317 (2004).
- Wood, K. V., Lam, Y. A., Seliger, H. H., McElroy, W. D. Complementary DNA coding click beetle luciferases can elicit bioluminescence of different colors. Science. 244, 700-702 (1989).
- Wet, J. R. d. e., Wood, K. V., Helinski, D. R., DeLuca, M. Cloning of firefly luciferase cDNA and the expression of active luciferase in Escherichia coli. Proc Natl Acad Sci U S A. 82, 7870-7873 (1985).
- Hastings, J. W. Chemistries and colors of bioluminescent reactions: a review. Gene. 173, 5-11 (1996).
- Zhao, H. Emission spectra of bioluminescent reporters and interaction with mammalian tissue determine the sensitivity of detection in vivo. J Biomed Opt. 10, 41210-41210 (2005).
- Rice, B. W., Cable, M. D., Nelson, M. B. In vivo imaging of light-emitting probes. J Biomed Opt. 6, 432-440 (2001).
- Contag, C. H. Photonic detection of bacterial pathogens in living hosts. Mol Microbiol. 18, 593-603 (1995).
- Kuo, C., Coquoz, O., Troy, T. L., Xu, H., Rice, B. W. Three-dimensional reconstruction of in vivo bioluminescent sources based on multispectral imaging. J Biomed Opt. 12, 024007-024007 (2007).
- Weissleder, R. A clearer vision for in vivo imaging. Nat Biotechnol. 19, 316-317 (2001).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados