Method Article
小鼠神经干细胞移植手术与器官的诱向性鼠肝炎病毒感染小鼠的脊髓
摘要
小鼠神经干细胞分化到小鼠建立脱髓鞘脊髓移植是详细的。神经干细胞的准备工作,椎板切除胸椎9(T9),神经干细胞移植概述随着小鼠前和术后护理。
摘要
与鼠肝炎病毒的嗜神经JHM病毒(MHV)感染的小鼠类似脱髓鞘疾病多发性硬化症(MS)患者的病理和临床结果。我们已经表明,神经干细胞移植到患病老鼠在两个髓鞘和临床结果的显着改善的结果的脊髓。治疗慢性神经系统疾病的细胞替代疗法现在已经成为现实, 并在体内模型了解嫁接的细胞和主机组织的微环境之间的相互作用是至关重要的。此演示文稿提供了一个适应JHMV感染小鼠的脊髓细胞移植到的方法。简而言之,我们提供了一个对我的程序)神经干细胞移植前准备,二)小鼠前术后护理,三)通过椎板切除脊髓暴露,IV)立体定向神经干细胞注射,和IV)术后护理。
研究方案
1。制备
- 准备甲苯噻嗪,氯氨酮溶液(氯胺酮是一种受控物质。应保持详细的记录和存储在一个安全,锁定位置的解决方案)。
- 清洁和消毒设备。
- 准备擦拭无菌剂,然后用无菌纸毛巾覆盖手术区,并成立了显微。
2。供移植的细胞的制备
- 应重悬到10万个细胞/ E L浓度的细胞,虽然只有25万细胞移植是每鼠,过量的细胞所需的注射器加载的目的(准备至少30万个接收细胞的小鼠细胞)。
- 洗细胞移植的HBSS 3倍,在50 ml锥形瓶。细胞计数前的最后旋转。
- 经过最后的自旋向下,倒出的HBSS,并留在小瓶倒挂位置,以防止水滴达到颗粒。
- 用紫外线照射,无菌Kimwipe,干燥的内壁。不要让干的颗粒。
- 管直立,慢慢的,非常微妙的细胞重悬在一半的最终所需体积的HBSS。
- 测量成枪头吹打多数暂停,然后调整pipetter拨号,直到整个悬挂在枪头总量。这会告诉你是多少更多的HBSS所需浓度的需要。
- 使加入的HBSS体积所需的金额。
- 冰回原位。检查细胞的活力,如果他们必须在冰时间超过2小时。
3。手术和移植的小鼠的制备
- 通过腹腔注射氯胺酮(100mg/kg)和甲苯噻嗪(10mg/kg的)〜100μL剂量或等效的麻醉剂麻醉鼠标。从手术预习缝合,整个过程将需要30-40分钟。
- (可选:申请编号,彩色胶带,每个鼠标的尾部,以确保鉴定)
- 从腰背颈部剃须鼠标背部的面积,延长双侧从中线2厘米,与电动快船。头发应削减(它可能有必要对该地区去几次)尽可能接近。
- 要除去剩余的头发,申请用纱布一层薄薄的脱毛膏(奈尔)放倒撒施。
- 1-2分钟后,轻轻用肥皂水浸湿的纱布擦拭奈尔。准备区应清洁裸露的皮肤没有任何杂散件,可以在随后的外科手术伤口的头发。
碘化钾溶液消毒准备区。
4。椎板切除术
- 经常变化和/或整个过程中消毒手套。位置鼠标背侧头指向左侧(如果你是右撇子)。悬垂性动物,以确保不育和,只露出剃光的面积是。请laminecomy网站的有关胸椎T8跨越到T12的垂直切口(〜1.3厘米)。
- 左手举行的格雷夫钳,牢固地固定在T9( 图1A)脊柱,解除鼠标夸大脊柱弯曲。
- 使用手术刀将比分T10和T11之间的交界处,两者之间的刺状突起的空间。进一步暴露,小心杀而去揭露骨( 见图1B,C),肌肉层的交界处。
- 使用剪刀,以进一步明确的肌肉离椎板和小剪蒂周围。这将开辟一个椎骨之间的小空间。缓慢和微妙的这种差距插入一个刀片和剪刀剪断椎弓根。确保剪刀的弧度总是横向位置,远离电源线。在另一边重复上述步骤。 (参见图1D,E)
- 抬起椎板,显露脊髓和小心地剪断它关闭。确保不留下任何免费或锯齿状的碎骨落后。 ( 见图1楼 )
- 注射前,任何血液,用无菌棉签清洁。
5。注射细胞
- 附加汉密尔顿注射器的针头,针螺母和干净,用清水冲洗,然后70%的乙醇几次,终于HBSS中。每个水,70%的乙醇,或HBSS中填写后插入柱塞。
- 汉密尔顿注射器准备装载细胞取出柱塞和针螺母松动,拔针头从注射器中,以防止背压。确保无菌手套,小心处理针和螺母。
- 装入枪头细胞15μl和尖紧紧压入注射器的后端装入注射器细胞。
- 插入柱塞约5mm,然后拧紧针螺母。
- 压下柱塞联合国TIL细胞悬液退出针。
- 确保有注射器中无气泡和引力的梯度,以防止细胞的水平位置奠定注射器。
- laminectomized鼠标抓住spinalis背阔肌肌肉连接T8和T9( 图2B,C),刺。
- 左(垂直)的显微手臂夹紧止血钳,使老鼠的前爪在空气中,其后方的爪子轻轻抚摸无菌纸毛巾的平台,在图 2a和2b。
- 将注射器的权利显微臂(70 °角)和滑动至最低位置有可能前夹紧注射器。
- 稳定的鼠标,它的尾巴,寄托对纸巾和慢慢放下注射器( 图 2B )。
- 降低对线针和针1毫米插入对面半球的背中线( 图2C)。针尖应在靠近中央管灰质。
- 慢慢注入细胞2.5μl。在加入1μl/ 5秒的速度注入。注射细胞后,等待10秒,一次收回针一转的十分之一,每10秒,直到针的线。注意细胞悬液,可能流出。
- 快速缩回的注射器和脱离显微手臂。打下的注射器水平。
- 释放鼠标和转移缝合表。
- 重复步骤为每个鼠标5.7-5.14,直到注射器空。工具消毒(灭菌)和动物之间的针(用乙醇擦拭)。放弃细胞和重装,如果是可见的聚集。
- 5.1之间的负载步清洁的注射器。
6。缝合和术后护理
- 缝合切口。缝合针插入切口两侧的浅筋膜。线程串通过,拉动浅筋膜( 图3A),从而掩盖了脊髓暴露在拆除椎板现场。不要缝合皮肤肌附着在皮肤上或背面的骨骼肌。拉动整个穿过,留下约1 / 2"。使用持针器,三节的形成和线程修剪尽可能接近的结。
- 关闭切口,用两到三个订书钉(切口大小而定),皮肤( 图 3B )。小心地拉出皮肤远离鼠标,以避免装订底层肌肉。
- 使用26G3 / 8针注入0.5毫升乳酸林格分cutaneously腰背远离切口。
- 它在笼中放置鼠标。为了确保它能够舒适地呼吸,而在麻醉状态下,鼠标应该放在其副作用在笼子里,避免手术的部位和笼床上用品接触。网箱应放在加热垫。
- 小鼠监测麻醉后消失,以确保出血消退,缝合线仍然封闭,老鼠恢复到手术前的流动性。
- 治疗小鼠的镇痛丁丙诺啡(0.05-0.1毫克/公斤),手术后一次。
- 确保受损的老鼠有足够的食物和水,矿泉水瓶都配有扩展3.5英寸的嘴和老鼠,无法走路都是手工美联储水和/或高热量的膳食补充剂(Cal的营养,Tomlyn)。
7。代表性的成果:
预期的结果将缺乏在注射细胞悬液的外排和脊髓完整的外观,下面的过程识别。为此,在椎板切除术,并在注射明亮,直接鼠标的脊椎上的照明是至关重要的。最佳照明条件是促进光纤照明( 图2A)。
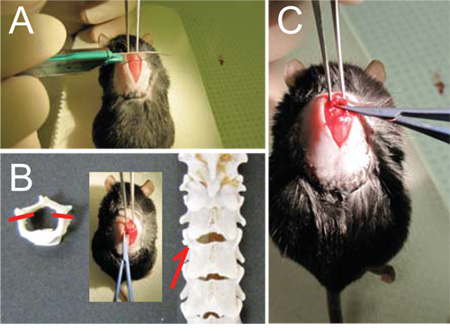
图1 -椎板切除术 (a)一旦椎T9是扎扎实实地举行格雷夫钳,(B,C)得分与手术刀的T10和T11之间的脊椎,以方便入境的微型剪刀。 (四)小心地将通过空间之间的微型剪刀T10和T11(箭头和插图,E)和削减每侧蒂(破折号,E),免费背椎板。 (F)的翻转椎板rostrally,就把它砍下来。
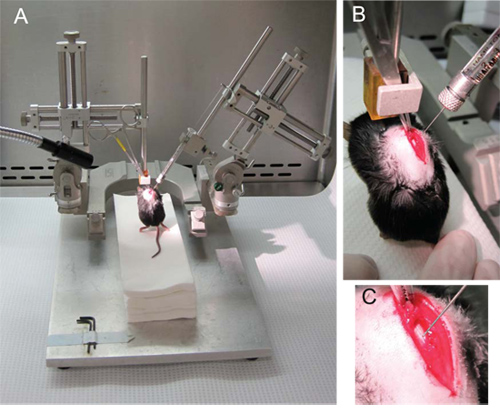
图2。 (一) 神经干细胞注射。右臂,左手臂和汉密尔顿注射器在70角连接鼠标的止血显微常规设置。 (二)止血举行的spinalis肌连接T8和T9的刺。 (三)的针是降低通过T他中线到对面半球的灰质,中央管近端。
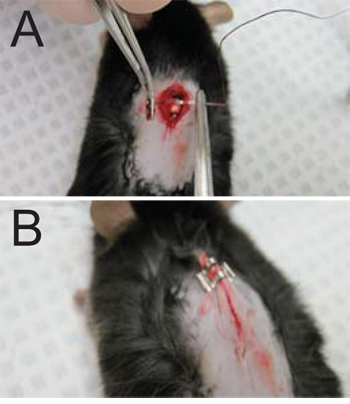
图3。 (一) 缝线和伤口缝合。的缝线适用于切口两侧的浅筋膜。 (二)关闭切口需要2-3订书钉(一主食上的伤口需要3所示)。
讨论
执行良好的移植,将取决于主要仔细椎板切除术和细胞注射。主要的缺陷,以避免在一个椎板切除脊髓损害。这期间可能出现的程序本身或锋利的骨碎片左下面的过程背后所造成的损害。要避免这些问题,确保弯曲的微型剪刀点总是面临着远离电源线,并仔细检查laminectomized脊椎,以确保所有的碎骨清除和其余椎体结构不公开突起或锯齿状边缘。
如前所述,外排的检测将成为可能,如果光线明亮,并直接在直射暴露脊髓注射。流出是最有可能发生30表针(与33计),如果注射过快。虽然这个协议给了我们很好的效果,有的报道不再收回针注射后8,9前的等待时间(最多5分钟) 。此外,较小的表针是可取的,但我们观察到,有些细胞是太容易溶解在通过通过33表针。
为了最大限度地提高效率,移植小组的人手四个不同的站(鼠标预习,椎板,注射和缝合)是可取的。此外,每道工序的时间应进行优化,以最大限度地减少细胞在冰上等待的时间。例如,我们四个(剂量注射器在每个负载)组移植小鼠,注射细胞的人开始加载后的第三个鼠标已经laminectomized和注射器的人准备的小鼠麻醉以下前一组的第二个鼠标后的集团一直laminectomized。在这种方式下,我们可以移植到小鼠在约3小时40的细胞(或控制媒体),即使每个鼠标将需要约30-40分钟。
目前在10个临床试验的一些中枢神经系统疾病的治疗的细胞替代疗法。有没有替代NSC移植和我们的协议为便于使用的MS的重要模式与病毒引起的脱髓鞘到小鼠脊髓神经干细胞植入体内模型,也可以很容易地适应其他车型。
披露声明
材料
| Name | Company | Catalog Number | Comments |
| 试剂/设备名称 | 公司 | 目录编号 | 评论(可选) |
|---|---|---|---|
| Ketaject | 凤凰旗医药 | NDC 57319-542-02 | |
| 甲苯噻嗪盐酸盐 | MP生物医学 | 158307 | |
| 奈尔 | 教会和德怀特有限公司 | ||
| 10μL汉密尔顿注射器W /可拆卸针 | 汉密尔顿公司 | 7635-01 | |
| 汉密尔顿针,30G或33 G,½英寸,30 °斜角 | 汉密尔顿公司 | 7803-077803-05 | 测试你的细胞的可行性,通过针头通过后,以确定最佳的压力表使用 |
| 微型剪刀 | 世界精密仪器 | 555500S | |
| 小格雷夫钳 | 福斯特 | 11053-10 | |
| 立体定向 | KOPF仪器 | 1772型号通用持有 | |
| 立体定向 | KOPF仪器 | 1773型电极支架 | |
| 立体定向 | KOPF仪器 | 型号902的小动物立体定位 | |
| 立体定向 | KOPF仪器 | 960型的左电极载体 | |
| 缝合线 | 爱惜康 | 95057-064 | |
| 乳酸钠林格 | Hospira公司 | NDC 0409-7953-03 | |
| 斯台普斯 | 精细科学 | 12032-07 | |
| 止血 | 福斯特 | 13010-12 | |
| 解剖刀,尺寸10,11 | 费舍尔 | 268878,268879 | |
| 缝合线 | 爱惜康 | 1676G | 5-0大小,3 / 8"圆,19毫米针,45CM编织线程 |
| 反射7伤口剪辑撒施 | 福斯特 | 12031-07 | |
| 7毫米反射伤口剪辑 | 福斯特 | 12032-07 | |
| 奥尔森的Hegar持针器 | 福斯特 | 12502-12 |
参考文献
- Bergmann, C. C., Lane, T. E., Stohlman, S. A. Coronavirus infection of the central nervous system: host-virus stand-off. Nat Rev Microbiol. 4, 121-132 (2006).
- Weiner, H. L. The challenge of multiple sclerosis: how do we cure a chronic heterogeneous disease. Ann Neurol. 65, 239-248 (2009).
- Fleming, J. O., Trousdale, M. D., Bradbury, J., Stohlman, S. A., Weiner, L. P. Experimental demyelination induced by coronavirus JHM (MHV-4): molecular identification of a viral determinant of paralytic disease. Microb Pathog. 3, 9-20 (1987).
- Totoiu, M. O., Nistor, G. I., Lane, T. E., Keirstead, H. S. Remyelination, axonal sparing, and locomotor recovery following transplantation of glial-committed progenitor cells into the MHV model of multiple sclerosis. Exp Neurol. 187, 254-265 (2004).
- Carbajal, K. S., Schaumburg, C., Strieter, R., Kane, J., Lane, T. E. Migration of engrafted neural stem cells is mediated by CXCL12 signaling through CXCR4 in a viral model of multiple sclerosis. Proc Natl Acad Sci U S A. 107, 11068-11073 (2010).
- Hardison, J. L., Nistor, G., Gonzalez, R., Keirstead, H. S., Lane, T. E. Transplantation of glial-committed progenitor cells into a viral model of multiple sclerosis induces remyelination in the absence of an attenuated inflammatory response. Exp Neurol. 197, 420-429 (2006).
- Blakemore, W. F., Crang, A. J. . Transplantation of glial cells into areas of demyelination in the adult rat spinal cord. , (1992).
- Liu, S. Embryonic stem cells differentiate into oligodendrocytes and myelinate in culture and after spinal cord transplantation. Proc Natl Acad Sci U S A. 97, 6126-6131 (2000).
- Keirstead, H. S. Human embryonic stem cell-derived oligodendrocyte progenitor cell transplants remyelinate and restore locomotion after spinal cord injury. J Neurosci. 25, 4694-4705 (2005).
- Mayor, S. First patient enters trial to test safety of stem cells in spinal injury. BMJ. 341, c5724-c5724 (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。