Method Article
Transplante de Células-Tronco cirúrgica do rato Neural na medula espinhal de camundongos infectados com o vírus da Hepatite neurotrófico rato
Resumo
O transplante de células-tronco do mouse neural (NSCs) na medula espinhal de ratos com desmielinização estabelecida é detalhado. A preparação de NSCs, a laminectomia de vértebra torácica 9 (T9), e transplante de NSCs é descrito juntamente com os cuidados pré e pós-operatório dos ratos.
Resumo
Camundongos infectados com a cepa JHM neurotrópica do mouse vírus da hepatite (MHV) Desenvolver resultados patológicos e clínicos semelhantes aos pacientes com a doença desmielinizante Esclerose Múltipla (MS). Nós mostramos que o transplante de NSCs na medula espinhal de ratos doentes resultados em uma melhora significativa em ambos os remielinização e no resultado clínico. Terapias com células de substituição para o tratamento de doenças neurológicas crônicas são agora uma realidade e em modelos in vivo são vitais para a compreensão das interacções entre as células enxertadas e microambiente tecido hospedeiro. Esta apresentação fornece um método adaptado para o transplante de células na medula espinhal de ratos infectados JHMV. Em resumo, nós fornecemos um procedimento para i) preparação de NSCs antes do transplante, ii) pré-operatório de ratos, iii) a exposição da medula espinhal através de laminectomia, iv) a injeção estereotáxica de NSCs, e iv) cuidados pós-operatórios .
Protocolo
1. Preparação
- Prepare xilazina-cetamina solução (ketamina é uma substância controlada. Registros detalhados devem ser mantidos e soluções armazenadas em um local seguro e trancado).
- Limpar e esterilizar equipamentos.
- Prepare área da cirurgia, limpando com o agente de assepsia e, em seguida, cobrir com papel toalha estéril, e configurar o micromanipulador.
2. Preparação de células para transplante
- As células devem ser ressuspendidas a uma concentração de 100.000 células / l E e, apesar de apenas 250.000 células são transplantadas por mouse, um excesso de células é necessário para fins de seringa de carga (preparar pelo menos 300 mil células por camundongo que receberam células).
- Lave as células a serem transplantadas 3 vezes em HBSS num frasco de 50 ml. Contar as células antes do spin-final.
- Após a centrifugação final para baixo, e deixar decantar HBSS frasco em posição de cabeça para baixo para evitar que gotas de alcançar o sedimento.
- Seca paredes interiores com um UV-irradiados Kimwipe, estéril. Não permita que o pellet para secar.
- Segurando o tubo na posição vertical, lenta e delicadamente ressuspender as células em metade do volume final desejado de HBSS.
- Medir o volume total por pipetagem a maioria da suspensão em uma ponta da pipeta e então ajustando o dial na pipeta até a suspensão inteira está na ponta da pipeta. Isso vai te dizer o quanto HBSS mais é necessário para a concentração desejada.
- Traga de volume para a quantidade desejada, adicionando HBSS.
- Coloque de volta no gelo. Verificar a viabilidade das células se deve ser sobre o gelo por mais de 2 hrs.
3. Preparação de ratos para a cirurgia e transplante
- Anestesiar o rato por injeção intraperitoneal de ketamina (100mg/kg) e xilazina (10mg/kg) em ~ 100 mL doses ou por um anestésico equivalente. Todo o processo de preparação cirúrgico para sutura terá de 30-40 minutos.
- (Opcional: aplique fita numerada, colorido para a cauda de cada rato para assegurar a identificação)
- Raspar a área dorsal do mouse a partir da parte inferior das costas para o pescoço, e estendendo dois centímetros da linha média bilateral, com tosquiadeiras elétricas. O cabelo deve ser cortado o mais próximo possível (pode ser necessário para ir sobre a área várias vezes).
- Para remover os pêlos restantes, aplique uma camada fina de creme de depilação (Nair) com uma gaze aplicador derrubado.
- Depois de 1-2 minutos, limpe Nair off com gaze umedecida levemente com água e sabão. A área preparada deve ser limpa a pele nua, sem peças perdidas de cabelo que poderiam entrar na ferida durante o procedimento cirúrgico subseqüente.
Esterilizar a área preparada com solução de iodeto.
4. Laminectomia
- Mudam freqüentemente e / ou esterilizar as luvas durante o procedimento. Posição ao lado do mouse dorsal com a cabeça apontando para a esquerda (se você for destro). Drape animais para garantir a esterilidade e que apenas a área raspada está exposto. Faça uma incisão vertical (~ 1,3 cm) sobre o local laminecomy spanning de cerca de vértebras torácicas T8 a T12.
- Com a pinça zu na mão esquerda, prender firmemente a coluna vertebral em T9 (Figura 1A) e levante o mouse até a exagerar a curvatura da coluna vertebral.
- Use o bisturi para marcar a junção entre T10 e T11, o espaço entre as duas saliências espinhosas. Ainda expor a junção com cuidado a demolição da camada muscular para expor o osso (ver Figura 1B, C).
- Use a tesoura para mais músculo clara distância da lâmina e em torno do pedículo com snips pequenos. Isto irá abrir um pequeno espaço entre as vértebras. Lenta e delicadamente inserir uma lâmina da tesoura para essa lacuna e snip do pedículo. Certifique-se a curvatura da tesoura é sempre posicionados lateralmente, longe do cabo. Repita no outro lado. (Ver Figura 1D, E)
- Levante a lâmina para expor o cabo e cuidadosamente snip-lo. Não se esqueça de deixar qualquer fragmentos de ossos livre ou irregulares para trás. (Ver Figura 1F)
- Antes da injeção, limpar o sangue para fora com cotonetes estéreis.
5. Injeção de células
- Coloque a agulha com agulha porca para a seringa Hamilton e limpá-los através de lavagem com água várias vezes, então 70% de etanol e, finalmente, HBSS. Inserir êmbolo após cada enchimento com água, etanol 70%, ou HBSS.
- Prepare a seringa Hamilton para carregar celular através da remoção do êmbolo e soltando a porca agulha e puxando a agulha para longe da seringa para evitar contrapressão. Garantir que a manipulação cuidadosa da agulha e porca é feito com luvas estéreis.
- Carga 15μl de células em pipeta ponta e pressione a ponta firmemente na extremidade traseira da seringa para carregar as células dentro da seringa.
- Insira o êmbolo aproximadamente 5mm e, em seguida, apertar a porca da agulha.
- Deprimem êmbolo unaté alguns da suspensão de células foi visto saindo da agulha.
- Certifique-se que não há bolhas na seringa e colocar a seringa na posição horizontal para evitar que as células de fazer um gradiente de gravidade.
- Agarrar o mouse laminectomized pelo músculo spinalis dorsi conectando os espinhos de T8 e T9 (Figura 2B, C).
- Prender o hemostat para o braço esquerdo micromanipulador (vertical) para que as patas da frente do rato estão no ar e suas patas traseiras tocando levemente uma plataforma de toalhas de papel estéreis, nas Figuras 2A e 2B.
- Conecte a seringa no braço direito micromanipulador (em um ângulo de 70 °) e deslize a seringa na posição mais baixa possível, antes de aperto.
- Estabilizar o mouse fixando sua cauda contra as toalhas de papel e abaixe lentamente a seringa (Figura 2B).
- Abaixe a agulha em direção ao cabo e insira a um milímetro agulha no hemisfério oposto através da linha média dorsal (Figura 2C). A ponta da agulha deve ser na substância cinzenta perto do canal central.
- Injecte lentamente 2.5μl de células. Injetar a uma taxa de 1μl / 5 segundos. Depois de injetar as células, espere uns 10 segundos e retirar a agulha 1 / 10 de uma volta em um momento cada 10 segundos até que a agulha está fora do cordão. Preste atenção ao efluxo possível de suspensão celular.
- Rapidamente retirar a seringa e retire-a do braço micromanipulador. Lay a seringa horizontalmente.
- Solte o mouse e transferência para a mesa sutura.
- Repita os passos 5,7-5,14 para cada rato até que a seringa é esvaziada. Esterilizar as ferramentas (no esterilizador) ea agulha (limpando com álcool) entre os animais. Descartar pilhas e recarregar se aglomeração é visível.
- Limpe a seringa como no passo 5,1 entre as cargas.
6. Suturas e pós-operatório de cuidados
- Suturar a incisão. Agulha de sutura é inserida na fáscia superficial em ambos os lados da incisão. O fio é amarrada através de, puxando fáscia superficial juntos (Figura 3A), cobrindo assim a medula espinal exposta no local da lâmina removido. Não sutura do músculo cutâneo ligado à pele ou do músculo esquelético das costas. Puxe a linha através de todo, deixando cerca de 1 / 2 ". Usando o porta-agulha, três nós são formados e linha é cortada o mais próximo do nó possível.
- Fechar a incisão através da aplicação de 2-3 grampos (dependendo do tamanho da incisão) para a pele (Figura 3B). Puxe cuidadosamente a pele longe do mouse para evitar grampear o músculo subjacente.
- Usando um 26G3 / 8 agulha injetar 0,5 ml de Ringer Lactato de sub-cutânea na região lombar longe da incisão.
- Colocar o mouse de volta em sua gaiola. Para garantir que ele é capaz de respirar confortavelmente enquanto sob anestesia, o mouse deve ser colocado de lado na gaiola, evitando o contato entre o local da cirurgia e roupa de cama gaiola. Gaiolas devem ser colocados em almofadas de aquecimento.
- Ratos são monitorados após a anestesia desgasta fora para garantir subsídios sangramento, suturas permanecem fechadas, e que os ratos voltar ao pré-cirurgia de mobilidade.
- Tratar ratos um tempo com a buprenorfina analgésico (0,05-0,1 mg / kg) após a cirurgia.
- Garantir camundongos deficientes têm acesso suficiente a alimentos e água: garrafas de água estão equipados com bicos estendida 3,5 polegadas e ratos que são incapazes de andar de mão são alimentados de água e / ou de alto teor calórico suplemento dietético (Nutri-Cal, Tomlyn).
7. Resultados representativos:
Resultados desejados será identificável pela falta de efluxo da suspensão de células durante a injeção e pelo aparecimento intactas da medula espinhal após o procedimento. Para este fim, é vital ter uma iluminação brilhante e direta na coluna do rato durante a laminectomia e durante a injeção. A iluminação ideal é facilitada pela iluminação de fibra óptica (Figura 2A).
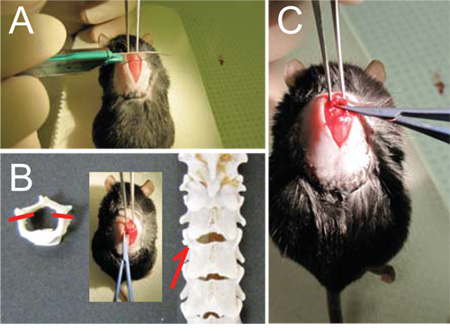
Figura 1 - Laminectomia (A) Uma vez vértebra T9 está solidamente realizada com a pinça Graefe, (B, C) pontuação da coluna vertebral com bisturi entre T10 e T11 para facilitar a entrada da tesoura micro.. (D) Deslize cuidadosamente a tesoura micro através do espaço entre T10 e T11 (setas e inset, E) e cortar os pedículos de cada lado (traços, E) para libertar a lâmina dorsal. (F) Virar a lâmina até rostralmente e cortá-lo.
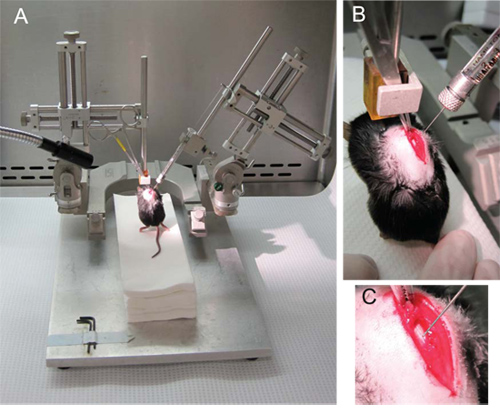
Figura 2. Injeção de NSCs. (A) A configuração geral do micromanipulador com o hemostat segurando o mouse conectado ao braço esquerdo e na seringa Hamilton no braço direito em um ângulo de 70. (B) O hemostat segurar o spinalis dorsi conectando os espinhos de T8 e T9. (C) A agulha é reduzido através de tele linha média e na matéria cinzenta no hemisfério oposto, proximal ao canal central.
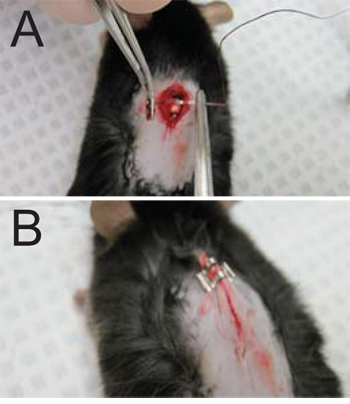
Figura 3. Suturas e fechamento da ferida. (A) Suturas são aplicados à fáscia superficial em ambos os lados da incisão. (B) A incisão é fechada com grampos 03/02, conforme necessário (um grampo mostrado em uma ferida que necessitam 3).
Discussão
Um transplante bem executado vai depender principalmente na laminectomia cuidadoso e injeção das células. A armadilha primário para evitar durante uma laminectomia é o prejudicial da medula espinhal. Isso pode ocorrer durante o procedimento em si ou por danos causados por fragmentos de ossos afiados deixado para trás após o procedimento. Para evitar essas, garantir que os pontos da tesoura curva micro são sempre de costas para o cabo e examinar cuidadosamente a espinha laminectomized para garantir que todos os fragmentos de ossos são limpos e que as bordas da estrutura remanescente vertebral não tem abertamente salientes ou irregulares.
Como mencionado anteriormente, a detecção de efluxo será possível se a luz está brilhando e diretamente na medula espinal exposta durante a injecção. Efluxo é mais provável que isso aconteça com 30 agulhas (versus 33 gauge) e se a injeção é feita muito rapidamente. Embora este protocolo tem nos dado bons resultados, outros têm relatado mais períodos de espera (até 5 minutos) antes de retrair a agulha de injeção seguinte 8,9. Além disso, as agulhas bitola menor são preferíveis, mas temos observado que algumas células são facilmente lisadas quando passou por 33 agulhas.
Para maximizar a eficiência, a equipe de transplante lotação as quatro estações diferentes (mouse prep, laminectomia, injeção, e suturas) é desejável. Além disso, o tempo para cada processo deve ser otimizado para minimizar o tempo as células estão esperando no gelo. Por exemplo, nós transplante de nossos ratos em grupos de quatro (o número de doses em cada carga da seringa), a pessoa injetar as células começa a carregar a seringa após o mouse terceiro foi laminectomized ea pessoa deve preparar os ratos anestesiar o seguinte grupo após o segundo rato do grupo anterior foi laminectomized. Desta forma, podemos transplante de células (ou controle de mídia) em 40 camundongos em cerca de 3 horas, apesar de cada rato terá aproximadamente 30-40 min.
Terapias com células de substituição para o tratamento de algumas doenças do SNC estão actualmente em ensaios clínicos 10. Não há substituto para modelos in vivo de transplante e NSC nosso protocolo para o enxerto de NSCs na medula espinhal de ratos com desmielinização induzida viral facilita o uso de um modelo importante de MS e também pode ser facilmente adaptado para outros modelos.
Divulgações
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente / equipamentos | Companhia | Número de catálogo | Comentários (opcional) |
|---|---|---|---|
| Ketaject | Parmaceuticals Phoenix | NDC 57319-542-02 | |
| Cloridrato de xilazina | Biomedicals MP | 158307 | |
| Nair | Church & Dwight Co. | ||
| 10 mL Hamilton Seringa agulha w / Removable | Empresa Hamilton | 7635-01 | |
| Agulhas Hamilton 30G, ou 33 G, ½ polegada, 30 ° chanfro | Empresa Hamilton | 7803-077803-05 | Testar a viabilidade de suas células após a passagem através de agulhas para identificar o melhor calibre para uso |
| Micro Tesoura | Precision Instruments mundo | 555500S | |
| Pinça Graefe pequena | FST | 11053-10 | |
| Estereotáxica | KOPF Instruments | Titular modelo 1772 Universal | |
| Estereotáxica | KOPF Instruments | Modelo de suporte do eletrodo 1773 | |
| Estereotáxica | KOPF Instruments | Modelo 902 estereotáxica de pequenos animais | |
| Estereotáxica | KOPF Instruments | Modelo 960 transportadora eletrodo esquerdo | |
| Suturas | Ethicon | 95057-064 | |
| Lactato de Ringer | Hospira | NDC 0409-7953-03 | |
| Staples | Ciência fina | 12032-07 | |
| Hemostat | FST | 13010-12 | |
| Bisturis, tamanhos 10,11 | Pescador | 268878, 268879 | |
| Suturas | ETHICON | 1676G | tamanho 5-0, 3 / 8 "círculo, agulha de 19mm, fio trançado 45 centímetros |
| Reflex 7 aplicador de clipe ferida | FST | 12031-07 | |
| 7 milímetros Reflex clips ferida | FST | 12032-07 | |
| Olsen-Hegar porta-agulha | FST | 12502-12 |
Referências
- Bergmann, C. C., Lane, T. E., Stohlman, S. A. Coronavirus infection of the central nervous system: host-virus stand-off. Nat Rev Microbiol. 4, 121-132 (2006).
- Weiner, H. L. The challenge of multiple sclerosis: how do we cure a chronic heterogeneous disease. Ann Neurol. 65, 239-248 (2009).
- Fleming, J. O., Trousdale, M. D., Bradbury, J., Stohlman, S. A., Weiner, L. P. Experimental demyelination induced by coronavirus JHM (MHV-4): molecular identification of a viral determinant of paralytic disease. Microb Pathog. 3, 9-20 (1987).
- Totoiu, M. O., Nistor, G. I., Lane, T. E., Keirstead, H. S. Remyelination, axonal sparing, and locomotor recovery following transplantation of glial-committed progenitor cells into the MHV model of multiple sclerosis. Exp Neurol. 187, 254-265 (2004).
- Carbajal, K. S., Schaumburg, C., Strieter, R., Kane, J., Lane, T. E. Migration of engrafted neural stem cells is mediated by CXCL12 signaling through CXCR4 in a viral model of multiple sclerosis. Proc Natl Acad Sci U S A. 107, 11068-11073 (2010).
- Hardison, J. L., Nistor, G., Gonzalez, R., Keirstead, H. S., Lane, T. E. Transplantation of glial-committed progenitor cells into a viral model of multiple sclerosis induces remyelination in the absence of an attenuated inflammatory response. Exp Neurol. 197, 420-429 (2006).
- Blakemore, W. F., Crang, A. J. . Transplantation of glial cells into areas of demyelination in the adult rat spinal cord. , (1992).
- Liu, S. Embryonic stem cells differentiate into oligodendrocytes and myelinate in culture and after spinal cord transplantation. Proc Natl Acad Sci U S A. 97, 6126-6131 (2000).
- Keirstead, H. S. Human embryonic stem cell-derived oligodendrocyte progenitor cell transplants remyelinate and restore locomotion after spinal cord injury. J Neurosci. 25, 4694-4705 (2005).
- Mayor, S. First patient enters trial to test safety of stem cells in spinal injury. BMJ. 341, c5724-c5724 (2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados