Method Article
Il trapianto chirurgico di cellule staminali neurali del mouse nel midollo spinale di topi infettati con virus dell'epatite neurotropi mouse
In questo articolo
Riepilogo
Il trapianto di cellule staminali neurali del mouse (NSC) nel midollo spinale di topi con demielinizzazione stabilito è dettagliata. La preparazione del NSC, la laminectomia della vertebra toracica 9 (T9), e il trapianto di NSC si delinea con l'assistenza pre-e post-operatoria dei topi.
Abstract
Topi infettati con il ceppo JHM neurotropica del virus dell'epatite topo (MHV) sviluppare gli esiti patologici e clinici simili a pazienti con la malattia demielinizzante sclerosi multipla (SM). Abbiamo dimostrato che il trapianto di NSC nel midollo spinale di topi malati risultati in un miglioramento significativo in entrambi i rimielinizzazione e nel risultato clinico. Terapie di sostituzione cellulare per la cura di malattie croniche neurologiche sono ormai una realtà e in modelli in vivo sono di vitale importanza per comprendere le interazioni tra le cellule trapiantate e tessuti microambiente ospitante. Questa presentazione fornisce un metodo adatto per trapiantare le cellule nel midollo spinale di topi infettati JHMV. In breve, mettiamo a disposizione una procedura per i) preparazione di NSCs prima del trapianto, ii) pre-operatorio di topi, iii) l'esposizione del midollo spinale tramite laminectomia, iv) l'iniezione stereotassica di NSCs, e iv) assistenza post-operatoria .
Protocollo
1. Preparazione
- Preparare xylazina-ketamina soluzione (La ketamina è una sostanza controllata. Record dettagliato deve essere mantenuto e soluzioni custoditi in cassaforte, la posizione chiusa).
- Pulire e sterilizzare attrezzature.
- Preparare zona chirurgia strofinando con agente asettico e poi coprire con carta assorbente sterile, e impostare il micromanipolatore.
2. Preparazione di cellule per il trapianto
- Le cellule devono essere risospeso ad una concentrazione di 100.000 cellule / l É e, anche se solo 250.000 cellule vengono trapiantate per il mouse, un eccesso di cellule è necessaria per scopi di carico siringa (preparare almeno 300.000 cellule per topo riceve cellule).
- Lavare le cellule da trapiantare 3 volte in HBSS in un flaconcino da 50 ml. Contare le celle prima della centrifuga finale.
- Dopo la centrifuga finale verso il basso, e lasciare decantare HBSS flaconcino in posizione capovolta per evitare che le goccioline di raggiungere il pellet.
- Pareti interne a secco con un UV-irradiato, Kimwipe sterile. Non lasciare che il pellet ad asciugare.
- Tenendo il tubo in posizione verticale, molto lentamente e delicatamente risospendere le cellule in metà del volume finale desiderato HBSS.
- Misurare il volume totale pipettando la maggioranza della sospensione in un puntale e quindi regolando la ghiera sulla pipetter fino a quando la sospensione intero la punta della pipetta. Questo vi dirà quanto più HBSS è necessario per la concentrazione desiderata.
- Portare il volume al livello desiderato con l'aggiunta di HBSS.
- Mettere di nuovo sul ghiaccio. Verificare la vitalità delle cellule, se essi devono essere in ghiaccio per più di 2 ore.
3. Preparazione di topi per la chirurgia e trapianti
- Anestetizzare il topo mediante iniezione intraperitoneale di ketamina (100mg/kg) e xilazina (10mg/kg) in circa 100 dosi microlitri o un equivalente anestetico. L'intera procedura di preparazione chirurgica di sutura richiederà 30-40 minuti.
- (Opzionale: applicare numerate, nastri colorati per la coda di ogni mouse per garantire l'identificazione)
- Radere l'area dorsale del mouse dalla parte bassa della schiena al collo, ed estendendo bilaterali 2 centimetri dalla linea mediana, con il tagliaunghie elettrici. I capelli devono essere tagliati il più vicino possibile (può essere necessario andare oltre l'area più volte).
- Per rimuovere i capelli rimanenti, applicare un sottile strato di crema depilazione (Nair) con una garza punta applicatore.
- Dopo 1-2 minuti, pulire Nair con garza bagnate leggermente con acqua e sapone. L'area preparata deve essere pulita la pelle nuda, senza pezzi randagi di capelli che potrebbero entrare nella ferita nel corso della successiva procedura chirurgica.
Sterilizzare l'area preparato con soluzione di ioduro.
4. Laminectomia
- Cambiano frequentemente e / o sterilizzare i guanti durante l'intera procedura. Posizionare il lato dorsale del mouse con la testa rivolta a sinistra (se siete di mano destra). Drappo animali per garantire la sterilità e che solo l'area rasata è esposto. Effettuare una incisione verticale (~ 1,3 centimetri) sopra il luogo laminecomy si estende da circa vertebre toraciche T8 a T12.
- Con la pinza Graefe tenuto nella mano sinistra, fissare saldamente la colonna vertebrale a T9 (Figura 1A) e sollevare il mouse fino a esagerare la curvatura della spina dorsale.
- Utilizzare il bisturi per segnare la giunzione tra T10 e T11, lo spazio tra le due sporgenze spinose. Ulteriori esporre il bivio con attenzione rottamazione strato di muscolo, allontanandosi per esporre l'osso (vedi Figura 1B, C).
- Utilizzare le forbici per ulteriori muscolare chiara distanza dalla lamina ed intorno al peduncolo, con tagli di piccole dimensioni. Questo aprirà un piccolo spazio tra le vertebre. Lentamente e delicatamente inserire una lama delle forbici in questo divario e tagliare il peduncolo. Assicurarsi che la curvatura delle forbici è sempre posizionato lateralmente, lontano dal cordone ombelicale. Ripetere dall'altra parte. (Vedi Figura 1D, E)
- Sollevare la lamina di esporre il cavo e con attenzione lo snip off. Assicurarsi di non lasciare frammenti ossei liberi o frastagliate dietro. (Vedi Figura 1F)
- Prima dell'iniezione, pulire il sangue via con tamponi di cotone sterile.
5. L'iniezione di cellule
- Fissare l'ago con l'ago dado alla siringa Hamilton e pulirli da vampate di calore più volte con acqua, poi etanolo al 70% e, infine, HBSS. Inserire pistone dopo ogni riempire con acqua, etanolo al 70%, o HBSS.
- Preparare la siringa Hamilton per il caricamento delle cellule, rimuovendo il pistone e allentando il dado di ago e tirando l'ago dalla siringa per evitare contropressione. Garantire che la movimentazione accurata dell'ago e il dado è fatto con i guanti sterili.
- Carico 15μl di cellule in puntale e premere la punta saldamente l'estremità posteriore della siringa per caricare le cellule nella siringa.
- Inserire lo stantuffo circa 5mm e poi serrare il dado ago.
- Premere lo stantuffo ONUfinchè alcune delle sospensione cellulare viene visto uscire l'ago.
- Assicurarsi che non vi siano bolle nella siringa e laici la siringa in posizione orizzontale per evitare che le cellule di fare un gradiente di gravità.
- Prendete in mano il mouse laminectomized dal muscolo spinale dorsale che collega il spine di T8 e T9 (Figura 2B, C).
- Bloccare il hemostat a sinistra (verticale) micromanipolatore braccio in modo che le zampe anteriori del mouse sono nell'aria e le sue zampe posteriori leggermente toccando una piattaforma di asciugamani di carta sterile come in Figure 2A e 2B.
- Collegare la siringa al braccio destro micromanipolatore (ad un angolo di 70 °) e far scorrere la siringa nella posizione più bassa possibile, prima di serraggio.
- Stabilizzare il mouse da appuntare la coda contro i tovaglioli di carta e abbassare lentamente la siringa (Figura 2B).
- Abbassare l'ago verso il cavo e inserire l'ago nel 1 millimetro l'emisfero opposto attraverso la linea mediana dorsale (Figura 2C). La punta dell'ago deve essere nella materia grigia nei pressi del canale centrale.
- Iniettare lentamente 2.5μl delle cellule. Iniettare ad un tasso di 1ml / 5 secondi. Dopo aver iniettato le cellule, attendere 10 secondi e ritrarre l'ago di un decimo di giro alla volta ogni 10 secondi fino a quando l'ago è fuori del cavo. Prestare attenzione alla possibile efflusso di sospensione cellulare.
- Rapidamente ritrarre la siringa e staccarlo dal braccio micromanipolatore. Stendere la siringa in posizione orizzontale.
- Rilasciare il mouse e trasferimento a tavola sutura.
- Ripetere i passaggi 5,7-5,14 per ogni mouse fino a quando la siringa è vuota. Sterilizzare gli strumenti (nello sterilizzatore) e l'ago (strofinando con etanolo) tra gli animali. Eliminare le cellule e ricaricare se aggregazione è visibile.
- Pulire la siringa come nel passaggio tra 5,1 carichi.
6. Suture e post-op cura
- Sutura l'incisione. Aghi per suture è inserito nella fascia superficiale su entrambi i lati dell'incisione. Il filo è teso attraverso, tirando fascia superficiale insieme (Figura 3A), coprendo così il midollo spinale esposta nel sito di lamina rimosso. Non sutura il muscolo cutaneo attaccate alla pelle o il muscolo scheletrico della schiena. Tirare il filo intero attraverso, lasciando circa 1 / 2 ". Utilizzando la porta aghi, tre nodi si formano e filo è tagliato più vicino possibile al nodo più possibile.
- Chiudere l'incisione mediante l'applicazione di 2-3 punti (a seconda delle dimensioni di incisione) per la pelle (Figura 3B). Estrarre delicatamente la pelle di distanza dal mouse per evitare di pinzatura il muscolo sottostante.
- Utilizzando un 26G3 / 8 ago iniettare 0,5 ml Ringer lattato sottocute nella parte bassa della schiena dalla incisione.
- Posto del mouse indietro nella sua gabbia. Per assicurarsi che sia in grado di respirare confortevolmente mentre sotto anestesia, il mouse deve essere posizionato su un lato nella gabbia, evitando il contatto tra il sito chirurgico e biancheria da letto gabbia. Le gabbie dovrebbero essere immessi sul pad riscaldamento.
- I topi sono monitorati dopo l'anestesia svanisce per assicurare il sanguinamento, suture rimangono chiuse, e che i topi tornare al pre-intervento mobilità.
- Trattare i topi una volta con la buprenorfina analgesico (0,05-0,1 mg / kg) dopo l'intervento.
- Garantire topi compromessa hanno sufficiente accesso al cibo e all'acqua: bottiglie d'acqua sono dotati di beccucci estese 3,5 pollici e topi che non sono in grado di camminare sono l'acqua a mano nutriti e / o ad alto contenuto calorico supplemento dietetico (Nutri-Cal, Tomlyn).
7. Rappresentante dei risultati:
Risultati desiderati saranno riconoscibili dalla mancanza di efflusso di sospensione cellulare durante l'iniezione e dalla comparsa intatta del midollo spinale dopo la procedura. A tal fine, è fondamentale avere illuminazione brillante e diretta sul dorso del mouse durante la laminectomia e durante l'iniezione. Un'illuminazione ottimale è facilitato dalla fibra ottica di illuminazione (Figura 2A).
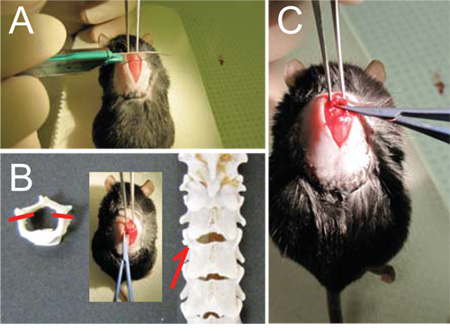
Figura 1 - laminectomia (A) Una volta vertebra T9 è solidamente tenuto con la pinza Graefe, (B, C) punteggio della colonna vertebrale con il bisturi tra le T10 e T11 per facilitare l'ingresso delle forbici micro.. (D) Far scorrere delicatamente le forbici micro attraverso lo spazio tra T10 e T11 (frecce e inserto, E) e tagliare i peduncoli su ogni lato (trattini, E) per liberare la lamina dorsale. (F) Capovolgere la lamina fino rostralmente e tagliarlo fuori.
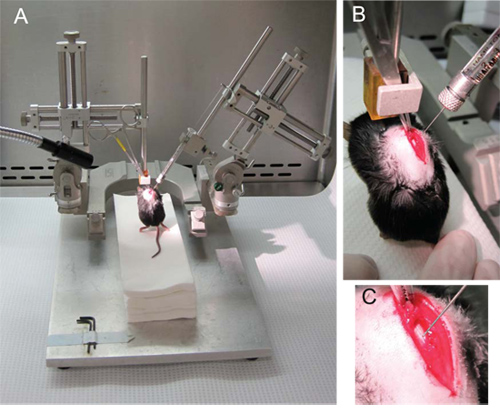
Figura 2. Iniezione di NSC. (A) L'impostazione generale del micromanipolatore con il hemostat tenendo premuto il mouse collegato al braccio sinistro e la siringa Hamilton sul braccio destro con un angolo di 70. (B) Il hemostat tenere il muscolo spinale dorsale collegare le spine di T8 e T9. (C) L'ago viene abbassato attraverso tlui linea mediana e nella materia grigia sull'emisfero opposto, in prossimità del canale centrale.
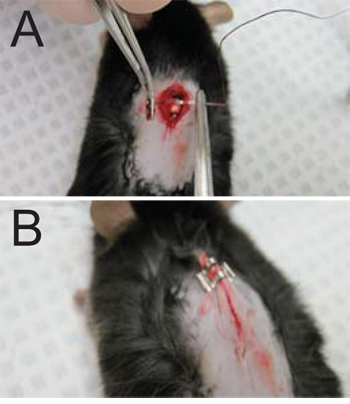
Figura 3. Suture e la chiusura della ferita. (A) Le suture vengono applicate alla fascia superficiale su entrambi i lati dell'incisione. (B) L'incisione viene chiusa con 2-3 punti in base alle esigenze (una graffetta mostrato una ferita che necessitano di 3).
Discussione
Un trapianto ben eseguito dipenderà principalmente sulla laminectomia attenta e l'iniezione delle cellule. L'insidia principale per evitare nel corso di una laminectomia è il danneggiamento del midollo spinale. Questo può verificarsi durante la procedura stessa o da danni causati da frammenti ossei taglienti lasciati alle spalle dopo la procedura. Per evitare questi, in modo che le punte delle forbici curve micro sono sempre rivolta verso il cavo e esaminare attentamente la colonna vertebrale laminectomized per assicurare che tutti i frammenti ossei vengono cancellate e che i bordi della struttura rimanente vertebrali non hanno apertamente sporgenti o frastagliati.
Come accennato in precedenza, la rilevazione di efflusso sarà possibile se la luce brilla e direttamente sul midollo spinale esposti durante l'iniezione. Efflusso è più probabile che accada con 30 aghi calibro (contro 33 gauge) e se l'iniezione viene fatta troppo rapidamente. Anche se questo protocollo ci ha dato buoni risultati, altri hanno riferito di attesa più lunghi periodi (fino a 5 minuti) prima di ritrarre l'iniezione ago seguenti 8,9. Inoltre, aghi di calibro più piccolo sono preferibili, ma abbiamo osservato che alcune cellule sono troppo facilmente lisati quando passa attraverso 33 aghi di calibro.
Per massimizzare l'efficienza, un team di trapianto equipaggi delle quattro stazioni differenti (mouse preparazione, laminectomia, iniezione, e suture) è auspicabile. Inoltre, i tempi per ogni procedura deve essere ottimizzato per minimizzare il tempo le cellule sono in attesa su ghiaccio. Per esempio, abbiamo i nostri topi trapiantati in gruppi di quattro (il numero di dosi in ogni carico della siringa), la persona iniettando le cellule inizierà a caricare la siringa dopo il mouse terzo è stato laminectomized e la persona che prepara i topi dovrebbero anestetizzare le seguenti gruppo dopo il secondo mouse del gruppo precedente è stato laminectomized. In questo modo, siamo in grado di trapiantare cellule (o un supporto di controllo) in 40 topi in circa 3 ore, anche se ogni mouse avrà circa 30-40 min.
Terapie di sostituzione cellulare per il trattamento di alcuni disturbi del SNC sono attualmente in sperimentazione clinica 10. Non vi è alcun sostituto per modelli in vivo di NSC trapianto e il nostro protocollo per l'attecchimento delle NSCs nel midollo spinale di topi affetti da demielinizzazione virale indotta facilita l'utilizzo di un importante modello di sclerosi multipla e può essere facilmente adattato ad altri modelli.
Divulgazioni
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente / attrezzature | Azienda | Numero di catalogo | Commenti (opzionale) |
|---|---|---|---|
| Ketaject | Phoenix Parmaceuticals | NDC 57319-542-02 | |
| Xylazina cloridrato | MP Biomedicals | 158307 | |
| Nair | Church & Dwight Co. | ||
| 10 microlitri Hamilton siringa w / rimovibile ago | Hamilton Azienda | 7635-01 | |
| Hamilton Aghi, 30 G o 33 G, ½ pollici, 30 ° smusso | Hamilton Azienda | 7803-077803-05 | Prova la vitalità delle cellule dopo il passaggio attraverso gli aghi per identificare il miglior indicatore da utilizzare |
| Micro forbici | Mondo Strumenti di precisione | 555500S | |
| Piccolo Graefe Pinza | FST | 11053-10 | |
| Stereotassica | KOPF Instruments | Modello 1772 Holder universale | |
| Stereotassica | KOPF Instruments | Modello 1773 Electrode Holder | |
| Stereotassica | KOPF Instruments | Modello 902 stereotassica di piccoli animali | |
| Stereotassica | KOPF Instruments | Modello 960 vettore elettrodo sinistro | |
| Suture | Ethicon | 95057-064 | |
| Ringer lattato | Hospira | NDC 0409-7953-03 | |
| Staples | Scienza multa | 12032-07 | |
| Emostatica | FST | 13010-12 | |
| Bisturi, dimensioni 10,11 | Pescatore | 268878, 268879 | |
| Suture | ETHICON | 1676G | Dimensione 5-0, 3 / 8 "cerchio, ago 19 mm, filo intrecciato 45 centimetri |
| Reflex 7 ferita applicatore Clip | FST | 12031-07 | |
| 7 millimetri clip ferita Reflex | FST | 12032-07 | |
| Olsen-Hegar ago titolare | FST | 12502-12 |
Riferimenti
- Bergmann, C. C., Lane, T. E., Stohlman, S. A. Coronavirus infection of the central nervous system: host-virus stand-off. Nat Rev Microbiol. 4, 121-132 (2006).
- Weiner, H. L. The challenge of multiple sclerosis: how do we cure a chronic heterogeneous disease. Ann Neurol. 65, 239-248 (2009).
- Fleming, J. O., Trousdale, M. D., Bradbury, J., Stohlman, S. A., Weiner, L. P. Experimental demyelination induced by coronavirus JHM (MHV-4): molecular identification of a viral determinant of paralytic disease. Microb Pathog. 3, 9-20 (1987).
- Totoiu, M. O., Nistor, G. I., Lane, T. E., Keirstead, H. S. Remyelination, axonal sparing, and locomotor recovery following transplantation of glial-committed progenitor cells into the MHV model of multiple sclerosis. Exp Neurol. 187, 254-265 (2004).
- Carbajal, K. S., Schaumburg, C., Strieter, R., Kane, J., Lane, T. E. Migration of engrafted neural stem cells is mediated by CXCL12 signaling through CXCR4 in a viral model of multiple sclerosis. Proc Natl Acad Sci U S A. 107, 11068-11073 (2010).
- Hardison, J. L., Nistor, G., Gonzalez, R., Keirstead, H. S., Lane, T. E. Transplantation of glial-committed progenitor cells into a viral model of multiple sclerosis induces remyelination in the absence of an attenuated inflammatory response. Exp Neurol. 197, 420-429 (2006).
- Blakemore, W. F., Crang, A. J. . Transplantation of glial cells into areas of demyelination in the adult rat spinal cord. , (1992).
- Liu, S. Embryonic stem cells differentiate into oligodendrocytes and myelinate in culture and after spinal cord transplantation. Proc Natl Acad Sci U S A. 97, 6126-6131 (2000).
- Keirstead, H. S. Human embryonic stem cell-derived oligodendrocyte progenitor cell transplants remyelinate and restore locomotion after spinal cord injury. J Neurosci. 25, 4694-4705 (2005).
- Mayor, S. First patient enters trial to test safety of stem cells in spinal injury. BMJ. 341, c5724-c5724 (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon