Method Article
Transplantation chirurgicale de cellules souches neurales de souris dans la moelle épinière des souris infectées avec le virus de l'hépatite murine neurotrope
Dans cet article
Résumé
La transplantation de cellules souches neurales de souris (CNS) dans la moelle épinière des souris avec une démyélinisation établi est détaillée. La préparation du NSC, la laminectomie de vertèbre thoracique 9 (T9), et la transplantation d'NSCs est décrite avec les soins pré-et post-opératoire de la souris.
Résumé
Les souris infectées avec la souche JHM neurotrope du virus de l'hépatite de la souris (MHV) de développer les résultats pathologiques et cliniques similaires aux patients atteints de la sclérose multiple maladie démyélinisante (SEP). Nous avons montré que la transplantation de NSC dans la moelle épinière des souris malades les résultats à une amélioration significative dans les deux remyélinisation et de résultats cliniques. Les thérapies de remplacement cellulaire pour le traitement des maladies chroniques neurologiques sont désormais une réalité et dans des modèles in vivo sont essentielles dans la compréhension des interactions entre les cellules greffées et microenvironnement du tissu hôte. Cette présentation fournit une méthode adaptée de transplantation de cellules dans la moelle épinière des souris infectées JHMV. En bref, nous offrons une procédure pour i) la préparation des CNS avant la greffe, ii) soins pré-opératoires de la souris, iii) l'exposition de la moelle épinière par l'intermédiaire laminectomie, iv) l'injection stéréotaxique du CNS, et iv) soins post-opératoires .
Protocole
1. Préparation
- Préparer xylazine-kétamine solution (kétamine est une substance contrôlée. Registres détaillés doivent être conservés et stockés dans des solutions un endroit sûr et verrouillé).
- Nettoyer et stériliser le matériel.
- Préparer aire d'opération en essuyant avec un agent d'asepsie et ensuite recouvrir de papier essuie-stériles, et mis en place le micromanipulateur.
2. Préparation des cellules pour la transplantation
- Les cellules doivent être remises en suspension à une concentration de 100 000 cellules / l E et, bien que seulement 250 000 cellules sont transplantées par souris, un excès de cellules est nécessaire à des fins de chargement seringue (préparer au moins 300 000 cellules par souris recevant des cellules).
- Laver les cellules à transplanter 3 fois dans HBSS dans un flacon conique de 50 ml. Compter les cellules avant l'essorage final.
- Après l'essorage final vers le bas, et de laisser décanter HBSS flacon à l'envers position pour empêcher les gouttelettes d'atteindre le culot.
- L'intérieur des murs à sec avec un rayonnement UV-irradiés, Kimwipe stérile. Ne laissez pas le culot de sécher.
- En tenant le tube debout, lentement et très délicatement remettre en suspension les cellules dans la moitié du volume final désiré de HBSS.
- Mesurez le volume total par pipetage la majorité de la suspension dans un embout de pipette puis en réglant le cadran sur le pipetteur jusqu'à la suspension totale est dans la pointe de la pipette. Cela vous indiquera combien plus HBSS est nécessaire pour la concentration voulue.
- Amener le volume à la quantité désirée en ajoutant HBSS.
- Remettre sur la glace. Vérifiez la viabilité des cellules si elles doivent être sur la glace pendant plus de 2 heures.
3. Préparation de la souris pour la chirurgie et la transplantation
- Anesthésier la souris par injection intrapéritonéale de kétamine (100mg/kg) et de xylazine (10mg/kg) dans ~ 100 doses ul ou un équivalent anesthésique. L'ensemble de la procédure de préparation chirurgicale pour suture prendra 30-40 minutes.
- (Facultatif: appliquer numérotées, un ruban de couleur à la queue de chaque souris pour assurer l'identification)
- Rasez la zone dorsale de la souris à partir du bas du dos à la nuque, et l'extension de 2 cm de la ligne médiane bilatérale, avec une tondeuse électrique. Les cheveux doivent être coupés aussi près que possible (il peut être nécessaire d'aller sur la zone plusieurs fois).
- Pour enlever les poils restants, appliquer une fine couche de crème dépilatoire (Nair) avec une gaze applicateur incliné.
- Après 1-2 minutes, essuyez Nair avec une gaze humidifiée légèrement avec de l'eau savonneuse. La zone préparée doit être propre peau nue sans aucun morceaux errants de cheveux qui pourrait entrer dans la plaie lors de la procédure subséquente chirurgicale.
Stériliser la zone préparée avec une solution d'iodure.
4. Laminectomie
- Changez fréquemment et / ou de stériliser les gants pendant toute la procédure. Placez le côté de la souris dorsale avec la tête pointant vers la gauche (si vous êtes droitier). Drapé des animaux pour assurer la stérilité et que seule la zone rasée est exposée. Faire une incision verticale (~ 1,3 cm) sur le site laminecomy allant de quelque vertèbres thoraciques T8 à T12.
- Avec la pince Graefe tenu dans la main gauche, de fixer solidement la colonne vertébrale au T9 (figure 1A) et soulevez la souris vers le haut à exagérer la courbure rachidienne.
- Utilisez le scalpel pour marquer la jonction entre T10 et T11, l'espace entre les deux protubérances épineuses. En outre exposer la jonction par attentivement la mise au rebut de la couche musculaire pour exposer l'os (voir figure 1B, C).
- Utilisez les ciseaux pour les muscles encore claires loin de la lame et autour du pédicule avec des cisailles de petite taille. Cela permettra d'ouvrir un petit espace entre les vertèbres. Lentement et délicatement insérez une lame des ciseaux dans cet espace et couper le pédicule. Assurez-vous que la courbure de la paire de ciseaux est toujours positionné latéralement, loin de la moelle. Répétez de l'autre côté. (Voir Figure 1D, E)
- Soulevez la lame d'exposer le cordon et soigneusement coupez. Soyez sûr de ne pas laisser des fragments d'os gratuits ou déchiquetés derrière. (Voir Figure 1F)
- Avant l'injection, nettoyer tout le sang loin avec des cotons-tiges stériles.
5. L'injection de cellules
- Fixez l'aiguille avec une aiguille de noix à la seringue de Hamilton et les nettoyer en rinçant plusieurs fois avec de l'eau, puis 70% d'éthanol, et enfin HBSS. Insérez le piston après chaque remplissage avec de l'eau, l'éthanol à 70%, ou HBSS.
- Préparez la seringue Hamilton pour le chargement de la cellule en retirant le piston et desserrant l'écrou d'aiguille et en tirant l'aiguille de la seringue de suite pour éviter la contre-pression. Assurez-vous que la manipulation soigneuse de l'aiguille et l'écrou sont fait avec des gants stériles.
- Charge 15μl de cellules dans la pointe de pipette et appuyez sur la pointe solidement dans l'extrémité arrière de la seringue pour charger les cellules dans la seringue.
- Insérez le piston de 5mm environ et puis serrer l'écrou de l'aiguille.
- Enfoncer le piston de l'ONUjusqu'à ce certains de la suspension cellulaire est vu sortir l'aiguille.
- Assurez-vous qu'il n'ya pas de bulles dans la seringue et jeter la seringue en position horizontale pour empêcher les cellules de faire un dégradé par la gravité.
- Prends de la souris laminectomized par le muscle dorsal spinalis reliant les épines de T8 et T9 (figure 2B, C).
- Pince hémostatique l'au bras micromanipulateur (vertical) gauche de sorte que les pattes avant de la souris sont dans l'air et ses pattes arrières touchant légèrement une plate-forme de serviettes en papier stériles comme dans les figures 2A et 2B.
- Fixer la seringue dans le bras droit de micromanipulateur (à un angle de 70 °) et faites glisser la seringue à la position la plus basse possible, avant le serrage.
- Stabiliser la souris en épinglant sa queue contre les serviettes en papier et abaissez lentement la seringue (figure 2B).
- Abaissez l'aiguille vers le cordon et insérez le 1mm aiguille dans l'hémisphère opposé à la ligne médiane dorsale (figure 2C). La pointe de l'aiguille doit être dans la matière grise à proximité du canal central.
- Injecter lentement 2.5μl de cellules. Injecter à un taux de 1 microlitre / 5 secondes. Après l'injection des cellules, attendez 10 secondes et une rétraction de l'aiguille d'un dixième de tour à la fois toutes les 10 secondes jusqu'à ce que l'aiguille est hors de la moelle. Prêtez attention à efflux possible de cellules en suspension.
- Rentrer rapidement la seringue et le détacher de la branche micromanipulateur. Poser la seringue vers le bas à l'horizontale.
- Relâchez la souris et le transfert à la table de suture.
- Répétez les étapes 5.7 à 5.14 pour chaque souris jusqu'à ce que la seringue est vide. Stériliser les outils (dans le stérilisateur) et l'aiguille (en essuyant avec de l'éthanol) entre les animaux. Jeter les cellules et recharger si l'agglutination est visible.
- Nettoyer la seringue à l'étape 5.1 entre les charges.
6. Sutures et les soins post-op
- Suture de l'incision. Aiguille à suture est insérée dans l'aponévrose superficielle des deux côtés de l'incision. Le fil est tendu à travers, tirant fascia superficiel ensemble (figure 3A), couvrant ainsi le cordon médullaire exposées sur le site de la lame enlevée. Ne pas suturer le muscle cutanée attaché à la peau ou les muscles squelettiques du dos. Tirer le fil entier à travers, en laissant environ 1 / 2 ". Utilisation du porte-aiguille, trois noeuds sont formés et le fil est coupé au plus près du noeud que possible.
- Fermer l'incision par l'application de deux à trois agrafes (selon la taille de l'incision) à la peau (figure 3B). Retirez soigneusement la peau loin de la souris afin d'éviter l'agrafage du muscle sous-jacent.
- L'utilisation d'un 26G3 / 8 aiguilles d'injecter 0,5 ml de Ringer sous-cutanée dans le bas du dos loin de l'incision.
- Placez la souris au retour dans sa cage. Afin de s'assurer qu'il est capable de respirer confortablement sous anesthésie, la souris doit être placée sur le côté dans la cage, en évitant tout contact entre le site de la chirurgie et de la literie cage. Les cages devraient être placées sur des coussins chauffants.
- Les souris sont surveillés après l'anesthésie s'estompe pour assurer s'apaise saignements, les sutures restent fermés, et que les souris retourner au pré-opératoire de la mobilité.
- Traiter les souris une seule fois avec la buprénorphine analgésique (0,05-0,1 mg / kg) après une chirurgie.
- Assurez-souris avec facultés affaiblies ont un accès suffisant à la nourriture et l'eau: bouteilles d'eau sont équipés d'étendue 3,5 pouces becs et des souris qui sont incapables de marcher sont nourris à la main l'eau et / ou à haute teneur en calories des compléments alimentaires (Nutri-Cal, Tomlyn).
7. Les résultats représentatifs:
Les résultats souhaités seront identifiables par l'absence d'efflux de la suspension cellulaire lors de l'injection et par l'aspect intact de la moelle épinière suite à la procédure. À cette fin, il est vital d'avoir un éclairage lumineux et direct sur la colonne vertébrale de la souris lors de la laminectomie et pendant l'injection. Éclairage optimal est facilitée par l'éclairage à fibres optiques (figure 2A).
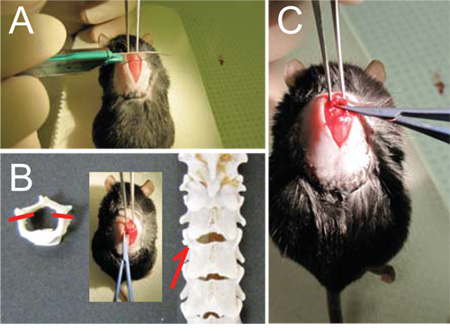
Figure 1 - Laminectomie (A) Une fois vertèbre T9 est solidement tenu avec la pince de Graefe, (B, C) Score de la colonne vertébrale avec un scalpel entre T10 et T11 pour faciliter l'entrée des ciseaux micro.. (D) Faites glisser les ciseaux micro travers l'espace entre T10 et T11 (flèches et en médaillon, E) et couper les pédicules de chaque côté (tirets, E) pour libérer la lame dorsale. (F) Flip la lame jusqu'à rostralement et le couper.
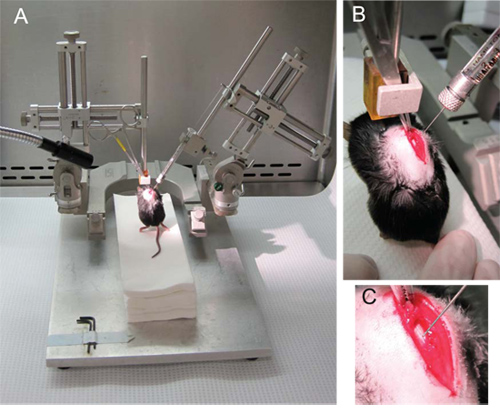
Figure 2. L'injection de NSC. (A) La configuration générale de l'micromanipulateur avec le hémostatique tenant la souris attaché au bras gauche et la seringue Hamilton sur le bras droit à un angle de 70. (B) Le hémostatique maintenir le muscle dorsal spinalis reliant les épines de T8 et T9. (C) L'aiguille est abaissée à tIl médiane et dans la matière grise dans l'hémisphère opposé, proximale du canal central.
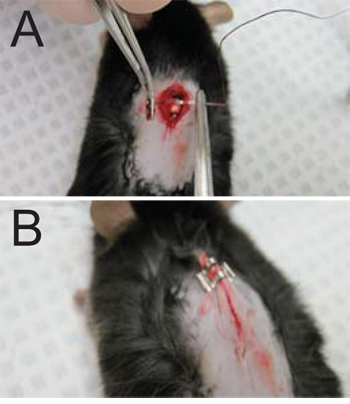
Figure 3. Sutures et fermeture de la plaie. (A) Les sutures sont appliqués à l'aponévrose superficielle des deux côtés de l'incision. (B) L'incision est refermée avec 2-3 agrafes au besoin (une agrafe montré sur une plaie nécessitant 3).
Discussion
Une greffe bien exécuté dépendra principalement de la laminectomie prudent et l'injection des cellules. L'écueil principal à éviter lors d'une laminectomie est l'endommagement de la moelle épinière. Cela peut se produire lors de la procédure elle-même ou par les dommages causés par des fragments d'os pointus laissés après la procédure. Pour éviter ces derniers, s'assurer que les points de la micro-ciseaux courbes sont toujours opposée à la corde et d'examiner attentivement la colonne vertébrale laminectomized pour s'assurer que tous les fragments d'os sont effacés et que les bords de la structure restante vertébrale n'a pas ouvertement en saillie ou dentelés.
Comme mentionné précédemment, la détection de l'efflux sera possible que si la lumière brille et directement sur le cordon médullaire exposés lors de l'injection. Efflux est le plus susceptible de se produire avec 30 aiguilles de calibre (contre 33 gauge) et si l'injection est faite trop rapidement. Bien que ce protocole nous a donné de bons résultats, d'autres ont rapporté plus les périodes d'attente (jusqu'à 5 minutes) avant de se rétracter l'aiguille d'injection suivante 8,9. Aussi, des aiguilles de calibre plus petit est préférable, mais nous avons constaté que certaines cellules sont lysées trop facilement quand on lui passe au travers de 33 aiguilles de calibre.
Afin de maximiser l'efficacité, une équipe de transplantation effectifs des quatre stations différentes (souris prep, laminectomie, une injection, et les sutures) est souhaitable. Par ailleurs, le timing pour chaque procédure doit être optimisé pour minimiser le temps, les cellules sont en attente sur la glace. Par exemple, nous greffe nos souris en groupes de quatre (le nombre de doses de chaque chargement de la seringue), la personne l'injection des cellules commence à charger la seringue après la souris tiers a été laminectomized et la personne qui prépare les souris devrait anesthésier les suivants groupe après la deuxième souris du groupe précédent a été laminectomized. De cette manière, nous pouvons transplanter des cellules (ou le contrôle des médias) dans 40 souris en environ 3 heures, même si chaque souris prendra min environ 30-40.
Les thérapies de remplacement cellulaire pour le traitement de certains troubles du SNC sont actuellement en essais cliniques 10. Il n'ya pas de substitut à des modèles in vivo de NSC transplantation et notre protocole pour la prise de greffe de NSC dans la moelle épinière des souris avec une démyélinisation induite virale facilite l'utilisation d'un modèle important de la SEP et peuvent également être facilement adapté à d'autres modèles.
Déclarations de divulgation
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif / équipements | Société | Numéro de catalogue | Commentaires (optionnel) |
|---|---|---|---|
| Ketaject | Phoenix Pharmaceutiques | NDC 57319-542-02 | |
| Chlorhydrate de xylazine | MP Biomédical | 158307 | |
| Nair | Church & Dwight Co. | ||
| 10 ul seringue Hamilton w / amovible aiguilles | Hamilton Company | 7635-01 | |
| Aiguilles Hamilton, 30G ou 33 G, ½ pouces, 30 ° conique | Hamilton Company | 7803-077803-05 | Test de la viabilité des cellules de votre passage suivant à travers des aiguilles d'identifier la meilleure mesure à utiliser |
| Micro Ciseaux | Instruments de précision du monde | 555500S | |
| Petite Pince Graefe | TSF | 11053-10 | |
| Stéréotaxique | KOPF Instruments | Modèle 1772 Support Universel | |
| Stéréotaxique | KOPF Instruments | Titulaire d'électrode Modèle 1773 | |
| Stéréotaxique | KOPF Instruments | Modèle 902 stéréotaxique du petit animal | |
| Stéréotaxique | KOPF Instruments | Modèle 960 porte-électrode gauche | |
| Sutures | Ethicon | 95057-064 | |
| Ringer | Hospira | NDC 0409-7953-03 | |
| Staples | Fine Science | 12032-07 | |
| Hémostatique | TSF | 13010-12 | |
| Scalpels, tailles 10,11 | Fisher | 268878, 268879 | |
| Sutures | ETHICON | 1676G | Taille 5-0, 3 / 8 "cercle, l'aiguille de 19mm, fil tressé 45cm |
| Reflex 7 applicateur clip de la plaie | TSF | 12031-07 | |
| 7mm clips plaies Reflex | TSF | 12032-07 | |
| Porte-aiguille Olsen Hegar | TSF | 12502-12 |
Références
- Bergmann, C. C., Lane, T. E., Stohlman, S. A. Coronavirus infection of the central nervous system: host-virus stand-off. Nat Rev Microbiol. 4, 121-132 (2006).
- Weiner, H. L. The challenge of multiple sclerosis: how do we cure a chronic heterogeneous disease. Ann Neurol. 65, 239-248 (2009).
- Fleming, J. O., Trousdale, M. D., Bradbury, J., Stohlman, S. A., Weiner, L. P. Experimental demyelination induced by coronavirus JHM (MHV-4): molecular identification of a viral determinant of paralytic disease. Microb Pathog. 3, 9-20 (1987).
- Totoiu, M. O., Nistor, G. I., Lane, T. E., Keirstead, H. S. Remyelination, axonal sparing, and locomotor recovery following transplantation of glial-committed progenitor cells into the MHV model of multiple sclerosis. Exp Neurol. 187, 254-265 (2004).
- Carbajal, K. S., Schaumburg, C., Strieter, R., Kane, J., Lane, T. E. Migration of engrafted neural stem cells is mediated by CXCL12 signaling through CXCR4 in a viral model of multiple sclerosis. Proc Natl Acad Sci U S A. 107, 11068-11073 (2010).
- Hardison, J. L., Nistor, G., Gonzalez, R., Keirstead, H. S., Lane, T. E. Transplantation of glial-committed progenitor cells into a viral model of multiple sclerosis induces remyelination in the absence of an attenuated inflammatory response. Exp Neurol. 197, 420-429 (2006).
- Blakemore, W. F., Crang, A. J. . Transplantation of glial cells into areas of demyelination in the adult rat spinal cord. , (1992).
- Liu, S. Embryonic stem cells differentiate into oligodendrocytes and myelinate in culture and after spinal cord transplantation. Proc Natl Acad Sci U S A. 97, 6126-6131 (2000).
- Keirstead, H. S. Human embryonic stem cell-derived oligodendrocyte progenitor cell transplants remyelinate and restore locomotion after spinal cord injury. J Neurosci. 25, 4694-4705 (2005).
- Mayor, S. First patient enters trial to test safety of stem cells in spinal injury. BMJ. 341, c5724-c5724 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon