需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
形态分析果蝇幼虫外周感觉神经元树突和轴突使用遗传马赛克
摘要
感觉神经元的树突分枝果蝇幼虫周围神经系统是有用的模型,以澄清一般和神经元类特定的神经细胞分化的机制。我们提出了一个实用指南生成和分析树突状树枝状的神经元遗传马赛克。
摘要
神经系统的发育需要的神经元的地位和身份,准确的神经元类的特定的树突状发展和轴突布线,正确规范。最近的树突状树枝状(DA) 的果蝇幼虫周围神经系统(PNS)的感觉神经元已成为强大的遗传模型,在其中阐明神经元分化的一般和特定类的机制。有四个主要的DA神经元类(I - IV)1 。他们被命名为了增加枝蔓乔木的复杂性,并在其分化2-10的基因控制类特定的差异。 DA感官系统是一个实际的模型研究的树突状形态 11-13的控制背后的分子机制,因为:1)它可以利用强大的基因在果蝇中的可用工具,2)的优势,DA神经元枝蔓乔木展开在下方的光骑士尺寸只有2AR幼虫角质层很容易地可视化体内的高分辨率,3)类特定的树突形态的多样性有利于比较分析,发现控制简单与高度分支的树突树形成的关键要素,以及4)树突状乔木的定型不同的DA能神经元的形状有利于形态的统计分析。
DA神经元活动的修改输出的一个幼虫的运动中枢模式发生器 14-16 。不同的DA神经元类有不同的感觉方式,和它们的激活会引起不同的行为反应14,16-20。此外,不同类别发送到果蝇幼虫中枢神经系统的腹 神经索(VNC) 的 21轴索预测刻板。这些预测终止两个DA神经元感觉方式和位置在体壁的树突状领域7,22地形意见书23。因此,DA的轴突预测的检查可用于澄清的内在机制, 地形测绘7,22,23,以及一个简单的电路调节幼虫运动14-17的接线。
我们在座的生成和分析遗传马赛克24标记的DA通过MARCM(马赛克Repressible细胞标记分析)1,10,25和FLP - 22,26,27技术(在图1总结)神经元的实用指南。
研究方案
1.Preparation试剂
- 准备钙离子免费HL3.1生理盐水28。
- (毫米):70氯化钠,氯化钾,氯化镁2 20 10 3,碳酸氢钠5 HEPES,115蔗糖,和5海藻糖; pH值7.2。过滤消毒,并储存于4 ° C。
注意:CA + +免费的解决方案可以防止肌肉收缩,在清扫。
- (毫米):70氯化钠,氯化钾,氯化镁2 20 10 3,碳酸氢钠5 HEPES,115蔗糖,和5海藻糖; pH值7.2。过滤消毒,并储存于4 ° C。
- 设为聚- L -赖氨酸(PLL)盖玻片。
- 4.2毫升水溶解100毫克PLL和300μL分装在Eppendorf管中,并冻结在-20 ° C
- 涂装前盖玻片,首先解冻等份,把它DDH 2 O10毫升加入20μL的柯达照片- FLO,最终的PLL浓度为0.7毫克/毫升。
- 浸没盖玻片在PLL解决方案的30分钟,捞出晾干,然后用清水冲洗简要水和干燥。重复两次。治疗盖玻片持续约一个月。
2。遗传杂交
- TØ生成MARCM克隆。下面是一个例子交叉使用泛DA驱动11,27:
FRT2A x hsFLP; Gal4的 109(2)80, 无人机,mCD8::GFP的浴缸,Gal80 FRT2A/SM5-TM6B - 要生成FLP -克隆 。下面是一个例子交叉使用一类IV专用驱动8:
PPK - GAL4 x YW,hsFLP无人机的首次登记税,CD2,Y +一站式FRT - mCD8:绿色荧光蛋白
3。收集胚胎
- 果蝇杂交保持在一个收集瓶在25℃,收集胚胎的酵母膏30,31一层薄薄的苹果汁琼脂平板上 29蔓延。
4。热休克治疗的胚胎
- 反对胚胎已经奠定了苹果汁琼脂平板放置的空盘。密封围绕这两大板块封口膜(图2)。
- 热休克期间,淹没日e在水浴板不放,使用金属的重量。
- 对于MARCM胚胎
- 收集2H胚胎和孵化包围在10厘米培养皿菜浸在25 ° C额外2H组织。
注:调整热休克协议改变了克隆产生的频率。 - 对于数量较少的克隆,着眼于单个孤立的神经元,淹没在上半年的水浴热休克38 ° C。
- 对于数量较大的克隆,热休克45分钟在38℃,在室温下30分钟,然后热休克恢复再额外30分钟。
- 收集2H胚胎和孵化包围在10厘米培养皿菜浸在25 ° C额外2H组织。
- 收集FLP - 24小时的胚胎和热休克1h后在38 ° C。
5。筛选克隆的
- 热休克后,取下盖子防水安排和苹果汁琼脂平板上放置蘸组织包围在10厘米培养皿菜。文化的胚胎和随后的幼虫在25 ° C,直到漂移ING 第三龄。
注:培养条件下,尤其是营养,已被证明改变DA的树突状乔木形态 32,33 。确保增长的幼虫访问酵母粘贴在任何时候,监测和补充需要粘贴为酵母。 - 这一点在协议开始,轻轻用昆虫钳操纵幼虫。
- 简要轻轻冲洗自来水中的幼虫,然后放到琼脂平板。
注意:此步骤减少从食物或幼虫表面污垢的自体荧光背景。 - 一个强大的荧光解剖显微镜下检查幼虫。确定GFP阳性神经元/体壁细胞的幼虫。
6, 在体内成像树突
- 一个抑郁症的载玻片放入一个小降80%甘油的幼虫。广场上滑动盖玻片固定幼虫。确保没有空气保持之间的幼虫和coversli第
- 轻轻推盖玻片,推出的幼虫,让可视化的神经元的利息。形象mCD8:通过共聚焦显微镜观察GFP标记树突状乔木。
7。幼虫清扫
开始前的注意事项:DA神经元的树突降低后迅速启动夹层。每一个人幼虫解剖,在不到5分钟,以确保良好的树突形态。
- 解剖徘徊在Sylgard板描述与以下修改以前34路龄幼虫3:
- DA神经元轴突总站成像,确保中枢神经系统是完整的和节段性神经不破。开放的幼虫后,首先仔细切开气管的连接体壁,然后轻轻取出整个肠道。
- 如果成像树突单独删除的中枢神经系统,让平坦的安装。
8。 Fixat离子和阻止幼虫鱼片
- 幼虫仍然寄托Sylgard板,固定在4%的PBS PFA上轻轻旋转振动筛在室温下20分钟。
- 卸下固定后的幼虫组织的痕迹(脂肪体,气管等)。
- 洗净PBST(含0.1%Triton X - 100的的PBS)的Sylgard板和筛3X 10分钟。如果检查轴突总站,保持Sylgard板的圆角。 (如果染色树突有可能在这一步转移34 0.5毫升管幼虫鱼片)
- 在振动筛上一个PBST座在5%的正常驴血清(NDS)幼虫在室温为20分钟。
9。染色幼虫鱼片
- 删除初级抗体孵育封闭液(5%的NDS / PBST)在4 ° C包围在一个小的特百惠容器过夜蘸组织。
- 管,并从4℃取出,在室温下孵育额外小时。
- 6X PBST清洗10分钟。新增二级antibody(5%的NDS / PBST),并盖以防止荧光团的照片, 漂白 34 。
- 可以在室温下孵育两小时或过夜,4 ° C的室温下一个小时。
- 在PBST洗幼虫6X 10分钟,并进行安装。
10。检查的枝蔓乔木安装幼虫鱼片
- 安装每个幼虫圆角平尽可能使用解剖剪刀或手术刀切断头部(包括口挂钩),后(包括气孔)34。
- 放置在幻灯片上角质层的一面朝下的幼虫圆角,安装在80%甘油,并密封指甲油盖玻片双方一个“快” 装载 34 。
- 一个永久性的安装和更清晰的图像
- 放置到一个PLL盖玻片下降的PBS解剖幼虫鱼片肌肉端时,它会很快坚持盖玻片。
- 安装后删除尽可能多的液体,howeveR不让它完全干燥。
- 以通过乙醇系列盖玻片(附加幼虫圆角):35%乙醇,50%,70%,95%,终于2X 100%的乙醇,每次10分钟(第二100%的乙醇溶液应经常更换);最后,在二甲苯洗2 - 3X 10分钟。
- 放在一个干净的幻灯片上的DPX mountant(Distyrene增塑剂,二甲苯 )的下降,并仔细地躺在上面盖玻片圆角方式。保持在黑暗中,等待一天的DPX设置前成像。
11。轴突总站检查安装幼虫鱼片
- 继续运行节段性神经之间的夹层,固定不变百佳和中枢神经系统的过程中,染色,以便追踪轴突从外周感觉神经元细胞体的VNC。
- 每个幼虫圆角角质层端安装在80%的甘油,在抑郁症的幻灯片。跟踪从DA细胞体的轴突共聚焦显微镜下的VNC的。注:PNS在每个体壁段项目的神经细胞同源段的VNC。
12。代表性的成果:
代表结果显示在图3-5。图3给出了一类四DA神经元在体内捕获的共聚焦显微镜下,整个乔木。图图4显示了免疫组化标记的Ⅲ类神经枝蔓乔木的一部分收起来,已正确固定保存形态。相关的插图可以不成功的解剖和(抗GFP抗体染色后)固定发生的退化。图5显示了一个IV级在中枢神经系统轴突总站(抗- GFP,绿色);所有的IV类总站合作与抗CD2(洋红色)染色。
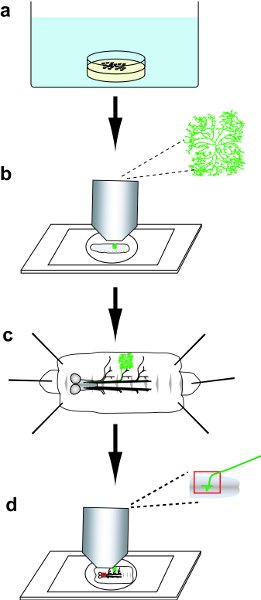
图1协议概述。 a)收集和再热休克胚胎。 B)选择与GFP阳性DA神经元克隆的幼虫,然后在现场幼虫的形象GFP标记的枝蔓乔木。三)解剖幼虫,然后免疫组化染色圆角。 D)山染色圆角,然后形象的树突状乔木和DA神经元克隆的轴突预测。

图2苹果汁琼脂平板热休克的制备。以板(白色箭头,AB),顶部(红色箭头B)添加第二培养皿和密封封口膜,B(蓝色箭头)。

图3 在体内一个mCD8枝蔓乔木形象:GFP标记MARCM的克隆(2.1基因型)代表一类四(v'ada)3龄幼虫神经元。比例尺为50μm。
d/3111/3111fig4.jpg“/>
图4 mCD8:GFP标记的抗GFP抗体染色III类神经元(ddaA),呈现出良好的形态后,成功剥离和固定(绿色)MARCM克隆。插图枝蔓退化(白色箭头)不成功的解剖和固定(洋红色)后发生的。比例尺为25微米。
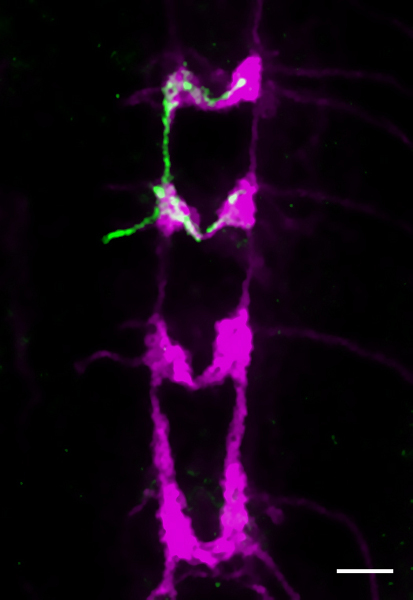
图5 第三龄幼虫VNC。一个FLP -克隆是一个单一的VI级(VDAB)轴突总站(2.2基因型)检测抗GFP抗体(绿色)。抗CD2标签所有IV类总站(洋红色)。比例尺为25微米。
讨论
果蝇幼虫DA神经元模型提供了一个优良的遗传系统调查机制,控制神经元的形态和电路形成。 MARCM是一般用于标签和产生突变的DA神经元克隆。 MARCM,我们使用一个泛神经( 如Gal4 的 C155)或DA神经元特异性司机。使用泛神经的驱动程序,它可以直接使用公共储备中心广泛使用的几个股票。然而,使用DA神经元的特定的驱动程序可以是有利的,因为标记克隆不会产生在中?...
披露声明
没有利益冲突的声明。
致谢
作者感谢理化学研究所的资金。我们也感谢Cagri Yalgin,加Delandre,和周杰伦帕里什讨论遗传和免疫组化协议。
材料
| 试剂名称 | 公司 | 目录编号 | 评论(可选) |
|---|---|---|---|
| SZX16荧光解剖镜下(GFPHQ过滤) | 奥林巴斯 | SZX16 | |
| 活昆虫钳 | 福斯特 | 26030-10 | |
| 26毫米x 76毫米抑郁症的载玻片 | Toshinriko有限公司 | T8 - R004 | |
| Sylgard 184(或Silpot 184) | 道康宁 | 3097358-1004 | |
| 聚- L -赖氨酸 | 西格玛 | P - 1524 | 该产品已被证明最有效的 |
| DPX安装培养基 | 西格玛 | 44581 | |
| 兔抗GFP | Invitrogen公司 | A - 11122 | 稀释1:500 |
| 大鼠抗- CD8 | Caltag | 5H10 | 稀释1:200 |
| 小鼠抗CD2 | 抗体ð serotec | MCA443R | 稀释1:700 |
| 鼠抗- Fasciclin2 | DSHB | 1D4 | 稀释1:10 |
参考文献
- Grueber, W. B., Jan, L. Y., Jan, Y. N. Tiling of the Drosophila epidermis by multidendritic sensory neurons. Development. 129, 2867-2878 (2002).
- Crozatier, M., Vincent, A. Control of multidendritic neuron differentiation in Drosophila: the role of Collier. Dev Biol. 315, 232-242 (2008).
- Hattori, Y., Sugimura, K., Uemura, T. Selective expression of Knot/Collier, a transcriptional regulator of the EBF/Olf-1 family, endows the Drosophila sensory system with neuronal class-specific elaborated dendritic patterns. Genes Cells. 12, 1011-1022 (2007).
- Jinushi-Nakao, S. Knot/Collier and cut control different aspects of dendrite cytoskeleton and synergize to define final arbor shape. Neuron. 56, 963-978 (2007).
- Sugimura, K., Satoh, D., Estes, P., Crews, S., Uemura, T. Development of morphological diversity of dendrites in Drosophila by the BTB-zinc finger protein abrupt. Neuron. 43, 809-822 (2004).
- Li, W., Wang, F., Menut, L., Gao, F. B. BTB/POZ-zinc finger protein abrupt suppresses dendritic branching in a neuronal subtype-specific and dosage-dependent. 43, 823-834 (2004).
- Zlatic, M., Landgraf, M., Bate, M. Genetic specification of axonal arbors: atonal regulates robo3 to position terminal branches in the Drosophila nervous system. Neuron. 37, 41-51 (2003).
- Grueber, W. B., Ye, B., Moore, A. W., Jan, L. Y., Jan, Y. N. Dendrites of distinct classes of Drosophila sensory neurons show different capacities for homotypic repulsion. Curr Biol. 13, 618-626 (2003).
- Grueber, W. B., Jan, L. Y., Jan, Y. N. Different levels of the homeodomain protein cut regulate distinct dendrite branching patterns of Drosophila multidendritic neurons. Cell. 112, 805-818 (2003).
- Moore, A. W., Jan, L. Y., Jan, Y. N. hamlet, a binary genetic switch between single- and multiple- dendrite neuron morphology. Science. 297, 1355-1358 (2002).
- Gao, F. B., Brenman, J. E., Jan, L. Y., Jan, Y. N. Genes regulating dendritic outgrowth, branching, and routing in Drosophila. Genes Dev. 13, 2549-2561 (1999).
- Corty, M. M., Matthews, B. J., Grueber, W. B. Molecules and mechanisms of dendrite development in Drosophila. Development. 136, 1049-1061 (2009).
- Moore, A. W. Intrinsic mechanisms to define neuron class-specific dendrite arbor morphology. Cell Adh. Migr. 2, 81-82 (2008).
- Hughes, C. L., Thomas, J. B. A sensory feedback circuit coordinates muscle activity in Drosophila. Mol. Cell. Neurosci. 35, 383-396 (2007).
- Nishimura, Y. Selection of Behaviors and Segmental Coordination During Larval Locomotion Is Disrupted by Nuclear Polyglutamine Inclusions in a New Drosophila Huntington's Disease-Like Model. J Neurogenet. 24, 194-206 (2010).
- Song, W., Onishi, M., Jan, L. Y., Jan, Y. N. Peripheral multidendritic sensory neurons are necessary for rhythmic locomotion behavior in Drosophila larvae. Proc. Natl. Acad. Sci. U. S. A. 104, 5199-5204 (2007).
- Hwang, R. Y. Nociceptive neurons protect Drosophila larvae from parasitoid wasps. Curr Biol. 17, 2105-2116 (2007).
- Xiang, Y. Light-avoidance-mediating photoreceptors tile the Drosophila larval body wall. Nature. 468, 921-926 (2010).
- Cheng, L. E., Song, W., Looger, L. L., Jan, L. Y., Jan, Y. N. The role of the TRP channel NompC in Drosophila larval and adult locomotion. Neuron. 67, 373-380 (2010).
- Babcock, D. T., Landry, C., Galko, M. J. Cytokine signaling mediates UV-induced nociceptive sensitization in Drosophila larvae. Curr Biol. 19, 799-806 (2009).
- Hafer, N., Schedl, P. Dissection of Larval CNS in Drosophila Melanogaster. J. Vis. Exp. (1), e85-e85 (2006).
- Grueber, W. B. Projections of Drosophila multidendritic neurons in the central nervous system: links with peripheral dendrite morphology. Development. 134, 55-64 (2007).
- Merritt, D. J., Whitington, P. M. Central projections of sensory neurons in the Drosophila embryo correlate with sensory modality, soma position, and proneural gene function. J Neurosci. 15, 1755-1767 (1995).
- Blair, S. S. Genetic mosaic techniques for studying Drosophila development. Development. 130, 5065-5072 (2003).
- Lee, T., Luo, L. Mosaic analysis with a repressible cell marker for studies of gene function in neuronal morphogenesis. Neuron. 22, 451-461 (1999).
- Wong, A. M., Wang, J. W., Axel, R. Spatial representation of the glomerular map in the Drosophila protocerebrum. Cell. 109, 229-241 (2002).
- Shimono, K. Multidendritic sensory neurons in the adult Drosophila abdomen: origins, dendritic morphology, and segment- and age-dependent programmed cell death. Neural Dev. 4, 37-37 (2009).
- Feng, Y., Ueda, A., Wu, C. F. A modified minimal hemolymph-like solution, HL3.1, for physiological recordings at the neuromuscular junctions of normal and mutant Drosophila larvae. J Neurogenet. 18, 377-402 (2004).
- Sullivan, W., Ashburner, M., Hawley, R. S. . Drosophila Protocols. , (2000).
- Kaczynski, T. J., Gunawardena, S. Visualization of the Embryonic Nervous System in Whole-mount Drosophila Embryos. J. Vis. Exp. (46), e2150-e2150 (2010).
- Featherstone, D. E., Chen, K., Broadie, K. Harvesting and preparing Drosophila embryos for electrophysiological recording and other procedures. J Vis Exp. , (2009).
- Medina, P. M., Swick, L. L., Andersen, R., Blalock, Z., Brenman, J. E. A novel forward genetic screen for identifying mutations affecting larval neuronal dendrite development in Drosophila melanogaster. Genetics. 172, 2325-2335 (2006).
- Mirouse, V., Swick, L. L., Kazgan, N., St Johnston, D., Brenman, J. E. LKB1 and AMPK maintain epithelial cell polarity under energetic stress. J Cell Biol. 177, 387-392 (2007).
- Brent, J., Werner, K., McCabe, B. D. Drosophila Larval NMJ Immunohistochemistry. J. Vis. Exp. 25, e1108-e1108 (2009).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118, 401-415 (1993).
- Sugimura, K. Distinct developmental modes and lesion-induced reactions of dendrites of two classes of Drosophila sensory neurons. J Neurosci. 23, 3752-3760 (2003).
- Zito, K., Parnas, D., Fetter, R. D., Isacoff, E. Y., Goodman, C. S. Watching a synapse grow: noninvasive confocal imaging of synaptic growth in Drosophila. Neuron. 22, 719-729 (1999).
- Landgraf, M., Sanchez-Soriano, N., Technau, G. M., Urban, J., Prokop, A. Charting the Drosophila neuropile: a strategy for the standardised characterisation of genetically amenable neurites. Dev Biol. 260, 207-225 (2003).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。