Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Morphologische Analyse Drosophila Larven peripheren sensorischen Neuron Dendriten und Axone mit Genetic Mosaike
In diesem Artikel
Zusammenfassung
Die dendritischen Verzweigung sensorischen Neuronen des Drosophila Larven des peripheren Nervensystems sind nützliche Modelle, um sowohl allgemeine als auch Neuron-Klasse-spezifische Mechanismen der neuronalen Differenzierung aufzuklären. Wir präsentieren eine praktische Anleitung zur Generierung und Analyse dendritischer Verzweigung Neuron genetischen Mosaiken.
Zusammenfassung
Entwicklung des Nervensystems erfordert die korrekte Spezifikation der Neuron Position und Identität, durch genaue Neuron-Klasse-spezifische dendritische Entwicklung und axonalen Verdrahtung gefolgt. Vor kurzem hat die dendritische Verzweigung (DA) sensorischen Neuronen der Drosophila Larve peripheren Nervensystem (PNS) haben sich leistungsfähige genetische Modelle, in denen sowohl allgemeine und Klassen-spezifische Mechanismen der neuronalen Differenzierung aufzuklären. Es gibt vier Haupt-DA Neuron Klassen (I-IV) 1. Sie sind in der Reihenfolge zunehmender Dendriten Laube Komplexität, benannt und haben klassenspezifische Unterschiede in der genetischen Kontrolle ihrer Differenzierung 2-10. Die DA sensorischen Systems ist ein praktisches Modell, um die molekularen Mechanismen hinter der Kontrolle von dendritischen Morphologie 11-13 zu untersuchen, weil: 1) es Vorteile der leistungsstarken genetischen Werkzeuge in der Fruchtfliege, 2) nehmen die DA Neuron Dendriten Laube breitet sich aus in nur 2 Dimensionen unter einem optisch clear Larvencuticula macht es einfach, mit hoher Auflösung in vivo, 3 Visualisierung) der Klasse-spezifische Vielfalt in dendritische Morphologie erleichtert eine vergleichende Analyse zu den wichtigsten Elementen der Kontrolle der Bildung von einfachen vs stark verzweigte dendritische Bäume zu finden, und 4) dendritischen Dorn stereotypen Formen der verschiedenen DA Neuronen zu erleichtern morphometrische statistischen Analysen.
DA Neuronen-Aktivität modifiziert die Ausgabe eines larvalen Fortbewegung central pattern generator 14-16. Die verschiedenen DA Neuron Klassen haben verschiedene sensorische Modalitäten und deren Aktivierung auslöst verschiedenen Verhaltensreaktionen 14,16-20. Außerdem verschiedene Klassen schicken axonalen Projektionen stereotyp in die Drosophila Larve des zentralen Nervensystems in der Bauchmark (VNC) 21. Diese Projektionen enden mit topographischen Darstellungen beider DA Neuron Sinnesmodalität und die Position in der Körperwand der dendritischen Bereich 7,22, 23. Daher Untersuchung von DA axonalen Projektionen können verwendet werden, um Mechanismen, die topographische Kartierung 7,22,23, sowie die Verkabelung einer einfachen Schaltung modulierenden Larven Fortbewegung 14-17 aufzuklären.
Wir stellen Ihnen hier eine praktische Anleitung zur Generierung und Analyse genetischer Mosaike 24 Kennzeichnung DA Neuronen über MARCM (Mosaic Analyse mit einem reprimierbaren Zell Marker) 1,10,25 und Flp-out 22,26,27 Techniken (zusammengefasst in Abb. 1)..
Protokoll
1.Vorbereitung von Reagenzien
- Bereiten Ca + +-freien HL3.1 Kochsalzlösung 28.
- In mM: 70 NaCl, 5 KCl, 20 MgCl 2, 10 NaHCO 3, 5 HEPES, 115 Saccharose und 5 Trehalose; pH 7,2. Filter sterilisieren und lagern bei 4 ° C.
Hinweis: Ca + +-freier Lösung verhindert Muskelkontraktion beim Präparieren.
- In mM: 70 NaCl, 5 KCl, 20 MgCl 2, 10 NaHCO 3, 5 HEPES, 115 Saccharose und 5 Trehalose; pH 7,2. Filter sterilisieren und lagern bei 4 ° C.
- Machen Poly-L-Lysin (PLL) Deckgläser.
- Lösen 100mg PLL in 4.2ml Wasser und machen 300μl Aliquots in Eppendorf-Röhrchen und bei -20 ° C.
- Vor der Beschichtung Deckgläser zunächst Tauwetter ein Aliquot, bringen Sie es bis zu 10ml in ddH 2 O, und fügen Sie 20 &mgr; l von Kodak Photo-Flo; die endgültige PLL-Konzentration liegt bei 0,7 mg / ml.
- Tauchen Deckgläser für 30 Minuten in PLL-Lösung, zu entfernen und trocken, dann kurz mit Wasser abspülen und trocknen. Zweimal wiederholen. Behandelte Deckgläser dauern ca. 1 Monat.
2. Genetische Kreuzungen
- To generieren MARCM Klone. Hier ist ein Beispiel Kreuz mit einem pan-DA Fahrer 11,27:
FRT2A x hsFLP; Gal4 109 (2) 80, UAS-mCD8:: GFP; Wanne-GAL80 FRT2A/SM5-TM6B - Zur Erzeugung von Flp-out-Klone. Hier ist ein Beispiel Kreuz mit einem Klasse IV-spezifische Treiber 8:
ppk-Gal4 x yw, hsFLP; UAS-FRT-CD2, y +-stop-FRT-mCD8:: GFP
3. Sammlung von Embryonen
- Keep Drosophila Kreuze in einer Sammlung Flasche bei 25 ° C und sammeln Embryonen auf einem Apfelsaft-Agar Platte 29 verteilt mit einer dünnen Schicht von Hefepaste 30,31.
4. Hitze-Schock-Behandlung von Embryonen
- Stellen Sie eine leere Platte im Gegensatz zum Apfelsaft-Agar-Platte, auf der die Embryonen gelegt worden. Seal um diese beiden Platten mit Parafilm (Abb. 2).
- Während Hitzeschockprotein, tauchen the Platte in das Wasserbad und halten Sie ihn mit dem Metall Gewicht.
- Für MARCM Embryonen
- Sammeln Embryonen für 2h und inkubieren in einer 10cm Petrischale umgeben von feuchten Gewebe bei 25 ° C für eine zusätzliche 2h.
Hinweis: Einstellung des Hitzeschock-Protokoll verändert die Frequenz, bei der Klone generiert werden. - Für eine kleinere Anzahl von Klonen, mit dem Ziel für einzelne isolierte Nervenzellen, tauchen und Hitzeschock im Wasserbad für 1 Stunde bei 38 ° C.
- Für eine größere Anzahl von Klonen Hitzeschock für 45 Minuten bei 38 ° C, bei RT 30 Minuten, dann Hitzeschock wieder erholen für einen zusätzlichen 30 Minuten.
- Sammeln Embryonen für 2h und inkubieren in einer 10cm Petrischale umgeben von feuchten Gewebe bei 25 ° C für eine zusätzliche 2h.
- Sammeln Flp-out Embryonen für 24 Stunden und Hitzeschock für 1h bei 38 ° C.
5. Screening nach Klonen
- Nach Hitzeschock, entfernen Sie den Deckel des Wasser-dichte Anordnung und Ort der Apfelsaft-Agar-Platte in eine 10 cm Petrischale mit angefeuchteten Gewebe umgeben. Kultur der Embryonen und Larven anschließende bei 25 ° C bis zu wandernIng. 3 rd instar.
Hinweis: Kulturbedingungen, insbesondere Ernährung, haben gezeigt, dass DA dendritischen Dorn Morphologie 32,33 zu ändern. Stellen Sie sicher, dass wachsenden Larven Zugang zu Hefepaste zu allen Zeiten; überwachen und füllt die Hefepaste wie erforderlich. - Von diesem Zeitpunkt an das Protokoll ab, manipulieren Larven vorsichtig mit einer Pinzette Insekten.
- Kurz und sanft spülen die Larven in Leitungswasser, und platzieren Sie dann auf eine Agarplatte.
Hinweis: Dieser Schritt reduziert Hintergrundgeräusche Autofluoreszenz aus der Nahrung oder Schmutz auf der Oberfläche Larven. - Untersuchen Sie die Larven unter einem starken Fluoreszenz Präpariermikroskop. Identifizieren Larven mit GFP-positive Neurone / Zellen im Körper Wand.
6. In-vivo-Bildgebung von Dendriten
- Legen Sie die Larve in eine Depression Objektträger mit einem kleinen Tropfen von 80% Glycerin. Legen Sie ein Deckglas auf dem Objektträger um die Larve zu immobilisieren. Stellen Sie sicher, dass keine Luft zwischen der Larve und die coversli bleibtSeite
- Schieben Sie das Deckglas auf die Larve Rolle der Visualisierung des Neurons von Interesse erlauben. Bild der mCD8:: GFP-markierten dendritischen Dorn über die konfokale Mikroskopie.
7. Larven Dissektion
Beachten Sie vor Beginn: DA Neuron Dendriten verschlechtern sich rasch nach Beginn der Dissektion. Dissect jede einzelne Larve in weniger als 5min zum guten Dendriten Morphologie gewährleisten.
- Dissect wandernde 3 rd Larvenstadium auf einem Sylgard Platte wie zuvor 34 mit den folgenden Modifikationen:
- Für die Darstellung von DA Neuron Axon-Termini, sicherzustellen, dass das ZNS intakt ist und der segmentalen Nerven sind nicht kaputt. Nach dem Öffnen der Larven, zunächst vorsichtig schneiden die Tracheal-Verbindungen, um den Körper Wand und dann vorsichtig die gesamte Darm.
- Wenn die Abbildung der Dendriten allein, entfernen Sie das ZNS zu erlauben eine flachere Montage.
8. Fixation und Sperrung von Larven Filets
- Mit der Larve noch auf die Platte Sylgard merken, fix it in 4% PFA in PBS für 20 Minuten bei RT auf einem sanft rotierenden Schüttler.
- Entfernen Spuren von Larven Gewebe (fat Körper, Luftröhre, etc.) nach der Fixierung.
- Wash in PBST (PBS mit 0,1% Triton X-100) 3x 10 Minuten auf dem Sylgard Platte und Shaker. Wenn die Prüfung Axon-Termini, halten Sie das Filet auf dem Teller Sylgard. (Wenn Färbung Dendriten ist es möglich, die Larven Filets auf einem 0,5 ml Röhrchen füllen bei diesem Schritt 34)
- Blockieren Sie die Larven für 20 Minuten bei RT in 5% normalem Esel-Serum (NDS) in PBST auf einem Schüttler.
9. Die Färbung der Larven Filets
- Blocking-Lösung und Inkubation in Primärantikörper (in 5% NDS / PBST) über Nacht bei 4 ° C in einer kleinen Tupperdose, umgeben von feuchten Gewebe.
- Entfernen Sie die Rohre von 4 ° C inkubieren eine weitere Stunde bei RT.
- Wash 6x 10 Minuten in PBST. Fügen Sie den sekundären antibOdy (in 5% NDS / PBST) und Abdeckung, um zu verhindern Fluorophor Photobleaching 34.
- Inkubieren entweder bei RT für 2 Stunden oder über Nacht bei 4 ° C eine Stunde bei RT folgten.
- Waschen Sie die Larven 6x 10 Minuten in PBST und fahren Sie mit Montage.
10. Montage der Larven Filets für die Prüfung der Dendriten Laube
- Montieren Sie je Larven Filet so flach wie möglich mit Sezieren einer Schere oder einem Skalpell den Kopf abzuschlagen (einschließlich der Mund Haken) und der hintere (einschließlich der Luftlöcher) 34.
- Setzen Sie den Larven Filet auf der Folie Nagelhaut-Seite nach unten, in 80% Glycerin montieren und Dichtung den Seiten des Deckglases mit Nagellack für einen "schnellen" Halterung 34.
- Für eine dauerhafte Befestigung und ein klareres Bild
- Setzen Sie den sezierten Larven Filet Muskel-Seite nach unten auf einen Tropfen PBS auf eine PLL Deckglas, wird es schnell zu dem Deckglas haften.
- Entfernen Sie so viel Flüssigkeit wie möglich nach der Montage, however nicht lassen Sie es vollständig trocknen.
- Nehmen Sie das Deckglas (mit angeschlossenem Larven Filet) durch eine Ethanol-Serie: 35% Ethanol, 50%, 70%, 95%, und schließlich 2x 100% Ethanol für jeweils 10 Minuten (2. 100% EtOH Lösung häufig geändert werden soll, gefolgt ), und schließlich, waschen 2-3x 10 Minuten in Xylol.
- Gib einen Tropfen des DPX Deckfluessigkeit (Distyrene Weichmacher Xylol) auf einen sauberen Objektträger und legen Sie es vorsichtig Deckglas Filet-side-down an der Spitze. Halten Sie in der Dunkelheit, und warten Sie einen Tag für die DPX vor Bildgebung gesetzt.
11. Montage der Larven Filets für die Prüfung der Axon-Termini
- Halten Sie die segmentalen Nerven, die zwischen den PNS und ZNS intakt während der Präparation, Fixierung und Färbung, damit die Verfolgung der Axone von peripheren sensorischen Neuronen Zellkörper zu den VNC.
- Montieren Sie je Larven Filet Nagelhaut-Seite nach unten in 80% Glycerin in eine Depression gleiten. Verfolgen Sie die Axone aus der DA Zellkörper zu denVNC unter dem konfokalen Mikroskop. Hinweis: PNS Neuronen in jeder Körperzelle Wandsegment Projekt auf die verwandten Segment des VNC.
12. Repräsentative Ergebnisse:
Repräsentative Ergebnisse sind in den Abbildungen 3-5 dargestellt. Abb.. 3 zeigt die ganze Laube einer Klasse IV da Neuron, in vivo unter dem konfokalen Mikroskop aufgenommen. Abb.. 4 zeigt eine Nahaufnahme eines Teils des Dendriten Laube eines immunhistochemisch markierten Klasse III Neuron, das richtig ist fest mit der Morphologie erhalten. Die zugehörigen Einschub zeigt die Erniedrigung, die nach einem erfolglosen Dissektion und Fixierung (beide gefärbt mit anti-GFP-Antikörper) auftreten können. Abb.. 5 zeigt eine einzelne Klasse IV Axon-Terminus in das ZNS (anti-GFP, grün), alle Klasse IV Termini sind mit anti-CD2 (magenta) co-gefärbt.
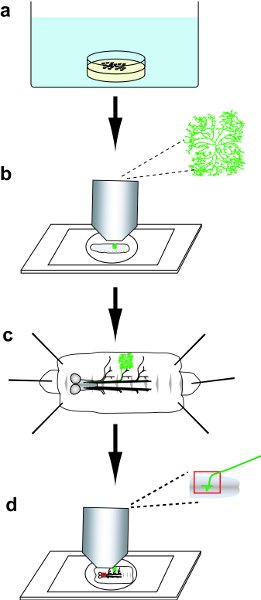
Abbildung 1 Protocol Überblick. a) Sammeln und dann Hitzeschock-Embryonen. b) Wählen Sie eine Larve mit einem GFP-positive DA Neuron zu klonen, und dann Bild der GFP-markierten Dendriten Laube in der Live-Larve. c) Präparieren Sie die Larve, und dann immunhistochemisch färben das Filet. d) Montieren Sie die Kirchenfenster Filet, und dann Bild der dendritischen Dorn und axonalen Projektionen der DA Neuron Klone.

Abbildung 2: Herstellung von Apfelsaft-Agar-Platte für Hitzeschock. Nehmen Sie die Platte (weißer Pfeil, ab), fügen Sie eine zweite Petrischale auf (roter Pfeil b) und Dichtung um mit Parafilm (blauer Pfeil, b).

Abbildung 3 in vivo Bild des Dendriten Laube eines mCD8:: GFP-markierten MARCM clone (Genotyp in 2,1), die eine Klasse IV (v'ada) Neuron einer 3 rd instar Larve. Scale-Bar ist 50 um.
d/3111/3111fig4.jpg "/>
Abbildung 4 mCD8:: GFP-markierten MARCM Klon eines Klasse-III-Neuron (ddaa) mit anti-GFP Antikörper gefärbt und zeigt gute Morphologie nach einer erfolgreichen Präparation und Befestigung (grün). Der Einschub zeigt Dendriten Abbau (weiße Pfeile), die nach erfolglosen Dissektion und Fixierung (magenta). Scale-Bar ist 25 um.
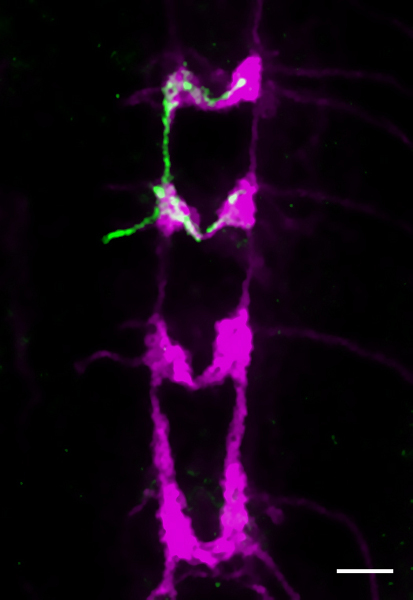
Abbildung 5 Die 3. Larvenstadium Larven VNC. Eine Flp-out-Klon aus einer einzigen Klasse VI (VDAB) Axon-Terminus (Genotyp in 2,2) wird unter Verwendung anti-GFP-Antikörper (grün). Anti-CD2 Etiketten aller Klasse IV Termini (magenta). Scale-Bar ist 25 um.
Access restricted. Please log in or start a trial to view this content.
Diskussion
Die Drosophila Larve DA Neuronenmodell liefert eine hervorragende genetische System von Mechanismen zu untersuchen, dass die Kontrolle Neuron Morphologie und Schaltung Bildung. MARCM ist in der Regel für die Kennzeichnung und zur Erzeugung von Mutanten DA Neuron Klone verwendet. Für MARCM wir verwenden entweder eine pan-neuronalen (zB Gal4 C155) oder DA Neuronen-spezifische Treiber. Mit einem pan-neuronaler Fahrer ist es möglich, direkt zu verwenden mehrere Bestände weit aus öff...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Die Autoren danken RIKEN für die Finanzierung. Wir danken auch Cagri Yalgin, Caroline Delandre und Jay Parrish für Diskussionen über genetische und Immunhistochemie-Protokollen.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare (optional) |
|---|---|---|---|
| SZX16 Fluoreszenz Dissektionsmikroskop (mit GFPHQ Filter) | Olymp | SZX16 | |
| Live-Insect Zange | FST | 26030-10 | |
| 26mm x 76mm Depression Objektträger | Toshinriko Co. | T8-R004 | |
| Sylgard 184 (oder Silpot 184) | Dow Corning | 3097358-1004 | |
| Poly-L-Lysin | Sigma | P-1524 | Dieses Produkt hat sich als am effektivsten |
| DPX Eindeckmedium | Sigma | 44581 | |
| Rabbit anti-GFP | Invitrogen | A-11122 | Verdünnung 1:500 |
| Rat anti-CD8 | Caltag | 5h10 | Verdünnung 1:200 |
| Maus anti-CD2 | AbD serotec | MCA443R | Verdünnung 1:700 |
| Maus anti-Fasciclin2 | DSHB | 1D4 | Verdünnung 1:10 |
Referenzen
- Grueber, W. B., Jan, L. Y., Jan, Y. N. Tiling of the Drosophila epidermis by multidendritic sensory neurons. Development. 129, 2867-2878 (2002).
- Crozatier, M., Vincent, A. Control of multidendritic neuron differentiation in Drosophila: the role of Collier. Dev Biol. 315, 232-242 (2008).
- Hattori, Y., Sugimura, K., Uemura, T. Selective expression of Knot/Collier, a transcriptional regulator of the EBF/Olf-1 family, endows the Drosophila sensory system with neuronal class-specific elaborated dendritic patterns. Genes Cells. 12, 1011-1022 (2007).
- Jinushi-Nakao, S. Knot/Collier and cut control different aspects of dendrite cytoskeleton and synergize to define final arbor shape. Neuron. 56, 963-978 (2007).
- Sugimura, K., Satoh, D., Estes, P., Crews, S., Uemura, T. Development of morphological diversity of dendrites in Drosophila by the BTB-zinc finger protein abrupt. Neuron. 43, 809-822 (2004).
- Li, W., Wang, F., Menut, L., Gao, F. B. BTB/POZ-zinc finger protein abrupt suppresses dendritic branching in a neuronal subtype-specific and dosage-dependent. 43, 823-834 (2004).
- Zlatic, M., Landgraf, M., Bate, M. Genetic specification of axonal arbors: atonal regulates robo3 to position terminal branches in the Drosophila nervous system. Neuron. 37, 41-51 (2003).
- Grueber, W. B., Ye, B., Moore, A. W., Jan, L. Y., Jan, Y. N. Dendrites of distinct classes of Drosophila sensory neurons show different capacities for homotypic repulsion. Curr Biol. 13, 618-626 (2003).
- Grueber, W. B., Jan, L. Y., Jan, Y. N. Different levels of the homeodomain protein cut regulate distinct dendrite branching patterns of Drosophila multidendritic neurons. Cell. 112, 805-818 (2003).
- Moore, A. W., Jan, L. Y., Jan, Y. N. hamlet, a binary genetic switch between single- and multiple- dendrite neuron morphology. Science. 297, 1355-1358 (2002).
- Gao, F. B., Brenman, J. E., Jan, L. Y., Jan, Y. N. Genes regulating dendritic outgrowth, branching, and routing in Drosophila. Genes Dev. 13, 2549-2561 (1999).
- Corty, M. M., Matthews, B. J., Grueber, W. B. Molecules and mechanisms of dendrite development in Drosophila. Development. 136, 1049-1061 (2009).
- Moore, A. W. Intrinsic mechanisms to define neuron class-specific dendrite arbor morphology. Cell Adh. Migr. 2, 81-82 (2008).
- Hughes, C. L., Thomas, J. B. A sensory feedback circuit coordinates muscle activity in Drosophila. Mol. Cell. Neurosci. 35, 383-396 (2007).
- Nishimura, Y. Selection of Behaviors and Segmental Coordination During Larval Locomotion Is Disrupted by Nuclear Polyglutamine Inclusions in a New Drosophila Huntington's Disease-Like Model. J Neurogenet. 24, 194-206 (2010).
- Song, W., Onishi, M., Jan, L. Y., Jan, Y. N. Peripheral multidendritic sensory neurons are necessary for rhythmic locomotion behavior in Drosophila larvae. Proc. Natl. Acad. Sci. U. S. A. 104, 5199-5204 (2007).
- Hwang, R. Y. Nociceptive neurons protect Drosophila larvae from parasitoid wasps. Curr Biol. 17, 2105-2116 (2007).
- Xiang, Y. Light-avoidance-mediating photoreceptors tile the Drosophila larval body wall. Nature. 468, 921-926 (2010).
- Cheng, L. E., Song, W., Looger, L. L., Jan, L. Y., Jan, Y. N. The role of the TRP channel NompC in Drosophila larval and adult locomotion. Neuron. 67, 373-380 (2010).
- Babcock, D. T., Landry, C., Galko, M. J. Cytokine signaling mediates UV-induced nociceptive sensitization in Drosophila larvae. Curr Biol. 19, 799-806 (2009).
- Hafer, N., Schedl, P. Dissection of Larval CNS in Drosophila Melanogaster. J. Vis. Exp. (1), e85-e85 (2006).
- Grueber, W. B. Projections of Drosophila multidendritic neurons in the central nervous system: links with peripheral dendrite morphology. Development. 134, 55-64 (2007).
- Merritt, D. J., Whitington, P. M. Central projections of sensory neurons in the Drosophila embryo correlate with sensory modality, soma position, and proneural gene function. J Neurosci. 15, 1755-1767 (1995).
- Blair, S. S. Genetic mosaic techniques for studying Drosophila development. Development. 130, 5065-5072 (2003).
- Lee, T., Luo, L. Mosaic analysis with a repressible cell marker for studies of gene function in neuronal morphogenesis. Neuron. 22, 451-461 (1999).
- Wong, A. M., Wang, J. W., Axel, R. Spatial representation of the glomerular map in the Drosophila protocerebrum. Cell. 109, 229-241 (2002).
- Shimono, K. Multidendritic sensory neurons in the adult Drosophila abdomen: origins, dendritic morphology, and segment- and age-dependent programmed cell death. Neural Dev. 4, 37-37 (2009).
- Feng, Y., Ueda, A., Wu, C. F. A modified minimal hemolymph-like solution, HL3.1, for physiological recordings at the neuromuscular junctions of normal and mutant Drosophila larvae. J Neurogenet. 18, 377-402 (2004).
- Sullivan, W., Ashburner, M., Hawley, R. S. Drosophila Protocols. , Cold Spring Harbor Laboratory Press. (2000).
- Kaczynski, T. J., Gunawardena, S. Visualization of the Embryonic Nervous System in Whole-mount Drosophila Embryos. J. Vis. Exp. (46), e2150-e2150 (2010).
- Featherstone, D. E., Chen, K., Broadie, K. Harvesting and preparing Drosophila embryos for electrophysiological recording and other procedures. J Vis Exp. , (2009).
- Medina, P. M., Swick, L. L., Andersen, R., Blalock, Z., Brenman, J. E. A novel forward genetic screen for identifying mutations affecting larval neuronal dendrite development in Drosophila melanogaster. Genetics. 172, 2325-2335 (2006).
- Mirouse, V., Swick, L. L., Kazgan, N., St Johnston, D., Brenman, J. E. LKB1 and AMPK maintain epithelial cell polarity under energetic stress. J Cell Biol. 177, 387-392 (2007).
- Brent, J., Werner, K., McCabe, B. D. Drosophila Larval NMJ Immunohistochemistry. J. Vis. Exp. 25, e1108-e1108 (2009).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118, 401-415 (1993).
- Sugimura, K. Distinct developmental modes and lesion-induced reactions of dendrites of two classes of Drosophila sensory neurons. J Neurosci. 23, 3752-3760 (2003).
- Zito, K., Parnas, D., Fetter, R. D., Isacoff, E. Y., Goodman, C. S. Watching a synapse grow: noninvasive confocal imaging of synaptic growth in Drosophila. Neuron. 22, 719-729 (1999).
- Landgraf, M., Sanchez-Soriano, N., Technau, G. M., Urban, J., Prokop, A. Charting the Drosophila neuropile: a strategy for the standardised characterisation of genetically amenable neurites. Dev Biol. 260, 207-225 (2003).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten