È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Analisi morfologica del Drosophila Larvale dendriti sensoriali e periferico Neuron assoni utilizzo Mosaici genetici
In questo articolo
Riepilogo
I neuroni sensoriali arborizzazione dendritica del Drosophila Larvale sistema nervoso periferico sono modelli utili per chiarire sia generale e classe di neuroni specifici meccanismi di differenziazione dei neuroni. Vi presentiamo una guida pratica per generare e analizzare arborizzazione dendritica dei neuroni mosaici genetici.
Abstract
Sviluppo del sistema nervoso richiede la corretta specificazione della posizione dei neuroni e l'identità, seguita da accurate neurone classe specifico per lo sviluppo dendritiche e cablaggio assonale. Recentemente l'arborizzazione dendritica (DA) neuroni sensoriali del sistema nervoso periferico Drosophila larvale (PNS) sono diventati potenti modelli genetici in cui per chiarire sia i meccanismi generali e specifiche della classe di differenziazione dei neuroni. Ci sono quattro principali classi di neuroni DA (I-IV) 1. Essi sono chiamati in ordine crescente di complessità dendrite pergolato, e sono specifiche della classe differenze nel controllo genetico della loro differenziazione 2-10. Il sistema DA sensoriale è un modello pratico per studiare i meccanismi molecolari alla base il controllo della morfologia dendritica 11-13 perché: 1) si può usufruire di potenti strumenti genetici disponibili nel moscerino della frutta, 2) il procuratore neurone dendrite pergolato si estende in soli 2 dimensioni sotto un ottica CLEar cuticola larvale che la rende facile la visualizzazione ad alta risoluzione in vivo, 3) la classe-specifica diversità nella morfologia dendritica facilita un'analisi comparativa per trovare elementi chiave Controllando la formazione di alberi dendritici semplici vs altamente ramificata, e 4) dendritiche pergolato stereotipata forme differenti di neuroni DA facilitare morfometriche analisi statistiche.
DA l'attività dei neuroni modifica l'uscita di un generatore di pattern locomozione larvale centrale 14-16. Le diverse classi di neuroni DA sono distinte modalità sensoriali, e la loro attivazione provoca diverse risposte comportamentali 14,16-20. Inoltre, diverse classi di inviare proiezioni stereotipo assonale nel sistema nervoso centrale Drosophila larvale nel cordone nervoso ventrale (VNC) 21. Queste proiezioni terminare con le rappresentazioni topografiche di entrambe le modalità DA neuroni sensoriali e la posizione nella parete del corpo del campo dendritiche 7,22, 23. Quindi l'esame di proiezioni DA assonale può essere usata per chiarire i meccanismi alla base mappatura topografica 7,22,23, così come il cablaggio di un semplice locomozione larvale circuito modulante 14-17.
Vi presentiamo qui una guida pratica per generare e analizzare i mosaici genetici 24 neuroni DA marcatura tramite MARCM (Analisi Mosaico con un marcatore cellulare reprimibile) 1,10,25 e Flp-out 22,26,27 tecniche (riassunti nella fig. 1).
Protocollo
1.Preparazione di reagenti
- Preparare Ca + +-libero HL3.1 saline 28.
- In mM: 70 NaCl, 5 KCl, 20 MgCl 2, 10 NaHCO 3, 5 HEPES, 115 saccarosio, trealosio e 5; pH 7,2. Filtro sterilizzare e conservare a 4 ° C.
Nota: Ca + +-senza soluzione impedisce la contrazione muscolare durante la dissezione.
- In mM: 70 NaCl, 5 KCl, 20 MgCl 2, 10 NaHCO 3, 5 HEPES, 115 saccarosio, trealosio e 5; pH 7,2. Filtro sterilizzare e conservare a 4 ° C.
- Fai la poli-L-lisina (PLL) coprioggetto.
- Sciogliere 100mg PLL in acqua 4.2ml e fare aliquote 300μl in tubi Eppendorf e congelare a -20 ° C.
- Prima coprioggetto rivestimento, disgelo prima una aliquota, portarla fino a 10ml in DDH 2 O e aggiungere 20μl di Kodak Photo-Flo, la concentrazione finale PLL è 0,7 mg / ml.
- Coprioggetto Immergere per 30 minuti in una soluzione PLL, rimuovere e asciutto, quindi risciacquare brevemente con acqua e asciugare. Ripetere due volte. Coprioggetto trattati durano circa un mese.
2. Incroci genetici
- To generare cloni MARCM. Ecco un esempio croce usando un pan-DA conducente 11,27:
FRT2A x hsFLP; GAL4 109 (2) 80, SUP-mCD8:: GFP; vasca-Gal80 FRT2A/SM5-TM6B - Per generare Flp-out cloni. Ecco un esempio utilizzando una croce IV classe specifica del driver 8:
PPK-GAL4 x yw, hsFLP; UAS-FRT-CD2, y +-stop-FRT-mCD8:: GFP
3. Collezione di embrioni
- Tenere attraversa Drosophila in una bottiglia di raccolta a 25 ° C e raccogliere embrioni su una piastra di agar succo di mela 29 distribuirlo con un sottile strato di pasta di lievito 30,31.
4. Calore trattamento d'urto degli embrioni
- Inserire un piatto vuoto in opposizione alla piastra di agar succo di mela su cui gli embrioni sono state stabilite. Tenuta attorno a queste due piastre con Parafilm (Fig. 2).
- Durante shock termico, immergere °piatto e nel bagno d'acqua e tenere premuto con un peso di metallo.
- Per gli embrioni MARCM
- Raccogliere embrioni per 2h e incubare in un piatto di 10 centimetri di Petri circondato da inumidito tessuti a 25 ° C per 2 ore aggiuntive.
Nota: Regolazione del protocollo di shock da calore altera la frequenza con cui vengono generate cloni. - Per un minor numero di cloni, con l'obiettivo di singoli neuroni isolati, immergere e shock termico nel bagnomaria per 1 ora a 38 ° C.
- Per un numero maggiore di cloni, shock termico per 45 minuti a 38 ° C, recuperare a RT 30 minuti, poi shock termico di nuovo per altri 30 minuti.
- Raccogliere embrioni per 2h e incubare in un piatto di 10 centimetri di Petri circondato da inumidito tessuti a 25 ° C per 2 ore aggiuntive.
- Raccogliere Flp-out embrioni per 24 ore, e lo shock termico per 1 ora a 38 ° C.
5. Screening per cloni
- Dopo la scossa di calore, rimuovere il coperchio della tenuta stagna disposizione e la piastra di agar succo di mela in una capsula di Petri 10 centimetri circondato da tessuti inumidito. Cultura gli embrioni e larve successive a 25 ° C fino a vagarezione 3 ° stadio.
Nota: le condizioni di cultura, soprattutto la nutrizione, hanno dimostrato di alterare DA morfologia dendritica pergolato 32,33. Assicurarsi che le larve di crescita hanno accesso a pasta di lievito in ogni momento; monitorare e riempire la pasta di lievito, come richiesto. - Da questo punto in poi il protocollo, manipolare delicatamente con pinze larve di insetti.
- Brevemente e risciacquare delicatamente le larve in acqua di rubinetto, e poi posto su una piastra di agar.
Nota: questo passaggio riduce sfondo auto-fluorescenza da cibo o sporcizia sulla superficie larvale. - Esaminare le larve sotto un potente microscopio a fluorescenza dissezione. Identificare le larve con GFP-positive neuroni / cellule nella parete del corpo.
6. Imaging in vivo dei dendriti
- Posizionare la larva in un bicchiere scivolo depressione con una piccola goccia di glicerolo 80%. Mettere un coprioggetti su slitta per immobilizzare la larva. Assicurarsi che non rimanga aria fra la larva e la coverslip.
- Spingere delicatamente il coprioggetto per rotolare la larva per permettere la visualizzazione del neurone di interesse. L'immagine della mCD8:: GFP-etichettata pergolato dendritiche tramite microscopia confocale.
7. Dissezione larvale
Nota prima di iniziare: DA dendriti dei neuroni degradare rapidamente dopo l'inizio della dissezione. Sezionare ogni singola larva in meno di 5min per garantire la buona morfologia dendrite.
- Sezionare vagare 3 ° larve instar su un piatto Sylgard come descritto in precedenza 34 con le seguenti modifiche:
- Per l'imaging di DA assoni dei neuroni termini, assicurarsi che il sistema nervoso centrale è intatto ei nervi segmentali non sono rotti. Dopo aver aperto le larve, prima accuratamente tagliate le connessioni tracheale alla parete del corpo e poi rimuovere delicatamente l'intestino intero.
- Se immagini il dendriti da solo, rimuovere il CNS per consentire una più piatta di montaggio.
8. Fixationi e blocco dei filetti larvale
- Con la larva ancora inchiodato alla piastra Sylgard, fissarlo in PFA 4% in PBS per 20 minuti a temperatura ambiente su un agitatore rotante con delicatezza.
- Rimuovere le tracce dei tessuti larvali (grasso corporeo, trachea, ecc) dopo la fissazione.
- Lavare in PBST (PBS con 0,1% Triton X-100) 10 minuti 3 volte sul piatto Sylgard e shaker. Se esaminando termini assone, tenere il filetto sul piatto Sylgard. (Se dendriti colorazione è possibile trasferire i filetti larvale di un tubo da 0,5 ml in questa fase 34)
- Bloccare le larve per 20 minuti a temperatura ambiente nel 5% di siero normale asino (NDS) in PBST su un agitatore.
9. Colorazione dei filetti larvale
- Rimuovere la soluzione di saturazione e incubare in anticorpo primario (nel 5% NDS / PBST) notte a 4 ° C in un piccolo contenitore Tupperware circondata da tessuto inumidito.
- Rimuovere i tubi da 4 ° C e incubare un'altra ora a temperatura ambiente.
- Lavare 10 minuti 6x in PBST. Aggiungere il antib secondariaMelody (nel 5% NDS / PBST), e coperchio per evitare fotometabolismo fluoroforo 34.
- Incubare sia a temperatura ambiente per due ore o una notte a 4 ° C seguita da un'ora a temperatura ambiente.
- Lavare i 10 minuti larve 6x in PBST e procedere al montaggio.
10. Montaggio di filetti larvale per l'esame del pergolato dendrite
- Montare ogni filetto larvale più piatto possibile con le forbici dissezione o un bisturi per tagliare la testa (compresi i ganci bocca), e la parte posteriore (compresi gli spiracoli) 34.
- Mettere il filetto di larve sul vetrino cuticola rivolto verso il basso, montare in 80% glicerolo, e sigillare i lati del coprioggetto con smalto per un 'veloce' montare 34.
- Per un montaggio permanente e un'immagine più chiara
- Mettere il filetto sezionato larvale muscolare rivolto verso il basso su una goccia di PBS su un vetrino PLL, sarà presto aderire al coprioggetto.
- Rimuovere quanto più liquido possibile dopo il montaggio, however non lasciarlo asciugare completamente.
- Prendere il coprioggetto (con annesso filetto larvale) attraverso una serie di etanolo: 35% di etanolo, seguito dal 50%, 70%, 95% e, infine, 2x etanolo al 100% per ogni 10 minuti (il 2 ° soluzione 100% EtOH dovrebbe essere cambiato di frequente ), infine, lavare 2-3x 10 minuti in xilene.
- Mettete una goccia di DPX montaggio (Xilene Plasticizer Distyrene) su un vetrino pulito e adagiare il filetto coprioggetto-side-down sulla parte superiore. Conservare al buio, e aspettare un giorno per il DPX per impostare prima di imaging.
11. Montaggio di filetti larvale per l'esame dei capolinea degli assoni
- Mantenere i nervi segmentali in esecuzione tra il PNS e il sistema nervoso centrale intatto durante la dissezione, la fissazione e colorazione per consentire il tracciamento degli assoni periferici dal corpo cellulare dei neuroni sensoriali al VNC.
- Montare ciascun filetto cuticola larvale rivolto verso il basso in 80% glicerolo in una diapositiva depressione. Traccia gli assoni dal corpo cellulare alla DAVNC sotto il microscopio confocale. Nota: i neuroni PNS in ogni progetto segmento del corpo muro al segmento affine of the VNC.
12. Rappresentante dei risultati:
Risultati rappresentativi sono riportati nelle figure 3-5. Fig. 3 mostra il pergolato di una intera classe IV da neurone, catturato in vivo al microscopio confocale. Fig. 4 mostra un primo piano di parte del pergolato dendrite di un immunoistochimiche etichettati classe III neurone che è stata correttamente fissata per preservare la morfologia. L'inserto associati mostra la degradazione che possono verificarsi dopo una dissezione senza successo e la fissazione (entrambi colorati con anticorpi anti-GFP). Fig. 5 mostra un unico capolinea classe IV assonale nel sistema nervoso centrale (anti-GFP, verde); tutti i termini IV classe sono co-colorati con anti-CD2 (magenta).
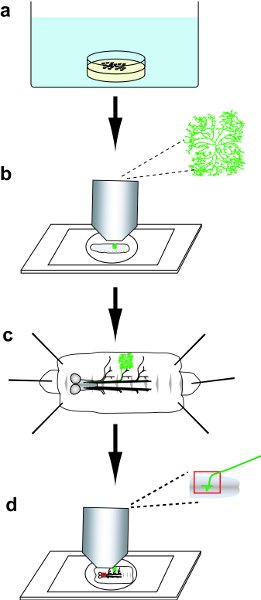
Figura 1 panoramica protocollo. a) raccogliere e poi heat-shock embrioni. b) Seleziona una larva con GFP-positive DA neurone clone, e poi l'immagine della GFP-etichettata dendrite pergolato nella larva vive. c) Dissect la larva, e poi immunoistochimiche macchia il filetto. d) Montare il filetto colorato, e poi l'immagine del pergolato dendritiche e proiezioni assonali dei cloni dei neuroni DA.

Figura 2 Preparazione della piastra di agar succo di mela per shock termico. Prendere la piastra (freccia bianca, ab), aggiungere un secondo piatto di Petri in alto (freccia rossa b) e sigillo in giro con Parafilm (freccia blu, b).

Figura 3 in immagini in vivo del pergolato dendrite di un mCD8:: GFP-etichettata clone MARCM (genotipo come in 2.1) che rappresenta una IV classe (v'ada) neurone di una larva di 3 ° stadio. Barra di scala è 50 micron.
d/3111/3111fig4.jpg "/>
Figura 4 mCD8:: GFP-etichettata clone MARCM di una categoria III neurone (ddaA) colorati con anticorpi anti-GFP, mostrando buona morfologia dopo la dissezione di successo e di fissazione (verde). L'inserto mostra dendrite degradazione (frecce bianche) che si verificano dopo la dissezione senza successo e la fissazione (magenta). Barra di scala è a 25 micron.
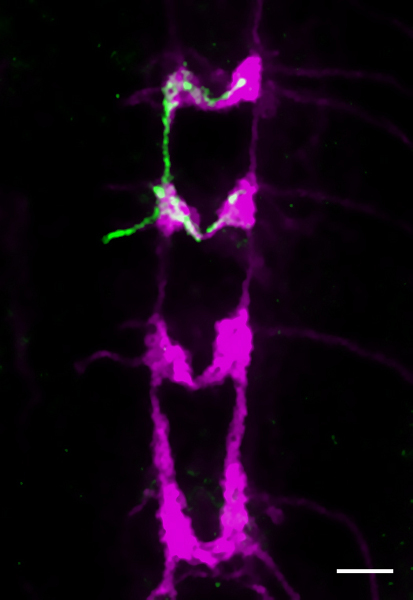
Figura 5 Il 3 ° instar larvale VNC. Un Flp-out di un singolo clone di classe VI (VDAB) capolinea assone (genotipo come in 2.2) viene rilevata con anticorpi anti-GFP (verde). Anti-CD2 etichette di tutte le classi IV termini (magenta). Barra di scala è a 25 micron.
Access restricted. Please log in or start a trial to view this content.
Discussione
La Drosophila larvale DA modello neurone fornisce un ottimo sistema per investigare i meccanismi genetici che controllano la morfologia dei neuroni e la formazione di circuito. MARCM è generalmente utilizzato per l'etichettatura e per la generazione di mutanti DA cloni neurone. Per MARCM abbiamo utilizzare un pan-neurale (es. GAL4 C155) o DA neurone specifico driver. Utilizzando un pan-neurali del driver è possibile usare direttamente diversi stock ampiamente disponibili presso...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Gli autori ringraziano RIKEN per il finanziamento. Ringraziamo anche Cagri Yalgin, Caroline Delandre, e Jay Parrish per le discussioni sui protocolli di genetica e di immunoistochimica.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Nome del reagente | Azienda | Numero di catalogo | Commenti (opzionale) |
|---|---|---|---|
| SZX16 dissezione microscopio a fluorescenza (con GFPHQ filtro) | Olimpo | SZX16 | |
| Vivere Pinza insetti | FST | 26030-10 | |
| 26 millimetri x 76mm depressione vetrini | Toshinriko Co. | T8-R004 | |
| Sylgard 184 (o Silpot 184) | Dow Corning | 3097358-1004 | |
| Poli-L-lisina | Sigma | P-1524 | Questo prodotto si è dimostrato più efficace |
| DPX montaggio medio | Sigma | 44581 | |
| Coniglio anti-GFP | Invitrogen | A-11122 | Diluizione 1:500 |
| Rat anti-CD8 | Caltag | 5H10 | Diluizione 1:200 |
| Topo anti-CD2 | AbD Serotec | MCA443R | Diluizione 1:700 |
| Topo anti-Fasciclin2 | DSHB | 1d4 | Diluizione 1:10 |
Riferimenti
- Grueber, W. B., Jan, L. Y., Jan, Y. N. Tiling of the Drosophila epidermis by multidendritic sensory neurons. Development. 129, 2867-2878 (2002).
- Crozatier, M., Vincent, A. Control of multidendritic neuron differentiation in Drosophila: the role of Collier. Dev Biol. 315, 232-242 (2008).
- Hattori, Y., Sugimura, K., Uemura, T. Selective expression of Knot/Collier, a transcriptional regulator of the EBF/Olf-1 family, endows the Drosophila sensory system with neuronal class-specific elaborated dendritic patterns. Genes Cells. 12, 1011-1022 (2007).
- Jinushi-Nakao, S. Knot/Collier and cut control different aspects of dendrite cytoskeleton and synergize to define final arbor shape. Neuron. 56, 963-978 (2007).
- Sugimura, K., Satoh, D., Estes, P., Crews, S., Uemura, T. Development of morphological diversity of dendrites in Drosophila by the BTB-zinc finger protein abrupt. Neuron. 43, 809-822 (2004).
- Li, W., Wang, F., Menut, L., Gao, F. B. BTB/POZ-zinc finger protein abrupt suppresses dendritic branching in a neuronal subtype-specific and dosage-dependent. 43, 823-834 (2004).
- Zlatic, M., Landgraf, M., Bate, M. Genetic specification of axonal arbors: atonal regulates robo3 to position terminal branches in the Drosophila nervous system. Neuron. 37, 41-51 (2003).
- Grueber, W. B., Ye, B., Moore, A. W., Jan, L. Y., Jan, Y. N. Dendrites of distinct classes of Drosophila sensory neurons show different capacities for homotypic repulsion. Curr Biol. 13, 618-626 (2003).
- Grueber, W. B., Jan, L. Y., Jan, Y. N. Different levels of the homeodomain protein cut regulate distinct dendrite branching patterns of Drosophila multidendritic neurons. Cell. 112, 805-818 (2003).
- Moore, A. W., Jan, L. Y., Jan, Y. N. hamlet, a binary genetic switch between single- and multiple- dendrite neuron morphology. Science. 297, 1355-1358 (2002).
- Gao, F. B., Brenman, J. E., Jan, L. Y., Jan, Y. N. Genes regulating dendritic outgrowth, branching, and routing in Drosophila. Genes Dev. 13, 2549-2561 (1999).
- Corty, M. M., Matthews, B. J., Grueber, W. B. Molecules and mechanisms of dendrite development in Drosophila. Development. 136, 1049-1061 (2009).
- Moore, A. W. Intrinsic mechanisms to define neuron class-specific dendrite arbor morphology. Cell Adh. Migr. 2, 81-82 (2008).
- Hughes, C. L., Thomas, J. B. A sensory feedback circuit coordinates muscle activity in Drosophila. Mol. Cell. Neurosci. 35, 383-396 (2007).
- Nishimura, Y. Selection of Behaviors and Segmental Coordination During Larval Locomotion Is Disrupted by Nuclear Polyglutamine Inclusions in a New Drosophila Huntington's Disease-Like Model. J Neurogenet. 24, 194-206 (2010).
- Song, W., Onishi, M., Jan, L. Y., Jan, Y. N. Peripheral multidendritic sensory neurons are necessary for rhythmic locomotion behavior in Drosophila larvae. Proc. Natl. Acad. Sci. U. S. A. 104, 5199-5204 (2007).
- Hwang, R. Y. Nociceptive neurons protect Drosophila larvae from parasitoid wasps. Curr Biol. 17, 2105-2116 (2007).
- Xiang, Y. Light-avoidance-mediating photoreceptors tile the Drosophila larval body wall. Nature. 468, 921-926 (2010).
- Cheng, L. E., Song, W., Looger, L. L., Jan, L. Y., Jan, Y. N. The role of the TRP channel NompC in Drosophila larval and adult locomotion. Neuron. 67, 373-380 (2010).
- Babcock, D. T., Landry, C., Galko, M. J. Cytokine signaling mediates UV-induced nociceptive sensitization in Drosophila larvae. Curr Biol. 19, 799-806 (2009).
- Hafer, N., Schedl, P. Dissection of Larval CNS in Drosophila Melanogaster. J. Vis. Exp. (1), e85-e85 (2006).
- Grueber, W. B. Projections of Drosophila multidendritic neurons in the central nervous system: links with peripheral dendrite morphology. Development. 134, 55-64 (2007).
- Merritt, D. J., Whitington, P. M. Central projections of sensory neurons in the Drosophila embryo correlate with sensory modality, soma position, and proneural gene function. J Neurosci. 15, 1755-1767 (1995).
- Blair, S. S. Genetic mosaic techniques for studying Drosophila development. Development. 130, 5065-5072 (2003).
- Lee, T., Luo, L. Mosaic analysis with a repressible cell marker for studies of gene function in neuronal morphogenesis. Neuron. 22, 451-461 (1999).
- Wong, A. M., Wang, J. W., Axel, R. Spatial representation of the glomerular map in the Drosophila protocerebrum. Cell. 109, 229-241 (2002).
- Shimono, K. Multidendritic sensory neurons in the adult Drosophila abdomen: origins, dendritic morphology, and segment- and age-dependent programmed cell death. Neural Dev. 4, 37-37 (2009).
- Feng, Y., Ueda, A., Wu, C. F. A modified minimal hemolymph-like solution, HL3.1, for physiological recordings at the neuromuscular junctions of normal and mutant Drosophila larvae. J Neurogenet. 18, 377-402 (2004).
- Sullivan, W., Ashburner, M., Hawley, R. S. Drosophila Protocols. , Cold Spring Harbor Laboratory Press. (2000).
- Kaczynski, T. J., Gunawardena, S. Visualization of the Embryonic Nervous System in Whole-mount Drosophila Embryos. J. Vis. Exp. (46), e2150-e2150 (2010).
- Featherstone, D. E., Chen, K., Broadie, K. Harvesting and preparing Drosophila embryos for electrophysiological recording and other procedures. J Vis Exp. , (2009).
- Medina, P. M., Swick, L. L., Andersen, R., Blalock, Z., Brenman, J. E. A novel forward genetic screen for identifying mutations affecting larval neuronal dendrite development in Drosophila melanogaster. Genetics. 172, 2325-2335 (2006).
- Mirouse, V., Swick, L. L., Kazgan, N., St Johnston, D., Brenman, J. E. LKB1 and AMPK maintain epithelial cell polarity under energetic stress. J Cell Biol. 177, 387-392 (2007).
- Brent, J., Werner, K., McCabe, B. D. Drosophila Larval NMJ Immunohistochemistry. J. Vis. Exp. 25, e1108-e1108 (2009).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118, 401-415 (1993).
- Sugimura, K. Distinct developmental modes and lesion-induced reactions of dendrites of two classes of Drosophila sensory neurons. J Neurosci. 23, 3752-3760 (2003).
- Zito, K., Parnas, D., Fetter, R. D., Isacoff, E. Y., Goodman, C. S. Watching a synapse grow: noninvasive confocal imaging of synaptic growth in Drosophila. Neuron. 22, 719-729 (1999).
- Landgraf, M., Sanchez-Soriano, N., Technau, G. M., Urban, J., Prokop, A. Charting the Drosophila neuropile: a strategy for the standardised characterisation of genetically amenable neurites. Dev Biol. 260, 207-225 (2003).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon