需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
胚胎腹侧中脑器官型片文化:一个系统来研究多巴胺能神经元发展在体外
摘要
描述一个方法来生成从E12.5小鼠胚胎脑器官切片。可用于器官切片文化观察多巴胺能神经元或其他腹侧中脑的神经元的行为。
摘要
鼠标是一个很好的的模式生物研究哺乳动物大脑的发展,由于大量的分子和基因数据。然而,发展中国家的小鼠大脑是不容易操纵和体内成像合适,因为小鼠胚胎是交通不便,不透明。器官型胚胎的大脑切片文化,因此被广泛用于研究在体外培养的小鼠大脑发育 。体外操纵或允许使用的转基因小鼠基因表达的修改,所以可以用荧光蛋白标记的神经元或神经胶质细胞的亚群。标记细胞的行为,然后可以使用时间推移成像观察。已定时成像研究细胞行为背后晚1-2萌芽阶段大脑皮层的发展,特别是成功。胚胎器官的大脑区域以外的前脑切片在文化系统较差establisHED。因此,时移成像数据描述了神经细胞迁移的财富,是仅限于前脑3,4。它仍然是不知道,是否背的大脑中发现的原则腹脑区的真实。在腹侧的大脑,神经元是神经元集群,而不是层组织,他们往往要经过复杂的迁徙轨迹,以达到他们的的最终位置。腹脑不仅是一个腹侧大脑发育良好的模型系统,也包含如多巴胺能神经元疾病过程中的有关神经元的人口。虽然功能和多巴胺能神经元变性一直在成人和脑老化的非常详细的调查,很少有人知道这些神经元的行为在其分化和迁移阶段5。我们在这里描述从胚胎一天(五)12.5鼠腹侧中脑切片培养的一代。这些切片邪教URES有可能适合监测在体外几天的多巴胺能神经元发展。我们强调在胚胎发育的早期阶段产生的脑切片的关键步骤, 并讨论保持在体外培养的多巴胺能神经元的正常发展的必要条件。我们也可以从时间的推移成像实验结果。在这些实验中,被打成腹侧中脑前体(包括多巴胺的前体)和他们的后裔在镶嵌的方式,使用一个基础的Cre / loxP位诱导的命运映射系统 6 。
研究方案
本协议修改Daza 等 ,2007年7月 。
1。筹备工作
- 可以准备提前一天
- 准备1X克雷布斯缓冲液(1.5升): 126 mM氯化钠,氯化钾2.5毫米,1.2毫米的NaH 2 PO 4:H 2 O MgCl 2的 1.2毫米,2.5毫米氯化钙 ,葡萄糖11毫米,25毫米碳酸氢钠3,调整pH至7.4。过滤消毒(0.22微米孔径),并储存在4 ° C
- 准备培养液(20毫升):5毫升的HBSS,9 mL的DMEM高糖,30%葡萄糖液850,5毫升马血清(25%)。添加200μL100X Penicllin /链霉素。保存在4 ° C。
- 开始清扫前的准备
- 准备100毫升4%低熔点琼脂糖(LMP琼脂糖)在1X克雷布斯缓冲区:微波解决方案,直到琼脂糖完全溶解,然后置于45℃水浴琼脂糖。
- 填充的振动圣多美与冰冷1X克雷布斯缓冲区的缓冲区托盘和开始冷却元件(保持在4 ° C)。修正在刀架和设置的手术刀,精细的画笔和一个小型的穿孔勺子拿起切片vibratome面积刀片。收集切片,准备与1X克雷布斯缓冲区的无菌培养皿中(35 × 10毫米)。置于冰上。
- 设置无菌培养皿(100 × 15毫米),清扫,并嵌入较小的无菌培养皿中(35 × 10毫米),小剪刀,两个钳(杜蒙5)的罚款,迷你穿孔勺,玻璃夹层面积巴斯德吸管火抛光圆封闭尖冰和1升1X克雷布斯缓冲区。用70%乙醇擦拭所有的清扫工具。
- 培养基中添加一个6孔板(1.5毫升/孔)的井,并放置在37℃培养箱。
- 准备用1.5毫升/以及无菌1X克雷布斯缓冲区和15μL青霉素/链霉素(100X)/六孔板。在无菌条件下,地方米尔licell细胞插入入井文化。将六孔板的vibratome使大脑切片可以转移到滤膜后切片即可。
2。胚胎的大脑解剖和嵌入
- 使用异氟醚麻醉怀孕母鼠和牺牲颈椎脱位(胚胎阶段E12.5)的鼠标。解剖出鼠标的子宫,子宫与产钳拉起。使用其他钳分开从子宫mesometrium。放置在冰冷1X克雷布斯缓冲区的子宫。使用细镊子从胚胎中分离出来的肌壁的子宫,赖克特的膜和卵黄囊。从子宫中取出胚胎。解剖胚胎放入一个单独的无菌1X克雷布斯缓冲区的Petri菜。
- 解剖立体显微镜下的大脑。解剖大脑,先切断胚胎的头部。固定头刺入的头(眼平)细钳。使用另一镊子小心取出皮肤和颅骨。使用镊子小心地抬起大脑,并转移到一个培养皿用无菌1X克雷布斯缓冲区。这是非常重要的,整个大脑的完整性保持在清扫过程中,由于脑组织的损害问题(如组织切碎)在切片的vibratome创建。
- 洗一次的大脑在4%低熔点(LMP)的琼脂糖。嵌入在新鲜的4%琼脂糖LMP 2-3大脑。尽量均匀放置在冰上的嵌入菜。使用用火抛光的圆尖,解除大脑,直到底部是凝固的琼脂糖的巴斯德吸管。在一个平面位置的水平琼脂糖块底部的大脑应该解决。
- 在琼脂糖完全凝固(约3分钟后),修剪周围的大脑琼脂糖胶琼脂糖块标本舞台上vibratome。当刷胶块,确保大脑的腹侧方是平行的平台,因为大脑应该是在一个横截面切。
3。 Vibratome切片
- 使用切割刀片。要获得完整的切片,这是非常重要切片的过程中温度保持在4 ° C。
- 第300微米厚的水平切片在频率为50赫兹,刀片幅度为1.1毫米和25毫米/秒的速度。
- 使用精细的画笔,以推动在一个小穿孔勺的切片收集脑片,并转移到一盘菜用无菌冰冷1X克雷布斯缓冲区。选择包含腹侧中脑组织切片( 见图1)。在一个E12.5小鼠大脑中有一个300微米的水平切片包含腹侧中脑组织,包括多巴胺能神经元。
4。切片文化
步骤4.2-4.5应在无菌条件下进行。
- 转移到一个Millicell小细胞培养在6孔板1X克雷布斯缓冲区(见1.2.5)的膜插入大脑切片。为了转移切片,使用迷你穿孔勺子(精细科学的工具)和罚款的画笔。一膜,可放置最多3片。
- 转移细胞膜片与培养基的6孔板(见1.2.5)。不应该由中等覆盖膜的顶部。脑片接收从下面,从上面的空气介质。
- 广场在孵化器的6孔板, 用 5%的CO 2在37 ° C。这是非常重要的切片放置在孵化器后,在2小时内解剖的初步步骤。准备时间更加延长,可能会导致穷人的生存切片。
- 片可维持在体外培养3天。更改第二天50%的培养基。
5。时间推移成像
- 让我们为4-5小时开始前的时间推移成像片在孵化器中恢复。
- 对于时间推移成像,保持膜插入切片,并转移到35毫米的Ibidiμ-的碟(盘底部的高光学质量的材料包括)插入。
- 添加1毫升培养液中加1.5μL抗坏血酸(200毫米)的菜。抗坏血酸防止光毒性片。
- 环境室切片在37 ° C,5%CO2,在时间推移成像。
6。代表性的成果
图1说明了从E12.5小鼠大脑器官切片文化的准备。图 2显示水平的器官切片(急性和文化几天后)获得形式E12.5小鼠大脑。为了便于比较,在同等发展阶段的冷冻脑切片所示。脑多巴胺能神经元酪氨酸羟化酶(TH)免疫组化显示。中脑多巴胺能神经元的项目,前脑的目标。这些预测在E12.5开始形成,并在随后的几天延长对前脑。我们认为,发展文化中的多巴胺能神经元的正常发展的一个很好的迹象的前脑预测。水平切片中脑多巴胺能神经元对他们适当的前脑的目标区域扩展的预测。 3格(体外天)或前脑的目标地区被破坏后,异常预测延长对背脑。 E12.5脑冠状切片的例子如图3所示。可视化与免疫TH延长异常预测背脑多巴胺能神经元。 图4显示了增殖,坏死和细胞凋亡在器官切片文化的分析。 BrdU IMmunostaining可视化增殖细胞示范养殖条件下,细胞增殖后,1格。扩散减少4格后。 3格后,许多在腹脑细胞发生坏死(碘化丙啶染色)和凋亡(免疫裂解的caspase - 3)。图5显示了YFP标记的神经元在急性切片成像实验时间推移监测的迁徙路径。
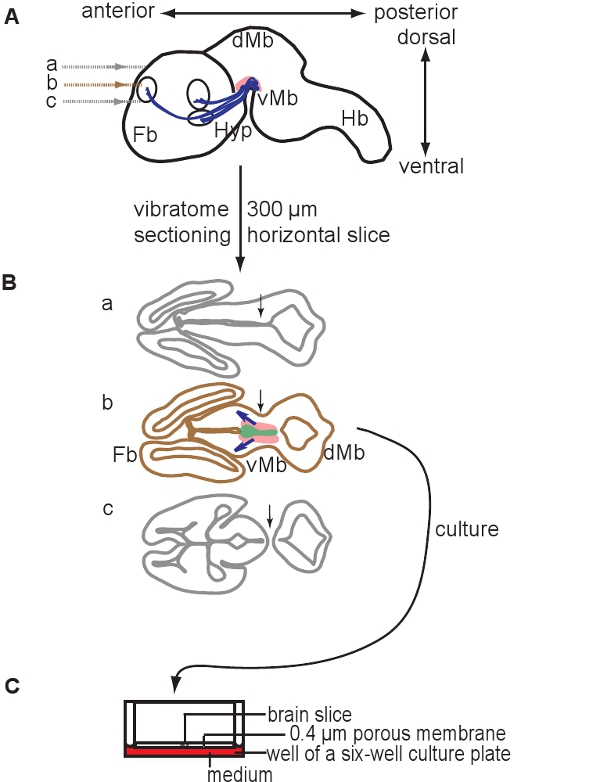
图1。原理说明编写的器官切片文化。 300微米水平的大脑切片切片E12.5大脑使用一个vibratome准备。 (一)原理的E12.5小鼠大脑矢状观点。部分级别表示。含有多巴胺能神经元的面积是在粉红色描绘的,预测在蓝色表示。 (二)三个可以从背获得片示意图腹侧和Tha吨包含两个前脑(FB)和脑(MB)。请注意,只有一个切片包含多巴胺能神经元(片二)。基于心室的位置和脑和前脑皮层组织(箭头,B节与节A和C)的连续性,可确定相应的切片。含有多巴胺能神经元的面积是在粉红色表示的,含有多巴胺的前体的面积是描绘绿色,蓝色箭头表示发展预测。 (三)含有多巴胺能神经元的片膜插入培养。缩写:VMB,中脑腹侧; DMB,脑背;羟脯氨酸,下丘脑;血红蛋白,后脑。
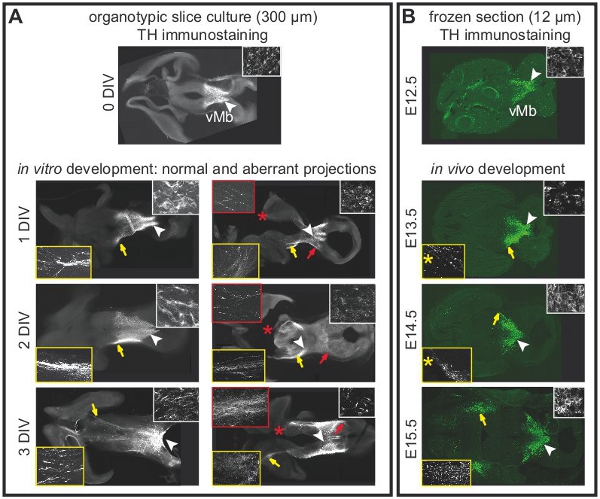
图2。器官切片培养的中脑多巴胺能神经元的预测都依赖于前脑的完整性。为标签的多巴胺能神经元的酪氨酸羟化酶(TH)免疫组化。 (一)急性片(0格)显示在腹侧中脑多巴胺能神经元的正常位置。白色箭头指示,在更高的放大倍率在插图所示的领域。尚未开发前脑的预测。 1格后,前脑的预测开始形成。预测延长到2-3格的前脑。白色箭头指示的insets高放大倍率(白框)中的细胞体的位置。黄色箭头突出,在更高的放大倍率的insets(黄框)中的完整的片正常的预测。异常预测开发与损坏前脑切片。红色箭头指示向背侧中脑的insets高放大倍率(红色框)中的异常预测。损害是用红色星号表示。 3格后,大多数片(N = 5 / 7)对背脑异常的预测。 (二)次水平在不同发育阶段的冷冻脑切片免疫组化显示的发展在体内的多巴胺能预测。白色箭头指示的insets高放大倍率(白框)中的细胞体的位置。黄色箭头突出位置在更高的放大插图(黄框)所示的预测。冰冻切片的水平选择密切匹配的器官切片的文化水平。需要注意的是一个单一的冰冻切片(12微米),并不代表整个器官片(300微米)。因此,在E13.5和E14.5所示的预测观察到120微米以上腹包含细胞体(黄色星号)的部分路段上。
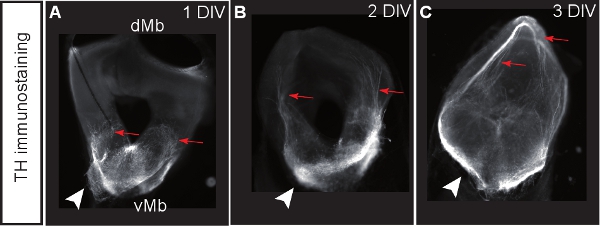
图3。冠状切片中脑多巴胺能神经元的标志物酪氨酸羟化酶(TH)染色的文化。 (AC)切片后,1,2或3格。多巴胺能神经元对脑背侧(R发展异常预测编箭头)。箭头显示多巴胺的细胞体的位置。
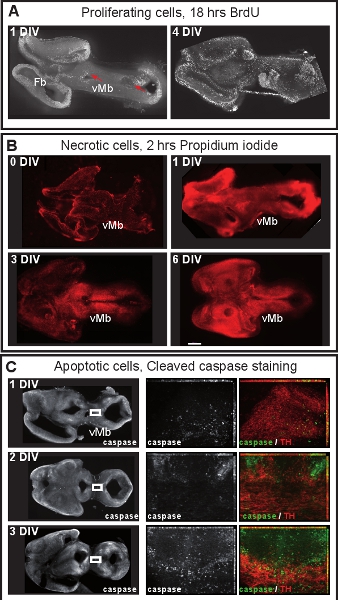
图4。脑器官切片文化细胞增殖和细胞活力。 (一)增殖细胞标记的BrdU(50毫微克/毫升,Sigma公司)除了到培养液中18小时随后免疫染色切片BrdU。 1格后,BrdU标记细胞位于脑室区(红色箭头)。 4格后,增殖细胞较为分散,不再保持鲜明的脑室区。 (二)坏死细胞被打成除了碘化丙啶(1μg/μLSigma公司),以2小时的培养液,荧光显微镜下观察。 1格后,腹侧中脑(VMB)是不坏死,但许多碘化丙啶标记细胞可在背侧中脑和前脑。 3格后的细胞活力降低腹midbra英寸比例尺:500微米(三)Immunostaing裂解的caspase - 3可视化细胞凋亡。在1或2格,只有少数(TH)的多巴胺能神经元凋亡。 3格后,多巴胺能神经元开始发生凋亡。在中间和右边的面板,在左侧面板盒装面积的放大倍率越高,。 14-16帧栈Z -放大倍率越高,图像的最大强度的预测。图像与蔡司Apotome设置每0.5微米。
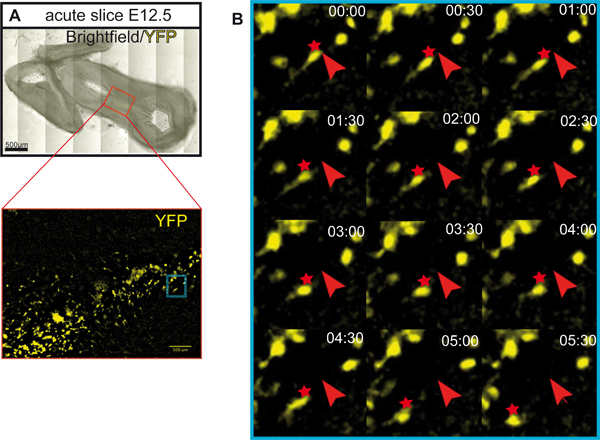
图5。YFP标记的神经元在急性切片的迁徙路线。 (一) YFP标记的神经元失效成像水平切片用于。切片孵育5小时前成像。细胞标记使用诱导的Cre / loxP系统6。 嘘CreER小鼠8和ROSA的loxP位一站式loxP位EYFP记者小鼠9我们重新使用。罗莎记者等位基因(EYFP的表达)的重组是在细胞诱导表达CreER(SHH -表达细胞),但只有在他莫昔芬(Sigma公司)的管理。在这个例子中,他莫昔芬(3 mg/40 g体重)给怀孕小鼠在E8.5。这个实验装置,主要是在多巴胺能神经元前体和他们的后裔在腹脑 10,11标签的结果。比例尺:500微米。 (二)在急性切片追踪YFP标记的神经元的迁徙路线。 YFP标记的命运映射神经元的延时图像被收购每蔡司显微镜Axio的观察员(客观EC PlnN 10倍/ 0.3)30分钟的总时间为5小时30分钟。切片孵育在37 ° C的环境室(孵化器XLS1 Pecon),并提供5%的CO 2在成像。标有红色箭头的细胞的初始位置;迁移位置用红色星号标记。
讨论
这里介绍的器官切片培养方法在体外分析发展中国家在胚胎腹侧中脑多巴胺能神经元和它们的迁徙和投影路线系统提供了一个短期的。我们发现,有一些在协议的重要步骤应仔细出席了会议,以获得片,使腹侧中脑多巴胺能神经元的正常发展。最关键的一步是胚胎脑,快速和精确的解剖。相比之下一代成人的大脑切片,这是关键部分的大脑上配有一个冷却系统,使用频率低,与高速结合,?...
披露声明
我们什么都没有透露。
致谢
我们感谢他们在帮助建立器官切片培养体系和沃尔夫冈夜蛾和批判性阅读的手稿Liviu加布里埃尔Bodea马汀娜Emond和伊莎贝尔Brachmann。我们要感谢弗兰克Costantini的R26记者小鼠和SHH CreER小鼠的克里夫塔宾。这项研究是从科学和北莱茵 - 威斯特法伦州(Programm楚Förderung DER Rückkehr DES wissenschaftlichen Spitzennachwuchses AUS DEM Ausland)的研究部资助的一个研究奖。
材料
特定的试剂和设备表
| 试剂名称 | 公司 | 目录编号 | 评论(可选) |
|---|---|---|---|
| DMEM培养液 | Sigma - Aldrich公司 | D6429 | |
| 葡萄糖30% | Sigma - Aldrich公司 | G7528 - 250 | |
| 马血清 | Invitrogen公司 | 26050-088 | |
| DMEM(4,5克/ L,GLC,与L -谷氨酰胺,娜PYR,碳酸氢钠) | Sigma - Aldrich公司 | D6429 - 500 | |
| 青霉素/链霉素100X | Sigma - Aldrich公司 | P4333 - 20 | |
| L -抗坏血酸 | Sigma - Aldrich公司 | A4403 | 200mm的股票和存储准备在-20 ° C |
| 超纯LMP琼脂糖 | Invitrogen公司 | 15517-022 | |
| Millicel插入 | Millipore公司 | PICMORG50 | |
| μ盘35毫米,低 | Ibidi | 80136 | |
| Vibratome | MICROM | 航模650V | |
| 刀片 | 普莱诺有限公司 | 121-6 | |
| Histoacryl胶 | BRAU9381104 | 布劳恩蛇牌 | |
| 穿孔勺直径 直径15毫米 | 精细科学工具 | 10370 -18 | |
| 钳5 Dumoxel | 精细科学工具 | 11252 - 30 |
immunostainings使用的抗体:
| 抗体的名称 | 公司 | 目录编号 | 评论(可选) |
| 兔抗酪氨酸羟化酶 | Millipore公司 | AB152 | 稀释1:500 |
| 小鼠抗酪氨酸羟化酶 | Millipore公司 | MAB318 | 稀释1:500 |
| 小鼠抗BrdU | BD Pharmingen公司 | 555627 | 稀释1:200 |
| 兔抗裂解的caspase 3 | 细胞信号技术 | 9661 | 稀释1:200 |
| 驴抗兔IgG - Alexa的488 | Invitrogen公司 | A21206 | 稀释1:500 |
| 驴抗鼠IgG - Cy3标记 | 杰克逊ImmunoResearch | 715-165-150 | 稀释1:200 |
参考文献
- Noctor, S. C., Martinez-Cerdeno, V., Ivic, L., Kriegstein, A. R. Cortical neurons arise in symmetric and asymmetric division zones and migrate through specific phases. Nat. Neurosci. 7 (2), 136-136 (2004).
- Martini, F. J. Biased selection of leading process branches mediates chemotaxis during tangential neuronal migration. Development. 136 (1), 41-41 (2009).
- Marin, O., Valiente, M., Ge, X., Tsai, L. H. Guiding neuronal cell migrations. Cold Spring Harb. Perspect. Biol. 2 (2), a001834-a001834 (2010).
- Ayala, R., Shu, T., Tsai, L. H. Trekking across the brain: the journey of neuronal migration. Cell. 128 (1), 29-29 (2007).
- Smidt, M. P., Burbach, J. P. How to make a mesodiencephalic dopaminergic neuron. Nat. Rev. Neurosci. 8 (1), 21-21 (2007).
- Legue, E., Joyner, A. L. Genetic fate mapping using site-specific recombinases. Methods. Enzymol. 477, 153-153 (2010).
- Daza, R. A., Englund, C., Hevner, R. F. Organotypic slice culture of embryonic brain tissue. CSH Protoc. , (2007).
- Harfe, B. D. Evidence for an expansion-based temporal Shh gradient in specifying vertebrate digit identities. Cell. 118 (4), 517-517 (2004).
- Srinivas, S. Cre reporter strains produced by targeted insertion of EYFP and ECFP into the ROSA26 locus. BMC Dev. Biol. 1, 4-4 (2001).
- Joksimovic, M. Spatiotemporally separable Shh domains in the midbrain define distinct dopaminergic progenitor pools. Proc. Natl. Acad. Sci. U. S. A. 106 (45), 19185-19185 (2009).
- Blaess, S. Temporal-spatial changes in Sonic Hedgehog expression and signaling reveal different potentials of ventral mesencephalic progenitors to populate distinct ventral midbrain nuclei. Neural. Dev. 6 (1), 29-29 (2011).
- Hippenmeyer, S. A developmental switch in the response of DRG neurons to ETS transcription factor signaling. PLoS Biol. 3 (5), e159-e159 (2005).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。