Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Cultures organotypique de mésencéphale ventral embryonnaire: Un système pour étudier le développement neuronal dopaminergique In vitro
Dans cet article
Résumé
Une méthode pour générer des tranches organotypiques de l'embryon murin E12.5 mésencéphale est décrite. Les cultures organotypique peut être utilisé pour observer le comportement des neurones dopaminergiques du mésencéphale ou d'autres neurones ventraux.
Résumé
La souris est un organisme excellent modèle pour étudier le développement du cerveau des mammifères en raison de l'abondance de données moléculaires et génétiques. Toutefois, le cerveau de souris en développement n'est pas adapté pour la manipulation facile et d'imagerie in vivo, depuis l'embryon de souris est inaccessible et opaque. Cultures organotypique de cerveaux embryonnaires sont donc largement utilisées pour étudier le développement du cerveau murin in vitro. Ex-vivo la manipulation ou l'utilisation de souris transgéniques permet la modification de l'expression génique afin que les sous-populations de cellules neuronales ou gliales peuvent être étiquetés avec des protéines fluorescentes. Le comportement des cellules marquées peuvent alors être observés à l'aide imagerie time-lapse. Time-lapse d'imagerie a été particulièrement fructueuse pour l'étude des comportements cellulaires qui sous-tendent le développement du cortex cérébral à la fin des stades embryonnaires 1-2. Embryonnaire des systèmes de culture organotypiques de tranches dans les régions du cerveau en dehors du cerveau antérieur sont establis moins bienhed. Par conséquent, la richesse des données d'imagerie time-lapse décrivant la migration des cellules neuronales est limitée à 3,4 le prosencéphale. Il n'est pas encore connu, si les principes découverts par le cerveau dorsale vrai pour les zones du cerveau ventral. Dans le cerveau ventrale, les neurones sont organisés en grappes neuronale plutôt que des couches et ils ont souvent à subir les trajectoires migratoires complexes pour atteindre leur position finale. Le mésencéphale ventral est non seulement un bon modèle pour le développement du cerveau ventral, mais contient aussi des populations neuronales comme les neurones dopaminergiques qui sont pertinentes dans les processus de la maladie. Alors que la fonction et la dégénérescence des neurones dopaminergiques a été étudiée en détail chez l'adulte et le vieillissement du cerveau, on connaît peu le comportement de ces neurones au cours de leur différenciation et 5 phase de migration. Nous décrivons ici la génération des cultures tranche du jour embryonnaire (E) 12,5 mésencéphale ventral de la souris. Ces cultes trancheres sont potentiellement adaptés à la surveillance développement des neurones dopaminergiques sur plusieurs jours in vitro. Nous mettons en évidence les étapes critiques dans la génération des tranches de cerveau à ces stades précoces du développement embryonnaire et de discuter les conditions nécessaires pour maintenir un développement normal des neurones dopaminergiques in vitro. Nous avons également présenter les résultats des expériences d'imagerie time lapse. Dans ces expériences, les précurseurs du mésencéphale ventral (y compris les précurseurs dopaminergiques) et leurs descendants ont été étiquetés de manière à l'aide d'une mosaïque de Cre / loxP système de cartographie basée sur le destin inductible 6.
Protocole
Certaines parties du présent protocole sont modifiées de Daza et al., 2007 7.
1. Préparatifs
- Peut être préparé un jour à l'avance
- Préparer 1X tampon de Krebs (1,5 L): 126 mM NaCl, 2,5 mM KCl, 1,2 mM NaH 2 PO 4: H 2 O, 1,2 mM de MgCl2, 2,5 mM de CaCl2, 11 mM de glucose, 25 mM NaHCO 3; ajuster le pH à 7,4. Stériliser par filtration (0,22 um taille des pores) et conserver à 4 ° C.
- Préparer le milieu de culture (20 ml): 5 ml de HBSS, 9 ml de DMEM glucose élevé, 850 ul de glucose à 30%, 5 ml de sérum de cheval (25%). Ajouter 200 uL Penicllin 100X / streptomycine. Conserver à 4 ° C.
- Préparer avant de commencer la dissection
- Préparer 100 ml de 4% de fusion bas agarose (agarose LMP) en 1X tampon de Krebs: micro-ondes la solution jusqu'à ce que l'agarose est complètement dissous, puis placer l'agarose dans un bain d'eau à 45 ° C.
- Remplissez le vibreurBac tampon Tomé avec tampon glacé 1X Krebs et commencer à l'élément de refroidissement (conserver à 4 ° C). Fixer une lame de rasoir dans le porte-lame et mettre en place la zone vibratome avec un scalpel, un pinceau fin et une cuillère perforée mini de ramasser les morceaux. Préparer des boîtes de Petri stériles (35 x 10 mm) avec 1x tampon de Krebs pour la collecte des tranches. Restez sur la glace.
- Mise en place de la zone de dissection avec des plats de Pétri (100 x 15 mm) pour la dissection et les petits boîtes de Petri stériles (35 x 10 mm) pour l'intégration, de petits ciseaux, deux pinces fines (Dumont 5), une cuillère perforée mini, un verre pipette Pasteur polies au feu avec une ronde fermée pointe et 1 L de 1X tampon de Krebs sur la glace. Essuyez tous les outils de dissection à l'éthanol 70%.
- Ajouter milieu de culture pour les puits d'une plaque de six puits (1,5 ml / puits) et le placer dans un incubateur à 37 ° C.
- Préparer une plaque de six puits avec 1,5 ml / puits stériles 1X tampon de Krebs et 15 uL Penicillium / streptomycine (100X) / puits. Dans des conditions stériles, placer Milinserts de culture cellulaire licell dans les puits. Placer la plaque de six puits à côté de la vibratome afin que les tranches de cerveau peuvent être transférées sur des membranes de filtre immédiatement après la coupe.
2. Dissection et enrobage de cerveaux d'embryons
- Anesthetize une souris femelles gravides en utilisant l'isoflurane et le sacrifice de la souris par dislocation cervicale (embryons doivent être au stade E12.5). Disséquer l'utérus de la souris en tirant vers le haut de l'utérus avec une pince. Utilisez une pince d'autres pour séparer les mésométrium loin de l'utérus. Placez l'utérus dans glacée 1X tampon de Krebs. Utilisez une pince fine pour séparer la paroi musculaire de l'utérus, de la membrane de Reichert et le viscéral du sac vitellin de l'embryon. Retirez les embryons dans l'utérus. Placer les embryons disséqué dans un plat séparé de Petri avec tampons stériles 1X Krebs.
- Disséquer le cerveau sous un stéréomicroscope. Pour disséquer le cerveau, d'abord couper la tête de l'embryon. Fixez la têteen perçant une pince fine à travers la tête (au niveau des yeux). Utilisez une autre paire de pinces pour enlever soigneusement la peau et le crâne. Utilisez une pince pour soulever délicatement la cervelle et le transférer dans une boîte de Pétri stériles avec tampon 1X Krebs. Il est très important que l'intégrité de l'ensemble du cerveau est maintenu lors de la dissection, puisque les dommages aux tissus du cerveau va créer des problèmes (comme le déchiquetage des tissus) pendant la coupe sur le vibratome.
- Laver le cerveau une fois dans 4% à faible point de fusion (LMP) agarose. Intégrer 2-3 cerveaux à un moment dans l'eau douce de 4% d'agarose LMP. Placez les plats intégrant sur la glace aussi uniforme que possible. Utiliser une pipette Pasteur avec une pointe polie au feu rond pour soulever le cerveau jusqu'à ce que le fond de l'agarose est solidifié. Le cerveau doit s'installer dans une position horizontale plane au fond du bloc d'agarose.
- Après l'agarose a entièrement solidifié (après environ 3 min), coupez l'agarose entourant le cerveau et de la colle le bloc d'agarose sur la scène éprouvettede l'vibratome. Lorsque le collage des blocs, assurez-vous que la face ventrale du cerveau est parallèle à la plate-forme, puisque le cerveau doit être coupé dans un plan de coupe horizontale.
3. Sectionnement Vibratome
- Utilisez une lame de rasoir pour la coupe. Pour obtenir des tranches intactes, il est très important de maintenir la température à 4 ° C pendant la coupe.
- L'article 300 um d'épaisseur des tranches horizontales à une fréquence de 50 Hz, amplitude de lame de 1,1 mm et une vitesse de 25 mm / sec.
- Utilisez le pinceau fin pour pousser la tranche dans une cuillère perforée mini pour recueillir les tranches de cerveau et de les transférer dans un plat avec le tampon glacée stériles 1X Krebs. Choisissez la tranche qui contient le tissu du mésencéphale ventral (voir Figure 1). Dans un cerveau de souris E12.5 il ya juste une tranche de 300 um horizontale qui contient des tissus du mésencéphale ventral, y compris les neurones dopaminergiques.
4. Trancher la culture
Étapes 4.2 à 4.5 doit être effectuée dans des conditions stériles.
- Transférer les tranches de cerveau sur un insert de cellules Millicell la membrane de la culture dans une plaque de six puits avec 1x tampon Krebs (voir point 1.2.5). Pour transférer la tranche utiliser la cuillère mini perforé (Fine Science Tools) et un pinceau fin. Jusqu'à 3 tranches peut être placé sur une membrane.
- Transférer la membrane avec la tranche de la plaque de six puits de milieu de culture (voir point 1.2.5). Le sommet de la membrane ne doit pas être couvert par médium. La tranche de cerveau reçoit moyennes de l'air par le bas et en haut.
- Placer la plaque de six puits dans un incubateur avec 5% de CO 2 à 37 ° C. Il est très important que les tranches sont placées dans l'incubateur dans les 2 heures après l'étape initiale de la dissection. Un temps de préparation plus étendue peut entraîner une faible survie des tranches.
- Tranches peuvent être maintenues in vitro jusqu'à 3 jours. Changement de 50% du milieu de culture sur le 2 ème jour.
5. Imagerie time-lapse
- Laissez les tranches de récupérer dans l'incubateur pendant 4-5 heures avant de commencer imagerie time-lapse.
- Pour imagerie time-lapse, garder les tranches sur l'insert membrane et le transfert de l'insérer dans un 35 mm ibidi μ-vaisselle (le fond du plat se compose du matériel avec une qualité optique de haut).
- Ajouter 1 mL de milieu de culture, plus 1,5 uL d'acide ascorbique (200 mM) pour le plat. L'acide ascorbique protège les tranches contre la phototoxicité.
- Incuber tranches dans un caisson climatique à 37 ° C avec 5% de CO2 pendant imagerie time-lapse.
6. Les résultats représentatifs
La figure 1 illustre la préparation de cultures organotypique de E12.5 cerveau de souris. La figure 2 montre les tranches organotypiques horizontale (aiguë et après plusieurs jours de culture) a obtenu le cerveau de souris sous forme E12.5. A titre de comparaison, des sections de cerveau congelé à des étapes équivalentes de développementsont affichés. Neurones dopaminergiques du mésencéphale sont visualisées par immunohistochimie de la tyrosine hydroxylase (TH). Mésencéphale projet dopaminergiques neurones cibles dans le cerveau antérieur. Ces projections commencent à se former à E12.5 et s'étendent vers le prosencéphale pendant les jours suivants. Nous considérons que le développement des projections du cerveau antérieur comme une bonne indication pour le développement normal des neurones dopaminergiques dans la culture. Dans le mésencéphale horizontale tranches neurones dopaminergiques d'étendre les projections vers leur zone de prosencéphale cible appropriée. Après 3 DIV (jours in vitro) ou lorsque les zones cibles du cerveau antérieur sont endommagés, des projections aberrantes s'étendent vers le mésencéphale dorsal. Exemples de coupes coronales du mésencéphale E12.5 sont présentés dans la figure 3. Les neurones dopaminergiques visualisées avec immunomarquage pour TH prolonger les projections aberrantes à l'mésencéphale dorsal. La figure 4 montre une analyse de la prolifération, les cellules nécrotiques et apoptotiques dans les cultures organotypique. BrdU immunostaining de visualiser les cellules en prolifération démontre que les cellules prolifèrent dans des conditions de culture après une DIV. La prolifération est réduite après 4 DIV. Après 3 DIV, de nombreuses cellules dans le mésencéphale ventral subissent une nécrose (coloration iodure de propidium) et apoptose (immunomarquage de la caspase-3 clivée). La figure 5 montre les chemins de migration des neurones marqués YFP surveillée dans une expérience d'imagerie time-lapse dans une tranche aiguë .
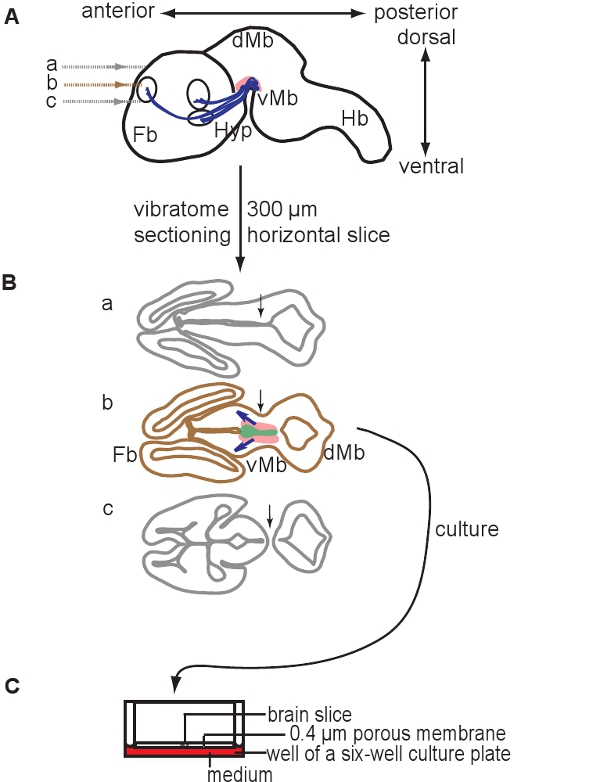
Figure 1. Schéma illustrant la préparation de cultures organotypique. 300 um tranches de cerveau horizontale sont préparés par sectionnement d'un cerveau en utilisant un vibratome E12.5. (A) vue sagittale schématique d'un cerveau de souris E12.5. Niveaux des sections sont indiquées. La zone contenant les neurones dopaminergiques est représenté en rose, les projections sont indiquées en bleu. (B) Schémas des trois tranches qui peuvent être obtenus à partir de dorsal à ventral et that contenir à la fois du cerveau antérieur (Fb) et le mésencéphale (Mo). Notez que seule une tranche contient les neurones dopaminergiques (b tranche). La tranche appropriée peuvent être identifiés en fonction de la position des ventricules et la continuité du tissu mésencéphale et du cerveau antérieur (flèches, comparer la section B de l'article a et c). La zone contenant les neurones dopaminergiques est indiqué en rose, la zone contenant des précurseurs dopaminergiques est représenté en vert, les flèches bleues indiquent les projections de développement. (C) La tranche contenant les neurones dopaminergiques est cultivé sur des inserts membrane. Abréviations: VMB, mésencéphale ventral; DMB, du mésencéphale dorsal; Hyp, l'hypothalamus; Hb, rhombencéphale.
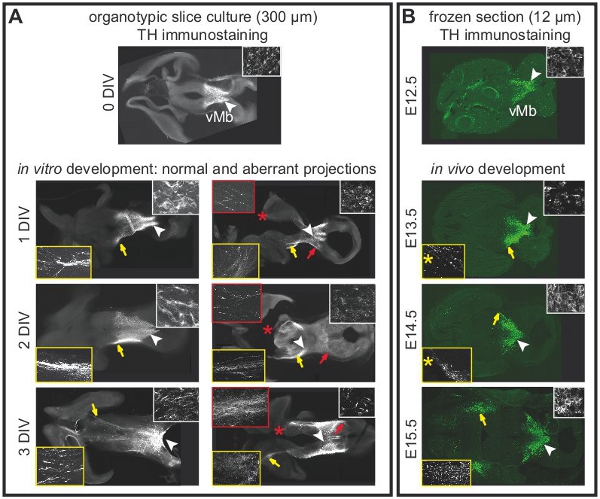
Figure 2. Projections des neurones dopaminergiques du mésencéphale dans les cultures organotypique sont dépendants de l'intégrité du cerveau antérieur. L'immunohistochimie de la tyrosine hydroxylase (TH) pour étiqueter les neurones dopaminergiques. (A) tranche aiguë (0 DIV)indiquant l'emplacement normal des neurones dopaminergiques dans le mésencéphale ventral. La flèche blanche indique la zone qui est montré dans un plus fort grossissement dans l'encart. Projections à l'prosencéphale n'ont pas encore développé. Après une DIV, les projections à l'prosencéphale commencent à se former. Projections s'étendre dans le cerveau antérieur à 2-3 DIV. Flèches blanches indiquent l'emplacement des corps cellulaires indiqué dans un plus fort grossissement dans les encarts (cadre blanc). Les flèches jaunes soulignent les projections normales en tranches intactes indiqué dans un plus fort grossissement dans les encarts (cadre jaune). Aberrant projections se développer en tranches avec du prosencéphale endommagé. Les flèches rouges indiquent les projections aberrantes de la dorsale du mésencéphale indiqué dans un plus fort grossissement dans les encarts (cadre rouge). Les dommages sont indiquées par des astérisques rouges. Après 3 DIV, la plupart des tranches (n = 5 / 7) avaient des projections aberrantes vers le mésencéphale dorsal. (B) immunomarquage TH sur l'horizontale des sections de cerveau congelé à différents stades de développement de montrer le développementdes projections dopaminergiques in vivo. Flèches blanches indiquent l'emplacement des corps cellulaires indiqué dans un plus fort grossissement dans les encarts (cadre blanc). Les flèches jaunes soulignent la position de la projections du plus fort grossissement dans les encarts (cadre jaune). Le niveau des sections gelées a été choisi pour se rapprocher du niveau de la tranche de cultures organotypiques. Notez qu'un sections congelées (12 um) ne représente pas toute la tranche organotypique (300 um). Par conséquent, les projections montré à E13.5 E14.5 et ont été observés sur les articles 120 um plus ventral que la section contenant les corps cellulaires (astérisques jaune).
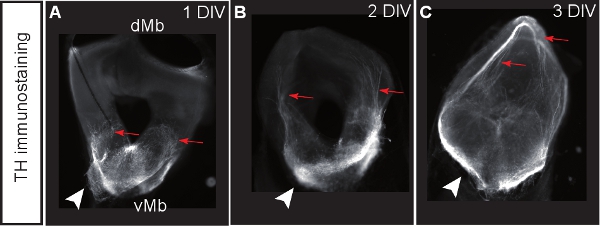
Figure 3. Mésencéphale cultures tranche coronale colorées pour la tyrosine hydroxylase (TH) comme un marqueur des neurones dopaminergiques. (AC) Tranches après DIV 1, 2 ou 3. Les neurones dopaminergiques développent des projections vers le mésencéphale aberrante dorsale (rflèches éd.) Pointes de flèches montrent l'emplacement des corps cellulaires dopaminergiques.
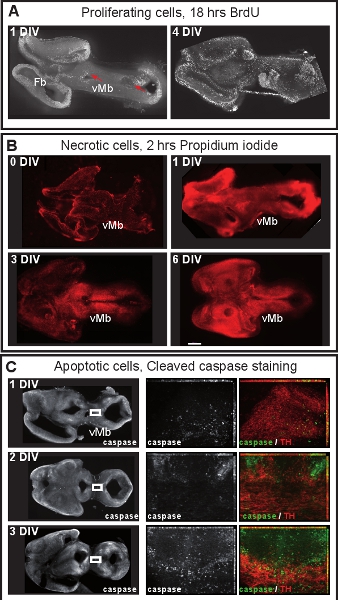
Figure 4. Prolifération cellulaire et la viabilité des cellules en culture organotypique mésencéphale. (A) Les cellules en prolifération ont été marqués par l'ajout de BrdU (50 ng / mL, Sigma) au milieu de culture pendant 18 h. Les tranches ont été par la suite immunocolorées pour BrdU. Après une DIV, les cellules BrdU marqués sont situés dans les zones ventriculaires (flèches rouges). Après 4 DIV, les cellules proliférantes sont plus dispersés et une zone ventriculaire distinctes n'est plus maintenu. (B) Les cellules nécrotiques ont été marqués par addition d'iodure de propidium (1μg/μL, Sigma) au milieu de culture pendant 2 heures et visualisé par microscopie à fluorescence. Après une DIV, le mésencéphale ventral (vmb) n'est pas nécrosée, mais de nombreuses cellules d'iodure de propidium marqué peut être vu dans le mésencéphale dorsal et du cerveau antérieur. Après 3 DIV de la viabilité cellulaire diminue dans le midbra ventralepo Barre d'échelle: 500 um (C) Immunostaing pour la caspase-3 clivée de visualiser les cellules apoptotiques. A 1 ou 2 DIV, seuls quelques neurones dopaminergiques (TH) sont apoptotiques. Après 3 DIV, les neurones dopaminergiques de commencer à entrer en apoptose. Panneaux au milieu et à droite sont forts grossissements de la zone encadrée dans les panneaux de gauche. Les images sont forts grossissements projections d'intensité maximale de z-stacks de 14-16 frames. Les images ont été prises toutes les 0,5 um avec un Zeiss Apotome set-up.
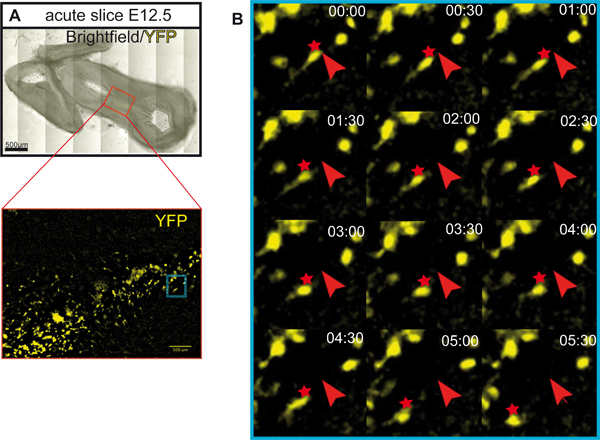
Figure 5. Route migratoire des YFP neurones marqués dans une tranche aiguë. (A) Tranche horizontale utilisé pour l'imagerie laps de temps de YFP neurones marqués. La tranche a été incubé pendant 5 heures avant l'imagerie. Les cellules ont été marquées en utilisant une inductible Cre / loxP système 6. Shh souris CREER 8 et souris ROSA journaliste loxP-STOP-loxP-EYFP 9, nousre utilisé. La recombinaison de l'allèle journaliste ROSA (et d'expression EYFP) est induite dans les cellules qui expriment CREER (Shh cellules exprimant), mais seulement sur l'administration de tamoxifène (Sigma). Dans cet exemple, le tamoxifène (3 mg/40 g de poids corporel) a été administré à des souris gravides à E8.5. Ce dispositif expérimental est principalement attribuable à l'étiquetage des précurseurs des neurones dopaminergiques et leurs descendants dans le mésencéphale ventral 10,11. Barre d'échelle: 500 um. (B) traçage de la route migratoire de la YFP neurones marqués dans une tranche aiguë. Time-lapse images de YFP neurones marqués destin tracé ont été acquises toutes les 30 min pour un temps total de 5 h 30 min sur un Zeiss Axio Observer-microscope (objectif CE PlnN 10x / 0,3). Les tranches ont été incubées dans une chambre environnementale (incubateur XLS1 Pecon) à 37 ° C et fourni avec 5% de CO 2 au cours de l'imagerie. La position initiale des cellules est marqué par des flèches rouges, les positions de migration sont marqués d'un astérisque rouge.
Discussion
La méthode organotypique culture présentées ici fournit un système pour le court terme dans l'analyse in vitro des neurones dopaminergiques de développement et de leurs routes migratoires et de projection dans le mésencéphale embryonnaire ventrale. Nous avons trouvé qu'il ya un certain nombre d'étapes critiques dans le protocole qui doit être soignée afin d'obtenir des tranches qui permettent le développement normal des neurones dopaminergiques du mésencéphale ventral. L'étape...
Déclarations de divulgation
Nous n'avons rien à révéler.
Remerciements
Nous remercions Martine Emond et Isabel Brachmann pour leur aide dans l'établissement du système de tranches organotypiques culture et Wolfgang Hübner et Liviu Gabriel Bodea pour la lecture critique du manuscrit. Nous tenons à remercier Frank Costantini pour le R26 souris Cliff Tabin journaliste et pour les souris CREER Shh. Cette étude a été financée par une bourse de recherche du ministère de la Science et la Recherche de la Rhénanie du Nord Westphalie (Programm zur Förderung der Rückkehr des wissenschaftlichen aus dem Ausland Spitzennachwuchses).
matériels
Table des réactifs spécifiques et des équipements
| Nom du réactif | Société | Numéro de catalogue | Commentaires (optionnel) |
|---|---|---|---|
| DMEM | Sigma-Aldrich | D6429 | |
| Glucose 30% | Sigma-Aldrich | G7528-250 | |
| Sérum de cheval | Invitrogen | 26050-088 | |
| DMEM (4,5 g / L Glc., Avec L-Gln, Na Pyr, NaHCO3) | Sigma-Aldrich | D6429-500 | |
| Pénicilline / streptomycine 100x | Sigma-Aldrich | P4333-20 | |
| Acide L-ascorbique | Sigma-Aldrich | A4403 | Préparez le bouillon 200mm et conserver à -20 ° C |
| UltraPure agarose LMP | Invitrogen | 15517-022 | |
| Insère Millicel | Millipore | PICMORG50 | |
| μ-plat de 35 mm, faible | Ibidi | 80136 | |
| Vibratome | Microm | HM 650V | |
| Lame de rasoir | Plano GmbH | 121-6 | |
| Histoacryl colle | BRAU9381104 | Braun Aesculap | |
| Dia cuillère perforée diamètre 15 mm | Outils Fine Science | 10370 -18 | |
| Pince 5 Dumoxel | Outils Fine Science | 11252-30 |
Anticorps utilisés pour immunomarquages:
| Nom de l'anticorps | Société | Numéro de catalogue | Commentaires (optionnel) |
| Lapin anti-tyrosine hydroxylase | Millipore | AB152 | Dilution 1:500 |
| Souris anti-tyrosine hydroxylase | Millipore | MAB318 | Dilution 1:500 |
| Souris anti-BrdU | BD Pharmingen | 555627 | Dilution 1:200 |
| Lapin anti-caspase 3 clivée | Technologie signalisation cellulaire | 9661 | Dilution 1:200 |
| D'âne anti-IgG de lapin-Alexa 488 | Invitrogen | A21206 | Dilution 1:500 |
| D'âne anti-IgG de souris-Cy3 | Jackson ImmunoResearch | 715-165-150 | Dilution 1:200 |
Références
- Noctor, S. C., Martinez-Cerdeno, V., Ivic, L., Kriegstein, A. R. Cortical neurons arise in symmetric and asymmetric division zones and migrate through specific phases. Nat. Neurosci. 7 (2), 136-136 (2004).
- Martini, F. J. Biased selection of leading process branches mediates chemotaxis during tangential neuronal migration. Development. 136 (1), 41-41 (2009).
- Marin, O., Valiente, M., Ge, X., Tsai, L. H. Guiding neuronal cell migrations. Cold Spring Harb. Perspect. Biol. 2 (2), a001834-a001834 (2010).
- Ayala, R., Shu, T., Tsai, L. H. Trekking across the brain: the journey of neuronal migration. Cell. 128 (1), 29-29 (2007).
- Smidt, M. P., Burbach, J. P. How to make a mesodiencephalic dopaminergic neuron. Nat. Rev. Neurosci. 8 (1), 21-21 (2007).
- Legue, E., Joyner, A. L. Genetic fate mapping using site-specific recombinases. Methods. Enzymol. 477, 153-153 (2010).
- Daza, R. A., Englund, C., Hevner, R. F. Organotypic slice culture of embryonic brain tissue. CSH Protoc. , (2007).
- Harfe, B. D. Evidence for an expansion-based temporal Shh gradient in specifying vertebrate digit identities. Cell. 118 (4), 517-517 (2004).
- Srinivas, S. Cre reporter strains produced by targeted insertion of EYFP and ECFP into the ROSA26 locus. BMC Dev. Biol. 1, 4-4 (2001).
- Joksimovic, M. Spatiotemporally separable Shh domains in the midbrain define distinct dopaminergic progenitor pools. Proc. Natl. Acad. Sci. U. S. A. 106 (45), 19185-19185 (2009).
- Blaess, S. Temporal-spatial changes in Sonic Hedgehog expression and signaling reveal different potentials of ventral mesencephalic progenitors to populate distinct ventral midbrain nuclei. Neural. Dev. 6 (1), 29-29 (2011).
- Hippenmeyer, S. A developmental switch in the response of DRG neurons to ETS transcription factor signaling. PLoS Biol. 3 (5), e159-e159 (2005).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon