Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Embriyonik ventral orta beyin Organotipik Dilim Kültürler: dopaminerjik Nöronal Gelişim Eğitim Bir Sistem In vitro
Bu Makalede
Özet
E12.5 fare embriyonik Ortabeyin Organotipik dilimler oluşturmak için bir yöntem açıklanmıştır. Organotipik dilim kültürleri dopaminerjik nöronlar veya diğer ventral orta beyin nöronları davranışını gözlemlemek için kullanılabilir.
Özet
Fare, moleküler ve genetik veri bolluğu nedeniyle memeli beyin gelişimini incelemek için mükemmel bir model organizmadır. Ancak, fare embriyo ulaşılmaz ve opak gelişmekte olan fare beyin kolay manipülasyon ve in vivo görüntüleme için uygun değildir. Bu nedenle embriyonik beyinleri Organotipik kesit kültürleri, in vitro fare beyin gelişimini incelemek için yaygın kullanılır. Ex-vivo gen ekspresyonu manipülasyon ya da transgenik farelerin değişikliğine izin verir, böylece nöronal veya glial hücrelerin alt popülasyonlar floresan proteinleri ile etiketlenmiş. Etiketli hücrelerinin davranış time-lapse görüntüleme kullanarak görülebilir. Time-lapse görüntüleme geç embriyonik aşamalarında 1-2 serebral korteks gelişiminin altında yatan hücre davranışları çalışmak için özellikle çok başarılı olmuştur. Embriyonik Organotipik dilim kültür sistemleri önbeyin dışında beyin bölgelerinde daha az iyi established. Bu nedenle, nöronal hücre göçü anlatan time-lapse görüntüleme verileri zenginlik önbeyin 3,4 ile sınırlı. Hala dorsal beyin keşfedilen ilkeler ventral beyin alanları için geçerli olup olmadığı bilinmemektedir. Nöronlar ventral beyin nöron kümeleri yerine katmanlar halinde organize edilen ve genellikle karmaşık göçmen yörüngeleri son konuma geçmesi gerekiyor. Ventral orta beynin ventral beyin gelişimi için sadece iyi bir model sistem değildir, aynı zamanda bu tür hastalık süreçlerinde ilgili dopaminerjik nöronlar gibi nöron popülasyonları içerir. Dopaminerjik nöronların fonksiyonu ve dejenerasyon, yetişkin ve yaşlanmanın beyin çok detaylı olarak incelenmiştir olsa da, kendi farklılaşmasını ve göç faz 5 sırasında bu nöronların davranışları hakkında çok az bilinmektedir. Biz burada embriyonik gün (E) 12.5 fare ventral orta beyin dilim kültürlerin üretimi açıklar. Bu dilim kültures potansiyel olarak, in vitro olarak birkaç gün içinde dopaminerjik nöron gelişimini izlemek için uygun . Biz bu embriyonik gelişimin erken safhalarında, beyin dilimleri üreten kritik adımları vurgulamak ve in vitro dopaminerjik nöronların normal gelişimi sağlamak için gerekli koşulları tartışmak . Ayrıca, mevcut sonuçları zaman atlamalı görüntüleme deneyleri. Bu deneylerde, ventral orta beyin öncüleri (dopaminerjik öncüleri de dahil olmak üzere) ve onların soyundan Cre / loxP tabanlı indüklenebilir kaderi haritalama sistemi 6 kullanarak bir mozaik şekilde etiketlenir.
Protokol
Bu protokol parçaları Daza ve ark değiştirilmiş, 7, 2007.
1. Hazırlıklar
- Bir gün önceden hazırlanmış olabilir
- : 1X Krebs tampon hazırlayın (1.5 L) 126 mM NaCl, 2.5 mM KCl, 1.2 mM NaH 2 PO 4: H 2 O, 1.2 mM MgCl 2, 2.5 mM CaCl 2, 11 mM glikoz, 25 mM NaHCO 3, pH 7.4 'e ayarlayın. Sterilize Filtresi (0.22 mikron gözenek boyutu) ve 4 mağaza ° C
- Kültür ortamı (20 ml) 5 ml HBSS, 9 mL DMEM yüksek glukoz,% 30 glukoz 850 mcL, 5 ml at serumu (% 25): hazırlayın. 200 mcL 100X Penicllin / Streptomisin ekleyin. Mağaza, 4 ° C
- Diseksiyonu başlamadan önce hazırlanın
- 1X Krebs tampon% 4 düşük erime agaroz (LMP agaroz) 100 mL hazırlayın: mikrodalga çözüm agaroz tamamen çözülür ve daha sonra 45 ° C su banyosunda agaroz yere kadar.
- Titreşim dolduruntome tampon buz 1X Krebs tampon ile tepsi ve (4 ° C'de tutmak) soğutma elemanı başlatmak. Bıçak taşıyıcı ve bir neşter, ince bir fırça ve dilim almak için bir mini delikli kaşık ile set-up vibratome alan bir jilet sabitleyin. Steril Petri kapları (35 x 10 mm), 1x Krebs tamponu ile dilimleri toplamak için hazırlayın. Buz üzerinde tutun.
- Diseksiyon için steril Petri kapları (100 x 15 mm) ve daha küçük steril Petri kapları (35 x 10 mm), gömmek için küçük makas, iki ince forseps (Dumont 5), mini delikli kaşık, bir bardak disseksiyon alanında, set-up bir yuvarlak ile parlatılır Pasteur pipeti yangın buz üzerinde 1X Krebs tampon ucu ve 1 L kapattı. % 70 etanol ile tüm diseksiyon araçları silin.
- Altı plaka (1.5 ml / kuyu) kuyular için kültür ortamı ve 37 ° C inkübatör içine koyun.
- 1.5 ml / iyi steril 1X Krebs tampon ve 15 mcL Penisilin / Streptomisin (100X) / iyi bir altı-kuyu plaka hazırlayın. Steril koşullar altında, Mil yerdekuyu içine licell Hücre Kültürü ekler. Beyin dilimleri hemen kesit sonra filtre membranlar aktarılır böylece vibratome sonraki altı plaka koyun.
2. Diseksiyon ve embriyonik beyinlere yerleştirilmesi
- Izofluran kullanarak hamile bir kadın fare anestezi ve servikal dislokasyon (embriyon aşamasında E12.5 olmalıdır) tarafından fare kurban. Forseps ile rahim yukarıya doğru çekerek fare rahim parçalara ayır. Diğer forseps rahim uzak mesometrium ayırmak için kullanın. Buz 1X Krebs tamponunda rahim yerleştirin. Embriyonun rahim, Reichert membranı ve visseral yolk kesesi kas duvar ayırmak için ince bir pens kullanın. Embriyolar rahim çıkarın. Disseke embriyoların steril 1X Krebs tampon ayrı bir Petri kabı içine yerleştirin.
- Stereomicroscope altında beyin parçalara ayır. Beyin teşrih için, ilk önce embriyonun baş kesti. Fix başkafa (göz seviyesi) ince forseps piercing. Deri ve kafatası dikkatli bir şekilde çıkarmak için forseps başka bir çift kullanın. Forseps beyin dikkatlice çıkarın ve steril 1X Krebs tamponu ile bir Petri kabı içine aktarmak için kullanın. Vibratome kesit sırasında beyin dokusunda hasarlar (doku parçalama gibi) sorunlar yaratacak bu yana tüm beyin bütünlüğünü, diseksiyon sırasında korunur çok önemlidir.
- % 4 düşük erime noktası (LMP) agaroz kez beyinlerini yıkayın. Taze% 4 LMP agaroz bir anda 2-3 beyinleri Embed. Mümkün bile buz üzerinde gömme yemekleri yerleştirin. Agaroz alt katılaşmış kadar beyinleri kaldırmak için bir yangın cilalı yuvarlak ucu ile Pasteur pipet kullanın. Beyinleri agaroz bloğun altındaki yatay düz bir konuma yerleşmek gerekir.
- Agaroz tamamen katılaşmış (yaklaşık 3 dakika sonra) sonra, beyinleri çevreleyen agaroz ve tutkal örnek sahneye agaroz blok Döşemevibratome. Yapıştırma blokları, beyinleri, yatay bir bölümünde düzlemde kesilmesi gerekir beri beynin ventral tarafında, platform paralel olduğunu emin olun.
3. Vibratome kesit
- Kesit için bir jilet kullanın. Kesit boyunca bozulmadan dilimler elde etmek için 4 ° C sıcaklığı korumak için çok önemlidir.
- 50 Hz frekansta Bölüm 300 mikron kalınlığında yatay dilim, bıçak 1,1 mm genlik ve 25 mm / sn hız.
- , Beyin dilim toplamak ve steril buz 1X Krebs tampon bir çanak içine transfer dilim bir mini delikli kaşık itmek için ince bir fırça kullanın. (Bkz. Şekil 1), ventral orta beyin dokusu içerir dilim seçin . E12.5 fare beyin dopaminerjik nöronlar da dahil olmak üzere, ventral orta beyin dokusu içerir sadece tek bir 300 mikron yatay dilim var.
4. Dilim kültür
Adımlar 4,2-4,5 steril koşullar altında yapılmalıdır.
- Millicell hücre kültürü membran eklemek 1x Krebs tamponu (nokta 1.2.5 'e bakınız) ile altı plaka üzerine beyin dilimleri aktarın. Dilim aktarmak için mini delikli kaşık (Güzel Bilim Araçları) ve ince bir fırça kullanın. 3 dilim kadar bir membran üzerine yerleştirilebilir.
- Kültür ortamı ile altı plaka dilim (nokta 1.2.5 'e bakınız) ile membran aktarın. Membran üst orta kapsadığı olmamalıdır. Yukarıdan aşağıya ve hava beyin dilim orta alır.
- 37% 5 CO 2 ile bir inkübatör altı plaka ° C Bu dilimleri diseksiyonu ilk adımdan sonra inkübatör 2 saat içinde yerleştirilmiş olduğu çok önemlidir. Daha uzun bir hazırlık süresi dilimleri kötü sağkalım neden olabilir.
- Dilimler, in vitro olarak 3 gün öncesine kadar muhafaza edilebilir. 2. gününde% 50 kültür ortamı değiştirin.
5. Time-lapse görüntüleme
- Time-lapse görüntüleme başlamadan önce 4-5 saat dilimleri inkübatörde kurtarmak olsun.
- Time-lapse görüntüleme için, membran eklemek dilim tutmak ve bir 35 mm Ibidi μ-çanak (çanak alt, yüksek optik kalite malzemeden oluşur) içine yerleştirin transfer.
- 1 ml kültür ortamı artı 1.5 mcL askorbik asit (200 mM) çanak ekleyin. Askorbik asit dilim fototoksisite karşı korur.
- 37 az bir çevre odasında dilimleri ° C'de% 5 CO2 ile time-lapse görüntüleme sırasında.
6. Temsilcisi Sonuçlar
Şekil 1 E12.5 fare beyin Organotipik dilim kültürlerin hazırlanması göstermektedir. Şekil 2 yatay Organotipik dilimleri (akut ve kültürün birkaç gün sonra) formu E12.5 fare beyin elde gösterir. Eşdeğer gelişim evreleri karşılaştırma, dondurulmuş beyin bölümleri içingösterilir. Orta beyin dopaminerjik nöronların tirozin hidroksilaz (TH) için immünhistokimya ile görüntülendi. Orta beyin dopaminerjik nöronların proje önbeyin hedefleri. Bu tahminler, E12.5 formu ve sonraki gün boyunca önbeyin doğru uzanan başlar. Biz kültür dopaminerjik nöronların normal gelişimi için iyi bir gösterge olarak önbeyin projeksiyonlar geliştirme düşünün. Yatay dilim orta beyin dopaminerjik nöronların uygun önbeyin hedef alanına doğru projeksiyonlar uzanır. 3 SAYI (in vitro gün) veya önbeyin hedef alanlar zarar görmüş sonra, anormal projeksiyonları dorsal orta beyin doğru uzatın. E12.5 Ortabeyin koronal dilim örnekleri Şekil 3'te gösterilmiştir. Dopaminerjik nöronların TH dorsal orta beyin anormal projeksiyonları genişletmek için immün ile görüntülendi. Şekil 4 Organotipik dilim kültürleri, nekrotik ve apoptotik hücrelerin hızla çoğalan bir analiz gösterir. BrdU imhızla çoğalan hücreleri görselleştirmek için munostaining 1 DIV sonra hücreler kültür koşulları altında çoğaldığını göstermektedir. Silahların Yayılmasını Önleme 4 SAYI sonra azalır. 3 SAYI sonra nekroz (propidium iyodür boyama) ve apotosis (bölünmüş kaspaz-3 için immün), ventral orta beyindeki birçok hücre tabi tutulurlar. Şekil 5, akut bir dilim time-lapse görüntüleme deneyde izlenen YFP etiketli nöronların göç yolları gösterir .
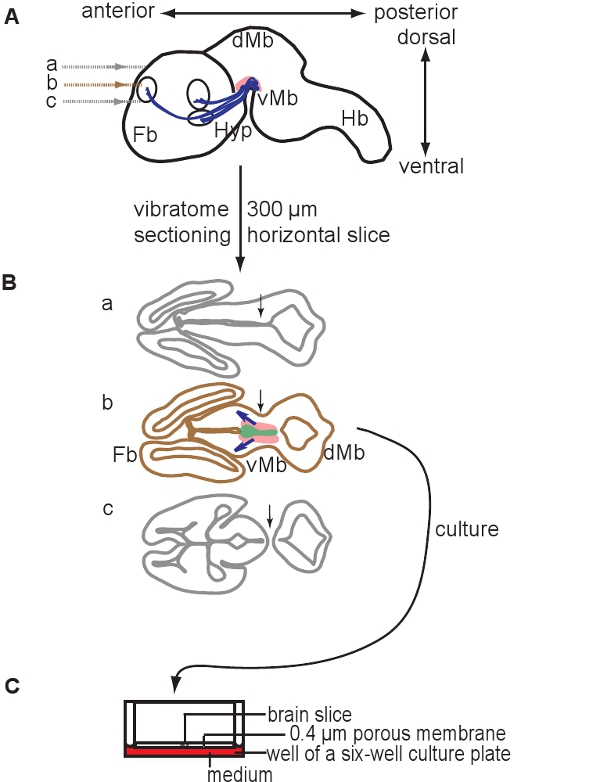
Şekil 1 Organotipik dilim kültürlerin hazırlanması gösteren şematik. 300 mikron yatay beyin dilimleri E12.5 beyin bir vibratome kullanarak bir kesit hazırlanmıştır. (A), bir E12.5 fare beyin Şematik sagital görünümü. Bölümleri seviyeleri belirtilmiştir. Dopaminerjik nöron içeren alan pembe tasvir, projeksiyonlar, mavi gösterilir. (B) dorsal elde edilebilir üç dilim Şemalar ventral ve that önbeyin (Fb) ve orta beyin (Mb) içerir. Sadece bir dilim dopaminerjik nöronların (dilim b) içerdiğini unutmayın. Uygun dilim ventriküllerin konumu ve orta beyin ve ön beyin dokusu (oklar, a ve c ile bölüm bölüm b karşılaştırmak) sürekliliğini göre tespit edilebilir. Dopaminerjik nöronların bulunduğu alan pembe gösterilir, dopaminerjik öncüleri içeren alan gelişmekte olan projeksiyonları gösteren yeşil, mavi oklar tasvir edilmiştir. (C) dopaminerjik nöron içeren dilim membran ekler kültüre. Kısaltmalar: vMb, ventral orta beyin, DMB, dorsal orta beyin; Hyp, hipotalamus; Hb, Beyin.
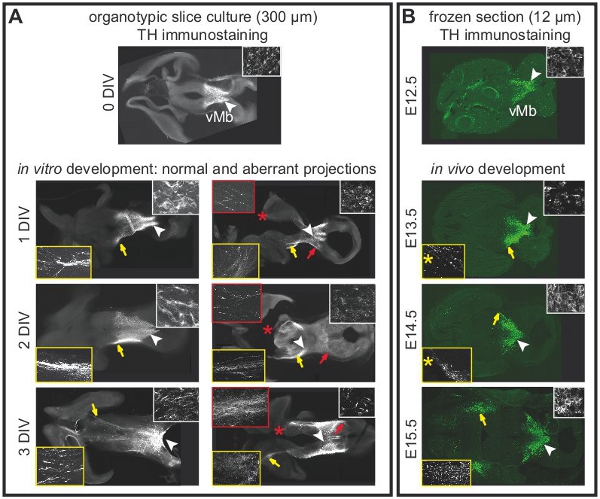
Şekil 2 Organotipik dilim kültürlerde orta beyin dopaminerjik nöronların Projeksiyonlar önbeyin bütünlüğünü bağlıdır. Dopaminerjik nöronların etiket tirozin hidroksilaz (TH) için İmmünohistokimya. (A) Akut dilim (0 DIV)ventral orta beyindeki dopaminerjik nöronların normal konumunu gösteren. Beyaz ok ucu içeride yüksek büyütme gösterilen alanda gösterir. Önbeyin Projeksiyonlar henüz geliştirilmiş değil. 1 DIV sonra, ön beyin için projeksiyonlar oluşturmaya başlar. Projeksiyonlar önbeyin 2-3 DIV içine uzanır. Beyaz ok uçları parçalar yüksek büyütme (beyaz karesi) gösterilen hücre organlarının yerini göstermektedir. Sarı oklar parçalar yüksek büyütme (sarı kare) gösterilen sağlam dilim normal projeksiyonlar vurgulayın. Aberran projeksiyonları hasarlı önbeyin dilimleri gelişir. Kırmızı oklar, dorsal orta beyin parçalar yüksek büyütme (kırmızı çerçeve) gösterilen anormal projeksiyonları göstermektedir. Hasar kırmızı yıldız işareti ile gösterilir. 3 SAYI sonra, en dilimleri (n = 5 / 7) dorsal orta beyin doğru anormal projeksiyonlar vardı. (B), farklı gelişim aşamalarında yatay dondurulmuş beyin bölümlerinde TH immün gelişimini göstermek içinin vivo olarak dopaminerjik projeksiyonlar. Beyaz ok uçları parçalar yüksek büyütme (beyaz karesi) gösterilen hücre organlarının yerini göstermektedir. Sarı oklar parçalar (sarı kare) yüksek büyütme gösterildiği projeksiyonlar konumunu vurgulamak frozen seviyesi Organotipik dilim kültürleri yakından maç için seçildi. Not tek bir frozen (12 mm) tüm Organotipik dilim (300 mikron) temsil etmez. Bu nedenle, E13.5 ve E14.5 gösterildiği projeksiyonlar, hücre gövdeleri (sarı yıldız) içeren bölümüne göre 120 mm daha ventral bölümlerde gözlendi.
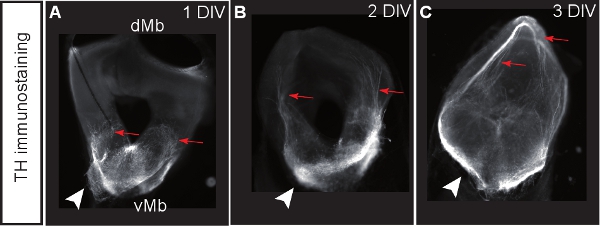
Şekil 3: orta beyin dopaminerjik nöronlar için bir belirteç olarak tirozin hidroksilaz (TH) lekeli koronal dilim kültürler . (AC) 1, 2 veya 3 SAYI sonra Dilimler. Dopaminerjik nöronlar dorsal orta beyin (r doğru anormal projeksiyonlar geliştirmeked oklar). Ok uçları dopaminerjik hücre organlarının yerini göstermek.
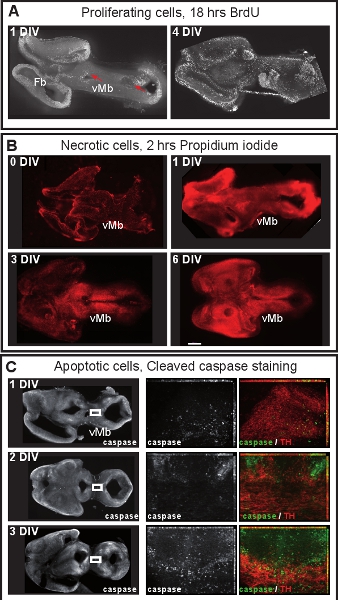
Şekil 4 Ortabeyin Organotipik dilim kültürleri hücre çoğalması ve hücre canlılığı. (A) Proliferatif hücreler 18 saat boyunca kültür ortamına BrdU (50 ng / ml, Sigma) yanı sıra işaretlenmiştir Dilimler daha sonra BrdU immunohistokimyasal. 1 DIV sonra BrdU işaretli hücrelerin ventriküler bölgeleri (kırmızı oklar) bulunmaktadır. 4 SAYI sonra, hızla çoğalan hücreleri daha dağınık ve farklı bir ventrikül bölge artık tutulur. (B) Nekrotik hücreler için kültür ortamına 2 saat ek propidium iyodür (1μg/μL Sigma) ile etiketli ve floresan mikroskobu ile görüntülendi. 1 DIV sonra, ventral orta beyin (vMb) nekrotik değildir, ama birçok propidium iyodür etiketli hücreleri dorsal orta beyin ve ön beyin görülebilir. 3 SAYI sonra hücre canlılığı ventral midbra azalırÖlçek çubuğu: 500 mikron (C) apoptotik hücreleri görselleştirmek için bölünmüş kaspaz-3 için Immunostaing içeri. 1 veya 2 SAYI, sadece birkaç dopaminerjik nöronların (TH) apoptotik. 3 SAYI sonra, dopaminerjik nöronların apoptozis geçmesi başlar. Orta ve sağda Panelleri kutulu alanının sol panelleri yüksek büyütmeler. Ne kadar yüksek büyütmeler görüntüleri 14-16 kare z yığınlarının maksimum yoğunluğu projeksiyonları. Görüntüler Zeiss Apotome set-up ile her 0,5 mikron alınmıştır.
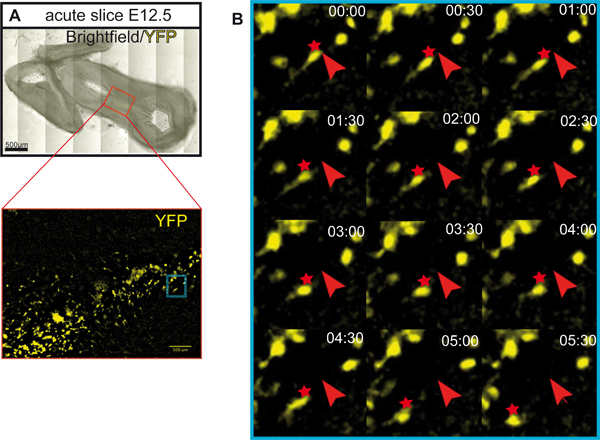
Şekil 5 akut bir dilim YFP etiketli nöronların Göçmen rota. (A) Yatay dilim YFP etiketli nöronların zaman atlamalı görüntüleme için kullanılır. Dilim 5 saat önce görüntüleme için inkübe edildi. Hücreler bir indüklenebilir Cre / loxP sistemi 6 ile etiketlenmiş. Shh CreER fareler 8 ve ROSA loxP-STOP-loxP-EYFP muhabiri fareler 9yeniden kullanılır. ROSA muhabiri allel (ve EYFP ifade) Rekombinasyon hücrelerin neden olduğunu ifade CreER (Shh ifade hücreleri), ancak Tamoksifen (Sigma) yönetimi üzerine. Bu örnekte, Tamoksifen (3 mg/40 g vücut ağırlığı) E8.5 gebe farelere verildi. Bu deneysel set-up öncelikle ventral orta beyin 10,11 dopaminerjik nöronlar ve onların soyundan öncüleri etiketleme sonuçları. Ölçek çubuğu: 500 mm. (B), akut bir dilim YFP etiketli nöronların göç rotası Tracing. YFP etiketli kader eşlenen nöronlar Time-lapse görüntüleri için her 30 dakikada bir toplam süre 5 saat 30 dakika bir Zeiss Axio-Gözlemci mikroskobu (objektif EC PlnN 10x / 0,3) satın alındı. Dilimler, 37 ° C'de (inkübatör XLS1 Pecon) bir kazanı inkübe ve görüntüleme sırasında% 5 CO 2 ile temin edildi . Hücrelerin ilk pozisyonda kırmızı oklar ile işaretlenmiş; göç pozisyonlar kırmızı yıldız ile işaretlenmiş.
Tartışmalar
Burada sunulan Organotipik dilim kültür yöntemi embriyonik ventral orta beyindeki dopaminerjik nöronlar ve onların göç ve projeksiyon yolları geliştirmek in vitro analizi kısa vadeli bir sistem sağlar. Biz ventral orta beyin dopaminerjik nöronların normal gelişimini sağlar dilimler elde etmek için özenle dikkat edilmelidir protokol kritik adımlar bir dizi olduğu bulundu. En kritik adım diseksiyonu embriyonik beyin, hızlı ve hassas olmak zorundadır. Yetişkin beyin dilimleri nesil aksine, ...
Açıklamalar
Biz ifşa etmek başka bir şey var.
Teşekkürler
Martine Emond ve Isabel Brachmann Organotipik dilim kültür sistemi ve Wolfgang Hübner ve yazının eleştirel okuma Liviu Gabriel Bodea kurulmasında yardım ettikleri için teşekkür ediyorum. Biz Frank Costantini Shh CreER fareler için R26 muhabiri fareler ve Cliff Tabin için teşekkür etmek istiyorum. Bu çalışmada, Kuzey Ren-Vestfalya (Programm zur Förderung der Rückkehr des wissenschaftlichen Spitzennachwuchses aus dem Ausland) Bilim ve Araştırma Bakanlığı Araştırma Ödülü tarafından finanse edildi.
Malzemeler
Özel reaktifler ve ekipman Tablo
| Reaktifi Adı | Şirket | Katalog numarası | Yorumlar (isteğe bağlı) |
|---|---|---|---|
| DMEM | Sigma-Aldrich | D6429 | |
| Glikoz 30% | Sigma-Aldrich | G7528-250 | |
| At Serumu | Invitrogen | 26050-088 | |
| DMEM (4,5 g / L GLC, L-Gln, Na Pyr, NaHCO3) | Sigma-Aldrich | D6429-500 | |
| 100x Penisilin / Streptomisin | Sigma-Aldrich | P4333-20 | |
| L-askorbik asit | Sigma-Aldrich | A4403 | -20 ° C'de 200mm stok ve depo hazırlamak |
| Ultrapure LMP agaroz | Invitrogen | 15517-022 | |
| Millicel ekler | Millipore | PICMORG50 | |
| düşük μ-çanak 35 mm, | Ibidi | 80136 | |
| Vibratome | Microm | HM 650V | |
| Jilet | Plano GmbH | 121-6 | |
| Histoacryl tutkal | BRAU9381104 | Braun Aesculap | |
| Delikli Kaşık Dia çapı 15 mm | Güzel Bilim Araçları | 10370 -18 | |
| Forseps 5 Dumoxel | Güzel Bilim Araçları | 11252 - 30 |
Immunostainings için kullanılan Antikorlar:
| antikor Adı | Şirket | Katalog numarası | Yorumlar (isteğe bağlı) |
| Tavşan anti-tirozin hidroksilaz | Millipore | AB152 | Seyreltme 1:500 |
| Fare anti-tirozin hidroksilaz | Millipore | MAB318 | Seyreltme 1:500 |
| Fare, anti-BrdU | BD Pharmingen | 555627 | Seyreltme 1:200 |
| Tavşan anti-cleaved kaspaz 3 | Hücre Sinyal Teknolojisi | 9661 | Seyreltme 1:200 |
| Eşek anti-tavşan IgG-Alexa 488 | Invitrogen | A21206 | Seyreltme 1:500 |
| Eşek anti-fare IgG-Cy3 | Jackson ImmunoResearch | 715-165-150 | Seyreltme 1:200 |
Referanslar
- Noctor, S. C., Martinez-Cerdeno, V., Ivic, L., Kriegstein, A. R. Cortical neurons arise in symmetric and asymmetric division zones and migrate through specific phases. Nat. Neurosci. 7 (2), 136-136 (2004).
- Martini, F. J. Biased selection of leading process branches mediates chemotaxis during tangential neuronal migration. Development. 136 (1), 41-41 (2009).
- Marin, O., Valiente, M., Ge, X., Tsai, L. H. Guiding neuronal cell migrations. Cold Spring Harb. Perspect. Biol. 2 (2), a001834-a001834 (2010).
- Ayala, R., Shu, T., Tsai, L. H. Trekking across the brain: the journey of neuronal migration. Cell. 128 (1), 29-29 (2007).
- Smidt, M. P., Burbach, J. P. How to make a mesodiencephalic dopaminergic neuron. Nat. Rev. Neurosci. 8 (1), 21-21 (2007).
- Legue, E., Joyner, A. L. Genetic fate mapping using site-specific recombinases. Methods. Enzymol. 477, 153-153 (2010).
- Daza, R. A., Englund, C., Hevner, R. F. Organotypic slice culture of embryonic brain tissue. CSH Protoc. , (2007).
- Harfe, B. D. Evidence for an expansion-based temporal Shh gradient in specifying vertebrate digit identities. Cell. 118 (4), 517-517 (2004).
- Srinivas, S. Cre reporter strains produced by targeted insertion of EYFP and ECFP into the ROSA26 locus. BMC Dev. Biol. 1, 4-4 (2001).
- Joksimovic, M. Spatiotemporally separable Shh domains in the midbrain define distinct dopaminergic progenitor pools. Proc. Natl. Acad. Sci. U. S. A. 106 (45), 19185-19185 (2009).
- Blaess, S. Temporal-spatial changes in Sonic Hedgehog expression and signaling reveal different potentials of ventral mesencephalic progenitors to populate distinct ventral midbrain nuclei. Neural. Dev. 6 (1), 29-29 (2011).
- Hippenmeyer, S. A developmental switch in the response of DRG neurons to ETS transcription factor signaling. PLoS Biol. 3 (5), e159-e159 (2005).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır