このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
胚腹側中脳の器官型スライス培養:ドーパミン作動性ニューロンの発達を研究するための体制 in vitroで
要約
E12.5マウス胚中脳から器官型スライスを生成する方法が記載されている。器官切片培養は、ドーパミン作動性ニューロンや他の腹側中脳の神経細胞の挙動を観察するために使用することができます。
要約
マウスは、分子や遺伝子データの豊富さに起因する哺乳類の脳の発達を研究するための優れたモデル生物です。マウスの胚にアクセスできず、不透明であるしかし、発展途上のマウスの脳は、 生体内で容易な操作と画像処理には適していません。胎児の脳の器官切片培養したがって、広くin vitroでマウスの脳の発達を研究するために使用されています。 生体外の操作やトランスジェニックマウスの使用ニューロンやグリア細胞の亜集団は、蛍光タンパク質で標識することができるように遺伝子発現を変更できます。標識された細胞の挙動は、タイムラプスイメージングを用いて観察することができます。タイムラプスイメージングは、後期胚の段階1-2に大脳皮質の発達の基礎となる細胞の挙動を研究するために、特に成功している。前脳の外側の脳領域における胚器官スライス培養系ではあまりよくestablisですHED。したがって、神経細胞の遊走を記述するタイムラプスイメージングデータの富は前脳3,4に限定されています。それは、背側の脳のために発見された原則は、腹側脳の領域に対しても当てはまるかどうか、まだ知られていないです。腹側脳では、神経細胞は神経細胞のクラスターではなく、レイヤーで構成されており、彼らはしばしば、彼らの最終的な位置に到達するための複雑な渡り鳥軌道を受けなければならない。腹側中脳は腹側脳の発達のための唯一の良いモデル系ではなく、またそのような病気のプロセスに関連するドーパミン作動性ニューロンなどの神経集団が含まれています。ドーパミン作動性ニューロンの機能と変性が成人と高齢化、脳内の非常に詳細に研究されている一方で、少しはその分化と移行フェーズ5の間にこれらのニューロンの振る舞いについては知られている。ここでは、胎生(E)12.5マウス腹側中脳から切片培養の生成を説明します。これらのスライスカルトURESは、in vitroで数日間にわたってドーパミン作動性ニューロンの開発を監視するための潜在的に適しています。我々は、胚発生のこれらの初期の段階で脳のスライスを生成するための重要なステップを強調表示し、in vitroでドーパミン作動性ニューロンの正常な発展を維持するために必要な条件を議論する。タイムラプスイメージング実験から我々はまた、今回の結果。これらの実験では、腹側中脳前駆体(ドパミン前駆体を含む)およびその子孫は、Creを/つのloxPベースの誘導性の運命のマッピングシステム6を使用してモザイクのように標識した。
プロトコル
このプロトコルの部分はダサらから変更されています。、2007 7。
1。準備
- 前日調製することができる
- :1Xクレブスバッファー(1.5 L)を準備 126 mMのNaCl、2.5mMのKClを、1.2 mMのはのNaH 2 PO 4:H 2 O、1.2 mMのMgCl 2、2.5mMのCaCl 2を 、11 mMグルコース、25mMのNaHCO 3水溶液は 、7.4にpHを調整する。滅菌フィルター(0.22μm孔径)と4℃で保存します。
- 5 mLのHBSS、9 mLのDMEM高グルコース、30%グルコースの850μL、5 mLのウマ血清(25%):培養液を(20mL)を準備します。 200μL100X Penicllin /ストレプトマイシンを追加。 4℃で保存します。
- 解剖を開始する前の準備
- 1Xクレブス緩衝液中4%低融点アガロース(LMPアガロース)を100 mLの調製:マイクロ波ソリューションをアガロースが完全に溶解し、次いで45℃の水浴中にアガロースを配置されるまで。
- 振動を埋める登米市バッファの氷冷した1 ×クレブスバッファーとトレーと(4℃に保つ)冷却素子を開始します。ブレードキャリアのかみそりの刃を固定して、メス、細かいブラシとスライスを拾うミニ穴あきスプーンでビブラトームエリアを設定します。スライスを収集するために1 ×クレブス緩衝液と滅菌ペトリ皿(35 × 10 mm)を用意します。氷上に置きます。
- 解剖のための滅菌ペトリ皿(100 × 15 mm)と小型滅菌ペトリ皿(35 × 10mm)を埋め込み、小さなはさみ、二つの微細な鉗子(デュモン5)、ミニ穴あきスプーン、ガラスと解剖の領域を設定するラウンドで研磨パスツールピペットの火災は、氷の上でヒントと1Xクレブス緩衝液1 Lを閉じました。 70%エタノールですべての解剖ツールを拭きます。
- 6ウェルプレート(1.5 mLの/ウェル)のウェルに培養液を追加し、37℃のインキュベーターに入れてください。
- 1.5 mLの/ウェル滅菌1Xクレブスバッファーおよび15μLPenicilin /ストレプトマイシン(100X)/ウェルで6ウェルプレートを準備します。無菌条件下で、ミルを配置各ウエルにlicellのセルカルチャーインサート。脳スライスがすぐに切削後はフィルター膜に転写することができるようにビブラトームの隣に6ウェルプレートを置きます。
2。胎児の脳の解剖と埋め込み
- イソフルランを使用して妊娠した雌マウスを麻酔し、(胚の段階E12.5にあるはずです)頚椎脱臼によりマウスを犠牲にする。鉗子で子宮を引き上げて、マウスの子宮をばらばらにする。子宮から子宮間膜を分離するために他のピンセットを使用してください。氷冷した1 ×クレブス緩衝液中で子宮を置きます。胚から子宮、ライヒェルトの膜と内臓卵黄嚢の筋肉壁を分離するために微細な鉗子を使用してください。子宮から胚を削除します。滅菌1Xクレブスバッファーを持つ別のシャーレに切除した胚を置きます。
- 実体顕微鏡下で脳を解剖。脳を解剖するには、まず胚の頭部を切断。頭を修正頭部(目の高さ)によって微細な鉗子を刺すことによって。慎重に皮膚や頭蓋骨を削除するには、鉗子の別のペアを使用してください。慎重に脳を持ち上げ、滅菌1Xクレブスバッファーを持つペトリ皿にそれを転送するために鉗子を使用してください。それは、脳組織への損害賠償はビブラトームで切片中に問題(例えば、組織の破砕など)を作成するので、脳全体の整合性は、解剖中に維持されることが非常に重要です。
- 1回4%低融点(LMP)アガロースの脳を洗ってください。新鮮な4パーセントLMPアガロースの時点で2〜3頭を埋め込みます。さらに可能な限り氷上で埋め込む皿を置きます。アガロースの底部が固化されるまで、脳を持ち上げるためにファイアーポリッシュラウンドチップでパスツールピペットを使用してください。脳には、アガロースブロックの底部に水平フラット位置に落ち着くはず。
- アガロースが完全に(約3分後)固化した後、アガロースは、試料ステージに脳と接着剤アガロースブロック周囲のトリムビブラトームの。ときに接着ブロックが、脳を水平断面でカットする必要があるので、脳の腹側には、プラットフォームに平行であることを確認してください。
3。切片ビブラトーム
- セクショニングのかみそりの刃を使用してください。そのままスライスを得るためには、セクショニング時に4℃で温度を維持するために非常に重要です。
- 50ヘルツの周波数でセクション300μm厚の水平スライス、ブレード1.1mmの振幅および25mm /秒の速度。
- 脳スライスを収集し、滅菌、氷冷1Xクレブスバッファーで皿にそれらを転送するためにミニ穴あきスプーンでスライスをプッシュする微細な絵筆を使用してください。 ( 図1を参照)腹側中脳の組織を含むスライスを選択してください。 E12.5マウスの脳ではドーパミン作動性ニューロンを含む腹側中脳の組織が含まれている一つ300μmの水平スライスがあります。
4。スライスの文化
ステップ4.2から4.5は、無菌条件下で行う必要があります。
- 1 ×クレブスバッファー(ポイント1.2.5を参照)で6ウェルプレートでMillicellの細胞培養膜インサート上の脳切片を移す。スライスを転送するには、ミニ穴あきスプーン(ファイン科学のツール)と微細なブラシを使用してください。最大3スライスが一つの膜上に配置することができます。
- 培地で6ウェルプレートにスライス(ポイント1.2.5を参照)を持つ膜を転送する。膜の上部には、培地によってカバーされるべきではない。脳スライスは上から下と空気から培地を受け取ります。
- 37℃5%CO 2でインキュベーターで6ウェルプレートを配置℃にそれは、スライスが解剖の最初のステップの後2時間以内にインキュベーターに配置されていることを非常に重要です。より拡張された準備時間は、スライスの生存率が低いことになる可能性があります。
- スライスは、3日前までin vitroで維持することができます。第2日目に培地の50%を変更します。
5。タイムラプスイメージング
- タイムラプスイメージングを開始する前に、スライスは4〜5時間インキュベーターにリカバリできます。
- タイムラプスイメージングのために、メンブレンインサート上のスライスを保ち、35ミリメートルIbidiのμ-皿(皿の底は、高い光学的品質を有する材料から構成される)への挿入を移す。
- 皿に培地を1mL加え、1.5μLアスコルビン酸(200 mm)を追加します。アスコルビン酸は、光毒性に対するスライスを保護します。
- 37℃の環境室内のスライスをインキュベート° Cタイムラプスイメージングの間に5%CO2で。
6。代表的な結果
図1は、E12.5マウスの脳から器官切片培養の準備を示しています。 図2は、水平方向の器官型スライス(急性と文化の数日後に)得られるフォームE12.5マウスの脳を示しています。同等の発達段階での比較のために、凍結脳切片示されています。中脳ドーパミン作動性ニューロンは、チロシン水酸化酵素(TH)の免疫組織化学と視覚化されます。中脳ドーパミン作動性ニューロンのプロジェクト前脳内のターゲットに。これらの予測は12.5日で形成し、その後の日中に脳に向かって拡張するために始めます。我々は、培養中のドーパミン作動性ニューロンの正常な開発のための良い指標として脳の突起の発達を考慮してください。水平スライスの中脳ドーパミン作動性ニューロン内の適切な前脳のターゲット領域に向かって突起を延長する。 3 DIV(in vitroでの日数)場合や、前脳の対象領域が損傷された後、異常な突起は背側中脳に向かって延びている。 E12.5中脳の冠状スライスの例を図3に示されています。ドーパミン作動性ニューロンは、THは、背側中脳に異常な突起を拡張するための免疫染色で可視化した。 図4器官切片培養における増殖、壊死とアポトーシス細胞の分析を示しています。 BrdUのIM増殖細胞を可視化するmunostainingは、細胞が1 DIVの後に培養条件下で増殖することを示しています。増殖は4 DIVの後に削減されます。 3 DIVの後、腹側中脳の多くの細胞が壊死(ヨウ化プロピジウム染色)とアポトーシスを(切断されたカスパーゼ3の免疫染色)を行います。 図5は、急性スライスのタイムラプスイメージングの実験に、監視YFP標識ニューロンの回遊経路を示しています。
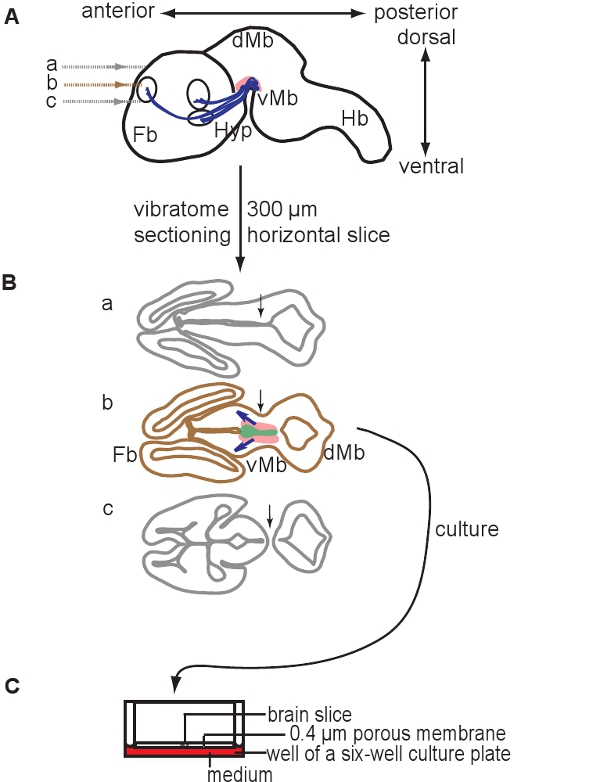
図1。器官切片培養の準備を示す回路図。 300μmの水平方向の脳のスライスをビブラトームを用いてE12.5脳を切片によって調製される。 E12.5マウス脳の(A)の回路図矢ビュー。セクションのレベルが示されます。ドーパミン作動性ニューロンを含む領域がピンク色で描かれている、予測は青色で表示されています。 (B)腹側と股関節に背側から得られる3つのスライスの回路図は、tは前脳(FB)と中脳(Mb)の両方が含まれています。 1つのスライスがドーパミン作動性ニューロン(スライスb)を含むことに注意してください。適切なスライスは、心室の位置と中脳と前脳組織(矢印、セクションAとCとセクションBを比較)の連続性に基づいて識別することができます。ドーパミン作動性ニューロンを含む領域がピンク色で示され、ドーパミンの前駆体を含む領域は、開発の予測を示す緑、青の矢印で描かれている。 (C)ドーパミン作動性ニューロンを含むスライスを膜インサート上で培養される。略語:VMB、腹側中脳、DMB、背側中脳、HYP、視床下部、ヘモグロビン、後脳。
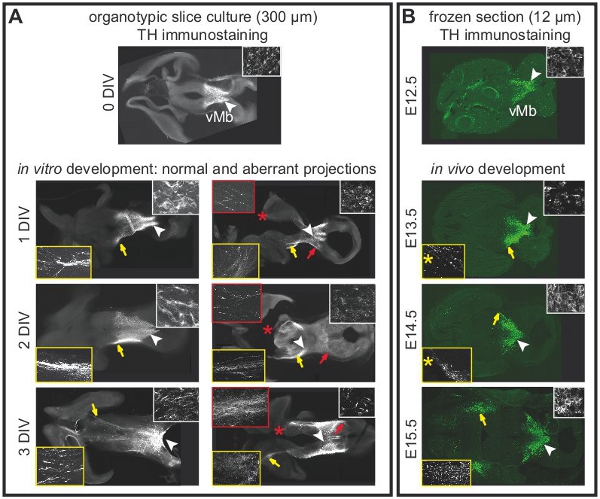
図2。器官切片培養における中脳ドーパミン作動性ニューロンの予測は、前脳の整合性に依存しています。ドーパミン作動性ニューロンを標識するためにチロシンヒドロキシラーゼ(TH)の免疫組織化学。 (A)急性スライス(0 DIV)腹側中脳のドーパミン作動性ニューロンの正常な位置を示している。白い矢印は、はめ込みの高倍率で表示されている領域を示します。前脳への投射は未だ開発されていない。 1 DIVの後、前脳に突起が形成され始める。の予測は2-3 DIVで前脳に拡張する。白い矢印は、インセットの高倍率(白枠)に示すように細胞体の位置を示している。黄色の矢印は、インセットの高倍率(黄色枠)に示すようにそのままのスライスで、通常の予測を強調表示します。異常な予測は、損傷した脳を持つスライスに開発する。赤い矢印は、インセットの高倍率(赤枠)に示すように背側中脳への異常な予測を示している。ダメージは赤いアスタリスクで示されます。 3 DIVの後、ほとんどのスライス(N = 5 / 7)背側中脳に向かって異常な突起を持っていた。 (B)の異なる発生段階において水平凍結脳切片の免疫染色THは、開発を表示するin vivoでのドーパミン作動性投射の。白い矢印は、インセットの高倍率(白枠)に示すように細胞体の位置を示している。黄色の矢印は、インセット(黄色枠)の高倍率に示すように突起の位置を強調表示します。凍結切片のレベルと密接器官切片培養のレベルに合わせて選ばれた。単一の凍結切片(12μm)と全体の器官型スライス(300μm)を表していないことに注意してください。従って、E13.5およびE14.5に示すように、突起が細胞体(黄色のアスタリスク)を含むセクション以外は120μm以上の腹側の節で観察された。
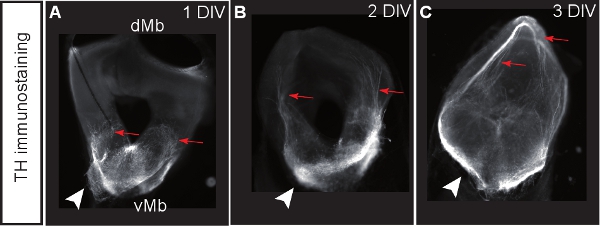
図3。ドーパミン作動性ニューロンのマーカーとしてのチロシンヒドロキシラーゼ(TH)のために染色した中脳冠状切片培養。 1、2または3 DIVの後(AC)のスライス。ドーパミン作動性ニューロンは背側中脳(Rに向かって異常な突起を開発するedの矢印)。矢頭は、ドーパミン作動性細胞体の位置を示しています。
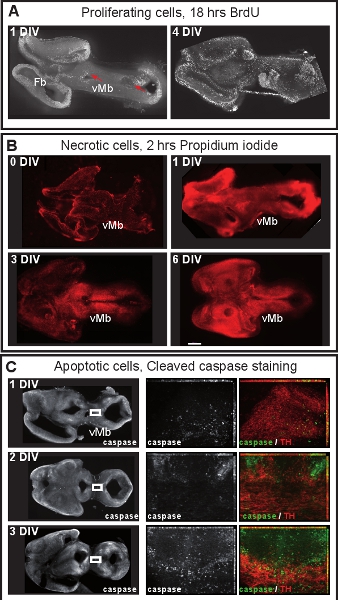
図4中脳器官切片培養における細胞増殖と細胞の生存。 (A)増殖する細胞は、18時間培養液にBrdUを(50 ng / mLの、シグマ)を添加することにより標識したスライスは、その後のBrdUに対する免疫染色を行った。 1 DIVの後、BrdUの標識細胞は心室ゾーン(赤色の矢印)に配置されています。 4 DIVの後、増殖細胞はより多くの散乱であり、別個の脳室帯はもはやメンテナンスされていない。 (B)壊死性細胞は、2時間の培養液にヨウ化プロピジウムの加算(1μg/μL、シグマ)で標識し、蛍光顕微鏡で可視化した。 1 DIVの後、腹側中脳(VMB)は壊死性ではなく、多くのヨウ化プロピジウム標識された細胞は背側中脳と前脳で見ることができます。 3 DIVの後に細胞の生存率は、腹側midbraに減少するインチスケールバー:アポトーシス細胞を可視化するために、切断されたカスパーゼ-3に対するImmunostaingが500μm(C)。 1または2 DIVで、わずかドーパミン作動性ニューロン(TH)がアポトーシスです。 3 DIV後は、ドーパミン作動性ニューロンはアポトーシスを開始します。途中で、右上のパネルは、左のパネルで囲み領域の高倍率です。高倍率の画像を14-16フレームのz -スタックの最大強度の予測です。画像はツァイス線分のセットアップですべての0.5μm程度を採取した。
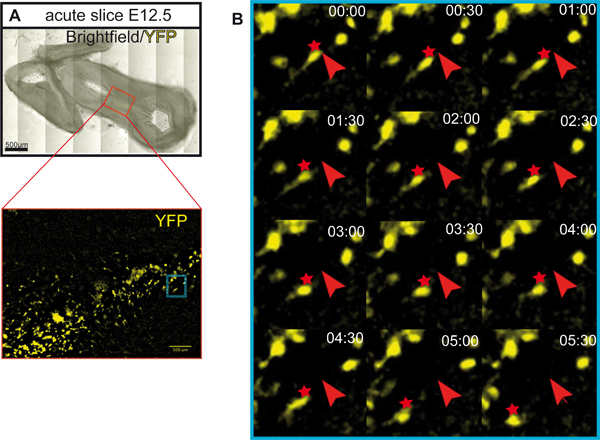
図5。急性スライスにおけるYFP標識ニューロンの遊走経路。 (A) 水平方向のスライスは、YFP標識ニューロンのタイムラプスイメージングに使用する。スライスは、イメージングの前に5時間インキュベートした。細胞は、誘導性のCre / loxP部位システム6を使用して標識した。Shhの CreERマウス 8およびROSA つのloxP - STOP - loxP部位- EYFPのレポーターマウスは9我々再使用する。 ROSAレポーターの対立遺伝子(およびEYFPの発現)の組換えが明示CreER(Shhの発現細胞)が、しかし唯一のタモキシフェン(シグマ)の投与時に細胞内で誘導される。この例では、タモキシフェン(3 mg/40 g体重)はE8.5で妊娠中のマウスに投与した。この実験的な主に腹側中脳10,11におけるドーパミン作動性ニューロンとその子孫の前駆体のラベリングの結果を設定します。スケールバー:500μmである。 (B)急性スライスにYFP標識ニューロンの回遊ルートをトレース。 YFP標識運命マッピングされた神経細胞のタイムラプス画像は5時間の合計時間ツァイスAxioは、オブザーバー顕微鏡(対物EC PlnN 10倍/ 0.3)で30分間毎に30分を取得した。スライスは37℃の環境室(インキュベータXLS1 Pecon)でインキュベートし、撮像中に5%CO 2で供給された。細胞の初期位置は赤い矢印でマークされ、移行の位置は赤いアスタリスクでマークされます。
ディスカッション
ここで紹介する器官のスライス培養法は、胚の腹側中脳のドーパミン作動性ニューロンとそれらの回遊と投影経路の開発の in vitro解析における短期的なシステムを提供する。我々は慎重に腹側中脳ドーパミン作動性ニューロンの正常な発展を可能にするスライスを得るためにに出席されるべきプロトコルの重要なステップの数があることがわかった。最も重要なステップは、高?...
開示事項
我々は、開示することは何もない。
謝辞
我々は器官のスライス培養系とヴォルフガングヒューと原稿の重要な読書のためのLiviuガブリエルBodeaを確立する彼らの助けのためにマルティーヌEmondとイザベルBrachmannに感謝。我々は、ShhのCreERマウスのためのR26レポーターマウスとクリフTabin用フランクコンスタンティーニに感謝します。本研究では、ノルトラインヴェストファーレン州(PROGRAMMツアFörderungルワールRückkehrデwissenschaftlichen Spitzennachwuchses AUS DEM Ausland)の科学研究省から研究賞によって資金を供給された。
資料
特定の試薬と機器の表
| 試薬の名前 | 会社 | カタログ番号 | コメント(省略可能) |
|---|---|---|---|
| DMEM | シグマアルドリッチ | D6429 | |
| グルコース30パーセント | シグマアルドリッチ | G7528 - 250 | |
| ウマ血清 | インビトロジェン | 26050-088 | |
| DMEM(4,5 g / Lのグルコース、L - Glnを、ナトリウムフエンヒローラ、NaHCO 3で) | シグマアルドリッチ | D6429 - 500 | |
| ペニシリン/ストレプトマイシン100倍 | シグマアルドリッチ | P4333 - 20 | |
| L -アスコルビン酸 | シグマアルドリッチ | A4403 | -20℃で200mmの株式や店舗を準備する |
| 超高純度LMPアガロース | インビトロジェン | 15517-022 | |
| Millicelインサート | ミリポア | PICMORG50 | |
| 低μ皿35ミリメートル、 | Ibidi | 80136 | |
| ビブラトーム | Microm | HM 650V | |
| かみそりの刃 | プラノ社 | 121〜6 | |
| Histoacryl接着剤 | BRAU9381104 | ブラウンAesculap | |
| 穴あきスプーン径 直径15ミリメートル | ファイン科学ツール | 10370 -18 | |
| 鉗子5 Dumoxel | ファイン科学ツール | 11252〜30 |
immunostainingsのために使用される抗体。
| 抗体の > 名前 | 会社 | カタログ番号 | コメント(省略可能) |
| ウサギ抗チロシンヒドロキシラーゼ | ミリポア | AB152 | 希釈1:500 |
| マウス抗チロシンヒドロキシラーゼ | ミリポア | MAB318 | 希釈1:500 |
| マウス抗BrdU | BD Pharmingen社 | 555627 | 希釈1:200 |
| ウサギ抗切断型カスパーゼ3 | セルシグナリングテクノロジー | 9661 | 希釈1:200 |
| ロバ抗ウサギIgG -アレクサ488 | インビトロジェン | A21206 | 希釈1:500 |
| ロバ抗マウスIgG - Cy3を | ジャクソンイムノ | 715-165-150 | 希釈1:200 |
参考文献
- Noctor, S. C., Martinez-Cerdeno, V., Ivic, L., Kriegstein, A. R. Cortical neurons arise in symmetric and asymmetric division zones and migrate through specific phases. Nat. Neurosci. 7 (2), 136-136 (2004).
- Martini, F. J. Biased selection of leading process branches mediates chemotaxis during tangential neuronal migration. Development. 136 (1), 41-41 (2009).
- Marin, O., Valiente, M., Ge, X., Tsai, L. H. Guiding neuronal cell migrations. Cold Spring Harb. Perspect. Biol. 2 (2), a001834-a001834 (2010).
- Ayala, R., Shu, T., Tsai, L. H. Trekking across the brain: the journey of neuronal migration. Cell. 128 (1), 29-29 (2007).
- Smidt, M. P., Burbach, J. P. How to make a mesodiencephalic dopaminergic neuron. Nat. Rev. Neurosci. 8 (1), 21-21 (2007).
- Legue, E., Joyner, A. L. Genetic fate mapping using site-specific recombinases. Methods. Enzymol. 477, 153-153 (2010).
- Daza, R. A., Englund, C., Hevner, R. F. Organotypic slice culture of embryonic brain tissue. CSH Protoc. , (2007).
- Harfe, B. D. Evidence for an expansion-based temporal Shh gradient in specifying vertebrate digit identities. Cell. 118 (4), 517-517 (2004).
- Srinivas, S. Cre reporter strains produced by targeted insertion of EYFP and ECFP into the ROSA26 locus. BMC Dev. Biol. 1, 4-4 (2001).
- Joksimovic, M. Spatiotemporally separable Shh domains in the midbrain define distinct dopaminergic progenitor pools. Proc. Natl. Acad. Sci. U. S. A. 106 (45), 19185-19185 (2009).
- Blaess, S. Temporal-spatial changes in Sonic Hedgehog expression and signaling reveal different potentials of ventral mesencephalic progenitors to populate distinct ventral midbrain nuclei. Neural. Dev. 6 (1), 29-29 (2011).
- Hippenmeyer, S. A developmental switch in the response of DRG neurons to ETS transcription factor signaling. PLoS Biol. 3 (5), e159-e159 (2005).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved