需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
使用超声波血脑屏障破坏和锰增强MRI的脑功能成像
摘要
一个被描述为广泛的开放血脑屏障在鼠标使用微泡和超声技术。使用这种技术,锰,可管理的鼠脑。因为锰是一个磁共振造影剂,在去极化神经元的积累,这种方法能够使神经元的活动影像。
摘要
虽然老鼠是主导的模型系统,为研究神经科学,脑功能成像在小鼠遗传和分子基础仍然是技术上的挑战。一种方法,激活诱导锰增强磁共振成像(MRI检查目的),已成功地用于映射在啮齿类动物的神经元活动1-5。在AIM MRI,锰2 +作用钙模拟,并在6,7去极化神经元累积。由于锰2 +缩短的T 1组织的财产,升高的神经元活动的地区,将加强在MRI。此外,锰2 +清除慢慢从活化地区,因此,可以进行刺激之前成像磁铁外,从而提高实验的灵活性。然而,因为锰2 +不容易穿过血脑屏障(BBB)的,需要打开血脑屏障限制使用的AIM MRI,尤其是在小鼠。
开放血脑屏障的工具之一是ULTrasound。虽然潜在的破坏性,如果超声结合管理与充气微泡(即超声造影剂),血脑屏障开放所需的声压是相当低的。可以使用这种超声和微泡的结合,可靠地打开,而不会造成组织损伤8-11血脑屏障。
在这里,一种方法是执行旨在利用微气泡和超声波打开血脑屏障的MRI。静脉注射perflutren微泡后,重点不突出的脉冲超声波束被剃光鼠标头3分钟。为简单起见,我们称这BBB的开放的技术与微泡和超声BOMUS 12。使用BOMUS打开整个血脑屏障的两个大脑半球,锰是管理整个鼠脑。轻轻镇静小鼠的实验刺激后,AIM MRI是用来映射神经反应。
至证明这种方法,本BOMUS和AIM MRI用于映射单方面的触须轻轻镇静小鼠13机械刺激。因为BOMUS可以打开整个两半球血脑屏障,无刺激大脑的一侧是用来控制背景非特异性刺激。由此产生的3D激活地图同意的桶领域皮质14的触须地区出版的申述。在超声开放血脑屏障的是快速,非侵入性的,可逆的,因此这种方法是适用于高吞吐量和/或纵向研究在清醒小鼠。
研究方案
1。组装和校准超声诊断系统
- 直径宽,足以覆盖的小鼠大脑和中心频率在2 MHz的范围内与单元素的超声换能器的超声系统开始。传感器是由50分贝功率的放大器,它是连接到一个信号发生器产生超声波脉冲序列。
- 要校准的超声波系统的声压,使用与施加电压产生的声压水听器。传感器放置在一个以上的水听器的水箱。申请一个简单的脉冲(例如,换能器的频率在10周期与脉冲重复频率为10赫兹的正弦波)的传感器。使用一个3轴的翻译阶段找到峰值响应,这应该是在传感器的自然疫源地(约60毫米13毫米直径的2.15兆赫传感器)超声波束的中心。
- 使多次测量过响E的输入电压(例如, 页 50-400毫伏),以验证系统的线性。用一个简单的线性回归估计输入电压,声压之间的关系。在我们的系统,258和167 mV峰峰值输入电压的峰值负声压为0.52和0.36兆帕。
- 节目的信号发生器产生超声波脉冲序列组成的阵阵正弦脉冲换能器的频率在50000周期每爆裂和64毫秒的突发期。校准测量的基础上,设置脉冲幅度产生峰值负声压传感器的自然疫源地的中心,在0.36兆帕。
2。准备试剂
- 四水氯化锰(MnCl 2·4H 2 O)溶于无菌水,浓度在100毫米(300 mOsM)和过滤消毒。
- 产生由“activatin的perflutren脂质微球G“小瓶天的实验。在45秒的制造商提供的搅拌器,一个单一的小瓶可以被激活一次在一天的开始,没有休息一天激活使用。
- 紧接微管理,搅拌1分钟悬浮微手工小瓶。退出微气泡从小瓶时,不室内空气注入小瓶,因为这降低了剩余的微气泡。离开小瓶,直到最后一天的使用,然后存放在冰箱。一个单一的小瓶保持这种方式,可以持续数天。重新激活存储在搅拌器小瓶,在随后的日子里第一次使用前。
3。动物的制备
- 异氟醚麻醉的动物,鼻锥交付。鼻锥装置的设计应固定在同一位置,每次动物的头,准确和可靠。我们的设备15头保持在日E“头骨扁平化”的立场(即背侧颅骨表面是水平的)Paxinos脑图谱16。滴定麻醉维持85至125每分钟呼吸的呼吸频率。维持体温,用热灯或吹空调。保护润滑剂眼睛。
- 取下的从鼠标头皮的头发用电动微调。
- 将尾静脉导管及腹腔内(IP)的导管。为生存而研究,一定要使用适当的无菌技术; IP导管放置在这篇文章中的视频显示,仅适用于非生存实验是适当的。
- 使神经刺激实验所需的任何额外的准备。为每桶领域皮质触须刺激的映射,使用解剖显微镜和显微剪刀削减触须尽可能接近皮肤表面的毛囊或周围的皮肤无刺激性。
- 地方上的超声凝胶头皮,然后降低水载列头(例如,7.6微米的垃圾桶内胆)薄薄的塑料片上。达到水用棉签拭子列通过推得到任何空气被困气泡在超声凝胶。放置在其自然的焦距(58毫米)的超声换能器直接在老鼠大脑中的水柱,并用指尖擦拭传感器,以消除任何气泡。
4。血脑屏障与微泡和超音波(BOMUS)开幕
- 锰剂量为0.5 mmol /公斤的IP解决方案给予腹腔注射。例腹腔导管,所以锰不流了出来,并等待10分钟,以允许它来分发( 图1)。
- 要打开血脑屏障,管理30μLperflutren脂质微球(激活的DEFINITY),通过尾静脉导管,同时,启动超声脉冲序列。 Çontinue insonification 3分钟。
5。神经刺激
- 允许约40分钟脑水平的Mn 2 +稳定前开始神经刺激。在这种方式中,由于锰戏剧性的基线增强+跨越血脑屏障的扩散可以区别于微妙差增强,由于刺激。然后,开始与您选择的范例( 图1)的刺激。
- 触须的刺激,关闭异氟醚和清除鼻锥。在距离皮肤约2-5毫米的触须阵列通过手动移动软艺术家的画笔,在圆周运动(1-5赫兹)。继续刺激90分钟。锰有镇静的效果,让奔放的刺激的动物。如果动物变得焦躁不安,管理5%,约15秒钟,异氟醚经鼻锥。
6。的MagnetiC谐振成像
- 刺激后,通过鼻锥恢复麻醉。继续保持体温和滴定异氟醚的水平到85至125每分钟呼吸的呼吸频率。
- 磁共振成像线圈放置在鼠标和转移的磁共振成像系统。采集高分辨率三维T 1加权磁共振图像。例如,使用三维扰相梯度回波(SPGR)序列的回顾与下列参数:重复时间为25 ms;回声时间为2 ms,翻转角30度; 15.63 kHz的带宽;鉴于20×20场× 12毫米; 128×128×60的矩阵。
7。图像分析
- 图像分析是特定于所使用的刺激范式。为触须刺激实验( 图2),从一些动物导入到一个合适的分析环境的图像。如果某些动物的刺激,而其他人则在左侧,FL刺激右侧IP部分,所有图像都有效的“左刺激。”然后,比较每个大脑的刺激侧对侧无刺激侧,创建一个复制和镜像左,无刺激,创建图片集。注册所有图片到一个共同的空间,然后一个3×3×3像素高斯核平滑。
- 数学分析环境,如MATLAB,数据导出。另外,面膜中的数据集不相关的解剖。强度正常化等 Venot迭代法的图像。17,18。
- 使用配对,单尾t检验比较每个大脑刺激时双方对每个大脑的刺激双方的每个像素对侧相应的像素。
- 显示的结果p值的地图,以确定地区差活动( 图3)。
8。代表结果
这里介绍的方法有两个基金 amental步骤:(1)血脑屏障开放与微泡和超声(BOMUS)和(2)激活诱导的锰增强磁共振成像“(AIM的MRI)。因为前者取决于后者的一步,它是重要的,以验证成功实施BOMUS的。
破坏的血脑屏障给药后的T缩短在对T的信号在脑实质增加1加权成像造影剂(如锰或钆基剂)结果相比,大脑这BOMUS未执行( 图4)。这锰增强的分布是不完全一致,虽然它与动物之间是相当一致的。分布反映血脑屏障开放的唯一的不均匀性,而且是内在的非均匀分布锰大脑内的19。血脑屏障开放的空间和时间的动力已经进一步说明12。
耳鼻喉科“>,一旦BOMUS已成功实施,下一步就是执行目的的MRI许多实验范式是可能的。然而,因为有许多潜在的困惑,控制和分析,必须精心设计的影响因子包括不均匀的血脑屏障开放,不均匀积累锰在大脑中,锰扩散的时空动态,非特异性神经元的活动。在这个演示中,触须单方面刺激神经反应映射。要考虑的不均匀性和锰通量,无刺激的侧各脑被用来作为内部控制。要占到非特异性神经元的活动可能会有所不同动物之间,分析,统计测试,以确定是一贯的动物( 图2)之间的不同的地区,结果差异的三维地图和三维p值图( 图3),其中显示区域的右侧对侧刺激触须更高的信号。在地图的左侧,表明该地区有显着较高的信号刺激触须同侧。 p值的地图确定的高架信号对侧刺激触须相当于初级感觉皮层,其响应触须刺激电20,21和2 -脱氧葡萄糖的研究已被广泛记录的每桶领域的广泛地区。一个更完整的讨论,这些结果已经公布以前13。
图1。协议的时间表与BOMUS和AIM MRI(,摘自Howles 等 13),脑功能成像。
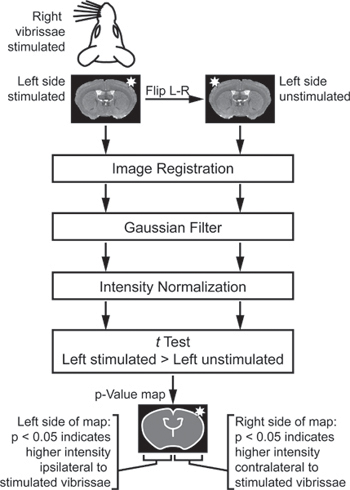
图2。识别地区Ø分析计划f每个大脑的刺激和未刺激双方之间的不同强度。来比较每个大脑的刺激侧对侧无刺激侧,重复和镜像左,无刺激,创建图片集。这些图像登记,筛选,和规范化。最后,比较在测试图像左侧的刺激和左无刺激。 t检验是“配对”,使每个大脑的刺激侧相同的大脑相比,无刺激侧。 t检验是“单尾”,这样一个P-值图的边表示对大脑的刺激侧的信号明显较高,而p值映射对方表示无刺激侧的信号明显更高大脑(改编自Howles 等 。13)。
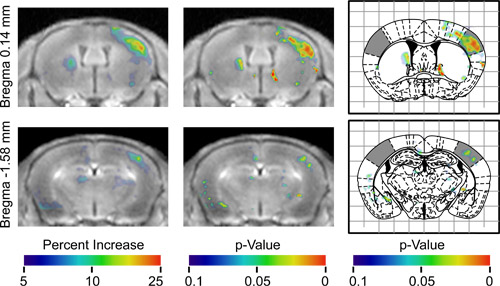
图3。汇集7只动物在两个不同的轴向位置的分析结果。 ţ他的第一列显示对齐所有注册图像的均值,所有小鼠,以便有效地刺激了他们的左边触须。这些图像与彩色地图显示信号的平均水平,在每个像素相对增加对侧覆盖,彩条。彩色图像的右侧区域显示刺激对侧半球有更高的信号。彩色图像的左侧区域显示刺激同侧半球有更高的信号。第二列显示的p值指示信号增加的统计意义的地图覆盖相同的图像。第三列显示了同样的p值的地图覆盖Paxinos立体定向图谱16与阴影(,摘自Howles 等 13)的感觉皮层每桶领域的相应数字。
/ 4055/4055fig4.jpg“/>
图4。的Mn 2 +在大脑中的分布。图像被收购后为0.5 mmol /公斤的IP MnCl 2 170分钟,从BOMUS治疗组(n = 5)和对照组(n = 4)小鼠。正常化后,意味着和计算标准偏差图(左图)。增强更大的BOMUS治疗的小鼠。虽然这增强了整个大脑的统一,这是相当一致的,除了附近的大脑和心室的边缘。使用感兴趣区域(ROI),围绕各种结构绘制,平均信噪比(+ 1个SD)计算在每个组(右图)。处理BOMUS,动物表现出更大的信噪比,但也有更大的结构与动物之间的差异(,摘自Howles 等 13)。
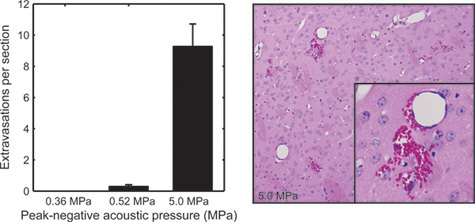
图5。审查的BOMUS组织的影响,从BOMUS治疗小鼠的大脑是固定的,本身ctioned在500 - 微米的间隔,苏木精伊红染色。声压0.36兆帕(N = 3),0.52兆帕(4例),5.0兆帕(N = 1)所示的红细胞外渗看到在大脑各部分的平均数。错误条显示标准错误。第二个面板显示从暴露到5.0兆帕(改编从Howles 等 。12)大脑严重的红血细胞外渗的例子。
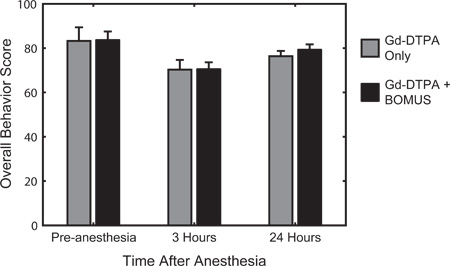
图6。行为的定量测试是用于麻醉前评估活动,觉醒,和响应,3小时和24小时后从麻醉中复苏。评分系统,前面所述12日 ,是基于行之有效的定量鼠标行为评估的发展在1968年22欧文。平均行为(±标准差)的得分(N = 3)为控制和BOMUS(0.36兆帕)处理(N = 8)动物所示。相对于麻醉前的基线,所有的动物行为3小时后,麻醉得分下降,但它们在很大程度上恢复的第二天。在每个时间点,两组之间无明显差异,这表明,的BOMUS没有可测量的影响动物的行为(改编自等人 Howles。,12)。
Access restricted. Please log in or start a trial to view this content.
讨论
在这里,一个方法是为无创性开放血脑屏障贯穿整个鼠脑超声和微泡(BOMUS)。随着BBB开放,锰2 +管理和激活诱导锰增强磁共振成像(MRI检查目的)被用来形象短时间刺激在轻轻镇静小鼠的神经元反应。
取得足够的血脑屏障开放与负峰值声压为0.36兆帕。请注意,这是在超声束的中心在头皮表面的压力。单元素的传感器的光束轮廓的测量表明,在光束边缘的声压是...
Access restricted. Please log in or start a trial to view this content.
披露声明
没有利益冲突的声明。
致谢
所有工作是在公爵在体内显微镜中心,美国国立卫生研究院/ NIBIB 国家生物医学技术资源中心(P41 EB015897)和国家癌症研究所的小动物成像资源计划(U24 CA092656)。 NSF研究生研究奖学金(2003014921),提供额外的支持。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 试剂名称 | 公司 | 目录编号 | 评论 |
| 水听器 | 索诺拉州医疗系统,朗蒙特,CA | 四至-251的SN | |
| 翻译阶段 | Newport公司,加利福尼亚州欧文 | ||
| 超声换能器 | 奥林巴斯公司,无损检测,沃尔瑟姆马 | A306S-SU | 回顾伴随传感器找到确切的中心频率,特别是传感器,对目录中所列的标称频率可能不同于制造商的测试表。 (例如,我们的传感器的标称频率为2.25 MHz的,但实际的中心频率为2.15 MHz的。) |
| VEVO影像站 | VisualSonics,Inc。加拿大多伦多 | ; | |
| 50 dB的功率放大器 | E和我,纽约州罗切斯特市 | 模型240L | |
| 信号发生器 | 安捷伦科技公司,加利福尼亚州圣克拉拉 | 型号33220A | |
| MnCl 2 - (H2O)4 | 西格玛 | 分子量不同批次,要求制造商精确测量 | |
| perflutren脂微 | 马北比尔里卡,医学影像,lantheus | DEFINITY的 | |
| 微搅拌器 | 马北比尔里卡,医学影像,lantheus | VIALMIX | |
| 磁共振成像线圈 | M2M影像公司,Hillcrest的,OH | 35毫米直径的正交传输/接收量线圈 | |
| 磁共振成像系统 | GE医疗,MilwaukeE,WI | GE EXCITE控制台的操作7-T的水平孔磁铁 | |
| 图像分析环境 | 面相影像,加利福尼亚州圣迭戈,MathWorks公司,Natick市马 | 阿米拉的MATLAB |
参考文献
- Aoki, I. Detection of the anoxic depolarization of focal ischemia using manganese-enhanced MRI. Magnet. Reson. Med. 50, 7-12 (2003).
- Aoki, I. Dynamic activity-induced manganese-dependent contrast magnetic resonance imaging. DAIM MRI). Magnet. Reson. Med. 48, 927-933 (2002).
- Duong, T. Q., Silva, A. C., Lee, S. P., Kim, S. G. Functional MRI of calcium-dependent synaptic activity: Cross correlation with CBF and BOLD measurements. Magnet. Reson. Med. 43, 383-392 (2000).
- Lin, Y. J., Koretsky, A. P. Manganese ion enhances T-1-weighted MRI during brain activation: An approach to direct imaging of brain function. Magnet. Reson. Med. 38, 378-388 (1997).
- Lu, H. B. Cocaine-induced brain activation detected by dynamic manganese-enhanced magnetic resonance imaging (MEMRI). P. Natl. Acad. Sci. U.S.A. 104, 2489-2494 (2007).
- Drapeau, P., Nachshen, D. A. Manganese fluxes and manganese-dependent neurotransmitter release in presynaptic nerve-endings isolated from rat-brain. J. Physiol-London. 348, 493-510 (1984).
- Narita, K., Kawasaki, F., Kita, H. Mn and Mg influxes through Ca channels of motor-nerve Terminals are prevented by verapamil in Frogs. Brain Res. 510, 289-295 (1990).
- Hynynen, K., McDannold, N., Vykhodtseva, N., Jolesz, F. A. Noninvasive MR imaging-guided focal opening of the blood-brain barrier in rabbits. Radiology. 220, 640-644 (2001).
- Sheikov, N., McDannold, N., Vykhodtseva, N., Jolesz, F., Hynynen, K. Cellular mechanisms of the blood-brain barrier opening induced by ultrasound in presence of microbubbles. Ultrasound Med. Biol. 30, 979-989 (2004).
- McDannold, N., Vykhodtseva, N., Raymond, S., Jolesz, F. A., Hynynen, K. MRI-guided targeted blood-brain barrier disruption with focused ultrasound: Histological findings in rabbits. Ultrasound Med. Biol. 31, 1527-1537 (2005).
- McDannold, N., Vykhodtseva, N., Hynynen, K. Targeted disruption of the blood-brain barrier with focused ultrasound: association with cavitation activity. Phys. Med. Biol. 51, 793-807 (2006).
- Howles, G. P. Contrast-enhanced in vivo magnetic resonance microscopy of the mouse brain enabled by noninvasive opening of the blood-brain barrier with ultrasound. Magnet. Reson. Med. 64, 995-1004 (2010).
- Howles, G. P., Qi, Y., Johnson, G. A. Ultrasonic disruption of the blood-brain barrier enables in vivo functional mapping of the mouse barrel field cortex with manganese-enhanced MRI. Neuroimage. 50, 1464-1471 (2010).
- Woolsey, T. A., Welker, C., Schwartz, R. H. Comparative anatomical studies of sml face cortex with special reference to occurrence of barrels in layer-4. J. Comp. Neurol. 164, 79-94 (1975).
- Howles, G. P., Nouls, J. C., Qi, Y., Johnson, G. A. Rapid production of specialized animal handling devices using computer-aided design and solid freeform fabrication. J. Magnet. Reson. Imag. 30, 466-471 (2009).
- Paxinos, G., Franklin, K. B. J. The mouse brain in stereotaxic coordinates. , 2nd edn, Academic Press. (2001).
- Cross, D. J. Statistical mapping of functional olfactory connections of the rat brain in vivo. Neuroimage. 23, 1326-1335 (2004).
- Venot, A., Lebruchec, J. F., Golmard, J. L., Roucayrol, J. C. An automated-method for the normalization of scintigraphic images. J. Nucl. Med. 24, 529-531 (1983).
- Aoki, I., Naruse, S., Tanaka, C. Manganese-enhanced magnetic resonance imaging (MEMRI) of brain activity and applications to early detection of brain ischemia. Nmr. Biomed. 17, 569-580 (2004).
- Welker, E., Vanderloos, H. Quantitative correlation between barrel-field size and the sensory innervation of the whiskerpad - a comparative-study in 6 strains of mice bred for different patterns of mystacial vibrissae. J. Neurosci. 6, 3355-3373 (1986).
- McCasland, J. S., Woolsey, T. A. High-resolution 2-deoxyglucose mapping of functional cortical columns in mouse barrel cortex. J. Comp. Neurol. 278, 555-569 (1988).
- Irwin, S. Comprehensive observational assessment : A systematic quantitative procedure for assessing behavioral and physiologic state of mouse. Psychopharmacologia. 13, 222-257 (1968).
- Choi, J. J., Pernot, M., Small, S. A., Konofagou, E. E. Noninvasive, transcranial and localized opening of the blood-brain barrier using focused ultrasound in mice. Ultrasound Med. Biol. 33, 95-104 (2007).
- McDannold, N., Vykhodtseva, N., Hynynen, K. Use of ultrasound pulses combined with definity for targeted blood-brain barrier disruption: A feasibility study. Ultrasound Med. Biol. 33, 584-590 (2007).
- Silva, A. C., Lee, J. H., Aoki, L., Koretsky, A. R. Manganese-enhanced magnetic resonance imaging (MEMRI): methodological and practical considerations. Nmr. Biomed. 17, 532-543 (2004).
- Meiri, U., Rahamimoff, R. Neuromuscular transmission - inhibition by manganese ions. Science. 176, 308(1972).
- Aschner, M., Guilarte, T. R., Schneider, J. S., Zheng, W. Manganese: Recent advances in understanding its transport and neurotoxicity. Toxicol. Appl. Pharm. 221, 131-147 (2007).
- Watanabe, T., Frahm, J., Michaelis, T. Manganese-enhanced MRI of the mouse auditory pathway. Magnet. Reson. Med. 60, 210-212 (2008).
- Yu, X., Wadghiri, Y. Z., Sanes, D. H., Turnbull, D. H. In vivo auditory brain mapping in mice with Mn-enhanced MRI. Nat. Neurosci. 8, 961-968 (2005).
- Yu, X. Statistical mapping of sound-evoked activity in the mouse auditory midbrain using Mn-enhanced MRI. Neuroimage. 39, 223-230 (2008).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。