Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Neuroimagen Funcional Utilizando ultrasonidos hematoencefálica perturbación de la barrera y la RM-manganeso mayor
En este artículo
Resumen
Una técnica se describe en términos generales para la apertura de la barrera sangre-cerebro en el ratón utilizando microburbujas y ultrasonido. Usando esta técnica, el manganeso se puede administrar al cerebro del ratón. Debido a que el manganeso es un agente de contraste de MRI que se acumula en las neuronas despolarizadas, este enfoque permite imágenes de la actividad neuronal.
Resumen
Aunque los ratones son el sistema de modelo dominante para el estudio de las bases genéticas y moleculares de la neurociencia, la neuroimagen funcional en ratones sigue siendo un reto técnico. Uno de los enfoques, la activación inducida por el manganeso potenciado por resonancia magnética (MRI AIM), ha sido utilizado con éxito para mapear la actividad neuronal en roedores 1-5. En AIM resonancia magnética, Mn 2 + actúa como un análogo de calcio y se acumula en las neuronas despolarizadas 6,7. Debido a Mn 2 + se acorta la T 1 propiedad del tejido, las regiones de la actividad neuronal elevada mejorará en la RM. Además, Mn 2 + borra lentamente desde las regiones activadas, por lo tanto, la estimulación puede realizarse fuera del imán antes de la imagen, permitiendo una mayor flexibilidad experimental. Sin embargo, debido a Mn 2 + no atraviesa fácilmente la barrera hematoencefálica (BBB), la necesidad de abrir el BBB ha limitado el uso de resonancia magnética de AIM, sobre todo en los ratones.
Una herramienta para la apertura de la BBB es ULTrasound. Aunque potencialmente perjudicial, si el ultrasonido se administra en combinación con microburbujas llenas de gas (es decir, los agentes de contraste por ultrasonidos), la presión acústica requerida para la apertura BBB es considerablemente menor. Esta combinación de ultrasonidos y microburbujas puede ser utilizada para abrir de forma fiable la BBB sin causar daño a los tejidos 8-11.
Aquí, se presenta un método para la realización de AIM resonancia magnética mediante el uso de microburbujas y ultrasonido para abrir la barrera hematoencefálica. Después de una inyección intravenosa de microburbujas perflutren, un haz desenfocado ultrasonido pulsado se aplica a la cabeza del ratón afeitado durante 3 minutos. Para simplificar, nos referimos a esta técnica de Apertura BBB con microburbujas y ultrasonido como BOMUS 12. Usando BOMUS para abrir la BBB lo largo de ambos hemisferios cerebrales, manganeso se administra al cerebro de ratón conjunto. Después de la estimulación experimental de los ratones ligeramente sedado, AIM resonancia magnética se utiliza para asignar la respuesta neuronal.
ADemostramos este enfoque, en este documento y la RM BOMUS AIM se utilizan para asignar estimulación unilateral mecánica de las vibrisas en ratones ligeramente sedado 13. Debido BOMUS puede abrir la BBB lo largo de ambos hemisferios, el lado no estimulada del cerebro se utiliza para controlar para la estimulación de fondo no específica. El mapa resultante de la activación 3D está de acuerdo también con las representaciones de las regiones publicados vibrisas del campo de la corteza barril de 14. La apertura de ultrasonidos de la BBB es rápido, no invasivo y reversible, y por lo tanto este enfoque es adecuado para los estudios de alto rendimiento y / o longitudinales en ratones despiertos.
Protocolo
1. Montar y calibrar el sistema ultrasonido
- El sistema de ultrasonidos se inicia con un transductor de ultrasonidos de un solo elemento con un diámetro lo suficientemente amplia como para cubrir el cerebro de ratón y una frecuencia central en el intervalo de 2 Mhz. El transductor es impulsado por un amplificador 50-dB de potencia, que está conectada a un generador de señal que produce la secuencia de pulsos de ultrasonido.
- Para calibrar la presión acústica del sistema de ultrasonidos, utiliza un hidrófono para relacionar el voltaje aplicado a la presión acústica resultante. Coloque el transductor en un tanque de agua sobre el hidrófono. Aplicar un pulso simple (por ejemplo, una sinusoide 10-ciclo a la frecuencia del transductor con una frecuencia de repetición de impulsos de 10 Hz) para el transductor. Utilice una etapa de traducción de 3 ejes para encontrar la respuesta del pico, el cual debe estar en el centro del haz de ultrasonidos en el foco natural del transductor (aproximadamente 60 mm para nuestra transductor 13 mm de diámetro MHz 2,15).
- Tome varias medidas más de un sonare de tensiones de entrada (por ejemplo, 50-400 mV pp) para verificar la linealidad del sistema. Utilizar una regresión lineal simple para estimar la relación entre la tensión de entrada y la presión acústica. En nuestro sistema, los voltajes de entrada de 258 y 167 mV pp correspondía a pico negativas presiones acústicas de 0,52 y 0,36 MPa.
- Programa el generador de señales para producir una secuencia de pulsos de ultrasonido que consta de ráfagas de impulsos sinusoidales en la frecuencia del transductor con 50000 ciclos por explosión y un período de ráfaga de 64 ms. En base a las mediciones de calibración, ajustar la amplitud del pulso para generar pico negativas presiones acústicas de 0,36 MPa en el centro del foco natural del transductor.
2. Preparar los reactivos
- Disolver cloruro de manganeso tetrahidratado (MnCl 2 .4 H 2 O) en agua estéril a una concentración de 100 mM (300 mOsm) y el filtro de esterilizar.
- Producir el lípido perflutren microesferas "activating "el vial en el agitador suministrado por el fabricante durante 45 s. Para un día de experimentos, un solo vial puede ser activado una vez al comienzo del día y utilizado sin reactivación para el resto del día.
- Inmediatamente antes de la administración de microesferas, agitar el vial con la mano durante 1 minuto para volver a suspender las microesferas. Al retirar microburbujas del vial, no se inyecte aire ambiente en el vial, ya que esto degrada las microburbujas restantes. Deje el vial hasta que el último uso de la jornada, a continuación, guárdelo en el refrigerador. Mantenida de esta manera, un solo vial puede durar varios días. Re-activar el vial almacenado en el agitador, antes de la primera utilización en los días siguientes.
3. Preparación de Animales
- Se anestesia a los animales con isoflurano, entregado por cono de la nariz. El aparato de cono de la nariz debe estar diseñado para fijar la cabeza del animal precisa y fiable en la misma posición cada vez. Nuestro equipo mantiene 15 º en la cabezae "cráneo-plano" la posición (es decir, la superficie del cráneo dorsal es horizontal) utilizado en el atlas de Paxinos cerebral 16. Valorar la anestesia para mantener una frecuencia respiratoria entre 85 y 125 respiraciones por minuto. Mantenga la temperatura del cuerpo, utilizando una lámpara de calor o de aire soplado. Proteger los ojos con el lubricante.
- Retire el cabello del cuero cabelludo del ratón utilizando una cortadora eléctrica.
- Colocar un catéter vena de la cola y un catéter intraperitoneal (IP). Para los estudios de supervivencia, asegúrese de usar una técnica estéril apropiada; la colocación del catéter IP se muestra en el video de este artículo es apropiada sólo para experimentaciones sin supervivencia.
- Haga los preparativos adicionales necesarios para el experimento de estimulación neuronal. Por mapeo de la estimulación de la corteza vibrisas campo barril, utiliza un microscopio de disección y tijeras de microcirugía para cortar el vibrisas lo más cerca posible a la superficie de la piel sin irritar el folículo o piel circundante.
- Coloque el gel de ultrasonido en elcuero cabelludo y, a continuación inferior una columna de agua contenida por una lámina delgada de plástico (por ejemplo, un 7,6 micras basura bolsa de basura) en el cabezal. Acceda a través de la columna de agua con un hisopo con punta de algodón para expulsar las burbujas de aire que quedan atrapadas en el gel de ultrasonido. Coloque el transductor de ultrasonido a su distancia focal natural (58 mm) directamente sobre el cerebro del ratón en la columna de agua y limpie el transductor con la punta del dedo para eliminar las burbujas de aire atrapadas.
4. Barrera hematoencefálica con microburbujas de apertura y de sonido Ultra (BOMUS)
- Dale una inyección intraperitoneal de la solución de manganeso a una dosis de 0,5 mmol / kg IP. Se tapa el catéter intraperitoneal de modo que el manganeso no fluye hacia fuera, y esperar 10 minutos para permitir que se distribuya (Figura 1).
- Para abrir la BBB, administrar 30 l de lípidos perflutrén microesferas (DEFINITY activado) a través del catéter vena de la cola, y simultáneamente, iniciar la secuencia de pulsos de ultrasonido. Cigan insonification durante 3 minutos.
5. La estimulación neuronal
- Deje aproximadamente 40 minutos para los niveles cerebrales de Mn 2 + para estabilizar antes de comenzar la estimulación neuronal. De esta manera, la mejora dramática de referencia debido a Mn 2 + difusión a través de la BBB se puede distinguir de la mejora diferencial sutil debido a la estimulación. A continuación, comenzar la estimulación con su paradigma de elección (Figura 1).
- Para la estimulación de vibrisas, apague el isoflurano y quitar el cono de la nariz. Mover un pincel suave artista manualmente en un movimiento circular (1-5 Hz) a través de la matriz vibrisas a una distancia de aproximadamente 2-5 mm de la piel. Continúe la estimulación durante 90 minutos. El manganeso tiene un efecto sedante que permite la estimulación incontrolada del animal. Si el animal se pone inquieto, administrar 5% de isoflurano a través de cono de la nariz durante 15 segundos aproximadamente.
6. Magnetic Resonancia
- Después de la estimulación, reanudar la anestesia a través de cono de la nariz. Continuar manteniendo la temperatura corporal y el nivel de titulación de isoflurano a una frecuencia respiratoria de 85 a 125 respiraciones por minuto.
- Coloque el ratón en una bobina de la RM y la transferencia al sistema de resonancia magnética. Adquirir 3D de alta resolución en T1 imágenes de RM. Por ejemplo, use un gradiente 3D malcriado recordó eco (SPGR) de secuencia con los siguientes parámetros: tiempo de repetición de 25 ms, el tiempo de eco de 2 ms, ángulo de inclinación de 30 grados, ancho de banda de 15,63 kHz; campo de visión de 20 × 20 × 12 mm; matriz de 128 x 128 x 60.
7. Análisis de Imagen
- Análisis de la imagen es específica para el paradigma estimulación utilizado. Para el experimento de estimulación vibrisas (Figura 2), importar las imágenes de varios animales en un entorno de análisis adecuado. Si algunos animales se estimularon a la derecha, mientras que otros se estimularon a la izquierda, FLip alguna manera que todas las imágenes son efectivamente "a la izquierda-estimulado." Entonces, para comparar el lado estimulado de cada cerebro a su lado contralateral no estimulada, crear un duplicado y reflejado a la izquierda-no estimulada conjunto de imágenes se crea. Registro de todas las imágenes a un espacio común y luego suavizar con un 3 × 3 × 3 píxeles kernel gaussiano.
- Exportar los datos a un entorno de análisis matemático, como MATLAB. Opcionalmente, enmascarar la anatomía pertinente en las bases de datos. De intensidad normalizar las imágenes por el método iterativo de Venot et al. 17,18.
- Use un dos a dos, de una sola cola de pruebas t para comparar cada voxel de los lados de cada cerebro estimulado a la contralateral voxel correspondiente a los lados no estimulados de cada cerebro.
- Muestra el valor de p resultante mapa para identificar las regiones de actividad diferencial (Figura 3).
8. Los resultados representativos
El método que aquí se presenta tiene dos fondos amental medidas: (1) apertura BBB con microburbujas y ultrasonido (BOMUS) y (2) la activación inducida por el manganeso potenciado por resonancia magnética (MRI AIM). Debido a que el último paso depende del primero, es importante verificar BOMUS exitosos de implementación.
La interrupción de la barrera sangre-cerebro después de la administración de una T 1-acortamiento agente de contraste (tales como manganeso o un agente de gadolinio) se traduce en un aumento de la señal en el parénquima cerebral en T 1-imagen ponderada en comparación con los cerebros en la que BOMUS no se realizó (Figura 4). La distribución de esta mejora de manganeso no es completamente uniforme, aunque es bastante constante entre los animales. La distribución refleja no sólo falta de homogeneidad en la abertura de BBB, pero también es la intrínseca distribución no uniforme de Mn en el cerebro 19. La dinámica espacial y temporal de la apertura de BBB se han descrito anteriormente más 12.
ent "> Una vez BOMUS ha sido implementado con éxito, el siguiente paso es llevar a cabo AIM RM Muchos paradigmas experimentales son posibles.. Sin embargo, debido a que hay muchos factores de confusión potenciales, los controles y los análisis deben diseñarse cuidadosamente los efectos de confusión incluyen homogénea apertura BBB, la acumulación heterogénea de Mn en el cerebro, la dinámica temporal de la difusión de Mn y la actividad neuronal específica. En esta demostración, la respuesta neuronal a la estimulación unilateral de las vibrisas fue asignada. Para tener en cuenta las heterogeneidades y Mn de flujo, sin estimulación del lado de cada cerebro Se utilizó como control interno. Para dar cuenta de la actividad inespecífica neuronal que puede variar entre los animales, el análisis utilizado pruebas estadísticas para identificar las regiones que fueron sistemáticamente diferente entre los animales (Figura 2). Los resultados fueron un mapa diferencia tridimensional y un tridimensional valor p mapa (Figura 3), el lado derecho de la cual se indica regionesde la más alta de la señal contralateral a la vibrisas estimulado. El lado izquierdo del mapa indica que las regiones tenían señal significativamente mayor ipsilateral al vibrisas estimulada. El mapa de p-valor identificado una amplia región de la señal de elevada contralateral a la vibrisas estimulado que corresponde al campo de barril de la corteza sensorial primaria, cuya respuesta a la estimulación vibrisas ha sido ampliamente documentada por los estudios de electrofisiología 20,21 y 2-desoxiglucosa. Una discusión más completa de estos resultados ha sido publicado previamente 13.
Figura 1. Protocolo para la línea de tiempo con la neuroimagen funcional BOMUS y AIM resonancia magnética (Adaptado de Howles et al. 13).
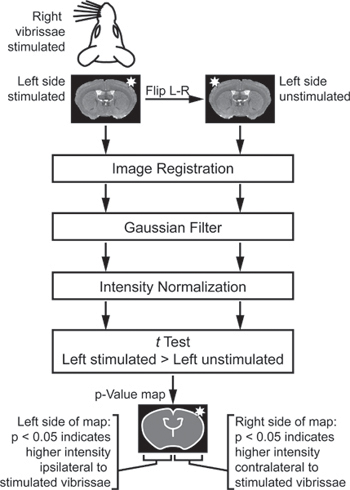
Figura 2. Análisis de esquema para la identificación de regiones of diferente intensidad entre los lados estimuladas y no estimuladas de cada cerebro. Para comparar el lado estimulado el cerebro de cada uno a su lado contralateral no estimulada, un duplicado y reflejado a la izquierda-no estimulada conjunto de imágenes se crea. Estas imágenes están registradas, se filtró, y normalizado. Por último, en la prueba se comparan las imágenes izquierda y se fue estimulada estimuladas. El test de la t es "emparejado", de modo que el lado estimulada de cada cerebro está sólo en comparación con el lado no estimulada del mismo cerebro. La prueba t es "una sola cola" de modo que un lado del mapa de p-valor indica la señal significativamente mayor en el lado estimulado del cerebro, mientras que el otro lado del mapa de p-valor indica la señal significativamente mayor en el lado de la unstimulated cerebro (Adaptado de Howles et al. 13).
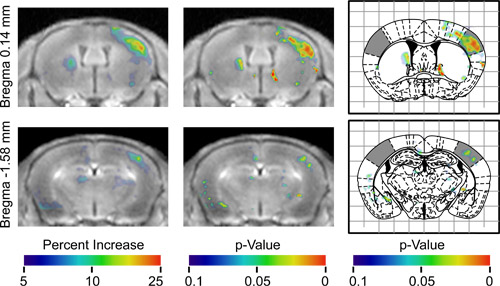
Figura 3. Resultados de análisis conjunto de 7 animales en dos posiciones axiales diferentes. T que la primera columna muestra la media de todas las imágenes registradas alineados, por lo que efectivamente todos los ratones tenían su vibrisas izquierda estimulado. Estas imágenes se superpone con un mapa de color que indica el porcentaje de incremento en promedio de la señal en cada voxel relativa al hemisferio contralateral, como se indica por la barra de color. Regiones coloreadas en la parte derecha de la imagen muestran que el hemisferio contralateral a la estimulación tenía mayor relación señal. Regiones coloreadas en la parte izquierda de la imagen muestran que el hemisferio ipsilateral a la estimulación tenía mayor relación señal. La segunda columna muestra las mismas imágenes superpuestas con el mapa de p-valor que indica la significación estadística del aumento de la señal. La tercera columna muestra el mismo valor de p mapa superpuesto a las cifras correspondientes del atlas estereotáxica Paxinos 16 con los campos de cañón de la corteza sensorial sombra (Adaptado de Howles et al. 13).
/ 4055/4055fig4.jpg "/>
Figura 4. Distribución espacial de Mn 2 + en el cerebro. Las imágenes fueron adquiridas 170 minutos después de 0,5 IP MnCl mmol / kg de 2-BOMUS tratados (n = 5) y control (n = 4) ratones. Después de la normalización, la media y desviación estándar de los mapas se calcularon (panel izquierdo). Mejora fue mayor en los ratones tratados con BOMUS. A pesar de esta mejora no fue uniforme a través del cerebro, que era bastante coherente, excepto cerca de los bordes del cerebro y los ventrículos. Uso de las regiones de interés (ROI) dibujados alrededor de diversas estructuras, la media de SNR (+ 1 SD) se calculó a través de cada grupo (panel derecho). BOMUS los animales tratados mostraron una mayor SNR, sino también una mayor variación entre las estructuras y entre los animales (Adaptado de Howles et al. 13).
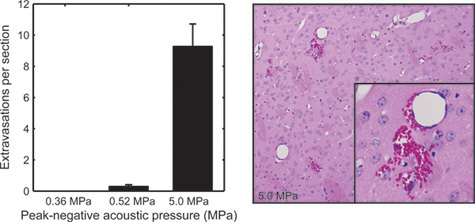
Figura 5. Para examinar los efectos de tejido de BOMUS, los cerebros de los ratones tratados con BOMUS se fijaron, en síctioned a 500 - intervalos de micras, y se tiñeron con hematoxilina y eosina. El número medio de células sanguíneas rojas extravasaciones vistos en cada sección del cerebro se muestra para presiones acústicas de 0,36 MPa (n = 3), 0,52 MPa (n = 4), y 5,0 MPa (n = 1). Las barras de error muestran el error estándar. El segundo panel muestra un ejemplo de grave extravasación de células rojas de la sangre del cerebro expuesto a 5,0 MPa (Adaptado de Howles et al. 12).
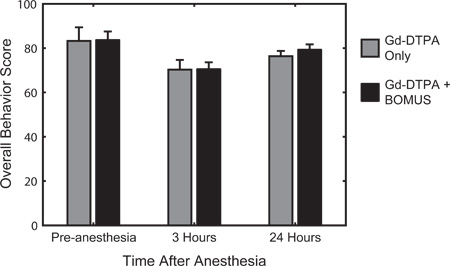
Figura 6. Las pruebas de comportamiento cuantitativo se utilizó para evaluar la actividad, la excitación y la capacidad de respuesta antes de la anestesia, y 3 y 24 horas después de la recuperación de la anestesia. El sistema de puntuación, descrito previamente 12, se basó en la evaluación bien establecido de comportamiento del ratón cuantitativa desarrolloed por Irwin en 1968 22. El comportamiento de la media (± SEM) La puntuación para el control (n = 3) y BOMUS (0,36 MPa), tratamiento (n = 8) los animales se muestra. En relación con la línea de base pre-anestesia, todos los animales muestran una disminución en la puntuación de la conducta 3 horas después de la anestesia, pero en gran medida por la recuperación al día siguiente. En cada momento, no se observaron diferencias entre los dos grupos, lo que indica que BOMUS no afectará sensiblemente el comportamiento animal (Adaptado de Howles et al. 12).
Access restricted. Please log in or start a trial to view this content.
Discusión
Aquí, un método no invasivo fue presentado por la apertura de la BBB a través del cerebro del ratón entero con ultrasonido y microburbujas (BOMUS). Con la apertura de BBB, Mn 2 + fue administrada y la activación inducida por el manganeso potenciado por resonancia magnética (MRI AIM) se utilizó para la respuesta neuronal a la imagen de corta duración en ratones estimulación ligeramente sedado.
Adecuado apertura BBB se logró con una presión acústica de pico negativo de 0...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Todo el trabajo se realizó en el Centro Duke para la microscopía in vivo, una NIH / NIBIB nacional de Tecnología Biomédica del Centro de Recursos (P41 EB015897) y Instituto Nacional del Cáncer de imágenes de Pequeños Animales del Programa de Recursos (U24 CA092656). El apoyo adicional fue proporcionado por la NSF Graduate Research Fellowship (2003014921).
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios |
| Hidrófono | Sonora Medical Systems, Longmont, CA | SN-251 S4 | |
| Traducción fase | Newport Corporation, Irvine, CA | ||
| El ultrasonido transductor | Olympus NDT, Inc., de Waltham MA | A306S-SU | Examen hoja del fabricante de prueba que acompaña al transductor para encontrar el centro exacto de la frecuencia que transductor en particular, que puede diferir de la frecuencia nominal que figuran en el catálogo. (Por ejemplo, la frecuencia nominal de nuestro transductor fue de 2,25 MHz, pero la frecuencia central real fue 2,15 MHz). |
| Vevo imágenes de la estación | VisualSonics, Inc. de Toronto, Canadá | ; | |
| 50 dB amplificador de potencia | E & I, Rochester, NY | modelo 240L | |
| Generador de señales | Agilent Technologies, Santa Clara, CA | modelo 33220A | |
| MnCl 2 - (H2O) 4 | Sigma | El peso molecular varía según el lote, llame al fabricante para la medición exacta | |
| Perflutren microesferas de lípidos | Lantheus Medical Imaging, N. Boston, MA | DEFINITY | |
| Microesferas agitador | Lantheus Medical Imaging, N. Boston, MA | Vialmix | |
| RM bobina de | M2M Imaging Corp., Hillcrest, OH | 35 mm de diámetro en cuadratura de transmisión / recepción bobina volumen | |
| Sistema de resonancia magnética | GE Healthcare, Milwaukee, WI | GE consola EXCITE operar un imán 7-T horizontal agujero | |
| Entorno de análisis de imagen | Visage Imaging, San Diego, CA, The MathWorks, Natick MA | Amira MATLAB |
Referencias
- Aoki, I. Detection of the anoxic depolarization of focal ischemia using manganese-enhanced MRI. Magnet. Reson. Med. 50, 7-12 (2003).
- Aoki, I. Dynamic activity-induced manganese-dependent contrast magnetic resonance imaging. DAIM MRI). Magnet. Reson. Med. 48, 927-933 (2002).
- Duong, T. Q., Silva, A. C., Lee, S. P., Kim, S. G. Functional MRI of calcium-dependent synaptic activity: Cross correlation with CBF and BOLD measurements. Magnet. Reson. Med. 43, 383-392 (2000).
- Lin, Y. J., Koretsky, A. P. Manganese ion enhances T-1-weighted MRI during brain activation: An approach to direct imaging of brain function. Magnet. Reson. Med. 38, 378-388 (1997).
- Lu, H. B. Cocaine-induced brain activation detected by dynamic manganese-enhanced magnetic resonance imaging (MEMRI). P. Natl. Acad. Sci. U.S.A. 104, 2489-2494 (2007).
- Drapeau, P., Nachshen, D. A. Manganese fluxes and manganese-dependent neurotransmitter release in presynaptic nerve-endings isolated from rat-brain. J. Physiol-London. 348, 493-510 (1984).
- Narita, K., Kawasaki, F., Kita, H. Mn and Mg influxes through Ca channels of motor-nerve Terminals are prevented by verapamil in Frogs. Brain Res. 510, 289-295 (1990).
- Hynynen, K., McDannold, N., Vykhodtseva, N., Jolesz, F. A. Noninvasive MR imaging-guided focal opening of the blood-brain barrier in rabbits. Radiology. 220, 640-644 (2001).
- Sheikov, N., McDannold, N., Vykhodtseva, N., Jolesz, F., Hynynen, K. Cellular mechanisms of the blood-brain barrier opening induced by ultrasound in presence of microbubbles. Ultrasound Med. Biol. 30, 979-989 (2004).
- McDannold, N., Vykhodtseva, N., Raymond, S., Jolesz, F. A., Hynynen, K. MRI-guided targeted blood-brain barrier disruption with focused ultrasound: Histological findings in rabbits. Ultrasound Med. Biol. 31, 1527-1537 (2005).
- McDannold, N., Vykhodtseva, N., Hynynen, K. Targeted disruption of the blood-brain barrier with focused ultrasound: association with cavitation activity. Phys. Med. Biol. 51, 793-807 (2006).
- Howles, G. P. Contrast-enhanced in vivo magnetic resonance microscopy of the mouse brain enabled by noninvasive opening of the blood-brain barrier with ultrasound. Magnet. Reson. Med. 64, 995-1004 (2010).
- Howles, G. P., Qi, Y., Johnson, G. A. Ultrasonic disruption of the blood-brain barrier enables in vivo functional mapping of the mouse barrel field cortex with manganese-enhanced MRI. Neuroimage. 50, 1464-1471 (2010).
- Woolsey, T. A., Welker, C., Schwartz, R. H. Comparative anatomical studies of sml face cortex with special reference to occurrence of barrels in layer-4. J. Comp. Neurol. 164, 79-94 (1975).
- Howles, G. P., Nouls, J. C., Qi, Y., Johnson, G. A. Rapid production of specialized animal handling devices using computer-aided design and solid freeform fabrication. J. Magnet. Reson. Imag. 30, 466-471 (2009).
- Paxinos, G., Franklin, K. B. J. The mouse brain in stereotaxic coordinates. , 2nd edn, Academic Press. (2001).
- Cross, D. J. Statistical mapping of functional olfactory connections of the rat brain in vivo. Neuroimage. 23, 1326-1335 (2004).
- Venot, A., Lebruchec, J. F., Golmard, J. L., Roucayrol, J. C. An automated-method for the normalization of scintigraphic images. J. Nucl. Med. 24, 529-531 (1983).
- Aoki, I., Naruse, S., Tanaka, C. Manganese-enhanced magnetic resonance imaging (MEMRI) of brain activity and applications to early detection of brain ischemia. Nmr. Biomed. 17, 569-580 (2004).
- Welker, E., Vanderloos, H. Quantitative correlation between barrel-field size and the sensory innervation of the whiskerpad - a comparative-study in 6 strains of mice bred for different patterns of mystacial vibrissae. J. Neurosci. 6, 3355-3373 (1986).
- McCasland, J. S., Woolsey, T. A. High-resolution 2-deoxyglucose mapping of functional cortical columns in mouse barrel cortex. J. Comp. Neurol. 278, 555-569 (1988).
- Irwin, S. Comprehensive observational assessment : A systematic quantitative procedure for assessing behavioral and physiologic state of mouse. Psychopharmacologia. 13, 222-257 (1968).
- Choi, J. J., Pernot, M., Small, S. A., Konofagou, E. E. Noninvasive, transcranial and localized opening of the blood-brain barrier using focused ultrasound in mice. Ultrasound Med. Biol. 33, 95-104 (2007).
- McDannold, N., Vykhodtseva, N., Hynynen, K. Use of ultrasound pulses combined with definity for targeted blood-brain barrier disruption: A feasibility study. Ultrasound Med. Biol. 33, 584-590 (2007).
- Silva, A. C., Lee, J. H., Aoki, L., Koretsky, A. R. Manganese-enhanced magnetic resonance imaging (MEMRI): methodological and practical considerations. Nmr. Biomed. 17, 532-543 (2004).
- Meiri, U., Rahamimoff, R. Neuromuscular transmission - inhibition by manganese ions. Science. 176, 308(1972).
- Aschner, M., Guilarte, T. R., Schneider, J. S., Zheng, W. Manganese: Recent advances in understanding its transport and neurotoxicity. Toxicol. Appl. Pharm. 221, 131-147 (2007).
- Watanabe, T., Frahm, J., Michaelis, T. Manganese-enhanced MRI of the mouse auditory pathway. Magnet. Reson. Med. 60, 210-212 (2008).
- Yu, X., Wadghiri, Y. Z., Sanes, D. H., Turnbull, D. H. In vivo auditory brain mapping in mice with Mn-enhanced MRI. Nat. Neurosci. 8, 961-968 (2005).
- Yu, X. Statistical mapping of sound-evoked activity in the mouse auditory midbrain using Mn-enhanced MRI. Neuroimage. 39, 223-230 (2008).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados