Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Utilisation de neuro-imagerie fonctionnelle par ultrasons rupture de la barrière hémato-encéphalique et le manganèse-IRM
Dans cet article
Résumé
Une technique est décrite pour large ouverture de la barrière hémato-encéphalique chez la souris en utilisant des microbulles et des ultrasons. En utilisant cette technique, le manganèse peut être administré au cerveau de la souris. Parce que le manganèse est un agent de contraste IRM qui s'accumule dans les neurones dépolarisés, cette approche permet d'imagerie de l'activité neuronale.
Résumé
Bien que les souris sont le système modèle dominant pour l'étude des fondements génétiques et moléculaires des neurosciences, de la neuroimagerie fonctionnelle chez la souris reste techniquement difficile. Une approche, induite par activation de manganèse IRM (AIM IRM), a été utilisée avec succès pour cartographier l'activité neuronale chez les rongeurs 1-5. Dans AIM IRM, Mn 2 + agit comme un analogue de calcium et s'accumule dans les neurones dépolarisés 6,7. Parce que Mn 2 + réduit le T 1 propriété de tissu, les régions de l'activité neuronale élevée permettra d'améliorer en IRM. Par ailleurs, Mn 2 + efface lentement à partir des régions activées, par conséquent, la stimulation peut être effectuée en dehors de l'aimant avant d'imagerie, permettant une plus grande flexibilité expérimentale. Cependant, parce que Mn 2 + ne traverse pas facilement la barrière hémato-encéphalique (BHE), la nécessité d'ouvrir la BHE a limité l'utilisation de l'IRM AIM, en particulier chez la souris.
Un outil pour l'ouverture de la BHE est ULTrasound. Bien que potentiellement dommageable, si l'échographie est administré en combinaison avec du gaz-remplis de microbulles (c.-à-agents de contraste ultrasonores), la pression acoustique nécessaire pour l'ouverture est considérablement inférieure à BBB. Cette combinaison d'ultrasons et microbulles peut être utilisé pour assurer l'ouverture du Bureau sans provoquer des lésions tissulaires 8-11.
Ici, on présente une méthode pour effectuer AIM IRM en utilisant des microbulles et des ultrasons pour ouvrir la BHE. Après une injection intraveineuse de microbulles perflutren, un faisceau d'ultrasons pulsés floue est appliquée à la tête de la souris rasé pendant 3 minutes. Par souci de simplicité, nous nous référons à cette technique de l'ouverture de BBB avec microbulles et ultrasons BOMUS 12. Utilisation BOMUS pour ouvrir le BBB à travers les deux hémisphères cérébraux, le manganèse est administré à l'ensemble de cerveau de souris. Après stimulation expérimentale des souris légère sédation, AIM IRM est utilisée pour cartographier la réponse neuronale.
Àillustrent cette approche, ici BOMUS et AIM IRM sont utilisées pour cartographier unilatérale stimulation mécanique de la vibrisses chez la souris légère sédation 13. Parce que BOMUS pouvez ouvrir le BBB à travers les deux hémisphères, du côté du cerveau non stimulé est utilisée pour contrôler la stimulation de fond non spécifique. La carte d'activation résultante 3D est en bon accord avec les représentations publiés des régions vibrisses du champ baril cortex 14. L'ouverture à ultrasons de la BHE est rapide, non invasive et réversible, et donc cette approche est appropriée pour les études à haut débit et / ou longitudinales dans les souris éveillées.
Protocole
1. Assembler et calibrer les systèmes ultrasons
- Le système à ultrasons commence par un transducteur à ultrasons à un seul élément d'un diamètre suffisamment large pour couvrir le cerveau de la souris et une fréquence centrale dans la gamme de 2 MHz. Le transducteur est entraîné par un amplificateur de 50 dB puissance, qui est relié à un générateur de signal qui produit la séquence d'impulsions à ultrasons.
- À étalonner la pression acoustique du système à ultrasons, utiliser un hydrophone de relier la tension appliquée à la pression acoustique résultante. Placez la sonde dans un réservoir d'eau au cours de l'hydrophone. Appliquer une simple impulsion (par exemple, une sinusoïde 10-cycle à la fréquence du transducteur avec une fréquence de répétition des impulsions de 10 Hz) pour le transducteur. Utiliser un étage de translation 3-axe pour trouver la réponse de crête, qui doit être au centre du faisceau d'ultrasons à foyer naturel du transducteur (environ 60 mm à notre 13 mm de diamètre transducteur MHz 2,15).
- Faire plusieurs mesures sur une sonnée des tensions d'entrée (par exemple, de 50 à 400 mV pp) pour vérifier la linéarité du système. Utilisez une régression linéaire simple pour estimer la relation entre la tension d'entrée et de la pression acoustique. Dans notre système, des tensions d'entrée de 258 et 167 mV pp correspondait aux heures de pointe négatifs pressions acoustiques de 0,52 et 0,36 MPa.
- Programmer le générateur de signal pour produire une séquence d'impulsions à ultrasons comprenant des salves d'impulsions sinusoïdales à la fréquence du transducteur avec 50000 cycles par salve et une période de salve de 64 ms. Sur la base des mesures d'étalonnage, de régler l'amplitude d'impulsion pour générer des pressions acoustiques de pointe négatifs de 0,36 MPa au centre de foyer naturel du transducteur.
2. Préparer les réactifs
- Dissoudre le chlorure de manganèse tétrahydraté (MnCl 2 .4 H 2 O) dans l'eau stérile à une concentration de 100 mM (300 mOsM) et le filtre stériliser.
- Produire le lipide perflutren microsphères par "activating "le flacon dans l'agitateur fourni par le fabricant pendant 45 s. pour un jour d'expériences, un flacon unique peut être activé une fois au début de la journée et utilisé sans réactivation pour le reste de la journée.
- Immédiatement avant l'administration de microsphères, agiter le flacon à la main pendant 1 min à remettre en suspension des microsphères. Lors du retrait des microbulles dans le flacon, ne pas injecter de l'air ambiant dans le flacon, car cela dégrade les microbulles restants. Laisser le flacon jusqu'à ce que la dernière utilisation de la journée, puis de le stocker dans un réfrigérateur. Maintenu dans ce mode, un seul flacon peut durer plusieurs jours. Réactiver le flacon stockée dans l'agitateur, avant la première utilisation selon les jours.
3. Préparation des animaux
- Anesthésier les animaux avec de l'isoflurane, délivré par cône de nez. L'appareil cône de nez doit être destiné à fixer la tête de l'animal avec précision et fiabilité dans la même position à chaque fois. Notre dispositif 15 maintient la tête dans ee "crâne plat" position (c.-à-la surface du crâne dorsale est horizontale) utilisé dans l'atlas de Paxinos cerveau 16. Titrer l'anesthésie afin de maintenir un rythme respiratoire entre 85 et 125 respirations par minute. Maintenir la température du corps en utilisant une lampe chauffante ou de l'air soufflé. Protéger les yeux avec du lubrifiant.
- Retirez les cheveux sur le cuir chevelu de la souris en utilisant une tondeuse électrique.
- Placez un cathéter dans la veine caudale et une intrapéritonéale (IP) du cathéter. Pour les études de survie, veillez à utiliser une technique stérile appropriée; la pose du cathéter IP démontré dans la vidéo de cet article est approprié seulement pour les non-survie expériences.
- Effectuez les préparatifs supplémentaires nécessaires à l'expérience de stimulation neuronale. Pour la cartographie de la stimulation du cortex vibrisses domaine baril, utiliser un microscope à dissection et de ciseaux de microchirurgie à couper le vibrisses aussi proche que possible de la surface de la peau sans l'irriter le follicule ou de la peau environnante.
- Gel pour ultrasons sur la placele cuir chevelu, puis abaissez une colonne d'eau contenue par une fine feuille de plastique (par exemple, une doublure 7,6 um poubelle bin) sur la tête. Atteindre à travers la colonne d'eau avec un coton-tige pour faire sortir les bulles d'air qui se retrouvent piégés dans le gel pour ultrasons. Placez le transducteur à ultrasons à sa distance focale naturelle (58 mm) directement sur le cerveau de souris dans la colonne d'eau, puis essuyez la sonde avec un bout de doigt pour enlever les bulles d'air emprisonnées.
4. Ouverture de la barrière hémato-encéphalique avec microbulles et sonores Ultra (BOMUS)
- Donner une injection intrapéritonéale de la solution de manganèse à une dose de 0,5 mmol / kg IP. Boucher le cathéter intrapéritonéal de sorte que le manganèse ne s'écoule pas, et attendre 10 minutes pour lui permettre de distribuer (Figure 1).
- Pour ouvrir la BHE, administrer 30 uL de lipides perflutren microsphères (DEFINITY activé) à travers le cathéter dans la veine caudale, et en même temps, lancer la séquence d'impulsions ultra-sons. Continuer insonification pendant 3 minutes.
5. Stimulation neuronale
- Comptez environ 40 minutes pour les concentrations cérébrales de Mn 2 + à stabiliser avant de commencer la stimulation neuronale. De cette façon, la mise en valeur de référence spectaculaire en raison de Mn 2 + la diffusion à travers la BHE peut être distinguée de la mise en valeur subtile différence due à la stimulation. Puis, commencer la stimulation avec votre paradigme de choix (Figure 1).
- Pour la stimulation des vibrisses, éteignez l'isoflurane et enlever le cône de nez. Déplacez pinceau d'un artiste doux manuellement dans un mouvement circulaire (1-5 Hz) à travers le réseau vibrisses à une distance d'environ 2-5 mm de la peau. Continuer la stimulation pendant 90 min. Le manganèse a un effet sédatif qui permet la stimulation effrénée de l'animal. Si l'animal devient agité, administrer 5% d'isoflurane par cône de nez pendant environ 15 secondes.
6. Magnetic imagerie par résonance
- Après la stimulation, de reprendre l'anesthésie par l'intermédiaire cône de nez. Continuer à maintenir la température du corps et en titrant le niveau isoflurane à une fréquence respiratoire de 85 à 125 respirations par minute.
- Placez la souris dans une bobine d'IRM et de transférer dans le système IRM. Acquérir 3D à haute résolution T 1-pondérées des images IRM. Par exemple, utiliser un gradient 3D gâté rappelé écho (SPGR) de séquence avec les paramètres suivants: temps de répétition de 25 ms, le temps d'écho de 2 ms; angle de bascule de 30 degrés; bande passante de 15,63 kHz; champ de vision de 20 × 20 × 12 mm; matrice de 128 × 128 × 60.
7. Analyse d'Image
- L'analyse d'image est spécifique au paradigme de stimulation utilisé. Pour l'expérience de stimulation des vibrisses (Figure 2), d'importer les images de plusieurs animaux dans un environnement d'analyse approprié. Si certains animaux ont été stimulés sur le droit tandis que d'autres ont été stimulées sur la gauche, flip certaine façon à ce que toutes les images sont effectivement "à gauche stimulée." Ensuite, pour comparer le côté stimulé de chaque cerveau de son côté non stimulé controlatéral, créer un double et miroir de gauche non stimulées ensemble image est créée. Inscrivez-vous toutes les images à un espace commun, puis de les lisser avec un 3 × 3 × 3 pixels du noyau gaussien.
- Exportez les données vers un environnement d'analyse mathématique, tels que MATLAB. En option, l'anatomie masquer pertinent dans les ensembles de données. Intensité-normaliser les images par la méthode itérative de Venot et al. 17,18.
- Utiliser un paires, t test unique à queue pour comparer chaque voxel des côtés de chaque stimulées cerveau pour le voxel correspondant controlatérale sur les côtés non stimulées de chaque cerveau.
- Afficher la résultante p-valeur de la carte pour identifier les régions d'activité différentielle (figure 3).
8. Les résultats représentatifs
La méthode présentée ici a deux fonds étapes amental: (1) d'ouverture de BBB avec microbulles et des ultrasons (BOMUS) et (2) activation-induced Manganèse-IRM (AIM IRM). Parce que la dernière étape dépend de la première, il est important de vérifier la mise en œuvre avec succès BOMUS.
La perturbation de la barrière hémato-encéphalique après administration d'un T 1-raccourcissement agent de contraste (comme le manganèse ou d'un agent à base de gadolinium) se traduit par une augmentation du signal dans le parenchyme cérébral sur T 1-imagerie pondérée par rapport aux cerveaux dans lequel BOMUS n'a pas été effectuée (figure 4). La distribution de cette amélioration de manganèse n'est pas complètement uniforme, bien qu'il soit assez cohérente entre les animaux. La répartition ne reflète pas seulement dans inhomogénéité ouverture BBB, mais est également la valeur intrinsèque distribution non uniforme de Mn dans le cerveau 19. Les dynamiques spatiales et temporelles de l'ouverture BBB ont encore été décrit précédemment 12.
ent "> Une fois BOMUS a été appliquée avec succès, la prochaine étape consiste à effectuer AIM IRM nombreux paradigmes expérimentaux sont possibles;.. Cependant, parce qu'il ya beaucoup de potentiels facteurs de confusion, les contrôles et les analyses doivent être soigneusement conçues effets confondants comprennent inhomogène ouverture BBB, l'accumulation hétérogène de Mn dans le cerveau, la dynamique temporelle de la diffusion de Mn, et non spécifique de l'activité neuronale. Dans cette démonstration, la réponse à la stimulation neuronale unilatérale de l'vibrisses a été cartographiée. Pour tenir compte des inhomogénéités et Mn flux, le côté non stimulé de chaque cerveau a été utilisé comme un contrôle interne. Pour tenir compte de l'activité neuronale non spécifique qui peut varier entre les animaux, l'analyse des tests statistiques utilisés pour identifier les régions qui étaient systématiquement différente chez les animaux (Figure 2). Les résultats ont été une carte de différence en trois dimensions et une tridimensionnelle valeur p carte (figure 3), le côté droit de régions qui indiqued'un signal plus élevé controlatéral à la vibrisses stimulé. Le côté gauche de la carte indique les régions qui avaient significativement plus élevée du signal ipsilatéral à la vibrisses stimulé. La carte p-valeur identifiée dans une vaste région de signal élevée controlatéral à la vibrisses stimulé ce qui correspond au champ baril de le cortex sensoriel primaire, dont la réponse à la stimulation des vibrisses a été largement documenté par électrophysiologie 20,21 et 2-désoxyglucose études. Une discussion plus complète de ces résultats a été publiée auparavant 13.
Figure 1. Calendrier Protocole pour la neuroimagerie fonctionnelle avec BOMUS et AIM IRM (Adapté de Howles et al. 13).
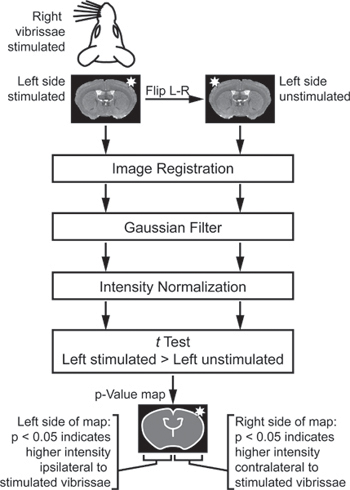
Schéma d'analyse Figure 2. Pour identifier les régions of intensité différente entre les côtés stimulés et non stimulés de chaque cerveau. Pour comparer le côté stimulé de chaque cerveau de son côté non stimulé controlatéral, un double et miroir de gauche non stimulées ensemble image est créée. Ces images sont enregistrées, filtrée, et normalisée. Enfin, au test compare les images de gauche et de gauche stimulés non stimulées. Le test t est "jumelé" de sorte que le côté stimulé de chaque cerveau est seulement par rapport au côté non stimulé de la même cerveau. Le test t est «mono-queue" de sorte qu'un côté de la carte p-valeur indique que le signal significativement plus élevée sur le côté stimulé du cerveau, tandis que l'autre côté de la carte p-valeur indique que le signal significativement plus élevée sur le côté non stimulé de l' cerveau (Adapté de Howles et al. 13).
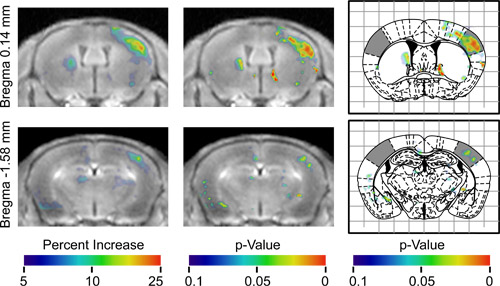
Figure 3. Résultats de l'analyse groupée de 7 animaux moins deux positions axiales différentes. T il la première colonne montre la moyenne de toutes les images enregistrées alignés, de sorte que toutes les souris efficacement eu leur vibrisses gauche stimulée. Ces images sont recouvertes avec une carte de couleurs indiquant l'augmentation pour cent en moyenne du signal à chaque voxel par rapport à l'hémisphère controlatéral, comme indiqué par la barre de couleur. Régions de couleur sur le côté droit de l'image montre où l'hémisphère controlatéral à la stimulation avait plus de signal. Régions de couleur sur le côté gauche de l'image montre où l'hémisphère ipsilatéral à la stimulation avait plus de signal. La deuxième colonne montre les mêmes images superposées avec la carte p-valeur indiquant la signification statistique de l'augmentation du signal. La troisième colonne indique la même p-valeur de la carte en surimpression sur les chiffres correspondants de l'atlas de Paxinos stéréotaxique 16 avec les champs canon du cortex sensoriel ombragée (Adapté de Howles et al. 13).
/ 4055/4055fig4.jpg "/>
Figure 4. Répartition spatiale de Mn 2 + dans le cerveau. Les images ont été acquises 170 min après 0,5 IP mmol / kg MnCl 2 à partir de BOMUS-traités (n = 5) et le contrôle (n = 4) chez la souris. Après la normalisation, la moyenne et des cartes d'écart-type ont été calculés (panneau de gauche). Amélioration était plus grande chez les souris traitées BOMUS. Bien que cette amélioration n'a pas été uniforme à travers le cerveau, il était assez cohérente, à l'exception près des bords du cerveau et les ventricules. Utilisation des régions d'intérêt (ROI) tracées autour de différentes structures, la moyenne SNR (+ 1 SD) a été calculé pour chaque groupe (panneau de droite). BOMUS les animaux traités ont montré une plus grande SNR, mais aussi une plus grande variance entre les structures et entre les animaux (Adapté de Howles et al. 13).
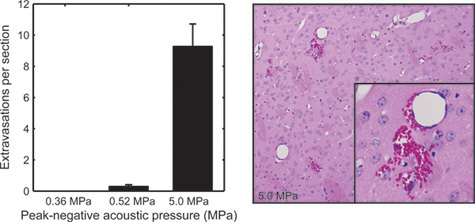
Figure 5. Pour examiner les effets de tissus BOMUS, cerveaux de souris traitées BOMUS ont été fixés, en soictioned à 500 - intervalles um, et colorées à l'hématoxyline et l'éosine. Le nombre moyen de globules rouges extravasations vus dans chaque partie du cerveau est montré pour des pressions acoustiques de 0,36 MPa (n = 3), 0,52 MPa (n = 4), et 5,0 MPa (n = 1). Les barres d'erreur indiquent l'erreur standard. Le deuxième volet montre un exemple de graves extravasation des globules rouges à partir du cerveau exposé à 5,0 MPa (Adapté de Howles et al. 12).
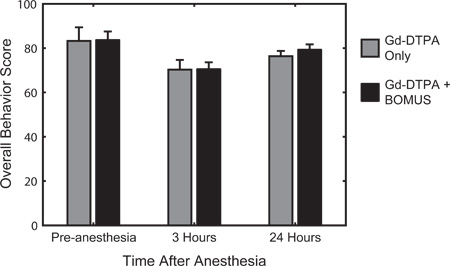
Figure 6. Quantitative tests comportementaux a été utilisé pour évaluer l'activité, l'excitation, et la réactivité avant l'anesthésie, et 3 et 24 heures après le rétablissement de l'anesthésie. Le système de notation, décrit précédemment 12, a été basée sur l'évaluation bien établie de la souris quantitative du comportement de développered par Irwin en 1968 22. Le comportement moyen (± SEM) score pour le contrôle (n = 3) et BOMUS (0,36 MPa) traitée (n = 8) animaux est montré. Par rapport à la base de pré-anesthésie, tous les animaux montrent une diminution du score le comportement de 3 heures après l'anesthésie, mais ils ont largement de récupérer le lendemain. A chaque instant, aucune différence n'a été observée entre les deux groupes, indiquant que BOMUS n'a pas mesurable sur le comportement des animaux (Adapté de Howles et al. 12).
Access restricted. Please log in or start a trial to view this content.
Discussion
Ici, une méthode non invasive a été présenté pour l'ouverture de la BHE dans le cerveau de souris entier avec des ultrasons et des microbulles (BOMUS). Après avoir ouvert le BBB, Mn 2 + a été administré et l'activation induite par le manganèse-IRM (IRM AIM) a été utilisée pour la réponse neuronale à l'image de courte durée de stimulation chez les souris légère sédation.
Suffisant ouverture BBB a été réalisé avec un pic de pression négative acous...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Tous les travaux ont été effectués au Centre Duke pour microscopie in vivo, une NIH / NIBIB nationale de la technologie biomédicale du Centre de ressources (P41 EB015897) et NCI Programme de petites ressources animales Imaging (U24 CA092656). Un soutien supplémentaire a été fourni par la NSF bourse d'études supérieures de recherche (2003014921).
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Le numéro de catalogue | Commentaires |
| Hydrophone | Sonora Medical Systems, Longmont, CA | SN S4-251 | |
| Stade de la traduction | Newport Corporation, Irvine, CA | ||
| Transducteur à ultrasons | Olympus NDT, Inc, Waltham MA | A306S-SU | Votre avis feuille de test du fabricant qui accompagne le transducteur de trouver la fréquence exacte du centre de ce transducteur particulier, qui peut différer de la fréquence nominale indiquée dans le catalogue. (Par exemple, la fréquence nominale de notre capteur est de 2,25 MHz, mais la fréquence centrale réelle était de 2,15 MHz.) |
| Vevo Imaging station | VisualSonics, Inc Toronto, Canada | ; | |
| 50 dB amplificateur de puissance | E & I, Rochester, NY | modèle 240L | |
| Générateur de signal | Agilent Technologies, Santa Clara, CA | modèle 33220A | |
| MnCl 2 - (H2O) 4 | Sigma | Poids moléculaire varie en fonction du lot, contacter le fabricant pour la mesure exacte | |
| Lipidique perflutrène microsphères | Lantheus Medical Imaging, N. Billerica, MA | DEFINITY | |
| Agitateur MICROSPHERE | Lantheus Medical Imaging, N. Billerica, MA | Vialmix | |
| Imagerie par résonance magnétique bobine | m2m Imaging Corp, Hillcrest, OH | 35 mm de diamètre en quadrature de transmission / réception bobine de volume | |
| Système d'IRM | GE Healthcare, Milwaukee, WI | Console EXCITE GE exploitation d'un 7-T aimant horizontal alésage | |
| Environnement d'analyse d'image | Imagerie Visage, San Diego, CA, The MathWorks, Natick MA | Amira MATLAB |
Références
- Aoki, I. Detection of the anoxic depolarization of focal ischemia using manganese-enhanced MRI. Magnet. Reson. Med. 50, 7-12 (2003).
- Aoki, I. Dynamic activity-induced manganese-dependent contrast magnetic resonance imaging. DAIM MRI). Magnet. Reson. Med. 48, 927-933 (2002).
- Duong, T. Q., Silva, A. C., Lee, S. P., Kim, S. G. Functional MRI of calcium-dependent synaptic activity: Cross correlation with CBF and BOLD measurements. Magnet. Reson. Med. 43, 383-392 (2000).
- Lin, Y. J., Koretsky, A. P. Manganese ion enhances T-1-weighted MRI during brain activation: An approach to direct imaging of brain function. Magnet. Reson. Med. 38, 378-388 (1997).
- Lu, H. B. Cocaine-induced brain activation detected by dynamic manganese-enhanced magnetic resonance imaging (MEMRI). P. Natl. Acad. Sci. U.S.A. 104, 2489-2494 (2007).
- Drapeau, P., Nachshen, D. A. Manganese fluxes and manganese-dependent neurotransmitter release in presynaptic nerve-endings isolated from rat-brain. J. Physiol-London. 348, 493-510 (1984).
- Narita, K., Kawasaki, F., Kita, H. Mn and Mg influxes through Ca channels of motor-nerve Terminals are prevented by verapamil in Frogs. Brain Res. 510, 289-295 (1990).
- Hynynen, K., McDannold, N., Vykhodtseva, N., Jolesz, F. A. Noninvasive MR imaging-guided focal opening of the blood-brain barrier in rabbits. Radiology. 220, 640-644 (2001).
- Sheikov, N., McDannold, N., Vykhodtseva, N., Jolesz, F., Hynynen, K. Cellular mechanisms of the blood-brain barrier opening induced by ultrasound in presence of microbubbles. Ultrasound Med. Biol. 30, 979-989 (2004).
- McDannold, N., Vykhodtseva, N., Raymond, S., Jolesz, F. A., Hynynen, K. MRI-guided targeted blood-brain barrier disruption with focused ultrasound: Histological findings in rabbits. Ultrasound Med. Biol. 31, 1527-1537 (2005).
- McDannold, N., Vykhodtseva, N., Hynynen, K. Targeted disruption of the blood-brain barrier with focused ultrasound: association with cavitation activity. Phys. Med. Biol. 51, 793-807 (2006).
- Howles, G. P. Contrast-enhanced in vivo magnetic resonance microscopy of the mouse brain enabled by noninvasive opening of the blood-brain barrier with ultrasound. Magnet. Reson. Med. 64, 995-1004 (2010).
- Howles, G. P., Qi, Y., Johnson, G. A. Ultrasonic disruption of the blood-brain barrier enables in vivo functional mapping of the mouse barrel field cortex with manganese-enhanced MRI. Neuroimage. 50, 1464-1471 (2010).
- Woolsey, T. A., Welker, C., Schwartz, R. H. Comparative anatomical studies of sml face cortex with special reference to occurrence of barrels in layer-4. J. Comp. Neurol. 164, 79-94 (1975).
- Howles, G. P., Nouls, J. C., Qi, Y., Johnson, G. A. Rapid production of specialized animal handling devices using computer-aided design and solid freeform fabrication. J. Magnet. Reson. Imag. 30, 466-471 (2009).
- Paxinos, G., Franklin, K. B. J. The mouse brain in stereotaxic coordinates. , 2nd edn, Academic Press. (2001).
- Cross, D. J. Statistical mapping of functional olfactory connections of the rat brain in vivo. Neuroimage. 23, 1326-1335 (2004).
- Venot, A., Lebruchec, J. F., Golmard, J. L., Roucayrol, J. C. An automated-method for the normalization of scintigraphic images. J. Nucl. Med. 24, 529-531 (1983).
- Aoki, I., Naruse, S., Tanaka, C. Manganese-enhanced magnetic resonance imaging (MEMRI) of brain activity and applications to early detection of brain ischemia. Nmr. Biomed. 17, 569-580 (2004).
- Welker, E., Vanderloos, H. Quantitative correlation between barrel-field size and the sensory innervation of the whiskerpad - a comparative-study in 6 strains of mice bred for different patterns of mystacial vibrissae. J. Neurosci. 6, 3355-3373 (1986).
- McCasland, J. S., Woolsey, T. A. High-resolution 2-deoxyglucose mapping of functional cortical columns in mouse barrel cortex. J. Comp. Neurol. 278, 555-569 (1988).
- Irwin, S. Comprehensive observational assessment : A systematic quantitative procedure for assessing behavioral and physiologic state of mouse. Psychopharmacologia. 13, 222-257 (1968).
- Choi, J. J., Pernot, M., Small, S. A., Konofagou, E. E. Noninvasive, transcranial and localized opening of the blood-brain barrier using focused ultrasound in mice. Ultrasound Med. Biol. 33, 95-104 (2007).
- McDannold, N., Vykhodtseva, N., Hynynen, K. Use of ultrasound pulses combined with definity for targeted blood-brain barrier disruption: A feasibility study. Ultrasound Med. Biol. 33, 584-590 (2007).
- Silva, A. C., Lee, J. H., Aoki, L., Koretsky, A. R. Manganese-enhanced magnetic resonance imaging (MEMRI): methodological and practical considerations. Nmr. Biomed. 17, 532-543 (2004).
- Meiri, U., Rahamimoff, R. Neuromuscular transmission - inhibition by manganese ions. Science. 176, 308(1972).
- Aschner, M., Guilarte, T. R., Schneider, J. S., Zheng, W. Manganese: Recent advances in understanding its transport and neurotoxicity. Toxicol. Appl. Pharm. 221, 131-147 (2007).
- Watanabe, T., Frahm, J., Michaelis, T. Manganese-enhanced MRI of the mouse auditory pathway. Magnet. Reson. Med. 60, 210-212 (2008).
- Yu, X., Wadghiri, Y. Z., Sanes, D. H., Turnbull, D. H. In vivo auditory brain mapping in mice with Mn-enhanced MRI. Nat. Neurosci. 8, 961-968 (2005).
- Yu, X. Statistical mapping of sound-evoked activity in the mouse auditory midbrain using Mn-enhanced MRI. Neuroimage. 39, 223-230 (2008).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon