Method Article
甲状腺未分化癌的原位小鼠模型
摘要
这里描述的甲状腺未分化癌的原位小鼠模型生成。这种技术采用的人甲状腺未分化癌的细胞免疫缺陷小鼠进入甲状腺手术放置,从而创造了更多的临床相关的设置,研究疾病的进展,以及屏幕创新的治疗干预。
摘要
已经建立了人甲状腺癌的动物模型中有几种类型的,包括皮下移植和原位移植到免疫缺陷小鼠的癌细胞。皮下移植瘤模型一直宝贵的临床前筛选和评估新的治疗方法。有很多的优点,使用皮下模型; 1)快速,2)重现性好,和3)肿瘤的建立,生长,治疗剂,可通过目测进行监测。然而,大量证据揭示缺憾皮下移植瘤模型1-3。例如,皮下移植瘤模型中证明疗效的药物治疗往往没有显着影响,对人类疾病。微移植或注射xenographic在于该网站在此相异的心脏。
原位移植瘤模型提供了更多的生物学家gically相关的上下文中来研究这种疾病。到他们的的解剖起源相当于内宿主动物植入病变的细胞或组织的优势,包括肿瘤 - 宿主相互作用的一个合适的地点,与疾病相关的转移的发展和能力的考查特定网站的影响力调查治疗的补救措施。因此,原位移植瘤模型怀有更多的临床价值,因为它们密切重现人类疾病。由于这些原因,一些团体已经采取原位甲状腺癌模型的优势,作为一种研究工具4-7。
在这里,我们描述了一种方法,,建立原位模型的研究甲状腺未分化癌(ATC),它具有很强的侵袭,抗拒治疗,几乎是致命的,在所有确诊患者。养空管细胞制备,作为含有基底膜基质的溶液中解离的细胞悬浮液。小体积慢慢注入连结到正确的甲状腺影响。整体外观和健康的小鼠进行监控,以确保最小的手术后并发症,以了解癌症的病理渗透率。在第4周,处死小鼠,收集和组织进行组织学分析。动物可能会在稍后的时间点,研究更先进的病情发展。生产这种原位小鼠模型建立了一个平台,实现两个目标:1)进一步了解的ATC病理,和2)屏幕当前和未来的治疗药物疗效ATC打击。
研究方案
1。细胞的制备
注释:1)的完全RPMI 1640的培养基配方(500毫升)包括435毫升的RPMI 1640,加入50ml热灭活的胎牛血清,5毫升的非必需的氨基酸,5毫升丙酮酸钠,5毫升抗生素,抗真菌剂; 2)这里基底膜在4℃的前一天收获细胞。
- 人力ATC细胞株THJ-11T 8 6孔培养板,生长在80-90%汇合收获一次。
- 离心沉淀细胞,在200×g离心4分钟,在室温下。
- 吸媒体和悬浮细胞在RPMI 1640媒体[2毫升/ 6孔板]。
- 举一个小体积的细胞悬液,加一体积的0.4%台盼蓝染色,并确定使用TC10自动细胞计数的细胞密度。
- 需要得到5×10 5细胞/小鼠倍的数量注入小鼠的细胞悬浮液的体积计算。
注:为了确保广告等同于注射细胞悬液,准备细胞好像你是双注射的小鼠数量( 例如,如果注入5只小鼠,然后,仿佛你准备细胞悬液注入10只老鼠)。
- 所需体积的细胞悬液转移到15毫升锥形管。
- 离心沉淀细胞,在200×g离心4分钟,在室温下。
- 吸媒体和悬浮细胞在完全RPMI 1640媒体。
- 细胞转移到1.6毫升管,加入1倍体积的基底膜,轻轻混匀,慢慢吹打和。
注:每个鼠标将收到10μl的细胞悬液/基底膜鸡尾酒的。由于5×10 5细胞悬浮在10微升注射量已成功地应用在先前的ATC原位研究9-10,我们使用本报告中的这些参数。
- 将细胞悬液在冰上,直到准备使用。
- 清洁手术的区域,其中包括解剖范围和周边地区的,用70%乙醇擦拭所有表面。
- 打开加热灯/垫动物将被从手术中恢复。
- 管理0.1毫升氯胺酮/甲苯噻嗪(包括氯胺酮9毫克/毫升和甲苯噻嗪1mg/ml的药物鸡尾酒),每10克体重腹腔注射1毫升,27G½“结核菌素注射器。
- 准备手术鼠标:1)鼠标(从下颌线,上方的胸骨和出武器),2)颈部区域刮胡子,擦洗手术区三次chorhexadine浸湿纱布广场,3)最终完成擦洗用优碘浸湿纱布,4 )轻轻涂抹眼膏,以防止眼睛干涩。
- 检查踏板反射,以确保鼠标充分镇静。
- 背斜卧在一次性无菌区障碍的解剖范围下将动物和保护动物的地方布胶带。
- 磨砂手和fingernails然后把无菌手术手套。
- 在一个无菌的方式,打开包装,并安排手术仪器。
- 将无菌的悬垂性动物,只留下手术部位暴露。
3。外科手术进入甲状腺细胞注射
- 使用无菌的,一次性手术刀,做一个1到1.5厘米的纵向切口,沿中线的咽喉。
注:从中线偏差复杂更深的切削访问气管。正中切口相当精确,让你逗左右唾液腺划破膜组织,减少划伤或切断大动脉的机会。
- 拨打第二个切口进气管周围的带状肌,然后右侧阴刻肌肉拉向一边,露出右甲状腺。
- 持有的肌肉层,在这一点上,可以使用止血为方便甲状腺( 图1)的一部分。
注:另外,如果进行两个手术人员,肌肉层可能只是回用钳子而准备的注射针筒交给外科医生的协助人员。
- 缓缓注入10微升细胞悬液进入右甲状腺使用31G 5/16“然后轻轻取出针胰岛素注射器。
4。手术部位和鼠标恢复闭幕
- 缝合肌肉层6.0缝合材料,使用一个连续或间断缝合风格。
- 以同样的方式缝合皮肤。
- 三联抗生素软膏,直接在切口部位涂抹上一层。
- 允许动物复原在背斜卧上暖加热垫。一旦动物可以实现胸骨斜卧没有援助,它可以与其他老鼠放回。
- 检查切口部位和整体健康的动物每天手术后一个星期,然后检查,每周一次。如果缝线14天之后仍然完好,它们将被删除。
注:动物健康状况下降( 如大幅减肥,邋遢的头发,呼吸困难)表现应被人道毁灭,收集和组织。
- 一旦老鼠已经达到了预定的手术后的时间点,管理氯胺酮/甲苯噻嗪上述稳重。
- 心脏灌注动物和收获甲状腺/气管和其他组织(未在这里详细描述)。
结果
我们检测到19共20只小鼠注射4周后ATC细胞的侵入性甲状腺肿瘤。在图2A中所示的例子中,接收5X10 5 ATC所附的条件下生长的细胞原位注射的小鼠,表现出显着的癌细胞浸润进入甲状腺4周后喷射。经苏木精伊红(H&E)染色性质的入侵ATC细胞特征的梭形细胞中巨型的细胞,嗜酸性粒细胞细胞质和细胞核大。为了进行比较,非注射的对照动物的甲状腺,气管从图2B中所示。卵泡未注射动物显示接近尾声,尚未松动,结社和本质上有一个圆形的形态。
无意的结果由于甲状腺和使用小尺寸的可注射的发送,可能出现问题。 图3A示出了最常观察到的,这是发展的肿瘤以外的质量,但不涵盖,甲状腺。这是可能多针穿透和超越甲状腺,由于当细胞被开除。有时候,小鼠表现为无肿瘤的生长,大体,组织学,检测到如图3B所示。没有检测肿瘤发展,可引起驱逐从注射部位和传播到邻近的组织和空腔的细胞悬液。
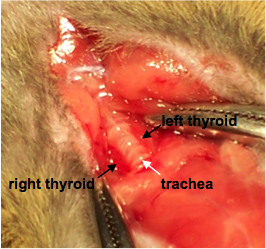
图1。暴露甲状腺。标签表示左,右甲状腺气管两侧。
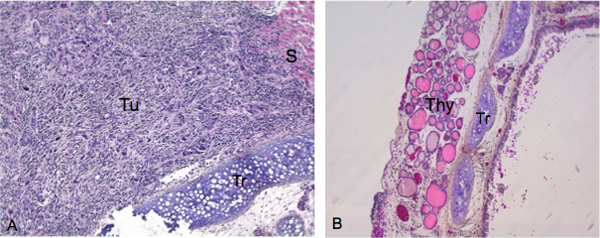
图2。组织学检查肿瘤的生长和成功后甲状腺注射vasion。组织标本切片沿冠状面A)拍摄的图像在200X的小鼠表现出大量的肿瘤生长特性梭形细胞中巨型的细胞,嗜酸性粒细胞的细胞质和细胞核大,苏木精伊红( ħ&ē)染色。 涂表示从肿瘤细胞侵入甲状腺的初级病变。B)气管和甲状腺从控制动物(图像100X)。 涂,肿瘤;Ş,平滑肌; TR,气管; 你 ,甲状腺。
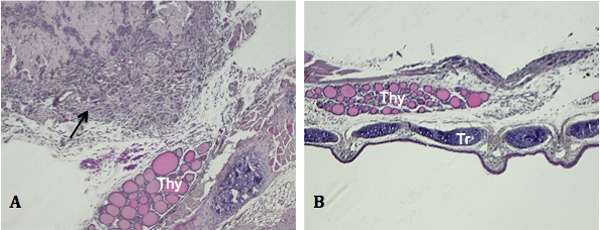
图3。意外的结果原位注射组织标本切片沿冠状面A)外设肿瘤的生长没有明显增长的thyroi。(黑色箭头,拍摄的图像在100X)B)缺乏肿瘤检测总额时(图中未示出)或组织学检查(放大50倍拍摄的图像)。 你的甲状腺。
讨论
在我们的模型中,动物表现出甲状腺肿瘤的转移和疾病相关的恶病质和呼吸窘迫,注射后4周。与大多数其他原位模型,利用注射交付的细胞悬浮液,注射到周围组织和后喷射漏超越的目标扩大是可能的。有了这样说,一个辨认潜在的未知此过程中产生的脱靶暴露于非疾病相关的转移或并发症的效果。这是一个普遍关注与大多数xenographic移植,而不管被调查的疾病。然而,无意转移的后果可能会显着地最小化,确保整个斜面针尖已经渗透膜紧贴地覆盖在甲状腺细胞悬浮液慢慢排出。如果观察到泄漏注射过程中或之后,也可以省略这些动物在研究之外。
,至关重要的是,动物灌注收获甲状腺/气管和其他组织的前。组织形态和完整性有两方面的好处,1)红血细胞被清除,并不会弄乱组织学标本和2)将被保留。此外,切除甲状腺/气管具有一个附加的肿瘤质量或掩埋于解剖标志可以被识别之前,被嵌入的组织学制备的方式应切成。这将极大地减少样品制备时间。
在这份报告中,我们描述了当地的晚期甲状腺肿瘤的生长和侵袭后ATC细胞原位注射。 ATC转移可以调查分析其他组织使用标准的组织污渍,如苏木精伊红的组织准备工作,或通过免疫组化利用细胞或病理相关标记。该系统能够进一步发展,由g荧光记者甲状腺癌细胞enetically修改,以便实时成像可被用来监测转移和治疗性治疗的功效。
披露声明
什么都没有透露。
致谢
笔者想感谢博士。 :李文军和丹尼尔KREISEL的(在圣路易斯华盛顿大学医学院)他们协助手术培训。 RYL由美国国立卫生格兰特R01 DK068057和总统的美国圣路易斯大学研究基金支持。
材料
| Name | Company | Catalog Number | Comments |
| RPMI 1640 cell culture media | Mediatech | 10-041-CV | Media and additives used depend on cell line |
| TC10 Automated Cell Counter | Bio-Rad | 145-0001 | |
| Matrigel | Becton, Dickinson and Company | 354234 | |
| Graefe Forceps, Serrated; Slight Curve, 4" | Roboz | RS-5135 | |
| Disposable scalpel, No. 15 | Feather | 2975#15 | |
| Olsen Hegar Needle Holder - 4 ½" delicate serrated | gSource | gS 21.5400 | |
| 6-0 nylon black monofilament suture | Surgical Specialties Corporation | 1279B | |
| Heating Pad, reusable, 8" x 12" | |||
| Cloth tape, 1" X 10 yds | Medline | MIINON260101 | For restraining anesthetized mouse |
| Peanut Clipper/Trimmer | Wahl | 8655 | For removing hair from surgical site |
| ChlorHex-Q SCRUB 2% | Penn Veterinary Supply | VED1222 | |
| Betadine | Henry Schein Company | 6906727 | |
| Petrolatum ophthalmic ointment | Dechra Veterinary Products | 17033-211-38 | |
| 2 x 2 gauze, 12-ply | Butler Animal Health Supply | 6936 | |
| Sterile Field, Barrier, 18" x 26" | Busse | 696 | |
| Drapes (CSR Wrap) | Cardinal Health | AT 21 412 | |
| 27G ½" needle | Becton, Dickinson and Company | 309623 | |
| 31G 5/16" needle | Becton, Dickinson and Company | 328438 | |
| Ketamine (9 mg/ml) / xylazine (1 mg/ml) solution | |||
| Triple antibiotic ointment |
参考文献
- Bibby, M. C. Orthotopic models of cancer for preclinical drug evaluation: advantages and disadvantages. Eur. J. Cancer. 40, 852-857 (2004).
- Hoffman, R. M. Orthotopic metastatic mouse models for anticancer drug discovery and evaluation: a bridge to the clinic. Invest. New Drugs. 17, 343-359 (1999).
- Killion, J. J., Radinsky, R., Fidler, I. J. Orthotopic models are necessary to predict therapy of transplantable tumors in mice. Cancer Metastasis Rev. 17, 279-284 (1998).
- Kim, S., et al. An orthotopic model of anaplastic thyroid carcinoma in athymic nude mice. Clin. Cancer Res. 11, 1713-1721 (2005).
- Nucera, C., et al. A novel orthotopic mouse model of human anaplastic thyroid carcinoma. Thyroid. 19, 1077-1084 (2009).
- Todaro, M., et al. Tumorigenic and metastatic activity of human thyroid cancer stem cells. Cancer Res. 70, 8874-8885 (2010).
- Tran Cao, H. S., et al. Real-time imaging of tumor progression in a fluorescent orthotopic mouse model of thyroid cancer. Anticancer Res. 30, 4415-4422 (2010).
- Marlow, L. A., et al. Detailed molecular fingerprinting of four new anaplastic thyroid carcinoma cell lines and their use for verification of RhoB as a molecular therapeutic target. J. Clin. Endocrinol. Metab. 95, 5338-5347 (2010).
- Nehs, M. A., et al. Late Intervention with anti-BRAF (V600E) therapy induces tumor regression in an orthotopic mouse model of human anaplastic thyroid cancer. Endocrinology. 153, 985-994 (2012).
- Nucera, C., et al. Targeting BRAFV600E with PLX4720 displays potent antimigratory and anti-invasive activity in preclinical models of human thyroid cancer. Oncologist. 16, 296-309 (2011).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。