Method Article
Un modèle de souris orthotopique de cancer de la thyroïde anaplasique
Dans cet article
Résumé
Génération d'un modèle orthotopique murin de carcinome thyroïdien anaplasique est décrite ici. Cette technique utilise mise en place chirurgicale des cellules de cancer de la thyroïde anaplasique de l'homme dans la thyroïde des souris immunodéficientes, créant ainsi un cadre plus cliniquement pertinente pour étudier la progression de la maladie ainsi que l'écran interventions thérapeutiques innovantes.
Résumé
Plusieurs types de modèles animaux de cancers de la thyroïde de l'homme ont été mis en place, y compris sous-cutanée et l'implantation orthotopique xénogreffe de cellules cancéreuses chez des souris immunodéficientes. Des modèles de xénogreffes sous-cutanées ont été précieux pour le dépistage et l'évaluation de nouveaux traitements thérapeutiques précliniques. Il ya un certain nombre d'avantages à utiliser un modèle sous-cutanée; 1) rapide, 2) reproductibles, et 3) la création tumeur, la croissance et la réponse aux agents thérapeutiques peuvent être contrôlés par une inspection visuelle. Toutefois, des preuves substantielles a mis en lumière les lacunes des modèles de xénogreffes sous-cutanées 1-3. Par exemple, les traitements médicamenteux qui démontrent des propriétés curatives dans des modèles de xénogreffes sous-cutanées n'ont souvent pas d'impact notable sur la maladie humaine. Le micro du site de transplantation xénographique ou injection est au cœur de cette dissemblance.
Des modèles de xénogreffes tumorales orthotopiques offrent une plus biologiquement contexte pertinent pour étudier la maladie. Les avantages de l'implantation de cellules ou de tissus malades dans leur origine équivalent anatomique à l'intérieur d'un animal hôte comprend un site approprié pour interactions tumeur-hôte, le développement des métastases liées à la maladie et la possibilité d'examiner l'influence spécifique du site sur les recours thérapeutiques expérimentaux. Par conséquent, des modèles de xénogreffe orthotopique abritent valeur beaucoup plus clinique, car ils se reproduisent étroitement les maladies humaines. Pour ces raisons, un certain nombre de groupes ont tiré parti d'un modèle de cancer de la thyroïde orthotopic comme un outil de recherche 4-7.
Nous décrivons ici une approche qui établit un modèle orthotopique pour l'étude du cancer de la thyroïde anaplasique (ATC), qui est très envahissante, résiste au traitement, et est virtuellement mortelle chez tous les patients diagnostiqués. ATC cellules en culture sont préparés sous forme de suspension cellulaire dissociée dans une solution contenant une matrice de membrane basale. Un petit volume est lentement injecté dans la glande thyroïde droite. L'apparence générale et la santé des souris sont contrôlés pour assurer un minimum de complications post-opératoires et de mesurer pénétrance pathologique du cancer. Les souris sont sacrifiées à 4 semaines, et le tissu est prélevé pour analyse histologique. Les animaux peuvent être prises à temps des points plus tard pour examiner de plus la progression de la progression de la maladie. La production de ce modèle orthotopique de la souris établit une plate-forme qui permet d'atteindre deux objectifs: 1) améliorer notre compréhension de la pathologie ATC, et 2) les agents thérapeutiques actuelles et futures écran d'efficacité dans la lutte contre l'ATC.
Protocole
1. Préparation des cellules
Notes: 1) RPMI 1640 complet basé sur la culture recette médias (500 ml) contient 435 ml de RPMI 1640, 50 ml chaleur FBS inactivé, 5 ml d'acides aminés non essentiels, pyruvate de sodium à 5 ml, 5 ml antibiotique antifongique; 2) le lieu matrigel à 4 ° C un jour avant la récolte des cellules.
- Lignée cellulaire humaine ATC THJ-11T 8 sont cultivées dans des plaques de culture 6 puits et récolté une fois à 80-90% de confluence.
- Sédimenter les cellules par centrifugation à 200 g pendant 4 min à température ambiante.
- Aspirer les médias et suspendre les cellules dans du RPMI 1640 [2 ml / 6 plaque bien].
- Prenez un petit volume de la suspension cellulaire, l'ajouter à un volume de 0,4% de colorant bleu trypan et déterminer la densité cellulaire à l'aide TC10 Compteur de cellules automatisé.
- Calculer le volume de la suspension cellulaire nécessaire pour obtenir 5 x 10 5 cellules / souris fois le nombre des souris par injection.
Note: Pour assurer annonce synonyme suspension cellulaire pour injection, préparer des cellules comme si vous vous injectez le double du nombre de souris (par exemple si l'injection de 5 souris, puis préparer une suspension cellulaire comme si vous étiez en injectant 10 souris).
- Transfert volume nécessaire de la suspension cellulaire dans un tube conique de 15 ml.
- Sédimenter les cellules par centrifugation à 200 g pendant 4 min à température ambiante.
- Aspirer les médias et suspendre les cellules dans complètes 1640 RPMI.
- Transférer les cellules dans un tube de 1,6 ml, ajouter 1 volume de Matrigel et mélanger doucement par pipetage lentement dans et hors.
Note: Chaque souris recevra 10 pl de la suspension / matrigel cocktail cellulaire. Depuis 5 x 10 5 cellules en suspension dans un volume injectable 10 ul ont été utilisés avec succès dans l'ATC précédentes études orthotopiques 9-10, nous avons utilisé ces paramètres dans le présent rapport.
- Placez suspension cellulaire sur la glace jusqu'au moment de servir.
- Nettoyez la zone chirurgicale, qui comprend la dissection et la région avoisinante, en essuyant toutes les surfaces avec de l'éthanol à 70%.
- Allumez les lampes / coussins chauffants où les animaux seront en convalescence.
- Administrer 0,1 ml de kétamine / xylazine (cocktail de médicaments composé de kétamine à 9 mg / ml et xylazine 1mg/ml) par 10 g de corps par voie intrapéritonéale de poids en utilisant un 1 ml, 27G ½ "seringue tuberculine.
- Prep souris pour la chirurgie: 1) Se raser la région du cou de la souris (de la ligne de la mâchoire en haut du sternum et sur les armes), 2) frotter zone chirurgicale trois fois avec chorhexadine carrés de gaze imbibées, 3) gommage finale fait avec de la bétadine gaze imbibée, 4 ) appliquer doucement la pommade oculaire pour éviter les yeux de sécher.
- Vérifiez la pédale réflexe pour assurer la souris est correctement mis sous sédation.
- Placez animaux en décubitus dorsal sur une barrière de champ stérile à usage unique dans le champ de dissection et de sécuriser l'animal en place avec du ruban adhésif en toile.
- Scrubs mains et fingernails puis mettre des gants chirurgicaux stériles.
- D'une manière stérile, la chirurgie ouverte emballer et organiser instruments.
- Placez champ stérile sur animal, ne laissant que le site chirurgical exposée.
3. Surgical accès à la thyroïde et l'injection de cellules
- Utilisation d'un stérile, jetable scalpel, faire une incision longitudinale de 1 à 1,5 cm le long de la ligne médiane de la gorge.
Note: Déviation de la ligne médiane complique plus profond de coupe pour accéder à la trachée. Assez incision médiane précis vous permet de taquiner et de couper à travers le tissu membraneux tenant glandes salivaires gauche et droite ensemble et réduit les risques de entailler ou couper les grandes artères.
- Faire une deuxième incision dans les muscles de la sangle entourant la trachée puis tirez le côté droit du muscle incisé sur le côté pour exposer la glande thyroïde droit.
- Hémostatiques peuvent être utilisés à ce stade de maintenir la couche musculaire uneune partie pour un accès facile à la glande thyroïde (figure 1).
Remarque: Par ailleurs, si la procédure effectuée par deux membres du personnel chirurgical, la couche musculaire peut simplement être freinée avec une pince alors une seringue injectable prêt est remis au chirurgien par le personnel d'assistance.
- Injecter lentement 10 pl de suspension cellulaire dans la glande thyroïde droite à l'aide d'un 31G 5/16 "seringue d'insuline puis retirez délicatement l'aiguille.
4. Fermeture du site opératoire et la récupération de la souris
- couche musculaire de suture avec 6,0 matériau de suture en utilisant soit un modèle de suture continue ou discontinue.
- Piquer la peau de la même façon.
- Appliquer une couche de pommade antibiotique triple directement sur le site d'incision.
- Autoriser l'animal à récupérer en décubitus dorsal sur coussin chauffant chaud. Une fois animal peut atteindre décubitus sternal sans assistance, il peut être placé en arrière avec les autres souris.
5. Le suivi post-opératoire et Tissue Collection
- Consultez le site de l'incision et la santé générale de l'animal tous les jours pendant une semaine après la chirurgie, puis vérifier une fois par semaine. Si les sutures sont encore intactes après 14 jours, ils sont supprimés.
Remarque: Les animaux présentant des signes de détérioration de la santé (par exemple, perte de poids importante, les cheveux débraillés, respiration laborieuse) devrait être euthanasié et tissus collectés.
- Une fois les souris ont atteint un point dans le temps post-opératoire prédéterminé, administrer la kétamine / xylazine comme décrit ci-dessus pour endormir.
- Perfuser animaux intracardiaque et la récolte thyroïde / trachée et autres tissus d'intérêt (pas décrite en détail ici).
Résultats
Nous avons détecté 19 tumeurs de la thyroïde invasives sur un total de 20 souris injectées avec des cellules ATC après 4 semaines. Dans l'exemple illustré à la figure 2A, les souris ayant reçu une injection orthotopique de 5x10 5 cellules ATC cultivées dans des conditions attachées, présentent une infiltration importante de cellules cancéreuses dans la glande thyroïde de 4 semaines après l'injection. La nature des cellules ATC invasion des cellules avec un monobroche caractéristiques et les cellules à moyen et à taille géante avec cytoplasme éosinophile et grands noyaux a été vérifiée par hématoxyline et l'éosine (H & E) coloration. A titre de comparaison, la thyroïde et la trachée d'un animal témoin non injectée est montré dans la figure 2B. Follicules de l'animal non injectée afficher un proche, et pourtant lâche, d'association et avoir essentiellement une morphologie ronde.
En raison de la petite taille de la thyroïde et de l'utilisation de l'accouchement injectable, les résultats non intentionnels peuvent survenir. Figure 3A illustre l'plus couramment observée, ce qui est le développement d'une tumeur à l'extérieur de la masse, mais pas englobant, la thyroïde. C'est plus que probable en raison de la pénétration des aiguilles à travers et au-delà de la thyroïde lorsque les cellules sont expulsés. De temps en temps, les souris présentant pas de croissance tumorale, à la fois grossière et histologiquement, sont détectés comme illustré sur la figure 3B. Absence de développement de la tumeur détectable peut être causé par l'expulsion de la suspension cellulaire à partir du site d'injection et la diffusion dans les tissus et les cavités voisines.
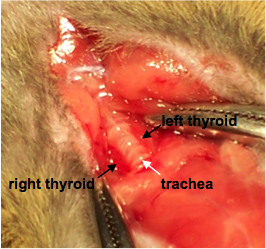
Figure 1. L'exposition de la thyroïde. Les étiquettes indiquent droite et à gauche glande thyroïde flanquant la trachée.
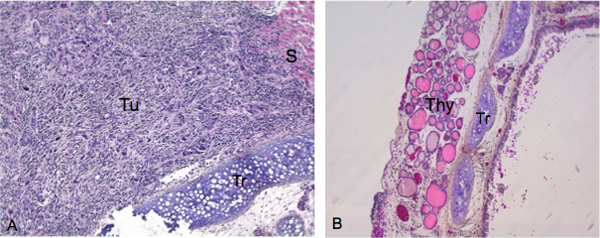
Figure 2. L'examen histologique de la croissance tumorale et dansinvasion après l'injection de la thyroïde avec succès. échantillons de tissus ont été sectionnés le long du plan coronal. A) Image prise à 200X de souris présentant la croissance tumorale importante avec des cellules monobroche caractéristiques et les cellules à moyen et à taille géante avec cytoplasme éosinophile et grands noyaux dans hématoxyline et l'éosine ( H & E) se colorent Tu indique la lésion primaire à partir de laquelle les cellules tumorales envahissent la thyroïde B) la trachée et de la thyroïde de l'animal de contrôle (image prise à 100X) Tu, tumeurs;... S, le muscle lisse; Tr, de la trachée; Thy, la glande thyroïde.
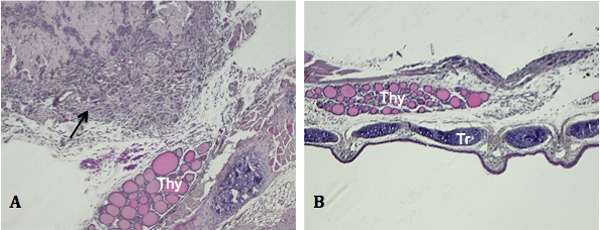
Figure 3. Résultats non intentionnels de l'injection orthotopique. Des échantillons de tissus ont été sectionnés le long du plan coronal. A) la croissance de la tumeur périphérique sans croissance évident dans le thyroid (flèche noire, image prise au 100X). B) L'absence de détection des tumeurs sur brut (non représenté) ou examen histologique (image prise à 50X). Thy, la glande thyroïde.
Discussion
Dans notre modèle, les animaux ont démontré la thyroïde métastase des tumeurs et les maladies liées détresse respiratoire par la cachexie et 4 semaines après l'injection. Comme avec la plupart des autres modèles utilisant orthotopiques livraison injectable d'une suspension de cellules, l'injection dans les tissus environnants et des fuites post-injection qui se propage au-delà de la cible sont possibles. Cela étant dit, une inconnue potentiel reconnaissable produite par cette procédure est l'effet de l'exposition hors cible à des métastases ou des complications non liées à la maladie. Il s'agit d'une préoccupation générale pour la plupart des transplantations xénographique, indépendamment de la maladie à l'étude. Néanmoins, les conséquences non intentionnelles de métastases peuvent être considérablement réduites en assurant toute la biseau de la pointe de l'aiguille a pénétré dans la membrane recouvrant parfaitement la glande thyroïde et expulser lentement la suspension cellulaire. Si une fuite est détectée pendant ou après l'injection, les animaux peuvent être omises de l'étude.
Il est essentiel que les animaux sont perfusés avant la récolte de la thyroïde / trachée et d'autres tissus. La morphologie des tissus et de l'intégrité Les avantages sont doubles, 1) les globules rouges sont purgés et ne seront pas encombrer échantillons histologiques et 2) sont conservés. En outre, une résection thyroïde / trachée qui ont soit une masse tumorale attaché ou sont ensevelis en son sein doit être coupé d'une manière qui repères anatomiques peuvent être identifiés avant d'être embarqués pour la préparation histologique. Cela va considérablement réduire le temps de préparation des échantillons.
Dans ce rapport, nous décrivons la croissance locale et l'invasion de la tumeur de la thyroïde avancé après l'injection orthotopique de cellules ATC. ATC métastases peut être étudiée en analysant les préparations histologiques d'autres tissus en utilisant des colorants histologiques standard, telles que l'hématoxyline et l'éosine, ou par immunohistochimie utilisant des cellules ou des marqueurs pertinents pathologie. Ce système peut être développé par gmodification enetically cellules cancéreuses de la thyroïde avec les journalistes de fluorescence de sorte que l'imagerie en direct peut être utilisé pour surveiller les métastases et l'efficacité des traitements thérapeutiques.
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Les auteurs tiennent à remercier les Drs. Li Wenjun et Daniel Kreisel (Washington University School of Medicine à St. Louis) pour leur aide dans la formation en chirurgie. RYL est soutenu par le National Institutes of Health Grant R01 DK068057 et le Fonds de recherche du président de la Saint Louis University.
matériels
| Name | Company | Catalog Number | Comments |
| RPMI 1640 cell culture media | Mediatech | 10-041-CV | Media and additives used depend on cell line |
| TC10 Automated Cell Counter | Bio-Rad | 145-0001 | |
| Matrigel | Becton, Dickinson and Company | 354234 | |
| Graefe Forceps, Serrated; Slight Curve, 4" | Roboz | RS-5135 | |
| Disposable scalpel, No. 15 | Feather | 2975#15 | |
| Olsen Hegar Needle Holder - 4 ½" delicate serrated | gSource | gS 21.5400 | |
| 6-0 nylon black monofilament suture | Surgical Specialties Corporation | 1279B | |
| Heating Pad, reusable, 8" x 12" | |||
| Cloth tape, 1" X 10 yds | Medline | MIINON260101 | For restraining anesthetized mouse |
| Peanut Clipper/Trimmer | Wahl | 8655 | For removing hair from surgical site |
| ChlorHex-Q SCRUB 2% | Penn Veterinary Supply | VED1222 | |
| Betadine | Henry Schein Company | 6906727 | |
| Petrolatum ophthalmic ointment | Dechra Veterinary Products | 17033-211-38 | |
| 2 x 2 gauze, 12-ply | Butler Animal Health Supply | 6936 | |
| Sterile Field, Barrier, 18" x 26" | Busse | 696 | |
| Drapes (CSR Wrap) | Cardinal Health | AT 21 412 | |
| 27G ½" needle | Becton, Dickinson and Company | 309623 | |
| 31G 5/16" needle | Becton, Dickinson and Company | 328438 | |
| Ketamine (9 mg/ml) / xylazine (1 mg/ml) solution | |||
| Triple antibiotic ointment |
Références
- Bibby, M. C. Orthotopic models of cancer for preclinical drug evaluation: advantages and disadvantages. Eur. J. Cancer. 40, 852-857 (2004).
- Hoffman, R. M. Orthotopic metastatic mouse models for anticancer drug discovery and evaluation: a bridge to the clinic. Invest. New Drugs. 17, 343-359 (1999).
- Killion, J. J., Radinsky, R., Fidler, I. J. Orthotopic models are necessary to predict therapy of transplantable tumors in mice. Cancer Metastasis Rev. 17, 279-284 (1998).
- Kim, S., et al. An orthotopic model of anaplastic thyroid carcinoma in athymic nude mice. Clin. Cancer Res. 11, 1713-1721 (2005).
- Nucera, C., et al. A novel orthotopic mouse model of human anaplastic thyroid carcinoma. Thyroid. 19, 1077-1084 (2009).
- Todaro, M., et al. Tumorigenic and metastatic activity of human thyroid cancer stem cells. Cancer Res. 70, 8874-8885 (2010).
- Tran Cao, H. S., et al. Real-time imaging of tumor progression in a fluorescent orthotopic mouse model of thyroid cancer. Anticancer Res. 30, 4415-4422 (2010).
- Marlow, L. A., et al. Detailed molecular fingerprinting of four new anaplastic thyroid carcinoma cell lines and their use for verification of RhoB as a molecular therapeutic target. J. Clin. Endocrinol. Metab. 95, 5338-5347 (2010).
- Nehs, M. A., et al. Late Intervention with anti-BRAF (V600E) therapy induces tumor regression in an orthotopic mouse model of human anaplastic thyroid cancer. Endocrinology. 153, 985-994 (2012).
- Nucera, C., et al. Targeting BRAFV600E with PLX4720 displays potent antimigratory and anti-invasive activity in preclinical models of human thyroid cancer. Oncologist. 16, 296-309 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon