Method Article
在斑马鱼幼虫的高通量自动化的行为分析
摘要
本实验室开发了一种新的高通量自动化的成像系统,是有用的,用于检测的几个不同的行为,在7天龄的斑马鱼幼虫。该系统可用于检测幼虫后已暴露于环境的有毒物质或药品的行为的微妙的变化,。
摘要
我们已经创建了一个新的高通量成像系统行为的分析,在7日龄的斑马鱼幼虫在多车道板。该系统测量自发行为和厌恶刺激的反应,这是显示PowerPoint演示文稿的幼虫通过 。记录的图像分析与ImageJ的宏,它自动将颜色通道,减去背景,并应用一个阈值,以确定个别幼虫放置在小巷里。然后,我们可以到一个Excel工作表导入坐标量化游泳速度,优先车道的边缘或侧面,休息行为,thigmotaxis,幼虫之间的距离,和回避行为。微妙的变化,行为很容易被发现使用我们的系统,它可用于接触环境毒物或药物后的行为分析。
引言
斑马鱼的遗传,发育和行为科学的1-4成为一种流行的模式。他们从他们的绒毛膜孵化2-3天受精后(DPF),充分发展4-5 DPF功能的器官,并表现出了大量的行为由7 DPF 5,6。斑马鱼幼虫非常适合高通量分析,因为其体积小7,8。软件是市售9-14斑马鱼幼虫和成虫的行为自动分析。然而,这种软件可以是昂贵的,具有有限的选择斑马鱼幼虫多孔板测量复杂的行为。
我们创建了一个新的高吞吐量的成像系统,是廉价的设置和可以量化7单丝旦斑马鱼幼虫15,16中的一些不同的行为。该系统使我们能够快速,高效地测试后胚胎暴露了一些微妙的行为异常药品和环境毒物16-18。
该系统的建成使用木制柜,房子在机柜顶部的一台数码相机。相机朝下柜被放置在一台笔记本电脑,屏幕朝上15的底部。时间推移成像是用来捕捉幼虫放置在小巷里。幼虫可以安装在四个多井或者多车道板被定位在笔记本电脑的屏幕的顶部。我们使用PowerPoint演示文稿作为一个厌恶刺激,幼虫回应移开,以避免向边缘(thigmotaxis)15,17和游泳。 ImageJ的图像导入自动化的宏用来分裂的颜色通道,减去背景和应用的阈值,以确定个别幼虫。坐标都列出了每个幼虫在每个图像,并可以插入一个Excel文件,我们用它来避免和thigmota量化红双喜的行为,鱼鱼类距离,游泳速度,而其余16量。
研究方案
1。斑马鱼胚胎,并提高幼虫的收集
- 高硼硅玻璃菜与“假”的草(由绿色纱)( 图1)应在黎明和插入的坦克,离开了两个小时,以收集斑马鱼的胚胎。的玻璃培养皿中的胚胎应浇在一个手持式过滤器中,并用去离子水漂洗。然后应胚胎生长在蛋水。的卵水中含有60毫克/升的去离子水和0.25 mg / L的亚甲基蓝的,这是用来作为防霉剂的即时海上活动。
- 根据个别实验假说,胚胎可以立即或在特定的发展阶段,使用毒物或药物治疗。的有毒物质和药品通常是溶解在DMSO中(在1,000倍的浓度),应进行进一步的稀释,在蛋水介质直接。
- 在胚胎和幼虫的治疗药品或毒物,幼虫和胚胎可以被安置在深的陪替氏培养皿中在每50毫升的密度为约50-60幼虫,直到7单丝旦(蛋水溶液应该改变至少每隔一天,以避免真菌/细菌生长的行为分析死胚)。
2。准备模具行为分析
- 专门开发的塑料模具测量11.7厘米×7.6厘米×5毫米,在内部构建定制。模具需要创建车道用琼脂糖倒入单井Thermo Scientific的塑料板。单一孔板测量12.4厘米×8.1厘米×1.2厘米。
- 的模具包含5个车道,在它的两侧是有角度的,在60℃。在模具中的各泳道与碱上面的顶部,这是最宽的,而底部的宽度为14毫米的18毫米3.5毫米高。有4毫米的车道在模具之间的间隙( 图2)。
- 为了准备车道融化的琼脂糖倒入50毫升(0.8%琼脂糖去离子D水与60 mg / L的即时海洋)在一个单一的孔板。然后,模具应被放置在非常缓慢的顶部的液体琼脂糖,以消除任何气泡的形成,并可以被删除时琼脂糖冷却(这需要大约45分钟)。
- 琼脂糖车道应不早于前一天运行行为实验(以避免干燥的琼脂糖)的泳道,可在室温下保存在碗碟上的盖大约36小时。琼脂糖车道应该只被用于一项实验中,然后应被丢弃。
3。图像捕捉
- 可放置最多20个幼虫,每个泳道中的板。通常5幼虫每泳道使用,以便最准确的跟踪游泳速度,并减少每次实验所需要的幼虫数。可填充有蛋水带或不带取决于实验的药物或毒物的泳道。然而,泳道不应为f酶联免疫吸附试验(ELISA),直到它们被放置在成像机柜的所有的方式,这将防止溢出。为了保持一致性,幼虫应该有一个驯化时间的10分钟后,它们被放置在琼脂糖模具定位在笔记本电脑的屏幕的顶部。高效移动幼虫从培养皿琼脂糖车道的,将有助于减少幼虫的压力。这是最简单的幼虫被安置在浅水坦克或培养皿。
- 成像柜包括佳能数码相机使用时间推移摄影和一台笔记本电脑。摄像机应放置在机柜的顶部,旨在实现了15.6英寸屏幕的笔记本电脑屏幕朝上( 图3),应放在机柜的底部。四大板块应手工定位的笔记本电脑屏幕上直接。此时车道可以封顶蛋水或化学处理,以便它是级别的顶部车道(以消除阴影的边缘上的升麻醉中的图像)。
- 使用PowerPoint演示文稿的厌恶刺激的幼虫。在过去移动红球,斑马鱼幼虫在6或12多孔板15,17,18。当前的PowerPoint开始的15分钟,然后15分钟的移动板的上半部分( 图4)上的红色条的空白白色背景。为了消除,幼虫过热,最好是购买一台笔记本电脑,屏幕温度不超过28°C。为了避免琼脂糖车道内的液体的蒸发,最大成像时间应保持在低于1小时。
- 数码相机应该被编程为延时摄影,拍照每6秒每实验共300张图片。然而,频率和长度可以调整,根据实验和行为量化。在过去的扩展成像时间被雇用,每幅图像之间使用较长的时间间隔。 CAMER一个可以设置在较低的分辨率进行成像以视频速度(每秒30帧)。虽然较低的分辨率限制到一个单一的多孔板,录音录像适合成像快速游泳赛事15。
4。图像分析
- ImageJ的图像应打开并使用内部专门写宏。宏自动分割可以被删除,使红色的颜色的颜色通道,减去背景,应用一个阈值,并确定通过颗粒分析幼虫。五车道幼虫分析是最当前的宏观Zebrafish_macro25k。使用提示宏设置的图像数量,颜色要减去,图像的阈值,等等。
- 所有的图像后运行通过ImageJ的宏,将显示一个结果文件将包含X,Y坐标个别幼虫为每个影像随着图像数量和车道数量。
- 成果文件应当以Excel格式保存,并根据的空白背景与移动栏背景以及数排序。应使用Excel模板,有方程内置自动确定井安置幼虫,幼虫之间的距离,移动速度,其余金额。最当前的Excel模板25ib创建在Creton实验室,这是可根据要求提供。图应该建立到Excel表显示各治疗组,治疗组和对照组之间的比较用t检验。进一步的统计分析,可以采用SPSS。
结果
在我们较早的检测,使用反弹球厌恶刺激,野生型幼虫,未经处理的响应通过游泳在阱(回避行为)对的阱(行为thigmotaxis)15的边缘移动的球。我们后来证实在这个实验thigmotaxis行为是衡量焦虑相关行为的斑马鱼幼虫17。有显着差异的幼虫运动,远离球和偏好的边缘时相比,空白背景。这些行为也被证实在我们的新的检测使用移动的红色条和更强大的16。此外,我们现在可以品尝包括游泳速度,其余井的一端或侧面的偏爱,和鱼之间的距离( 图5)在一个单一的检测数量较大的行为。控制幼虫生长在蛋水优先增加菜和车道的边缘FTER它们都带有一个厌恶刺激(移动红酒吧)。当幼虫生长在含有1微克/毫升DMSO的溶剂,通常用为1,000倍的储备溶液以溶解各种药品和有毒物质的蛋水时,得到类似的结果。
幼虫用鸡蛋水和DMSO(对照)和有不同浓度的非有机食品中常见的有机磷农药,代表性的结果如图5所示。所示的结果是从一个实验中的采样。然而,当重复的,结果表明游泳速度和thigmotaxis行为的改变而低浓度的有机磷农药,它模仿人类的食物消费水平18。

图1。收集盘。玻璃耐热菜是用来收集电子邮件mbryos从成人鱼缸。从高硼硅菜盖被切断,插入塑料电网和绿色纱缝上塑料电网。这将创建一个模仿自然的环境氛围的成年斑马鱼养殖。

图2。塑料模具和琼脂糖车道。 A)的模具如左图所示。 0.8%琼脂糖倒入一孔板,模具被缓慢插入,然后除去琼脂糖冷却时,B)在右边显示板琼脂糖的塑料模具中创建的车道。

图3。成像柜成像柜speciallŸ内置在我们的实验室和用于高通量行为分析。一个15万像素的数码相机被安装到机柜的顶部朝下,以收集时间的推移幼虫的递板放置一台笔记本电脑的屏幕上的图像。板和屏幕之间的是一个塑料的扩压器,用于在收集到的图像,以防止波纹图案。

图4。空白背景和PowerPoint厌恶的刺激 , 这是当前PowerPoint,用于唤起在斑马鱼幼虫的行为变化。它提供了强大的A)空白的背景和B)移动红杠之间的行为差异。
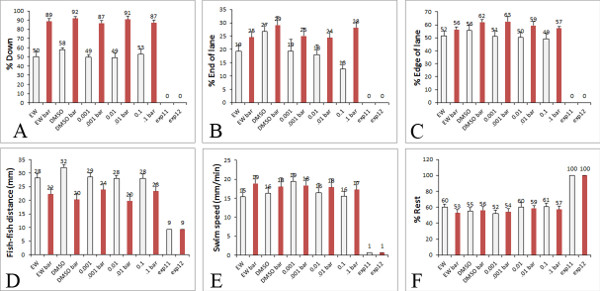
图5。定量高通量检测的行为,例如,从我们的行为,我们使用Excel工作表的x,y坐标的幼虫内检测量化的行为。白条幼虫暴露到一个空白的背景,红柱红动条的幼虫暴露在PowerPoint中显示数据显示数据。这些图表显示测量结果,可以得到从行为分析)幼虫占车道,B)幼虫百分比的车道上,C)幼虫上的车道边缘的百分比,D)之间的距离鱼(毫米),E),游泳速度的幼虫(毫米/分钟),F)占其余的幼虫。在所示的曲线图,数据是从treatm耳鼻喉科的幼虫用DMSO控制和几种农药的浓度从0.001到0.1微米(发现在人类饮食中常见的水平)。 点击这里查看大图 。
讨论
虽然我们不断地改善我们的新型行为检测,它一直是有用的检测在斑马鱼幼虫15的的避免和thigmotaxis行为。许多试验已经进行优化的化验结果,如所用颜色刺激,理想的数字幼虫每车道,长度和行为检测。以前,我们用多孔板(6孔或12孔)15,17,18。然而,最近我们已经创建了新型车道模具的幼虫,让我们聚集了大量行为的措施,在一个单一的含量16( 图5)创建一个更大的游动空间。其他修改包括显示的PowerPoint演示的变化(改变检测运动或长度)的大小(我们也有更狭窄的小巷模具)车道。
目前,这种高通量的自动化系统是独一无二的,它能够测量大范围的行为zebrafish幼虫,如速度,回避,接近其他幼虫和多车道板thigmotaxis的,在相同的时间。结果可以得到快速,在成像时,可以分析大量的幼虫。该系统是既便宜构建和快速,易于设置。这个系统的一个局限是无法评估的3-D运动在斑马鱼幼虫。跟踪成年斑马鱼的自动化系统,具有3-D的能力,并能识别范围更广的行为,例如向上或向下运动内的水柱10,19。另一个限制是,目前我们的成像系统未优化视频速度高通量分析。视频速度成像是可以将相机设置为较低的分辨率15时,但是这限制了分析,以一个单一的板块。
在使用新创建的“车道”的方法,精确地检测几个部分需要执行。当幼虫放置在t他车道,这是至关重要的,以确保液体水平很浅,直至将板定位在笔记本电脑的屏幕的顶部。如果车道得太满了液体,幼虫会逃逸到该板的外周。此外,当插入到琼脂糖模具,必须采取降低模具非常缓慢。如果模具的插入速度太快,气泡将形成在琼脂糖中,将确定的图像J宏作为额外的幼虫。据表示,如果琼脂糖车道甚至有几个气泡,最好是结交新朋友。
在未来,我们希望优化我们的行为的检测,以分析其他复杂的行为,如在斑马鱼幼虫的学习和研究如何学习可能会受到暴露在早期发展中的有毒物质和药品。我们目前正在检测分析学习行为,即行为的结果可能有助于确定哪些脑区,可能是有用的在开发过程中受到某些毒物或药物。自动检测已开发出用于测量学习行为的斑马鱼幼虫20和这些实验可能是可修正通过使用强大的回避反应在多车道板的高通量筛选。
我们建议,在今后的研究中,这种行为可以用来检测测试了大量的药品和有毒物质的发展的影响。此类研究提供了丰富的信息,对特定的风险因素,有助于制定出更好的怀孕妇女和儿童的健康和安全指引。
披露声明
作者宣称,他们有没有竞争经济利益。
致谢
我们感谢肖恩Pelkowski的协助优化的行为检测。这项工作是由美国国家儿童健康和人类发展研究所,R01 HD060647和全国环境卫生科学研究所,F32 ES021342和R03 ES017755支持。
材料
| Name | Company | Catalog Number | Comments |
| Reagent | |||
| Instant Ocean | That Pet Place | 198262 | |
| Agarose | Fisher | BP1356-100 | |
| Methylene Blue | That Pet Place | 214325 | |
| Equipment | |||
| One well plates | Fisher | 12-565-493 | |
| Digital camera | Canon | EOS Rebel T1i | |
| Imaging Cabinets | WoodCraft Towers | ||
| Laptops | Acer Aspire | Any is good as long as it has a 15.6 in. LCD screen with 1366 x 768 pixel resolution and a brightness of 220 cd/m2. | |
| Camera Lens | Canon | EF-S 55 - 250 mm f/4.0 - 5.6 IS zoom lens | |
| Plastic diffuser | Pendaflex | 52345 | |
| Software | |||
| PowerPoint 2010 | Microsoft | ||
| ImageJ | NIH | http://rsb.info.nih.gov/ij/ | |
| Excel 2010 | Microsoft | ||
| Statistical software | SPSS 20 | ||
参考文献
- Gerlai, R., Lahav, M., Guo, S., Rosenthal, A. Drinks like a fish: zebra fish (Danio rerio) as a behavior genetic model to study alcohol effects. Pharmacol. Biochem. Behav. 67, 773-782 (2000).
- Selderslaghs, I. W. T., Hooyberghs, J., De Coen, W., Witters, H. E. Locomotor activity in zebrafish embryos: A new method to assess developmental neurotoxicity. Neurotoxicol. Teratol. 32, 460-471 (2010).
- Norton, W., Bally-Cuif, L. Adult zebrafish as a model organism for behavioural genetics. BMC Neuroscience. 11, 90 (2010).
- Levin, E. D., Cerutti, D., Buccafusco, J. J. Ch. 15. Methods of behavioral analysis in neuroscience. , (2009).
- Kimmel, C., Ballard, W., Kimmel, S., Ullmann, B., Schilling, T. Stages of embryonic development of the zebrafish. Dev. Dyn. , 203-253 (1995).
- Westerfield, M. . The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio). , (2007).
- Kokel, D., Bryan, J., et al. Rapid behavior-based identification of neuroactive small molecules in the zebrafish. Nat. Chem. Biol. 6, 231-237 (2010).
- Rihel, J., Prober, D. A., et al. Zebrafish Behavioral Profiling Links Drugs to Biological Targets and Rest/Wake Regulation. Science. 327, 348-351 (2010).
- Cachat, J., Stewart, A., et al. Measuring behavioral and endocrine responses to novelty stress in adult zebrafish. Nat. Protoc. 5, 1786-1799 (2010).
- Cachat, J., Stewart, A., et al. Three-Dimensional Neurophenotyping of Adult Zebrafish Behavior. PLoS ONE. 6, e17597 (2011).
- Sledge, D., Yen, J. Critical duration of exposure for developmental chlorpyrifos-induced neurobehavioral toxicity. Neurotoxicol. Teratol. 33, 742-751 (2011).
- Stewart, A., Wu, N. Pharmacological modulation of anxiety-like phenotypes in adult zebrafish behavioral models. Prog. Neuropsychopharmacol. Biol. Psychiatry. 35, 1421-1431 (2011).
- Eddins, D., Cerutti, D., Williams, P., Linney, E., Levin, E. D. Zebrafish provide a sensitive model of persisting neurobehavioral effects of developmental chlorpyrifos exposure: comparison with nicotine and pilocarpine effects and relationship to dopamine deficits. Neurotoxicol. Teratol. 32, 99-108 (2010).
- Emran, F., Rihel, J., Dowling, J. A behavioral assay to measure responsiveness of zebrafish to changes in light intensities. J. Vis. Exp. (20), e923 (2008).
- Pelkowski, S., Kapoor, M., et al. A novel high-throughput imaging system for automated analyses of avoidance behavior in zebrafish larvae. Behav. Brain Res. 223, 135-144 (2011).
- Richendrfer, H., Pelkowski, S., et al. Assessment of developmental toxicity by automated analyses of behavior in zebrafish larvae. Unpublished observations. , (2012).
- Richendrfer, H., Pelkowski, S., Colwill, R. M., Creton, R. On the edge: pharmacological evidence for anxiety-related behavior in zebrafish larvae. Behav. Brain Res. 228, 99-106 (2012).
- Richendrfer, H. A., Pelkowski, S., Colwill, R., Creton, R. Developmental sub-chronic exposure to chlorpyrifos reduces anxiety-related behavior in zebrafish larvae. Neurotoxicol. Teratol. , (2012).
- Egan, R. J., Bergner, C. L., et al. Understanding behavioral and physiological phenotypes of stress and anxiety in zebrafish. Behav. Brain Res. 205, 38-44 (2009).
- Colwill, R., Creton, R., Kalluef, A., Stewart, A. . Zebrafish protocols for neurobehavioral research. 66, (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。