Method Article
Automatizados análises comportamentais de alto rendimento em larvas do peixe
Neste Artigo
Resumo
O nosso laboratório desenvolveu um novo sistema de imagem automatizado de alto débito, que é útil para a detecção de vários comportamentos diferentes em larvas de peixe-zebra de 7 dias de idade. O sistema pode ser utilizado para detectar alterações subtis no comportamento após as larvas foram expostas a agentes tóxicos ambientais ou de produtos farmacêuticos.
Resumo
Nós criamos um novo sistema de imagem de alto rendimento para a análise do comportamento em larvas do peixe de 7 dias de idade, em placas multi-pista. Este sistema mede comportamentos espontâneos ea resposta a um estímulo aversivo, o que é mostrado para as larvas através de uma apresentação de PowerPoint. As imagens gravadas são analisados com uma macro ImageJ, que divide automaticamente os canais de cor, subtrai o fundo, e aplica-se um limite de identificar a colocação larvas indivíduo nas pistas. Podemos, então, importar as coordenadas em uma folha de Excel para quantificar a velocidade de nado, preferência por borda ou na lateral da pista, o comportamento descansar, tigmotatismo, distância entre larvas e comportamento de evitação. Mudanças sutis no comportamento são facilmente detectados utilizando nosso sistema, tornando-o útil para análises comportamentais após a exposição a substâncias tóxicas ou produtos farmacêuticos ambientais.
Introdução
Zebrafish estão se tornando um modelo popular de ciências genéticas, comportamentais e de desenvolvimento 1-4. Chocam de seus córions por 2-3 dias após a fertilização (dpf), desenvolver plenamente os órgãos que funcionam por 4-5 dpf, e exibem um grande número de comportamentos por 7 dpf 5,6. Larvas do peixe são ideais para análises de alto rendimento por causa de seu pequeno tamanho 7,8. O software está disponível comercialmente para análises automatizadas de comportamento em larva e adulto zebrafish 9-14. No entanto, este software pode ser caro e possui opções limitadas de medição comportamentos complexos de larvas de peixe-zebra em placas de multi-poços.
Criamos um novo sistema de imagem de alto rendimento que é barato para configurar e pode quantificar uma série de comportamentos diferentes em sete dpf larvas do peixe 15,16. O sistema permite testar de forma rápida e eficiente subtis alterações comportamentais após exposição embrionário para uma série deprodutos farmacêuticos e substâncias tóxicas ambientais 16-18.
O sistema foi construído com armários de madeira, que abrigam uma câmara digital na parte superior do gabinete. A câmara fique virada para baixo para a parte inferior do armário em que um computador portátil é colocado com a tela voltada para cima 15. Lapso de tempo de imagem é usado para capturar a colocação das larvas nas pistas. As larvas podem ser alojados em até quatro placas de poços múltiplos ou multi-lane que estão posicionados no topo da tela do laptop. Usamos uma apresentação do PowerPoint como um estímulo aversivo para que as larvas responder, afastando-se (esquiva) e nadar para a borda (tigmotatismo) 15,17. As imagens são importadas para ImageJ em que uma macro automática é usado para dividir os canais de cor, subtraia o fundo, e um limiar para identificar larvas individual. As coordenadas são listadas para cada larva em cada imagem e pode ser inserido num ficheiro Excel que usamos para quantificar evitação e thigmotacomportamento xis, peixe a distância dos peixes, nadar a velocidade ea quantidade de repouso 16.
Protocolo
1. Coleta de embriões Zebrafish e Raising Larvas
- PYREX pratos com grama "fake" (feito a partir de fios verde) (Figura 1) deve ser inserido nos tanques de madrugada e saiu em duas horas, a fim de coletar embriões de peixe-zebra. Os pratos de vidro e contendo os embriões devem ser derramada sobre uma peneira manual e enxaguado com água desionizada. Os embriões devem ser cultivados em água de ovo. A água de ovo contém 60 mg / L de Instant Ocean em água desionizada e 0,25 mg / L de azul de metileno, que é utilizado como um inibidor de molde.
- Dependendo da hipótese da experiência individual, os embriões podem ser tratados imediatamente ou durante os estágios de desenvolvimento específicos usando substâncias tóxicas ou de produtos farmacêuticos. Os agentes tóxicos e produtos farmacêuticos são geralmente dissolvidos em DMSO (a uma concentração de 1000 X) e deve ser diluído directamente na água do meio ovo.
- Durante o tratamento embrionário e larval com fármacos ou tóxicoss, as larvas e os embriões podem ser alojados em pratos de Petri de profundidade, a uma densidade de cerca de 50-60 larvas por 50 ml até que as análises de comportamento de 7 dpf (solução aquosa de ovo deve ser alterada, pelo menos, a cada dois dias, para evitar o crescimento de fungos / bacteriana a partir de embriões mortos).
2. Preparando Moldes de Análises Comportamentais
- Especialmente desenvolvido moldes de plástico que medem 11,7 centímetros x 7,6 centímetros x 5 mm foram custom-built in-house. Os moldes são necessários para criar pistas usando agarose que é derramado em placas de plástico bem simples de Thermo Scientific. A única medida placas bem 12,4 centímetros x 8,1 centímetros x 1,2 cm.
- Os moldes contêm cinco pistas em que os lados são inclinadas a 60 °. As pistas nos moldes estão a 3,5 mm de altura, com uma base de 18 mm na parte superior, que é a mais larga que a largura da parte inferior é de 14 mm. Existe uma diferença de 4 mm entre as faixas no molde (Figura 2).
- Para preparar as pistas de deitar 50 ml de agarose fundida (0,8% de agarose em deionized de água com 60 mg / L de Instant Ocean) numa única placa com cavidades. O molde deve então ser colocados de forma muito lenta no topo do líquido de agarose para eliminar qualquer formação de bolhas e pode ser removido quando a agarose foi arrefecida (o que demora cerca de 45 min.)
- As pistas de agarose não deve ser feita no início de um dia antes da experiência de comportamento está a ser executado (para evitar a secagem de agarose) As pistas podem ser armazenadas à temperatura ambiente, com as tampas dos pratos para até cerca de 36 horas. As pistas de agarose deve ser usado apenas para uma experiência e deve, então, ser descartado.
3. Captura de Imagem
- Até 20 larvas podem ser colocados em cada pista das placas. Tipicamente 5 larvas por cada pista são utilizados para facilitar o rastreamento mais preciso da velocidade de mergulho e para reduzir o número de larvas que são necessárias por ensaio. As pistas podem ser cheios com água de ovo com ou sem fármacos ou substâncias tóxicas, dependendo da experiência. No entanto, as pistas não deve ser filled por todo o caminho até que sejam colocados nos armários de imagem, o que irá evitar transbordamento. Por razões de consistência, as larvas devem ter um período de aclimatação de 10 minutos depois de serem colocados nos moldes de agarose e posicionado na parte superior do ecrã do computador portátil. Eficientemente mover as larvas a partir da placa de Petri para a agarose pista vai ajudar a reduzir o estresse larvas. Isto é mais fácil quando as larvas estão alojados em tanques rasos ou em placas de Petri.
- Os armários de imagem incluem uma câmera digital Canon usado para a fotografia time-lapse e um laptop. A câmara deverá ser colocada na parte superior do armário e dirigido para a parte inferior do armário em que uma tela de 15,6 polegadas portátil deve ser colocado com a tela voltada para cima (figura 3). Quatro placas devem ser posicionados à mão diretamente no topo da tela do laptop. Neste momento, as pistas podem ser recheados com água ovo ou tratamento químico de modo que é nivelado com o topo da pista (para eliminar as sombras sobre as bordas do lanes nas imagens).
- Uma apresentação PowerPoint é usado como um estímulo aversivo para as larvas. Nos últimos móveis bolas vermelhas foram mostradas para larvas de peixe-zebra em 6 ou 12 multi-bem placas 15,17,18. A corrente PowerPoint inicia com um fundo em branco durante 15 min, seguido por 15 min de uma barra vermelha em movimento na metade de cima da placa (Figura 4). A fim de eliminar o superaquecimento das larvas, é melhor comprar um laptop com uma temperatura de tela que não vai acima de 28 ° C. Para evitar a evaporação do líquido no interior das pistas de agarose, o tempo de imagem máxima deve ser mantida abaixo de uma hora.
- A câmera digital deve ser programada para a fotografia time-lapse, tirando fotos a cada 6 segundos para um total de 300 imagens por experiência. No entanto, a frequência e duração podem ser ajustados dependendo da experiência e quantificação comportamental. Nos últimos tempos imagiologia extensas foram empregues usando intervalos mais longos entre cada imagem. O cameruma pode ser definida em uma resolução mais baixa para imagens em alta velocidade de vídeo (30 frames por segundo). Enquanto a resolução mais baixa limita as gravações para uma única chapa vários poços, as gravações de vídeo são apropriados para imagens rápidas eventos de natação 15.
4. Análise de Imagem
- As imagens devem ser abertos com ImageJ e usado com uma macro que foi escrito especificamente em casa. A macro automaticamente separa os canais de cor de modo a que a cor vermelha podem ser removidos, subtrai do fundo, aplica-se um limiar, e identifica as larvas através de análise de partículas. O macro mais atual para cinco análise larval pista é Zebrafish_macro25k. Use as instruções na macro para definir o número de imagens, cor a ser subtraído, o limiar de imagem, etc
- Depois que todas as imagens são executados através da macro ImageJ, um arquivo de resultados serão apresentados e conterá coordenadas x, y das larvas individual para cada imagem, juntamente com o número da imagem eo número de pista.
- O arquivo de resultados devem ser salvos em um formato Excel e classificadas com base em fundo branco contra o fundo móvel bar e, em seguida, o número também. Um modelo do Excel deve ser utilizado que tem equações construídas em que determina automaticamente a colocação das larvas nos poços, a distância entre as larvas, velocidade de movimento, e da quantidade de descanso. O modelo mais atual do Excel é 25ib criado no laboratório Creton, que está disponível mediante solicitação. Os gráficos que mostram os vários grupos de tratamento deve ser construído na folha de Excel, juntamente com os testes t para comparação entre os grupos de tratamento e controle. Posterior análise estatística pode ser realizada usando SPSS.
Resultados
Nos nossos ensaios anteriores, utilizando a bola que salta estímulo aversivo, larvas tipo selvagem, que são tratadas para responder a bola em movimento, nadando para baixo no poço (comportamento de evasão) e na direcção das bordas do poço (comportamento tigmotatismo) 15. Mais tarde confirmado que o comportamento tigmotatismo neste ensaio é uma medida do comportamento da ansiedade relacionada com larvas do peixe 17. Havia diferenças significativas na circulação larvas longe da bola e de preferência para o bordo, quando comparado com o fundo em branco. Esses comportamentos também foram confirmados em nosso novo ensaio com a barra vermelha que se deslocam e são ainda mais robusta 16. Além disso, podemos agora experimentar um maior número de comportamentos em um único ensaio, incluindo a velocidade de natação, de descanso, de preferência para o final ou no lado do bem, ea distância entre os peixes (Figura 5). Larvas de controlo cultivadas na água ovo mostram um aumento da preferência a ser baixo no prato e na extremidade da pista de umepois eles são apresentados com um estímulo aversivo (movendo barra vermelha). Resultados semelhantes são obtidos quando as larvas são cultivadas em ovos de água contendo 1 ug / ml de DMSO, um solvente, que é normalmente utilizado para dissolver os diferentes produtos farmacêuticos e substâncias tóxicas como soluções de 1,000 X.
Os resultados representativos são mostrados na Figura 5 em larvas tratadas com água e DMSO ovo (como controlos) e concentrações variadas de um dos pesticidas organofosforados comumente encontrados em alimentos não biológicos. Os resultados mostrados são de uma amostra a partir de um experimento. No entanto, quando repetida, os resultados indicam que a velocidade de mergulho e comportamento tigmotatismo é alterada por baixas concentrações de pesticidas organofosforados, que imitam os níveis de consumo humano 18.

Figura 1. Bandejas de cobrança. Pratos de vidro Pyrex são usados para coletar embryos dos tanques de peixes adultos. As tampas dos pratos Pyrex foram cortados e inseridos com grades de plástico e fio verde foi costurado para as grades do plástico. Isto cria uma atmosfera fértil para o peixe-zebra adultos, imitando o meio ambiente natural.

Figura 2. Molde plástico e pistas de agarose. A) O molde é mostrado à esquerda. 0,8% de agarose é vertida sobre uma placa de um poço, o molde é introduzido lentamente e em seguida removido quando o agarose arrefecida B) A placa da direita mostra as vias criadas em agarose por o molde de plástico..

Figura 3. Armários de imagem. Armários de imagem foram specially construída no nosso laboratório e utilizados para análises de comportamento de alto rendimento. A 15 megapixel câmera digital foi anexado ao topo do gabinete virada para baixo, a fim de reunir imagens de lapso de tempo das larvas em placas multilane colocados no topo da tela de um laptop. Entre as placas e a tela existe um difusor de plástico que é utilizado para evitar padrões ondulados nas imagens recolhidas.

Figura 4. Fundo branco e PowerPoint estímulo aversivo. Este é o atual PowerPoint que é usado para evocar mudanças comportamentais em larvas do peixe. Ele fornece as diferenças de comportamento entre os robustos A) o fundo branco e B) a barra vermelha em movimento.
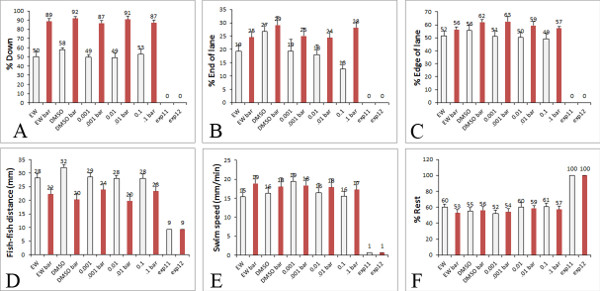
Figura 5. Comportamentos quantificados no ensaio de alto rendimento. Exemplo dos comportamentos que são quantificados a partir de nosso ensaio comportamental dentro da folha de Excel que usamos para x, y coordenadas das larvas. As barras brancas mostram os dados de larvas expostas a um fundo branco e as barras vermelhas mostram os dados do larvas expostas ao bar móvel vermelho no PowerPoint. Os gráficos indicam que as medições podem ser obtidas a partir de análise comportamental A) Percentagem de larvas para baixo na pista, B) Percentagem de larvas no final da pista, C) Percentagem de larvas na borda da pista, D) Distância entre peixe (mm), E) Swim velocidade das larvas (mm / min), F) Percentagem resto das larvas. Nos gráficos apresentados, os dados são de Treatment de larvas com controle DMSO e várias concentrações de um pesticida que vão ,001-,1 mM (níveis comumente encontrados na dieta humana). Clique aqui para ver a figura maior .
Discussão
Enquanto estamos melhorando continuamente nosso ensaio comportamental novela, tem sido sempre útil para a detecção de evasão e comportamento tigmotatismo em larvas do peixe 15. Muitos ensaios foram realizados a fim de optimizar os resultados do ensaio, tais como a cor do estímulo utilizada, o número ideal de larvas por pista, e duração de ensaio comportamental. Anteriormente, foram utilizados placas multi-poços (com 6 ou 12 poços) 15,17,18. No entanto, recentemente, criaram a novel pista molde para criar um espaço maior para a natação larvas que nos permite recolher um número maior de medições comportamentais num ensaio de 16 (Figura 5). Outras modificações incluem as variações do PowerPoint mostrado (circulação alterados ou comprimento de ensaio) e o tamanho das vias utilizadas (também temos moldes para pistas mais estreitas).
Atualmente, este sistema automatizado de alto rendimento é única em sua capacidade de medir uma grande variedade de comportamentos em ZEBRlarvas afish, ao mesmo tempo, tais como a velocidade, a evasão, a proximidade de outras larvas, e tigmotatismo em placas de multi-lane. Os resultados podem ser obtidos mais rapidamente e de um grande número de larvas podem ser analisados o tempo de imagiologia. O sistema é barata para construir e rápido e fácil de configurar. A limitação deste sistema é que os movimentos 3-D não pode ser avaliada em larvas do peixe-zebra. Os sistemas automatizados que acompanham peixe-zebra adulto tem a capacidade 3-D e pode identificar uma ampla gama de comportamentos tais como o movimento para cima ou para baixo na coluna de água 10,19. Outra limitação é que o nosso sistema de imagem atualmente não é otimizado para análises de alto rendimento em velocidade vídeo. Imaging velocidade vídeo é possível quando se configurar a câmera para uma resolução inferior 15, mas isso restringe a análise a um único prato.
Ao utilizar o método recentemente criado "pista", várias partes do ensaio necessária para ser executada de um modo preciso. Ao colocar as larvas em tele pistas, é fundamental para garantir que o nível de líquido é muito superficial, até as placas estão posicionadas no topo da tela do laptop. Se as pistas estão cheias de líquido, as larvas irão escapar para a periferia da placa. Além disso, quando se insere o molde em que a agarose, os cuidados devem ser tomados para baixar o molde muito lentamente. Se o molde é inserido demasiado depressa, formam-se bolhas de agarose e será identificada pelo J macro imagem como larvas adicional. É aconselhável que se as pistas de agarose tem até algumas bolhas, é melhor fazer novos.
No futuro, gostaríamos de otimizar nosso ensaio comportamental para analisar outros comportamentos complexos como a aprendizagem em larvas do peixe e examinar como o aprendizado pode ser afetado pela exposição a substâncias tóxicas e medicamentos no início do desenvolvimento. Estamos atualmente trabalhando em ensaios que podem ser úteis para analisar o comportamento de aprendizagem em que os resultados comportamentais podem facilitar a determinação de quais áreas do cérebro sãoafetados por certas substâncias tóxicas ou de produtos farmacêuticos durante o desenvolvimento. Ensaios automatizados foram desenvolvidos para medir a comportamentos em larvas do peixe 20 e estes ensaios de aprendizagem pode ser modificável para rastreio de alto rendimento, utilizando a resposta evitação robusto em placas de multi-lane.
Propomos que este ensaio comportamental poderia ser usada em estudos futuros para testar os efeitos do desenvolvimento de um grande número de produtos farmacêuticos e substâncias tóxicas. Tais estudos fornecem uma riqueza de informações sobre os fatores de risco específicos e contribuir para definir melhor as diretrizes de segurança e saúde para as mulheres grávidas e crianças.
Divulgações
Os autores declaram que não têm interesses financeiros concorrentes.
Agradecimentos
Agradecemos Sean Pelkowski para assistência na otimização do ensaio comportamental. Este trabalho foi apoiado pelo Instituto Nacional de Saúde Infantil e Desenvolvimento Humano, R01 HD060647 e do Instituto Nacional de Ciências de Saúde Ambiental, F32 e R03 ES021342 ES017755.
Materiais
| Name | Company | Catalog Number | Comments |
| Reagent | |||
| Instant Ocean | That Pet Place | 198262 | |
| Agarose | Fisher | BP1356-100 | |
| Methylene Blue | That Pet Place | 214325 | |
| Equipment | |||
| One well plates | Fisher | 12-565-493 | |
| Digital camera | Canon | EOS Rebel T1i | |
| Imaging Cabinets | WoodCraft Towers | ||
| Laptops | Acer Aspire | Any is good as long as it has a 15.6 in. LCD screen with 1366 x 768 pixel resolution and a brightness of 220 cd/m2. | |
| Camera Lens | Canon | EF-S 55 - 250 mm f/4.0 - 5.6 IS zoom lens | |
| Plastic diffuser | Pendaflex | 52345 | |
| Software | |||
| PowerPoint 2010 | Microsoft | ||
| ImageJ | NIH | http://rsb.info.nih.gov/ij/ | |
| Excel 2010 | Microsoft | ||
| Statistical software | SPSS 20 | ||
Referências
- Gerlai, R., Lahav, M., Guo, S., Rosenthal, A. Drinks like a fish: zebra fish (Danio rerio) as a behavior genetic model to study alcohol effects. Pharmacol. Biochem. Behav. 67, 773-782 (2000).
- Selderslaghs, I. W. T., Hooyberghs, J., De Coen, W., Witters, H. E. Locomotor activity in zebrafish embryos: A new method to assess developmental neurotoxicity. Neurotoxicol. Teratol. 32, 460-471 (2010).
- Norton, W., Bally-Cuif, L. Adult zebrafish as a model organism for behavioural genetics. BMC Neuroscience. 11, 90 (2010).
- Levin, E. D., Cerutti, D., Buccafusco, J. J. Ch. 15. Methods of behavioral analysis in neuroscience. , (2009).
- Kimmel, C., Ballard, W., Kimmel, S., Ullmann, B., Schilling, T. Stages of embryonic development of the zebrafish. Dev. Dyn. , 203-253 (1995).
- Westerfield, M. . The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio). , (2007).
- Kokel, D., Bryan, J., et al. Rapid behavior-based identification of neuroactive small molecules in the zebrafish. Nat. Chem. Biol. 6, 231-237 (2010).
- Rihel, J., Prober, D. A., et al. Zebrafish Behavioral Profiling Links Drugs to Biological Targets and Rest/Wake Regulation. Science. 327, 348-351 (2010).
- Cachat, J., Stewart, A., et al. Measuring behavioral and endocrine responses to novelty stress in adult zebrafish. Nat. Protoc. 5, 1786-1799 (2010).
- Cachat, J., Stewart, A., et al. Three-Dimensional Neurophenotyping of Adult Zebrafish Behavior. PLoS ONE. 6, e17597 (2011).
- Sledge, D., Yen, J. Critical duration of exposure for developmental chlorpyrifos-induced neurobehavioral toxicity. Neurotoxicol. Teratol. 33, 742-751 (2011).
- Stewart, A., Wu, N. Pharmacological modulation of anxiety-like phenotypes in adult zebrafish behavioral models. Prog. Neuropsychopharmacol. Biol. Psychiatry. 35, 1421-1431 (2011).
- Eddins, D., Cerutti, D., Williams, P., Linney, E., Levin, E. D. Zebrafish provide a sensitive model of persisting neurobehavioral effects of developmental chlorpyrifos exposure: comparison with nicotine and pilocarpine effects and relationship to dopamine deficits. Neurotoxicol. Teratol. 32, 99-108 (2010).
- Emran, F., Rihel, J., Dowling, J. A behavioral assay to measure responsiveness of zebrafish to changes in light intensities. J. Vis. Exp. (20), e923 (2008).
- Pelkowski, S., Kapoor, M., et al. A novel high-throughput imaging system for automated analyses of avoidance behavior in zebrafish larvae. Behav. Brain Res. 223, 135-144 (2011).
- Richendrfer, H., Pelkowski, S., et al. Assessment of developmental toxicity by automated analyses of behavior in zebrafish larvae. Unpublished observations. , (2012).
- Richendrfer, H., Pelkowski, S., Colwill, R. M., Creton, R. On the edge: pharmacological evidence for anxiety-related behavior in zebrafish larvae. Behav. Brain Res. 228, 99-106 (2012).
- Richendrfer, H. A., Pelkowski, S., Colwill, R., Creton, R. Developmental sub-chronic exposure to chlorpyrifos reduces anxiety-related behavior in zebrafish larvae. Neurotoxicol. Teratol. , (2012).
- Egan, R. J., Bergner, C. L., et al. Understanding behavioral and physiological phenotypes of stress and anxiety in zebrafish. Behav. Brain Res. 205, 38-44 (2009).
- Colwill, R., Creton, R., Kalluef, A., Stewart, A. . Zebrafish protocols for neurobehavioral research. 66, (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados