Method Article
检测现场的
摘要
H7定位独特的遗传标记,Z3276:一个定量PCR法检测检测大肠杆菌 O157发展。在定量PCR是结合单叠氮丙啶(PMA)处理活细胞检测。这个协议已经被修改,并适于方便和一致地处理大量样品的96孔板格式
摘要
独特的开放阅读框(ORF)Z3276被确定为特定遗传标志为E.大肠杆菌 O157:H7。 qPCR实验是检测大肠杆菌的开发大肠杆菌 O157:H7通过靶向ORF Z3276。用此方法,我们可以检测低至大肠杆菌的DNA的基因组的拷贝数大肠杆菌 O157:H7。该测定的灵敏度和特异性通过用大量的大肠杆菌的密集验证试验被证实大肠杆菌 O157:H7的菌株(N = 369)和非0157株(N = 112)。此外,我们结合了单叠氮丙啶(PMA)过程与新开发的qPCR协议,用于选择性检测从死细胞的活细胞。从PMA治疗的死细胞DNA扩增几乎完全相反,从PMA处理的活细胞中的DNA几乎不受放大抑制。此外,该协议已经被修改,并适于为一个简单的,一致的处理大量样品的96孔板格式。 Ŧ他的方法,预计将有准确的微生物和流行病学监测食品安全和环境光源的影响。
引言
PCR是一种常用的技术进行检测大肠杆菌的大肠杆菌 O157:从食品和环境样本H7。确定为E.特定生物标志物大肠杆菌 O157:H7是其中的关键因素成功的检测PCR方法之一。常用的PCR分析检测大肠杆菌的生物标志物大肠杆菌 O157:H7包括志贺毒素(STX 1和STX 2)1,2,uidA基因 3,4, 善良 5,6,rfbE 7,和的fliC基因8,9。这些生物标志物可以提供可变的效率识别,然而,大多数的生物标志物不能被用作唯一的生物标记物进行检测大肠杆菌的大肠杆菌 O157:H7。这种不足在靶基因的分化功率要求更具体,更强大的生物标志物(s)的鉴定大肠杆菌的大肠杆菌 O157:H7 10。
众多探针用于在大肠杆菌中的基因或假想的开放阅读框(ORFs) 大肠杆菌O157:H7型11被设计为基于本实验室的DNA基因分型芯片,并通过了国家生物技术信息中心的GenBank数据库中寻找线索qPCR分析。 Z3276的ORF,它是一种菌毛基因11的序列被选择为qPCR分析。随后,qPCR分析通过对PCR参数如浓度的引物和探针,以及退火和延伸温度(数据未示出)多次试验的开发。经过对参考菌株,如大肠杆菌激励包容性和排他性测试大肠杆菌 O157:H7,非O157和志贺氏菌在定量PCR中,ORF Z3276被认定为一个特定的和强大的遗传标记用于识别E的大肠杆菌 O157:H7。然后,我们开发使用这种独特的生物标志物的鉴定大肠杆菌的一个新的定量PCR方法大肠杆菌 O157:H7。
在检测大肠杆菌的另一个挑战大肠杆菌 O157:H7的污染FO消耗臭氧层物质和环境的准确测定从样品中的活细胞。 DNA的死亡细胞和不能区分存活在PCR法的延伸存在可能导致假阳性读数,从而导致在检测活细胞数的高估。因此,这限制了在PCR中使用的精确检测食源性致病菌12。一种新颖的方法来区分死细胞的DNA已被采取了在过去的几年里13-15结合单叠氮丙啶(PMA)处理与PCR检测方法。 PMA是能去的死细胞内,并相互插入到DNA,当暴露于光,但不能去活细胞的内部,以与活细胞的DNA反应。因此,在活细胞和死细胞的PMA处理的混合物中,死细胞的DNA不能在PCR扩增13。我们结合PMA治疗新开发的qPCR分析选择性地检测活的大肠杆菌大肠杆菌 O157:H7细胞。此外,我们已经取得了PMA-qPCR的一SSAY可以用于高通量检测。
研究方案
1。细菌菌株和DNA模板制备
- 成长的大肠杆菌菌株大肠杆菌 O157:H7,非O157和其他致病菌种,如沙门氏菌和志贺氏菌,在37℃过夜振荡。
- 使用适当的工具包(见表材料),并按照制造商的说明书提取细菌培养物的DNA。
- 测量光密度(OD 260)通过使用分光光度计来确定DNA的浓度。
2。引物和探针设计的qPCR实验方法
- 大肠杆菌 O157:H7的序列从GenBank登录号AE00517411。设计引物和探针使用适当的软件进行引物和探针设计,实时荧光定量PCR(见材料明细表)。
是引物和探针的序列如下:Z3276-正向(F)5'-TATTCCGCGATGCTTGTTTTT-3'
Z3276-反向(R)5'-ATTATCTCACCAGCAAACTGGCGG-3'
Z3276-Probe公司,FAM-CCGCAATCTTTCC-MGBNFQ - 重组的引物粉末与水,导致在10μM作为引物工作溶液的浓度。
- 稀释探头到10微米(μm)探头的工作方案。标记探针的效力与批次不同而不同。因此,使用以获得最佳性能的qPCR滴定前每批标记的探针。
3。设置定量PCR检测条件
- 制备反应混合物,它由25.0微升2倍的实时PCR主混合物,200nM的正向引物,200nM的反向引物,探针和100纳米。
- 添加5微升的样本DNA(100皮克)和水的适当体积达到50微升的最终体积。
- 对于非模板控制,使用5微升的水来代替DNA样本。
- 设置定量PCR条件如下:95℃保持10分钟进行活化的TaqMan的;接着40个循环的95℃10秒变性和60及#176,C为1分钟的退火/延伸。
4。定量PCR灵敏度测试
- 使从中期指数期的培养一个连续10倍稀释液(OD 600 = 0.5,约1.5×10 8 CFU / ml的通过电镀)。
- 加入100 ml细胞稀释到96孔板中一式三份。
- 离心板上,在2500×g离心10分钟。
- 加入50毫升的DNA提取液到每个孔中。
- 重悬细胞沉淀用多通道移液器。
- 用薄膜密封板,熬板在水浴10分钟,离心在2500×g离心2分钟。
5。准备活的和死细胞混合物的PMA处理
- 成长10毫升E的大肠杆菌 O157:H7在37°C至指数中期阶段,并划分成文化两等份。
- 在水浴中死细胞煮沸细胞的一个等份10分钟,并保持其他等分试样为活细胞。
- 验证再从热灭活等分无活细胞通过电镀在LB琼脂平板上的细胞。
- 取2毫升活和热灭活的细胞,并调整浓度至8×10 6 CFU /毫升的LB培养基中。创建四套细胞稀释液从8×10 0〜8×10 6 CFU /毫升。
- 使用前两组细胞稀释液与PMA或未经处理的活细胞。
- 到第三和第四组的细胞稀释液,加入8×10 6个死细胞,以每细胞稀释液(8×10 0 - 8×10 6),以使活的和死细胞的混合物。
- 对待第三套稀释的PMA和使用第四套稀释控制。
6。处理细胞用PMA
- 溶解PMA在二甲亚砜(或水),使10mM储备溶液并储存在-20℃下在黑暗中。
- 分装400微升的活细胞,死细胞和活细胞和死细胞的混合物三个独立的微管。
- 加入2.0毫升10毫PMA对每个等分试样的细胞,以50μM的终浓度。
- 孵育样品在环境温度下5分钟在黑暗中,轻轻摇动几次,3秒每次。
- 加入100微升的样品在96孔板中。
- 密封板的光学膜,并把该板在冰上。
- 从650瓦卤素光源20 cm套板和暴露2分钟的曝光。
- 离心板上,在2500×g离心10分钟,轻轻弃去上清液,并仔细漏板的一块吸收纸。
- 在50μlDNA提取溶液重悬细胞沉淀用移液器上下吹吸20次,一个多通道的Pipetman。
- 用薄膜密封板,煮沸水浴10分钟,离心2,500 xg离心2分钟。在板的上清液是从用PMA和准备的qPCR处理的细胞的DNA中。
- 执行定量PCR作为记述的床的上方,用5微升的DNA。
结果
检测大肠杆菌的大肠杆菌 O157:使用ORF Z3276 H7通过qPCR
一个这种测定法的关键因素是在定量PCR中使用的Z3276探针的灵敏度和特异性。它可以检测低至大肠杆菌的DNA的基因组的拷贝数大肠杆菌 O157:H7, 如图1A所示 。检查了120个非O157菌株,包括六个主要非O157 STEC菌株O104的:H4菌株, 沙门氏菌 , 志贺氏菌和菌株,无交叉反应性,发现,如表1所示。
在PMA处理与定量PCR结合
E.孵化大肠杆菌 O157:H7细胞用PMA(50毫米)5分钟在黑暗中进行曝光2分钟被选定为PMA处理条件。此外,我们修改PMA处理程序。与在交联工序中使用的各种透明微管相比,一个96孔板被发现是更有效的达到最佳的交联效果,并比光曝光过程中处理大量的样品管的更方便。
从PMA处理的活细胞和死细胞的定量PCR DNA扩增
从这一定量PCR检测死细胞DNA扩增的PMA介导的抑制效应,采用DNA从两个串行10倍活的或死的细胞稀释液中提取出来, 如图1所示。结果表明,从用PMA(红色曲线)和无PMA(蓝色曲线)处理的活细胞产生的曲线似乎线性和几乎彼此相同。轻微的CT值差异,用PMA和没有PMA( 图1A)处理的活细胞之间所示,表明PMA处理对活细胞中的定量PCR的DNA扩增的影响不大。但一个15 - CT值差异(32,000倍)与PMA处理的死细胞之间,没有物业管理公司,显示演示nstrating的PMA处理有效地抑制DNA扩增的死细胞( 图1B)。
从定量PCR活的和死细胞混合物检测活细胞
两套活细胞稀释液(8×10 0 - 8×10 6 CFU)与PMA或不PMA治疗,检测活细胞的活/死细胞混合物。在定量PCR的结果( 图2A)表明CT值作为相关处理的活细胞(紫色条),以未处理的样品(蓝色条)的数目的并联逆渐进趋势。处理后的活细胞产生了比未处理的活细胞的一个稍高的CT值。在CT值类似的逆渐进趋势观察到活细胞在用PMA(绿色棒)在图2B中被视为良好的活/死细胞的混合物的实数。此外,CT值的这种下降趋势是尽管106死细胞的存在与活细胞中的混合物的数量变化。这些结果表明,该活/死细胞混合物的CT值表示从单独的活细胞中的DNA,而从死细胞中的DNA扩增效率由PMA处理抑制。但是,用PMA治疗的活/死细胞混合物的CT值波动和没有反映在图2B中的(黄色条)的混合物中的活细胞数。
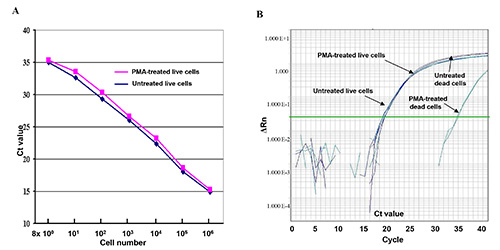
图1。活细胞和死细胞用PMA或没有在PMA qPCR分析处理(A)的连续10倍稀释E.直播大肠杆菌 O157:H7细胞稀释液(8×10 0 - 8×10 6 CFU)分别用PMA或没有PMA。CT值代表了qPCR实验的一式三份的平均CT值。 (B)用PMA和无PMA在第q比较qPCR分析处理的活细胞和死细胞的DNA扩增的比较。 ΔRn是指荧光强度的变化。 点击这里查看大图。
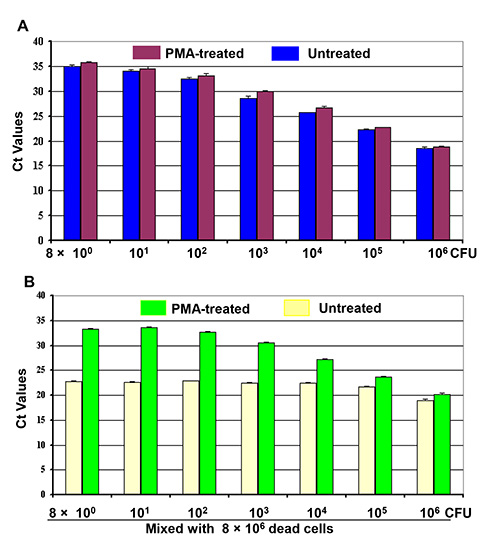
图2。从由PMA-qPCR的四组的细胞培养物的10倍稀释液(8×10 0 - 8×10 6 CFU)的活/死细胞混合物分化的活细胞所指示而进行。 ( 一 )第一组细胞稀释液用PMA处理,而第二个单元是稀释或未经处理的DNA提取之前。(B)8×10 6个死细胞与所述第三组和第四组的细胞稀释液,使两套活/死细胞的混合物所指示的。一组的细胞混合物中的溶液用PMA治疗,而另一组是DNA提取之前没有PMA处理。每个条形代表一式三份实验±标准差的平均CT值。
| 生物 | 血清型 | 供试菌株数 |
| 大肠杆菌 | 2006菠菜O157:H7菌株爆发 | 186 |
| 2006 Taco Bell的O157:H7菌株 | 58 | |
| 2006年约翰·塔克O157:H7菌株 | 11 | |
| 其他0157 DMB应变集合:H7爆发 | 112 | |
| O104:H4 | 3 | |
| O26 | 18 | |
| O103 | 13 | |
| O111 | 24 | |
| O121 | 2 | |
| O45 | 5 | |
| O145 | 9 | |
| O113 | 2 | |
| O91 | 1 | |
| O55 | 9 | |
| 其他 | 19 | |
| 沙门氏菌 | 伤寒 | 1 |
| 新港 | 2 | |
| 痢疾志贺菌 | 6 | 2 |
| 宋内志贺氏菌 | 未知 | 2 |
| 福氏痢疾杆菌 | 4 | 1 |
| 鲍氏志贺氏菌 | 1 | 1 |
| 总 | 481 | |
Ŧ能够1。 用于验证实时PCR检测鉴定大肠杆菌菌株大肠杆菌 O157:H7。
讨论
该研究的主要目的包括使用的ORF Z3276,独特的为E。大肠杆菌 O157:H7,作为定量PCR检测一个唯一的生物标志物。目前,大多数qPCR实验的目标致病基因,如STX1,STX2和善良 1,2,5,6或共享表型的基因,如uidA基因3,4,rfbE和的fliC基因8,9。偶尔,一个种或菌株不能明确的毒力基因(S)确定的,如1和STX STX 2基因,这些基因存在于不同的种或菌株16为好。使用rfbE和fliC的对靶基因,就需要这两个基因以用于完整的识别17。使用ORF Z3276作为生物标志物,这qPCR分析已被证明是敏感和特异的测定( 表1)。该测定法已受到严格的包容性和排他性测试,包括O157:H7菌株(n = 3的67),100多个非O157菌株,和其他致病菌种,如沙门氏菌和志贺氏菌 。所有O157:H7检测菌株呈正检测到,并且没有交叉反应性,发现从非O157菌株( 表一 ),表明ORF Z3276是一种独特的和强大的生物标志物的检测大肠杆菌的大肠杆菌 O157:H7。
该研究的另一个目的是通过PMA处理的DNA提取之前选择性地检测活细胞的死细胞。 PMA可以渗透到死细胞受损的膜和与DNA结合,从而抑制死细胞中PCR扩增13的DNA扩增。我们已经修改对PMA处理的程序,并适应它为过程的96孔板格式。的曝光正确的强度是必不可少的,以获得最佳的交联作用。以前,微管已被用于这个步骤13-15。然而,单独的微管是难以处理在光前曝光的步骤,而这些管子不是绝对透明的,以获得最佳的跨喜好。使用96孔板,我们改进PMA-处理的效率。这些变化可能会影响测定在几个方面:它们可以更容易地获得彻底和均匀的交联效果,特别是与许多样本;处理样品可以从一个板移动到另一个,以使其能够用于检测大量样品的,他们提供的自动化潜力的全过程这PMA-qPCR分析。这PMA-qPCR分析的局限性在于,PMA处理增加了PCR分析的成本有所并且稍微降低PCR检测的灵敏度。
披露声明
作者什么都没有透露。
致谢
我们感谢美国国土安全部美国提供资金的一部分。
材料
| Name | Company | Catalog Number | Comments |
| AB 7900HT Fast Real-time PCR system | ABI | ||
| 2x Universal master mix | ABI | 4304437 | |
| PrepMan Ultra | ABI | 4318930 | |
| Primer Express | ABI | ||
| Probes | ABI | Top of Form | |
| PMA | Biodium | 40013 | |
| Puregen cell and tissue kit | Qiagene | ||
| DU530 spectrophotometer | Beckman | ||
| Spectrophotometer | NanoDrop Technology | ND-1000 | |
| 650 W Halogen light source | Britek | H8061S | |
| Otptical Adhesive film | ABI | 4311971 | |
| Optical 96-well reaction plate | ABI | 4316813 |
参考文献
- Barletta, F., et al. Validation of five-colony pool analysis using multiplex real-time PCR for detection of diarrheagenic Escherichia coli. J. Clin. Microbiol. 47, 1915-1917 (2009).
- Gannon, V. P., King, R. K., Kim, J. Y., Thomas, E. J. Rapid and sensitive method for detection of Shiga-like toxin-producing Escherichia coli in ground beef using the polymerase chain reaction. Appl. Environ. Microbiol. 58, 3809-3815 (1992).
- Cebula, T. A., Payne, W. L., Feng, P. Simultaneous identification of strains of Escherichia coli serotype O157:H7 and their Shiga-like toxin type by mismatch amplification mutation assay-multiplex PCR. J. Clin. Microbiol. 33, 248-250 (1995).
- Li, Y., Mustapha, A. Simultaneous detection of Escherichia coli O157:H7, Salmonella, and Shigella in apple cider and produce by a multiplex PCR. J. Food. Prot. 67, 27-33 (2004).
- Schmidt, H., et al. Differentiation in virulence patterns of Escherichia coli possessing eae genes. Med. Microbiol. Immunol. 183, 23-31 (1994).
- Fratamico, P. M., Sackitey, S. K., Wiedmann, M., Deng, M. Y. Detection of Escherichia coli O157:H7 by multiple PCR. J. Clin. Microbiol. 33, 2188-2191 (1995).
- Desmarchelier, P. M., Bilge, S. S., Fegan, N., Mills, L., Vary, J. C., Tarr, P. I. A PCR specific for Escherichia coli O157 based on the rfb locus encoding O157 lipopolysaccharide. J. Clin. Microbiol. 36, 1801-1804 (1998).
- Fields, P. I., Blom, K., Hughes, H. J., Helsel, L. O., Feng, P., Swaminathan, B. Molecular characterization of the gene encoding H antigen in Escherichia coli and development of a PCR-restriction fragment length polymorphism test for identification of E. coli O157:H7 and O157:NM. J. Clin. Microbiol. 35, 1066-1070 (1997).
- Fricker, M., Messelhäußer, U., Bushch, U., Scherer, S., Ehling-Schulz, M. Diagnostic real-time PCR assays for detection of emetic Bacillus cereus strains in foods and recent food-borne outbreaks. Appl. Environ. Microbiol. 73, 1892-1898 (2007).
- Li, B., Chen, J. Q. Real-time PCR methodology for selective detection of viable Escherichia coli O157:H7 cells by targeting Z3276 as a genetic marker. Appl Environ. Microbiol. 78, 5297-5304 (2012).
- Perna, N. T., et al. Genome sequence of enterohaemorrhagic Escherichia coli O157:H7. Nature. 409, 529-533 (2001).
- Wang, S., Levin, R. E. Discrimination of viable Vibrio vulnificus cells from dead cells in real-time PCR. J. Microbiol. Methods. 64, 1-8 (2006).
- Nocker, A., Cheung, C. Y., Camper, A. K. Comparison of propidium monoazide with ethidium monoazide for differentiation of live vs. dead bacteria by selective removal of DNA from dead cells. J. Microbiol. Methods. 67, 310-320 (2006).
- Nocker, A., Sossa-Fernandez, P., Burr, M. D., Camper, A. K. Use of propidium monoazide for live/dead distinction in microbial ecology. Appl. Environ. Microbiol. 73, 5111-5117 (2007).
- Cawthorn, D. M., Witthuhn, R. C. Selective PCR detection of viable Enterobacter sakazakii cells utilizing propidium monoazide or ethidium bromide monoazide. J. Appl. Microbiol. 105, 1178-1185 (2008).
- Chassagne, L., Pradel, N., Robin, F., Livrelli, V., Bonnet, R., Delmas, J. Detection of stx1, stx2, and eae genes of enterohemorrhagic Escherichia coli using SYBR Green in a real-time polymerase chain reaction. Diagn. Microbiol. Infect. Dis. 64, 98-101 (2009).
- Liu, Y., Gilchrist, A., Zhang, J., Li, X. F. Detection of viable but nonculturable Escherichia coli O157:H7 bacteria in drinking water and river water. Appl. Environ. Microbiol. 74, 1502-1507 (2008).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。