Method Article
Rilevamento dal vivo
In questo articolo
Riepilogo
Un test qPCR è stato sviluppato per il rilevamento di Escherichia coli O157: H7 mira un marcatore genetico unico, Z3276. La qPCR è stato combinato con propidio monoazide (PMA) Trattamento per il rilevamento di cellule vive. Questo protocollo è stato modificato e adattato ad un formato piastra a 96 pozzetti per maneggevolezza e coerente di numerosi campioni
Abstract
Una cornice unica di lettura aperta (ORF) Z3276 è stato identificato come un marcatore genetico specifico per E. coli O157: H7. Un saggio qPCR stato sviluppato per il rilevamento di E. coli O157: H7 di mira ORF Z3276. Con questo test, possiamo individuare a partire da un paio di copie del genoma del DNA di E. coli O157: H7. La sensibilità e specificità del test sono state confermate dal test di convalida intensive con un gran numero di E. coli O157: H7 (n = 369) e ceppi non-O157 (n = 112). Inoltre, abbiamo procedura di propidio monoazide (PMA) in combinazione con il protocollo qPCR di nuova concezione per la rilevazione selettiva delle cellule vive da cellule morte. Amplificazione del DNA da cellule morte PMA-trattati è stata quasi completamente inibita in contrasto con l'amplificazione praticamente inalterati di DNA da cellule vive PMA-trattati. Inoltre, il protocollo è stato modificato e adattato ad un formato piastra a 96 pozzetti per un facile trasporto e coerente di un gran numero di campioni. Til suo metodo dovrebbe avere un impatto sulla microbiologico accurata e il monitoraggio epidemiologico della sicurezza alimentare e di origine ambientale.
Introduzione
PCR è una tecnica comune per il rilevamento di E. coli O157: H7 da campioni alimentari ed ambientali. Identificazione di biomarcatori specifici per E. coli O157: H7 è uno dei fattori chiave per la rilevazione successo in PCR. I biomarcatori comunemente utilizzati in saggi di PCR per il rilevamento di E. coli O157: H7 includono tossine Shiga (STX e STX 1 2) 1,2, 3,4 uidA, dell'EAEA 5,6, rfbE 7, e FLIC geni 8,9. Questi marcatori possono fornire efficienza variabile per l'identificazione, tuttavia, la maggior parte dei biomarker non possono essere utilizzati come biomarker unico per il rilevamento di E. coli O157: H7. Questa carenza di alimentazione differenziazione dei geni bersaglio richiede biomarker (s) più specifico e più forte per l'identificazione di E. coli O157: H7 10.
Numerose sonde per geni o ipotetiche fasi di lettura aperta (ORF) in E. coliO157: H7 11 sono stati progettati per qPCR saggio basato sugli indizi di microarray di genotipizzazione del DNA del nostro laboratorio e di ricerca all'interno del database GenBank del National Center for Biotechnology Information. La sequenza di Z3276 ORF, che è un gene fimbrial 11, è stato selezionato per il saggio qPCR. Successivamente, un saggio qPCR è stato sviluppato attraverso numerose prove sui parametri di PCR come concentrazioni di primer e sonde, nonché le temperature di ricottura e di estensione (dati non mostrati). Dopo i test inclusività di incentivazione e di esclusività su ceppi di riferimento come E. coli O157: H7, non-O157 e Shigella ceppi nel qPCR, la ORF Z3276 è stato identificato come un marcatore genetico specifico e forte per l'identificazione di E. coli O157: H7. Poi sviluppiamo un nuovo metodo qPCR utilizzando questo biomarker unico per l'identificazione di E. coli O157: H7.
Un'altra sfida nella rilevazione di E. coli O157: H7 in contaminati foods e l'ambiente è accurata determinazione di cellule vive da campioni. La presenza estesa di DNA da cellule morte e l'incapacità di differenziare redditività nel PCR potrebbe causare letture di falsi positivi, con conseguente sovrastima del numero di cellule vive di rilevamento. Di conseguenza, questo limita l'utilizzo della PCR in un rilevamento accurato di patogeni 12. Un nuovo approccio per differenziare DNA delle cellule morte è stata adottata combinando propidio monoazide (PMA) trattamento con procedura PCR negli ultimi anni 13-15. PMA è in grado di andare all'interno di cellule morte, e intercalare nel DNA quando esposto alla luce, ma non può andare all'interno di cellule vive per reagire con il DNA delle cellule vive. Così, in miscele PMA-trattate di cellule vive e morte, il DNA di cellule morte non può essere amplificato in PCR 13. Abbiamo combinato il trattamento PMA con il saggio qPCR di recente sviluppato per rilevare selettivamente dal vivo E. coli O157: H7 cellule. Inoltre, abbiamo fatto la PMA-qPCR unssay possibile per il rilevamento ad alta velocità.
Protocollo
1. Ceppi batterici e DNA Template Preparazione
- Crescere ceppi batterici di E. coli O157: H7, non-O157, e di altre specie patogene, quali Salmonella e Shigella, a 37 ° C durante la notte con agitazione.
- Estrarre il DNA da colture batteriche utilizzando l'apposito kit (vedi tabella dei materiali) e seguendo le istruzioni del produttore.
- Misurare la densità ottica (OD 260) per determinare le concentrazioni di DNA utilizzando uno spettrofotometro.
2. Primer and Probe Design per il saggio qPCR
- E. coli O157: H7 sono le sequenze da GenBank numero di accesso AE00517411. Primer design e la sonda utilizzando il software appropriato per primer e la progettazione della sonda per real-time PCR (vedi tabella materiali per i dettagli).
Le sequenze dei primer e la sonda sono i seguenti: Z3276-Forward (F) 5'-TATTCCGCGATGCTTGTTTTT-3 '
Z3276-retromarcia (R) 5'-ATTATCTCACCAGCAAACTGGCGG-3 '
Z3276-Probe, FAM-CCGCAATCTTTCC-MGBNFQ - Ricostituire la polvere di primer con acqua, ottenendo una concentrazione di 10 pM come soluzione lavoro primer.
- Diluire le sonde a 10 pM come soluzioni di lavoro della sonda. Sonde marcate variano in potenza con lotti. Pertanto, titolare ogni partita di sonde marcate prima di utilizzare per ottenere prestazioni ottimali qPCR.
3. Impostazione delle qPCR Assay Condizioni
- Preparare miscela di reazione, che consiste di 25,0 ml di 2x real-time PCR Master Mix, 200 nM di primer forward, 200 nM di primer reverse, e 100 nM di sonda.
- Aggiungere 5 ml di DNA campione (100 pg) e un volume adeguato di acqua fino a raggiungere un volume finale di 50 microlitri.
- Per il controllo nontemplate, usare 5 ml di acqua per sostituire il campione di DNA.
- Impostare le condizioni qPCR come segue: 95 ° C per 10 min per l'attivazione di TaqMan, seguita da 40 cicli di 95 ° C per 10 sec per denaturazione e 60 &# 176; C per 1 minuto per la ricottura / estensione.
4. qPCR Test di sensibilità
- Effettuare una diluizione di 10 volte in serie da una cultura di fase mid-esponenziale (OD 600 = 0.5; circa 1.5 x 10 8 UFC / ml mediante placcatura).
- Aggiungere 100 ml di diluizioni cellulari su una piastra da 96 pozzetti in triplicato.
- Centrifugare la piastra a 2.500 xg per 10 min.
- Aggiungere 50 ml di soluzione di estrazione del DNA a ciascun bene.
- Pellet cellulari Risospendere con una pipetta multicanale.
- Sigillare la piastra con una pellicola, la piastra bollire a bagnomaria per 10 minuti e si centrifuga a 2500 xg per 2 min.
5. Preparazione Miscele vivi e morti cellulari per il trattamento PMA
- Crescere 10 ml di E. coli O157: H7 a 37 ° C a metà fase esponenziale e dividere la cultura in due aliquote.
- Bollire una aliquota di cellule per 10 minuti in un bagno d'acqua per cellule morte e lasciare l'altra aliquota di cellule vive.
- Verificare l're sono cellule vive della aliquota calore ucciso da placcatura le cellule su piastre di agar LB.
- 2 ml di soluzione le cellule vive e uccisi col calore e regolare la concentrazione di 8 x 10 6 UFC / ml di terreno LB. Creare quattro serie di diluizioni cellulari che vanno da 8 x 10 0 a 8 x 10 6 UFC / ml.
- Utilizzare le prime due serie di diluizioni cellulari per cellule vive trattate con PMA o non trattati.
- Per la terza e quarta serie di diluizioni cellulari, aggiungere 8 x 10 6 cellule morte per ogni diluizione cella (8 x 10 0 - 8 x 10 6) per fare miscele di cellule vive e morte.
- Trattare la terza serie di diluizione con PMA e utilizzare la quarta serie di diluizione per il controllo.
6. Trattando le cellule con PMA
- Sciogliere PMA in dimetilsolfossido (o acqua) per fare magazzino 10 mM soluzione e conservati a -20 ° C al buio.
- Aliquota 400 ml di cellule vive, cellule morte, e la miscela di cellule vive e morte intre microtubi separati.
- Aggiungere 2,0 ml di PMA 10 mM per ogni aliquota di cellule ad una concentrazione finale di 50 mM.
- Incubare i campioni a temperatura ambiente per 5 minuti al buio, agitando delicatamente alcune volte, 3 secondi ogni volta.
- Aggiungere 100 ml di campioni su una piastra a 96 pozzetti.
- Sigillare la piastra con una pellicola ottica e mettere il piatto su ghiaccio.
- Impostare la piastra di 20 centimetri da una W sorgente alogena 650 ed esporre per 2 minuti per l'esposizione alla luce.
- Centrifugare la piastra a 2.500 xg per 10 min, scartare il surnatante delicatamente e accuratamente drenare la piastra su un foglio di carta assorbente.
- Pellet cellulari Risospendere in 50 ml di soluzione di estrazione del DNA da pipettando su e giù per venti volte con un multi-canale Pipetman.
- Sigillare la piastra con un film, bollire per 10 minuti in un bagno d'acqua, e centrifugare a 2500 xg per 2 min. Il surnatante nella piastra è il DNA da cellule trattate con PMA e pronto per qPCR.
- Eseguire qPCR come descriletto sopra, con 5 ml di DNA.
Risultati
Rilevamento di E. coli O157: H7 da qPCR utilizzando ORF Z3276
Uno dei fattori chiave di questo saggio è la sensibilità e la specificità della sonda Z3276 utilizzato nella qPCR. E 'in grado di rilevare a partire da un paio di copie del genoma del DNA di E. coli O157: H7 come mostrato nella Figura 1A. Dei 120 ceppi non-O157 esaminati, compresi i sei principali ceppi non-O157 STEC O104: H4 ceppi, Salmonella, e ceppi Shigella, non cross-reattività è stata trovata, come mostrato nella Tabella 1.
Combinazione del trattamento PMA con qPCR
Covare E. coli O157: H7 cellule con PMA (50 mm) per 5 min al buio ed esponendo alla luce per 2 min sono stati selezionati per le condizioni di trattamento di PMA. Inoltre, abbiamo modificato procedura di trattamento di PMA. Rispetto ai vari microtubi trasparenti utilizzati nel passaggio di reticolazione, una piastra a 96 pozzetti è risultato essere più efficaceraggiungere l'effetto di reticolazione ottimale e più conveniente di gestire un grande numero di provette per campioni durante il processo di esposizione alla luce.
L'amplificazione del DNA da cellule vive e morte PMA trattati in qPCR
Gli effetti di inibizione PMA-mediata di amplificazione del DNA da cellule morte in questo saggio qPCR sono stati mostrati in Figura 1 usando il DNA derivato da due 10 diluizioni cellulari vivi o morti seriali. I risultati mostrano che le curve generate dalle cellule vive trattate con PMA (curva rossa) e senza PMA (curva blu) sembrano lineare e quasi uguali tra loro. Differenze di valore CT Lievi stati mostrati tra le cellule vive trattate con PMA e senza PMA (Figura 1A), suggerendo che il trattamento PMA avuto poco effetto sulla amplificazione di DNA delle cellule vive nella qPCR. Ma un 15 - differenza di valore CT (32.000 volte) è stato mostrato tra le cellule morte trattate con PMA e senza PMA, demonstrating che il trattamento PMA efficacemente soppressa amplificazione del DNA dalle cellule morte (Figura 1B).
Rilevazione di cellule vive da miscele di cellule vive e morte in qPCR
Due serie di diluizioni di cellule vive (8 x 10 0-8 x 10 6 CFU) sono stati trattati con PMA o senza PMA per rilevare le cellule vive da miscele di cellule vive / morte. I risultati qPCR (Figura 2a) ha dimostrato un parallelo inverso andamento progressivo dei valori CT come correlata al numero di cellule vive trattate (barre viola) ai campioni non trattati (barre blu). Le cellule vive trattate prodotto un valori CT leggermente superiori a quelli delle cellule vive non trattate. Un simile inverso andamento progressivo in valori CT è stata osservata con il numero reale di cellule vive nelle miscele di cellule vive / morte trattate con PMA (barre verdi) e nella Figura 2B. Inoltre, questa tendenza al ribasso dei valori CT eraosservata con il numero di cellule vive nelle miscele nonostante la presenza di 106 cellule morte. Questi risultati hanno mostrato che i valori CT della miscela di cellule vive / morte rappresentato il DNA da solo le cellule vive, mentre l'amplificazione del DNA dalle cellule morte era efficacemente soppressa mediante trattamento PMA. Ma, i valori CT di miscele di cellule live / morti trattati con la PMA sono stati fluttuato e non hanno rispecchiato il numero di cellule vive nelle miscele in figura 2B (barre gialle).
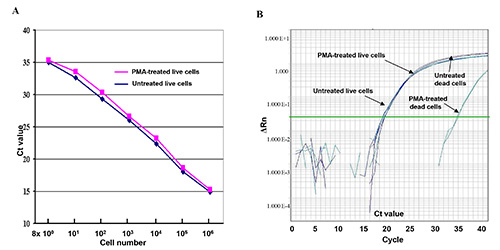
Figura 1. Dal vivo e le cellule morte trattate con PMA o senza PMA nel saggio qPCR. (A) di serie di 10-volte-diluito in diretta E. coli O157: H7 diluizioni cellulari (8 x 10 0-8 x 10 6 CFU) sono stati trattati con PMA o senza PMA.I valori CT rappresentano i valori medi di CT dei triplicati nel saggio qPCR. (B) Confronto di amplificazione del DNA delle cellule vive e cellule morte trattate con PMA e senza PMA nel confronto q qPCR dosaggio. ΔRn si riferisce a fluorescenza cambiamento di intensità. Clicca qui per vedere l'immagine ingrandita.
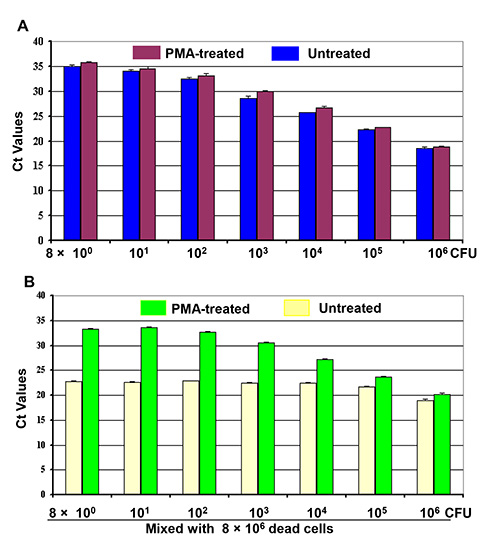
Figura 2. Differenziazione delle cellule vive da miscele di cellule live / morti di PMA-qPCR Quattro serie di diluizioni di 10 volte di colture cellulari (8 x 10 0-8 x 10 6 CFU). Stati fatti come indicato. (A) Prima serie di diluizione cellulare è stata trattata con PMA mentre la seconda diluizione cella era o non trattati prima dell'estrazione del DNA.(B) 8 x 10 6 cellule morte sono state mescolate con la terza e quarta serie di diluizioni cellulari per fare due serie di miscele di cellule vive / morte come indicato. Una serie di miscele di cellule è stato trattato con PMA e l'altra serie è stata trattata senza PMA prima dell'estrazione del DNA. Ogni barra rappresenta i valori medi di CT di un esperimento triplice copia ± SD.
| Organismo | Sierotipo | Numero di ceppi testati |
| E. coli | 2006 spinaci O157: H7 isolati focolai | 186 |
| 2006 Taco Bell O157: H7 isolati | 58 | |
| 2006 Taco John O157: H7 isolati | 11 | |
| Collezioni di deformazione DMB dagli altri O157: H7 focolai | 112 | |
| O104: H4 | 3 | |
| O26 | 18 | |
| O103 | 13 | |
| O111 | 24 | |
| O121 | 2 | |
| O45 | 5 | |
| O145 | 9 | |
| Ø113 | 2 | |
| O91 | 1 | |
| O55 | 9 | |
| Altro | 19 | |
| Salmonella | Typhi | 1 |
| Newport | 2 | |
| Shigella dysenteriae | 6 | 2 |
| Shigella sonnei | Sconosciuto | 2 |
| Shigella flexneri | 4 | 1 |
| Shigella boydii | 1 | 1 |
| Totale | 481 | |
Tgrado 1. ceppi utilizzati per la validazione in tempo reale PCR per l'identificazione di E. coli O157: H7.
Discussione
Un obiettivo primario dello studio comporta l'uso di una ORF Z3276, unico per E. coli O157: H7, come unico biomarcatore per l'analisi qPCR. Allo stato attuale, la maggior parte dei saggi qPCR stanno prendendo di mira geni di virulenza, come stx1, stx2, e dell'EAEA 1,2,5,6 o geni fenotipici condivisi, come uidA 3,4, rfbE e geni FLIC 8,9. Occasionalmente, una specie o ceppo non possono essere definitivamente identificati dal gene virulenza (s), come STX 1e STX 2 geni, come quei geni sono presenti in specie o ceppi 16 e diversi. Utilizzando rfbE e FLIC per geni target, sono necessari entrambi i geni ad essere utilizzati per l'identificazione completa 17. Uso ORF Z3276 come biomarker, questo dosaggio qPCR è stata dimostrata per essere saggio sensibile e specifico (Tabella 1). Questo test è stato sottoposto a test di inclusività ed esclusività severe, tra cui O157: H7 (n = 367), oltre 100 ceppi non-O157, e di altre specie patogene, quali Salmonella e Shigella. Tutti O157: H7 ceppi esaminati sono stati positivamente individuati, e nessun cross-reattività è stato trovato dai ceppi non-O157 (Tabella 1), indicando che ORF Z3276 è un biomarker unico e forte per il rilevamento di E. coli O157: H7.
L'altro obiettivo dello studio è quello di individuare selettivamente le cellule vive dalle cellule morte dal trattamento PMA prima dell'estrazione del DNA. PMA può penetrare all'interno delle cellule morte con membrana compromessa e legarsi al DNA, e quindi inibisce l'amplificazione del DNA di cellule morte in PCR 13. Abbiamo modificato la procedura PMA-trattamento, e adattato in un formato piastra a 96 pozzetti per la procedura. La giusta intensità di esposizione alla luce è indispensabile per ottenere un effetto ottimale reticolazione. In precedenza, microtubi sono stati utilizzati in questo passaggio 13-15. Tuttavia, microtubi separati sono difficili da gestire in luce expasso posure, e questi tubi non sono assolutamente trasparente per avere la migliore trasversale piacimento. Utilizzando una piastra a 96 pozzetti, abbiamo migliorato l'efficienza della PMA-trattamento. Questi cambiamenti possono influire sul dosaggio in diversi modi: rendono più facile ottenere un effetto di reticolazione completa e uniforme, soprattutto con numerosi campioni, i campioni trattati possono essere spostati da una piastra all'altra per rendere possibile il rilevamento di un gran numero di campioni, e prevedono questo test PMA-qPCR con potenziale automazione per l'intero processo. Il limite di questo saggio PMA-qPCR è che il trattamento PMA aumenta il costo PCR po e leggermente ridotta la sensibilità del saggio PCR.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Ringraziamo il Department of Homeland Security degli Stati Uniti per la fornitura di una parte del finanziamento.
Materiali
| Name | Company | Catalog Number | Comments |
| AB 7900HT Fast Real-time PCR system | ABI | ||
| 2x Universal master mix | ABI | 4304437 | |
| PrepMan Ultra | ABI | 4318930 | |
| Primer Express | ABI | ||
| Probes | ABI | Top of Form | |
| PMA | Biodium | 40013 | |
| Puregen cell and tissue kit | Qiagene | ||
| DU530 spectrophotometer | Beckman | ||
| Spectrophotometer | NanoDrop Technology | ND-1000 | |
| 650 W Halogen light source | Britek | H8061S | |
| Otptical Adhesive film | ABI | 4311971 | |
| Optical 96-well reaction plate | ABI | 4316813 |
Riferimenti
- Barletta, F., et al. Validation of five-colony pool analysis using multiplex real-time PCR for detection of diarrheagenic Escherichia coli. J. Clin. Microbiol. 47, 1915-1917 (2009).
- Gannon, V. P., King, R. K., Kim, J. Y., Thomas, E. J. Rapid and sensitive method for detection of Shiga-like toxin-producing Escherichia coli in ground beef using the polymerase chain reaction. Appl. Environ. Microbiol. 58, 3809-3815 (1992).
- Cebula, T. A., Payne, W. L., Feng, P. Simultaneous identification of strains of Escherichia coli serotype O157:H7 and their Shiga-like toxin type by mismatch amplification mutation assay-multiplex PCR. J. Clin. Microbiol. 33, 248-250 (1995).
- Li, Y., Mustapha, A. Simultaneous detection of Escherichia coli O157:H7, Salmonella, and Shigella in apple cider and produce by a multiplex PCR. J. Food. Prot. 67, 27-33 (2004).
- Schmidt, H., et al. Differentiation in virulence patterns of Escherichia coli possessing eae genes. Med. Microbiol. Immunol. 183, 23-31 (1994).
- Fratamico, P. M., Sackitey, S. K., Wiedmann, M., Deng, M. Y. Detection of Escherichia coli O157:H7 by multiple PCR. J. Clin. Microbiol. 33, 2188-2191 (1995).
- Desmarchelier, P. M., Bilge, S. S., Fegan, N., Mills, L., Vary, J. C., Tarr, P. I. A PCR specific for Escherichia coli O157 based on the rfb locus encoding O157 lipopolysaccharide. J. Clin. Microbiol. 36, 1801-1804 (1998).
- Fields, P. I., Blom, K., Hughes, H. J., Helsel, L. O., Feng, P., Swaminathan, B. Molecular characterization of the gene encoding H antigen in Escherichia coli and development of a PCR-restriction fragment length polymorphism test for identification of E. coli O157:H7 and O157:NM. J. Clin. Microbiol. 35, 1066-1070 (1997).
- Fricker, M., Messelhäußer, U., Bushch, U., Scherer, S., Ehling-Schulz, M. Diagnostic real-time PCR assays for detection of emetic Bacillus cereus strains in foods and recent food-borne outbreaks. Appl. Environ. Microbiol. 73, 1892-1898 (2007).
- Li, B., Chen, J. Q. Real-time PCR methodology for selective detection of viable Escherichia coli O157:H7 cells by targeting Z3276 as a genetic marker. Appl Environ. Microbiol. 78, 5297-5304 (2012).
- Perna, N. T., et al. Genome sequence of enterohaemorrhagic Escherichia coli O157:H7. Nature. 409, 529-533 (2001).
- Wang, S., Levin, R. E. Discrimination of viable Vibrio vulnificus cells from dead cells in real-time PCR. J. Microbiol. Methods. 64, 1-8 (2006).
- Nocker, A., Cheung, C. Y., Camper, A. K. Comparison of propidium monoazide with ethidium monoazide for differentiation of live vs. dead bacteria by selective removal of DNA from dead cells. J. Microbiol. Methods. 67, 310-320 (2006).
- Nocker, A., Sossa-Fernandez, P., Burr, M. D., Camper, A. K. Use of propidium monoazide for live/dead distinction in microbial ecology. Appl. Environ. Microbiol. 73, 5111-5117 (2007).
- Cawthorn, D. M., Witthuhn, R. C. Selective PCR detection of viable Enterobacter sakazakii cells utilizing propidium monoazide or ethidium bromide monoazide. J. Appl. Microbiol. 105, 1178-1185 (2008).
- Chassagne, L., Pradel, N., Robin, F., Livrelli, V., Bonnet, R., Delmas, J. Detection of stx1, stx2, and eae genes of enterohemorrhagic Escherichia coli using SYBR Green in a real-time polymerase chain reaction. Diagn. Microbiol. Infect. Dis. 64, 98-101 (2009).
- Liu, Y., Gilchrist, A., Zhang, J., Li, X. F. Detection of viable but nonculturable Escherichia coli O157:H7 bacteria in drinking water and river water. Appl. Environ. Microbiol. 74, 1502-1507 (2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon