需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
在进行米勒 - 尤列实验
摘要
米勒 - 尤列实验是有关非生物合成的有机化合物可能的相关性,以生命起源的一个开拓性的研究。简单的气体被引入到玻璃装置,并进行放电,模拟雷电的在原始地球大气 - 海洋系统的影响。该实验是一个星期进行,在这之后,由它收集到的样品为生命的化学构建块分析。
摘要
1953年,斯坦利·米勒汇报生产从简单的气态原料的生物分子,利用构造来模拟原始地球的大气 - 海洋系统的装置。米勒引入200ml水中的H 2 100毫米汞柱,200毫米汞柱的CH 4,和200毫米汞柱的NH 3进入该装置,然后进行此混合物中,在回流下,向放电了一个星期,而水是同时加热。该原稿的目的是为了给读者提供一个一般的实验方案,可以用来进行米勒 - 尤列型火花放电的实验中,使用简化的3升的反应烧瓶中。因为实验涉及暴露易燃气体高压放电,值得强调的重要步骤,减少爆炸的危险。在这项工作中所描述的一般性程序,可以外推到设计和进行各种各样的放电实验•本模拟原始行星环境。
引言
地球上生命起源的本质仍然是最不可思议的科学问题之一。在20世纪20年代俄罗斯生物学家亚历山大·奥帕林和英国进化生物学家和遗传学家约翰·霍尔丹提出的“原始汤”1,2的概念,描述了含有有机化合物的原始陆地海洋,可能有利于化学演化。然而,直到20世纪50年代,当化学家开始进行刻意的实验室研究旨在了解如何有机分子可能已经合成了从简单的原料,在早期地球。一到这个年底首次报道了甲酸的合成从水的CO 2的解决方案在1951年3照射。
1952年,斯坦利·米勒,然后一个研究生在芝加哥大学,走近哈罗德尤大约做实验,以评估的可能性,有机化合物对于生命起源重要的可能是早期地球上已经形成abiologically。本实验用设计来模拟原始地球定制的玻璃仪器( 图1A)进 行。米勒的实验模仿闪电由放电对较早期的气氛气体的混合物的作用下,在液体储水器的存在下,较早期的海洋。该装置还模拟蒸发和沉淀,通过使用加热套和冷凝器的分别。关于米勒使用的设备的具体细节可以在其他地方4被发现。一周火花后,将烧瓶中的内容物明显转化。水变成浑浊,颜色偏红5和电极上的累积4黄棕色物质。这一突破性的工作被认为是第一个故意的,高效的生物分子模拟原始地球条件下合成。
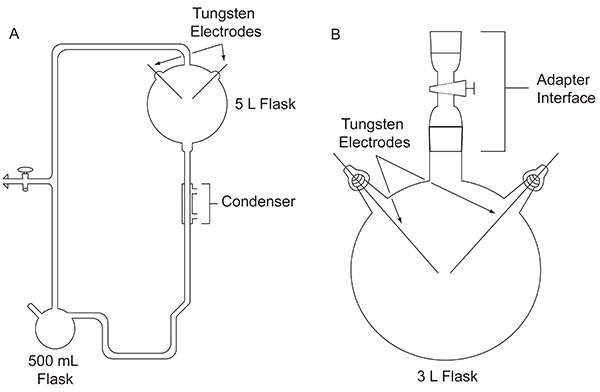
图1。这两种类型在本文中讨论的设备之间的比较。用于原始米勒-尤列实验(A)和这里(B)所述的协议中使用的简化的装置经典的设备, 点击这里查看大图 。
经过1953年的出版从米勒的经典实验,火花放电实验的许多变化,例如使用其他气体混合物,进行了探索在各种可能的早期地球环境的生产生活中的重要有机化合物的合理性结果。例如,一个CH 4的 / H 2 O / NH 3 / H 2 S的气体混合物,其以产生编码的含硫α-氨基酸的能力进行测试,但这些均未检出6。气相色谱-质谱(GC-MS)分析一个CH 4 / NH 3的混合物进行放电的显示,α-氨基腈,这是氨基酸的前体7的合成。 1972年,使用简单的装置,首先由破产管理署8( 图1B)介绍,米勒和他的同事证明了这一切已在默奇森陨石被确定的日期编码α-氨基酸9和非蛋白氨基酸10的合成,通过对CH 4,N 2和少量的NH 3来放电。后,使用相同的简化的实验设计,含H 2 O的气体混合物,N 2和CH 4,CO 2,或CO被激发到斯图镝(Dy)的氰化氢,甲醛和氨基酸的产率,为大气中的碳物种11的氧化态的函数。
除了替代实验设计多年来的探索,显著解析进步,因为米勒的经典实验,最近得益于米勒存档放电实验样品的多个探测调查的发生,会比提供了便利的技术米勒有机会获得在20世纪50年代。米勒的火山实验12,于1955年4首次报道,和1958年的H 2 S含实验13被证明已经形成了更广泛和更大的丰度,众多的氨基酸和胺类比经典的实验,其中包括许多了的以前没有发现的火花放电实验。
在本文中描述的实验可以使用进行多种气体的混合物。通常情况下,在最低限度,这样的实验将包含C-气体轴承,其N-轴承气体和水。与一些规划,气体几乎任何混合物可以探讨,但是,考虑到该系统的一些化学方面是很重要的。例如,将水相的pH值可对发生有14的化学一个显著影响。
这里介绍的方法已针对指导研究者如何进行类似的米勒-尤列实验中使用的是简化的3升的反应容器,如米勒1972年出版9,10描述火花放电实验。因为本实验中涉及的高电压电弧作用于可燃性气体, 关键的是,从反应烧瓶中除去O 2,以消除爆炸的危险,它可以发生降低含碳气体,如甲烷或一氧化碳的燃烧时,或反应ÕF H 2与氧气。
有应该准备进行这里讨论的实验时,必须牢记的其他细节。首先,当与玻璃真空管道和高压气体工作,存在两个内爆的固有危险性和过度加压,因此,安全眼镜必须在任何时候都被磨损。其次,实验通常是在低于大气压力下进行的。这最大限度地减少过度施压,所述歧管和反应烧瓶中的风险。玻璃器皿可以评分等于或高于大气压力,但是,上述1个大气压的压力下,不推荐。的压力可能会增加在这些实验中作为不溶于水的H 2是从减少气体(如CH 4和NH 3)的解放。过度施压可导致密封泄漏,从而可以使大气O 2进入反应烧瓶中,从而有可能引起燃烧,从而产生爆炸。三,它应该牢记的是,修改本协议来进行实验的变化,需要仔细规划,以确保不会产生不安全的情况。第四,强烈建议在整个协议尝试这个实验,以确定他或她是否熟悉潜在的陷阱和所有必要的硬件提供到位前仔细几次准实验者阅读。最后,涉及到的可燃气体进行实验要求符合实验者的主办机构的环境健康与安全部门指引。进行任何实验之前,请遵循这些建议。在这里的协议详解的所有步骤都符合作者的主机体制环境健康与安全指南。
研究方案
1。设置一个分水器/真空系统
- 使用玻璃歧管引入的气体到反应烧瓶中。此歧管能够购买或者建造由玻璃吹制设备,但必须包括可以被连接到真空系统,储气瓶,真空计,以及反应容器真空密封端口。
- 用磨口玻璃接头和玻璃塞与歧管阀。确保将插头所有的O型圈也有能力实现必要的密封件。如果使用玻璃接头,真空润滑脂足够量的可用于帮助使密封件,如果需要的话。硅真空润滑脂可用于避免潜在的有机污染。
- 使用玻璃旋塞上的歧管。申请所需真空脂的最低金额,使密封。
- 测量歧管体积。此卷将被用于相关的最终的气体压力在3升的反应烧瓶中的计算,应尽可能精确地已知的。
- 除非该歧管具有足够的连接来同时容纳所有气瓶,一次连接一个气缸的歧管。包括在这方面,一个抽头允许歧管被从周围大气隔离。
- 使用适当的,清洁的,惰性的,化学和耐泄漏油管和ultratorr真空配件的气瓶连接到歧管。 Ultratorr件,其中使用的是手指拧紧。
- 连接到所述歧管,真空泵能够建立<1毫米汞柱的真空度。真空泵排气应设在通风橱内,或适当地通过其它方式排出。
- 为了确保快速达到真空和保护泵,插入歧管和真空泵之间的一个陷阱。甲液氮手指陷阱推荐,因为它会阻止挥发性物质如NH 3,CO 2和H 2 O的进入泵。应注意,作为捕集挥发物,在娃中最差,可能过压歧管,从而导致玻璃的破裂。
- 连接到歧管,压力计或其他真空计能够1毫米汞柱的分辨率或更高。虽然不同的设备都可以使用,水银压力计,或麦克劳德计,优选为汞是相当不反应。
- 测量并使用合适的温度计记录环境温度。
2。反应瓶中的制备
- 加热所有的玻璃器皿在500℃下至少3小时,在使用前的空气,以除去有机污染物。
- 通过用干净的纸巾实验室和甲醇轻轻地洗涤,并在空气中干燥清洁的钨电极。
- 倾200毫升超纯水(18.2MΩ厘米,<5 ppb的TOC)的入3升的反应烧瓶中。
- 引入预清洗和消毒的磁力搅拌棒,这将确保前中可溶性气体的快速溶解和反应物的混合periment。
- 附加的钨电极使用的真空润滑脂最小量的3升的反应烧瓶中,与由烧瓶内1cm左右分离的提示。拧紧夹子。
- 插入具有一个内置的活栓到3L的反应烧瓶颈部的适配器以及用夹子固定。
- 通过适配器连接的3升的反应烧瓶中的气体歧管。用夹子夹住,或以帮助保护烧瓶中。
- 轻轻润滑所有的连接,以确保良好的真空密封。
- 打开上的歧管所有的阀门和旋塞,阀门除外6和旋塞阀1( 图4),并开启真空泵撤离歧管。一旦<1毫米汞柱稳定的真空读数已经实现,关闭阀门1和允许歧管坐〜15分钟,以检查真空泄漏。如果没有检测到,请转到步骤2.8。否则,解决各种连接直到泄漏可以被识别和修复。
- 一pply磁力搅拌下向反应容器中。打开阀1和旋塞1( 图4)疏散3升的反应烧瓶的顶部空间,直到压力达到<1毫米汞柱。
- 关闭阀门1( 图4)并监视3升的反应烧瓶内的压力。所测量的压力应该增加水的蒸气压。为了确保无泄漏存在,等待〜5分钟在这个阶段。如果压力(如读取压力计)的增加而阀1在此步骤中被关闭,为您在旋塞阀1的泄漏和各种反应烧瓶连接。如果没有发现泄漏,继续进行下一个步骤。
3。气态NH 3的简介
- 计算气态NH 3的必要的压力引入到歧管,使得200毫米汞柱的NH 3将被引入到反应烧瓶中。在讨论部分提供了有关如何执行此操作的详细信息。
- 关闭阀门1和6,和旋塞1( 图4)将任何气体进入歧管之前。保留其他阀门和旋塞打开。
- 引入NH 3进气歧管,直到一个小的压力(约10毫米汞柱),就达到了,然后通过打开阀1( 图4)抽真空歧管<1毫米汞柱的压力。重复3次。
- 引入NH 3进气歧管,以达到在步骤3.1中确定的压力。
- 打开旋塞1( 图4)引入200毫米汞柱的NH 3进3升的反应烧瓶中。的NH 3将在水中溶解在反应烧瓶中,并在压力将缓慢下降。
- 一旦压力停止下降,关闭活塞1( 图4)和记录由压力计读出的压力。这个值代表了烧瓶内的压力和将被用于计算后面将要引入到所述歧管的其它气体的压力。 打开阀1( 图4),以排空歧管<1毫米汞柱的压力。
- 关闭阀2( 图4),并断开歧管中的NH 3气瓶。
4。 CH 4的介绍
- 计算CH 4的必要的压力被引入到所述歧管,使得200毫米汞柱的 CH 4的将被引入到3升的反应烧瓶中。例如计算列在讨论部分。
- 连接CH 4气瓶到歧管。
- 打开所有阀门,旋塞,除了阀6和旋塞1( 图4),并排空歧管<1毫米汞柱的压力。
- 关闭阀1,一旦所述歧管被抽真空( 图4)。
- 引入的CH 4进气歧管,直到获得一个小的压力(约10毫米汞柱)。这将清除任何污染气体FR线路OM前面的步骤。打开阀1( 图4),以撤离所述歧管<1毫米汞柱。重复2倍多。
- 引入的CH 4进气歧管,直到在步骤4.1计算出的压力,就达到了。
- 打开旋塞1( 图4)引入200毫米汞柱的CH 4的进3升的反应烧瓶中。
- 关闭旋塞1一次的 CH 4的预定压力被引入到3升的反应烧瓶中( 图4)和记录由所述压力计测得的压力。
- 打开阀1(图4),以撤离所述歧管<1毫米汞柱。
- 关闭阀2( 图4),并断开歧管的CH 4缸。
5。此外气体的引入( 如 N2)
- 在这一点上,这是没有必要引入额外的气体。然而,如果需要,建议添加的N 2 100毫米汞柱。在这种情况下,计算N个2所需的压力被引入到所述歧管,使得N 2 100毫米汞柱将被引入到3升的反应烧瓶中。例如计算列在讨论部分。
- 连接的N 2气缸的歧管。
- 打开所有阀门,旋塞,除了阀6和旋塞1( 图4),并排空歧管<1毫米汞柱的压力。
- 关闭阀1,一旦所述歧管被抽真空( 图4)。
- 引入氮气进气歧管,直到获得一个小的压力(约10毫米汞柱)。打开阀1( 图4),以撤离所述歧管<1毫米汞柱。重复2倍多。
- 引入氮气进气歧管,直到在步骤5.1计算出的压力为止。
- 打开旋塞1( 图4)引入的N 2 100毫米汞柱到反应烧瓶中。
- 关闭旋塞1次氮气的预定压力被引入到反应烧瓶中,加入( 图4),并记录使用压力计的压力。
- 打开阀1( 图4),以撤离所述歧管<1毫米汞柱。
- 关闭阀2( 图4),并断开歧管中的氮气筒。
6。开始实验
- 通过关闭旋塞1和阀1( 图4)一旦所有的气体被引入到反应烧瓶中,以使环境空气可进入该歧管和带歧管到环境压力从歧管分离反应烧瓶中。
- 后从歧管仔细切断反应烧瓶中,将烧瓶中的某处它不会受到干扰( 例如,内部的空通风柜)。
- 断开真空泵,小心地取出冷阱,并允许内通风全操作通风柜。
- 固定特斯拉线圈连接到高频火花发生器。
- 相对的钨电极连接到电接地,使电流的跨越两个电极之间的间隙内畅通无阻。
- 设定火花发生器的输出电压,以大约30,000 V,详见由制造商提供的文档。
- 在此之前启动的火花时,关闭通风橱框格,作为该装置和实验者之间的安全防护罩。打开泰斯拉线圈开始实验,并允许产生火花,以1小时开/关周期持续2周(或其他期望的时段)。
7。实验结束
- 通过关闭泰斯拉线圈停止实验。
- 打开旋塞1( 图4)慢慢地将环境空气引入反应烧瓶中,并便于去除适配器和钨电极,以便SAmples可以被收集。如果需要的话,真空可以用于疏散有害反应的气体的反应烧瓶中。
8。采集液体样品
- 采用热解的玻璃吸管,去除反应瓶中液体样品,小心,尽量减少接触污染物,如那些可能通过接触吸管真空油脂或其他非无菌表面被引入。
- 将样品转移到一个无菌的塑料或玻璃容器中。塑料容器是不容易开裂或断裂时冻结,相比玻璃容器。
- 密封的样品容器和储存在能够在-20℃或更低的温度下达到作为不溶性产物的冷冻机可以防止试样溶液从在0℃下冷冻
9。清洁设备
- 用干净的抹布实验室仔细从设备的颈部取出真空脂,在适应ER和活门,和围绕所述钨电极的玻璃。
- 彻底清洁步骤9.1用甲苯描述的同一表面,从玻璃器皿完全去除有机真空润滑脂。如果使用硅润滑脂,高真空润滑脂可在热解后残留在玻璃器皿,创造将来的问题,如在讨论部分详述。
- 彻底清洗,反应烧瓶用刷子和下列溶剂中顺序为:超纯水(18.2MΩ厘米,<5ppb的TOC),超纯水(18.2MΩ厘米,<5 ppb的TOC)用5%的清洁剂,甲醇,甲苯,甲醇,超纯水(18.2MΩ厘米,<5 ppb的TOC)用5%的清洁剂,最后超纯水(18.2MΩ厘米,<5ppb的TOC)。
- 覆盖反应烧瓶用铝箔的所有打开的孔口和包装在铝箔的转接器及其组件。
- 一旦所有的玻璃器皿已经被铝箔包裹,在热解至少3小时空气中于500℃下
- 轻轻清洁电极用甲醇,让空气干燥。
10。样品分析
注意:当制备的样品进行分析,使用的酸水解的协议,如已详细描述的其他地方15,是用于获得更多的氨基酸是有用的。将回收的样品的一部分的水解提供了机会,同时分析游离氨基酸以及那些非生物条件下合成的对酸不稳定的前体。
- 用于氨基酸分析,使用合适的技术(例如液相色谱法和质谱法为基础的方法,或其它适当的方法)。这样的分析技术包括高效液相色谱荧光检测法(HPLC-FD)14,和超高效液相色谱-荧光检测的同时,飞行时间的正离子质谱(UHPLC-FD/ToF-MS)12,13。这个手稿描述了使用质谱分析通过一个三重四极杆质谱仪(QQQ-MS)与HPLC-FD一起分析。
结果
在放电实验合成的产物可以是相当复杂的,而且还有一些可以用来研究它们众多的分析方法。一些文献中较常用的技术,用于分析氨基酸在这里讨论。色谱和质谱方法是非常翔实的技术分析由米勒 - 尤列式火花放电实验产生的复杂的化学混合物。氨基酸分析可以使用邻-phthaldialdehyde/N-acetyl-L-cysteine(OPA / NAC)16,手性试剂对那个标记伯氨基基团,得到可在非手性固定相分离荧光非对?...
讨论
在这里所述的方案很多步骤都进行米勒 - 尤列型实验安全和正确的关键。首先,所有的玻璃器皿和样品处理工具,来与反应瓶或样品接触需要进行消毒。灭菌是通过彻底漂洗用超纯水(18.2MΩ厘米,<5 ppb的TOC)有关的项,然后包裹在铝箔上,在500℃下在空气中热分解为至少3小时前实现。一旦设备已经热解及在准备样品进行分析,必须小心,以避免有机污染物。被污染的风险可以通过佩戴丁腈手?...
披露声明
作者宣称没有竞争的财务权益。
致谢
本工作由NSF和NASA天体生物学项目的支持下,美国国家科学基金会中心的化学演化,CHE-1004570,和戈达德中心的天体生物学。 ETP要感谢由美国航天局行星生物学实习计划提供额外资金。作者还要感谢Asiri Galhena博士在成立最初的实验室设施非常宝贵的帮助。
材料
| Name | Company | Catalog Number | Comments |
| Glass Plugs for Manifold | Chemglass | CG-983-01 | |
| High Vacuum Grease | Apiezon | N/A | Type M/N |
| Silicon High Vacuum Grease | Dow Corning | 1597418 | |
| Teflon PFA Tubing | McMaster-Carr | 51805K54 | |
| Ultra-Torr Vacuum Fittings | Swagelok | SS-4-UT-6 | |
| Dry Scroll Vacuum Pump | Edwards | A72401905 | |
| U-Tube Manometer | Alta-Robbins | 100SS | |
| Tungsten Electrodes | Diamond Ground Products | TH2-1/16 | 2% thoriated |
| Methanol | Alfa Aesar | N/A | Ultrapure HPLC Grade |
| Teflon-Coated Magnetic Stir Bar | McMaster-Carr | 5678K127 | |
| Gaseous NH3 | Airgas | AMAHLB | 99.99% purity |
| Gaseous CH4 | Airgas | ME UHP300 | 99.99% purity |
| Gaseous N2 | Airgas | NI UHP300 | 99.999% purity |
| Tesla Coil | Electro-Technic Products | 15001 | Model BD-50E |
| 24 hr Plug-in Basic Timer | General Electric Company | 15119 | |
| Cleaning Detergent | Alconox | 1104 | |
| Toluene | Thermo Fisher Scientific | N/A | Optima Grade |
| Luna Phenyl-Hexyl HPLC Column | Phenomenex | 00G-4257-E0 | Brand: Luna |
| Formic Acid | Sigma-Alrich | F0507 | Used to make 50 mM ammonium formate |
参考文献
- Oparin, A. I. . The Origin of Life. , (1924).
- Haldane, J. B. The origin of life. Rationalist Annu. 148, 3-10 (1929).
- Garrison, W. M., Morrison, D. C., Hamilton, J. G., Benson, A. A., Calvin, M. Reduction of Carbon Dioxide in Aqueous Solutions by Ionizing Radiation. Science. 114, 416-418 (1951).
- Miller, S. L. Production of Some Organic Compounds under Possible Primitive Earth Conditions. J. Am. Chem. Soc. 77, 2351-2361 (1955).
- Miller, S. L. A Production of Amino Acids Under Possible Primitive Earth Conditions. Science. 117, 528-529 (1953).
- Heyns, H. K., Walter, W., Meyer, E. Model experiments on the formation of organic compounds in the atmosphere of simple gases by electrical discharges (Translated from German). Die Naturwissenschaften. 44, 385-389 (1957).
- Ponnamperuma, C., Woeller, F. α-Aminonitriles formed by an electric discharge through a mixture of anhydrous methane and ammonia. Biosystems. 1, 156-158 (1967).
- Oró, J. Synthesis of Organic Compounds by Electric Discharges. Nature. 197, 862-867 (1963).
- Ring, D., Wolman, Y., Friedmann, N., Miller, S. L. Prebiotic Synthesis of Hydrophobic and Protein Amino Acids. Proc. Natl. Acad. Sci. U.S.A. 69, 765-768 (1972).
- Wolman, Y., Haverland, W. J., Miller, S. L. Nonprotein Amino Acids from Spark Discharges and Their Comparison with the Murchison Meteorite Amino Acids. Proc. Natl. Acad. Sci. U.S.A. 69, 809-811 (1972).
- Roscoe, S., Miller, S. L. Energy Yields for Hydrogen Cyanide and Formaldehyde Syntheses: The HCN and Amino Acid Concentrations in the Primitive Ocean. Orig. Life. 17, 261-273 (1987).
- Johnson, A. P., et al. The Miller Volcanic Spark Discharge Experiment. Science. 322, 404 (2008).
- Parker, E. T., et al. Primordial synthesis of amines and amino acids in a 1958 Miller H2S-rich spark discharge experiment. Proc. Natl. Acad. Sci. U.S.A. 108, 5526-5531 (2011).
- Cleaves, H. J., Chalmers, J. H., Lazcano, A., Miller, S. L., Bada, J. L. A reassessment of prebiotic organic synthesis in neutral planetary atmospheres. Orig. Life Evol. Biosph. 38, 105-115 (2008).
- Glavin, D. P., et al. Amino acid analyses of Antarctic CM2 meteorites using liquid chromatography-time of flight-mass spectrometry. Meteorit. Planet. Sci. 41, 889-902 (2006).
- Zhao, M., Bada, J. L. Determination of α-dialkylamino acids and their enantiomers in geologic samples by high-performance liquid chromatography after a derivatization with a chiral adduct of o-phthaldialdehyde. J. Chromatogr. A. 690, 55-63 (1995).
- Strecker, A. About the artificial formation of lactic acid and a new Glycocoll the homologous body Justus Liebigs Annalen der Chemie. 75, 27-45 (1850).
- Miyakawa, S., Yamanashi, H., Kobayashi, K., Cleaves, H. J., Miller, S. L. Prebiotic synthesis from CO atmospheres: implications for the origins of life. Proc. Natl. Acad. Sci. U.S.A. 99, 14628-14631 (2002).
- Kobayashi, K., Kaneko, T., Saito, T., Oshima, T. Amino Acid Formation in Gas Mixtures by Particle Irradiation. Orig. Life Evol. Biosph. 28, 155-165 (1998).
- Sagan, C., Khare, B. N. Long-Wavelength Ultraviolet Photoproduction of Amino Acids on the Primitive Earth. Science. 173, 417-420 (1971).
- Harada, K., Fox, S. W. Thermal Synthesis of Natural Amino-Acids from a Postulated Primitive Terrestrial Atmosphere. Nature. 201, 335-336 (1964).
- Ponnamperuma, C., Lemmon, R. M., Mariner, R., Calvin, M. Formation of Adenine by Electron Irradiation of Methane Ammonia, and Water. Proc. Natl. Acad. Sci. USA. 49, 737-740 (1963).
- Bar-Nun, A., Bar-Nun, N., Bauer, S. H., Sagan, C. Shock Synthesis of Amino Acids in Simulated Primitive Environments. Science. 168, 470-473 (1970).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。