È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Condurre esperimenti Miller-Urey
In questo articolo
Riepilogo
L'esperimento di Miller-Urey è stato uno studio pionieristico per quanto riguarda la sintesi abiotica di composti organici con possibile rilevanza alle origini della vita. Gas semplici sono stati introdotti in un apparecchio di vetro e sottoposti ad una scarica elettrica, simulando gli effetti del fulmine nel sistema atmosfera-oceano primordiale della Terra. L'esperimento è stato condotto per una settimana, dopo di che, i campioni raccolti da esso sono stati analizzati per i mattoni chimica della vita.
Abstract
Nel 1953, Stanley Miller ha riferito la produzione di biomolecole da semplici materiali di partenza gassosi, utilizzando un apparato costruito per simulare il sistema atmosfera-oceano primordiale della Terra. Miller introdotto 200 ml di acqua, 100 mmHg di H 2, 200 mmHg di CH 4 e 200 mmHg di NH 3 nell'apparecchio, poi sottoposto questa miscela, a riflusso, ad una scarica elettrica per una settimana, mentre l'acqua era simultaneamente riscaldata. Lo scopo di questo manoscritto è di fornire al lettore un protocollo sperimentale generale che può essere utilizzato per condurre un esperimento scintilla di scarico tipo Miller-Urey, utilizzando un pallone di reazione 3 L semplificata. Poiché l'esperimento consiste nell'esporre gas infiammabili ad una scarica elettrica ad alta tensione, vale la pena evidenziare passi importanti che riducono il rischio di esplosione. Le procedure generali descritte in questo lavoro possono essere estrapolati per progettare e condurre una grande varietà di esperimento scarica elettricas simulando ambienti planetari primitivi.
Introduzione
La natura delle origini della vita sulla Terra rimane una delle questioni scientifiche più imperscrutabili. Nel 1920 il biologo russo Alexander Oparin e britannici evolutiva biologo e genetista John Haldane ha proposto il concetto di "brodo primordiale" 1,2, descrivendo gli oceani terrestri primitive contenenti composti organici che possono aver facilitato l'evoluzione chimica. Tuttavia, non è stato fino al 1950 quando i chimici cominciarono a condurre studi di laboratorio deliberatamente volti a comprendere come le molecole organiche avrebbero potuto essere sintetizzato da semplici materiali di partenza sulla Terra primitiva. Uno dei primi rapporti a tal fine è stata la sintesi di acido formico dalla irradiazione di soluzioni acquose di CO 2 nel 1951 3.
Nel 1952, Stanley Miller, allora studente laureato presso l'Università di Chicago, si avvicinò Harold Urey di fare un esperimento per valutare la possibilità che i composti organiciimportante per l'origine della vita potrebbero essere stati formati abiologicamente sulla Terra primitiva. L'esperimento è stato condotto utilizzando un apparato di vetro su misura (Figura 1A) progettato per simulare Terra primitiva. L'esperimento di Miller imitato fulmine dall'azione di una scarica elettrica su una miscela di gas che rappresentano l'atmosfera primordiale, in presenza di un serbatoio di acqua liquida, che rappresenta i primi oceani. L'apparecchio anche simulato evaporazione e precipitazione mediante l'utilizzo di un mantello riscaldante e di un condensatore, rispettivamente. I dettagli specifici circa l'apparato Miller utilizzato può essere trovato altrove 4. Dopo una settimana di scintille, il contenuto del pallone erano visibilmente trasformati. L'acqua trasformato una torbida, colore rossastro 5 e il materiale giallo-marrone accumulata sugli elettrodi 4. Questo lavoro pionieristico è considerato il primo intenzionale, efficace sintesi di biomolecole in condizioni simulate primitive della Terra.
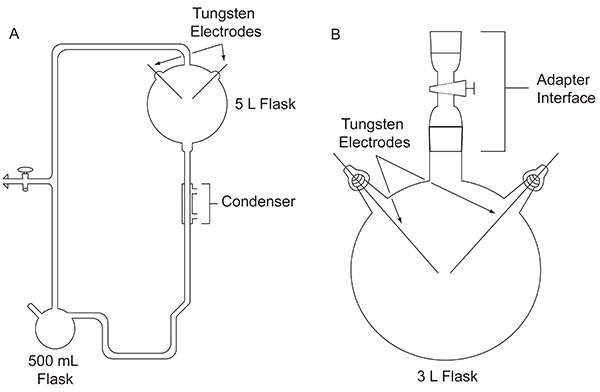
Figura 1. Confronto tra i due tipi di apparecchi descritti in questo documento. Apparecchiatura classico utilizzato per l'esperimento originale Miller-Urey (A) e l'apparato semplificato utilizzato nel protocollo qui descritto (B). Clicca qui per vedere l'immagine ingrandita .
Dopo la pubblicazione di 1953 risultati classico esperimento di Miller, numerose varianti dell'esperimento scintilla di scarico, ad esempio utilizzando altre miscele di gas, sono stati eseguiti per esplorare la plausibilità di produrre composti organici importanti per la vita sotto una varietà di possibili condizioni iniziali Terra. Ad esempio, un CH 4 / H 2 O / NH 3 / H 2 S miscela di gas è stato testato per la sua capacità di produrre gli acidi α-ammino contenenti zolfo codificati, anche se questi non sono stati rilevati 6. Cromatografia-spettrometria di massa di gas (GC-MS) analisi di un CH 4 / NH 3 miscela sottoposta ad una scarica elettrica ha mostrato la sintesi di α-aminonitriles, che sono precursori di acido ammino 7. Nel 1972, utilizzando un apparecchio semplice, introdotto da Oró 8 (Figura 1B), Miller e colleghi hanno dimostrato la sintesi di tutti gli acidi α-amminoacidi codificati 9 e amminoacidi non proteici 10 che erano stati identificati nel meteorite Murchison ad oggi, sottoponendo CH 4, N 2, e piccole quantità di NH 3 ad una scarica elettrica. In seguito, utilizzando lo stesso disegno sperimentale semplificato, miscele di gas contenenti H 2 O, N 2 e CH 4, CO 2, CO o sono stati scatenato per studentidy la resa di acido cianidrico, formaldeide, e amminoacidi in funzione dello stato di ossidazione di specie carbonio atmosferico 11.
Oltre all'esplorazione di disegni sperimentali alternativi nel corso degli anni, si sono verificati significativi progressi analitici dal classico esperimento di Miller, che ha recentemente aiutato indagini più di sondaggio di scarica elettrica campioni sperimentali archiviati da Miller, che sarebbe stato facilitato dalle tecniche Miller ha avuto accesso ad nel 1950. L'esperimento di Miller vulcanica 12, prima riportato nel 1955 4, e del 1958 H 2 S-contenenti esperimento 13 hanno mostrato di avere formato una varietà più ampia e maggiori abbondanze, di numerosi amminoacidi e ammine rispetto al classico esperimento, compresi molti dei quali che non erano stati precedentemente identificato in esperimenti di scarico scintilla.
L'esperimento descritto in questo documento può essere condotta utilizzandouna varietà di miscele di gas. Tipicamente, per lo meno, tali esperimenti contenere un gas C-cuscinetto, un gas N-cuscinetto, e acqua. Con una pianificazione, quasi qualsiasi miscela di gas può essere esplorato, tuttavia, è importante considerare alcuni aspetti chimici del sistema. Ad esempio, il pH della fase acquosa può avere un impatto significativo sulla chimica che avviene lì 14.
Il metodo qui descritto è stato adattato per istruire i ricercatori come condurre esperimenti di scarico scintilla che ricordano l'esperimento di Miller-Urey usando un recipiente di reazione 3 L semplificata, come descritto di Miller 1972 pubblicazioni 9,10. Da questo esperimento comporta un arco elettrico ad alta tensione che agisce sul gas infiammabili, è fondamentale per rimuovere O 2 dal pallone di reazione per eliminare il rischio di esplosione, che può verificarsi nella combustione di ridotte gas contenente carbonio quali metano o monossido di carbonio, o la reazione of H 2 con ossigeno.
Ci sono ulteriori dettagli che dovrebbero essere tenuti a mente quando si prepara a condurre l'esperimento discusso qui. In primo luogo, quando si lavora con le linee di vuoto di vetro e gas sotto pressione, esiste il pericolo insito sia di implosione e sovra-pressioni. Pertanto, occhiali di sicurezza devono essere indossati in ogni momento. Secondo luogo, l'esperimento è tipicamente effettuato a meno di pressione atmosferica. Ciò minimizza il rischio di sovra-pressione del collettore e pallone di reazione. Cristalleria può essere valutato pari o superiore alla pressione atmosferica, tuttavia, pressioni superiori a 1 atm non sono raccomandati. Pressioni possono aumentare in questi esperimenti come insolubile in acqua H 2 è liberato dai gas ridotte (come CH 4 e NH 3). Over-pressione può portare a perdite di tenuta, che può permettere O 2 atmosferico per entrare nel recipiente di reazione, rendendo possibile indurre combustione, con conseguente esplosione. In terzo luogo,occorre ricordare che la modifica di questo protocollo per condurre variazioni del esperimento richiede un'attenta pianificazione per garantire condizioni sicure non vengono creati. In quarto luogo, si raccomanda vivamente che il futuro sperimentatore leggere attraverso l'intero protocollo di cura più volte prima di tentare questo esperimento per essere sicuro che lui o lei ha familiarità con potenziali insidie e che tutto l'hardware necessario è disponibile e in atto. Infine, gli esperimenti che effettuano coinvolgono gas combustibili prevedono il rispetto di salute ambientale e sicurezza le linee guida dipartimentali dell'istituzione ospitante dello sperimentatore. Osservare queste raccomandazioni prima di procedere con eventuali esperimenti. Tutti i passi descritti nel protocollo qui sono in conformità con le linee guida di accoglienza Salute ambientali e di sicurezza istituzionali degli autori.
Protocollo
1. Impostazione di un sistema collettore / vuoto
- Utilizzare un collettore di vetro per introdurre gas nel pallone di reazione. Questo collettore può essere acquistato o costruito da un impianto di soffiatura del vetro, ma deve includere porte a tenuta di vuoto che possono essere collegati ad un sistema di aspirazione, bombole di gas, un vacuometro, e il recipiente di reazione.
- Utilizzare giunti a smeriglio e spine di vetro con valvole sul collettore. Assicurarsi che tutti gli O-ring sui tappi sono in grado di fare le guarnizioni necessarie. Se si utilizza giunti in vetro, una quantità sufficiente di grasso per vuoto può essere applicato per rendere una guarnizione, se necessario. Grasso per vuoto silicio può essere utilizzato per evitare la potenziale contaminazione organica.
- Utilizzare rubinetti di vetro sul collettore. Applicare la quantità minima di grasso per vuoto necessario fare un sigillo.
- Misurare il volume del collettore. Questo volume viene utilizzato per i calcoli relativi a pressioni del gas finali nel pallone di reazione 3 L e dovrebbe essere noto il più precisamente possibile.
- A meno che il collettore ha abbastanza connessioni per ospitare le bombole del gas contemporaneamente, collegare un cilindro alla volta al collettore. Includere in tale contesto, un rubinetto che consente il collettore sia isolato dall'atmosfera ambiente.
- Utilizzare adeguati, puliti, inerte, e chimica e perdite tubi resistenti e raccordi per vuoto ultratorr per collegare le bombole di gas al collettore. Raccordi Ultratorr, dove è utilizzato, devono essere finger-serrati.
- Collegare al collettore, una pompa a vuoto in grado di stabilire un vuoto di <1 mmHg. Lo scarico pompa a vuoto deve essere situata all'interno della cappa, o adeguatamente ventilato con altri mezzi.
- Per garantire un rapido raggiungimento del vuoto e per proteggere la pompa, inserire una trappola tra il collettore e la pompa del vuoto. Un azoto antischiacciamento liquido è raccomandato poiché impedisce volatili quali NH 3, CO 2 e H 2 O di entrare nella pompa. Si deve prestare attenzione, come volatili intrappolati, su warming, può sovrapressioni il collettore e provocare la rottura del vetro.
- Collegare al collettore, di un manometro o di altro calibro vuoto in grado di risoluzione di 1 mmHg o superiore. Mentre i vari dispositivi possono essere utilizzati, un manometro a mercurio, o calibro MacLeod, è preferibile in quanto il mercurio è abbastanza reattivo.
- Misurare e registrare la temperatura ambiente con un termometro adatto.
2. Preparazione del pallone di reazione
- Riscaldare la vetreria a 500 ° C per almeno 3 ore in aria prima dell'uso, per rimuovere contaminanti organici.
- Pulire gli elettrodi di tungsteno lavando delicatamente con salviette di laboratorio pulite e metanolo, ed essiccazione in aria.
- Versare 200 ml di acqua ultrapura (18,2 mW cm, <5 ppb TOC) nel pallone di reazione 3 L.
- Introdurre un ancoretta magnetica predepurata e sterilizzati, che garantirà un rapido scioglimento dei gas solubili e la miscelazione dei reagenti durante la experiment.
- Attaccare gli elettrodi di tungsteno al pallone di reazione 3 L utilizzando una quantità minima di grasso per vuoto, con punte separate da circa 1 cm all'interno della muffola. Fissare con clips.
- Inserire un adattatore di rubinetto incorporato nel collo del pallone di reazione 3 L e fissare con una clip.
- Collegare il pallone di reazione 3 L al collettore gas tramite l'adattatore. Utilizzare una clip o morsetto per proteggere il pallone.
- Ungere leggermente tutte le connessioni per garantire una buona tenuta di vuoto.
- Aprire tutte le valvole e rubinetti sul collettore, ad eccezione di Valve 6 e Stopcock 1 (figura 4), e accendere la pompa del vuoto per evacuare il collettore. Una volta che una misura del vuoto stabile di <1 mmHg è stata raggiunta, chiudere la valvola 1 e lasciare il collettore a sedere per ~ 15 minuti per controllare eventuali perdite di vuoto. Se non vengono rilevati, passare al punto 2.8. In caso contrario, risolvere i vari collegamenti fino a quando le perdite possono essere identificati e risolti.
- Lapply agitazione magnetica al recipiente di reazione. Aprire la valvola 1 e Stopcock 1 (figura 4) per evacuare spazio di testa del pallone di reazione 3 L finché la pressione ha raggiunto <1 mmHg.
- Chiudere la valvola 1 (figura 4) e monitorare la pressione all'interno del pallone di reazione 3 L. La pressione misurata dovrebbe aumentare la pressione di vapore d'acqua. Per garantire che non vi siano perdite, attendere ~ 5 min in questa fase. Se la pressione (come letto sul manometro) aumenta mentre la valvola 1 è chiusa durante questa fase, controllare eventuali perdite in Stopcock 1 e le varie connessioni pallone di reazione. Se non viene trovata alcuna perdita, procedere al passaggio successivo.
3. Introduzione di gassoso NH 3
- Calcolare la pressione necessaria di NH 3 gassosa introdurre nel collettore tale che 200 mmHg di NH 3 saranno introdotti nel pallone di reazione. I dettagli su come eseguire questa operazione sono fornite nella sezione di discussione.
- Chiudere le valvole1 e 6, e Stopcock 1 (figura 4) prima di introdurre del gas nel collettore. Lasciare le altre valvole e rubinetto aperto.
- Introdurre NH 3 nel collettore fino al raggiungimento di una pressione (circa 10 mmHg) e poi evacuare il collettore ad una pressione di <1 mmHg aprendo la valvola 1 (figura 4). Ripetere 3x.
- Introdurre NH 3 nel collettore raggiunge la pressione determinata nella fase 3.1.
- Aprire il rubinetto 1 (figura 4) introdurre 200 mmHg di NH 3 nel pallone di reazione 3 L. Il NH 3 si dissolve in acqua nel pallone di reazione e la pressione cadrà lentamente.
- Una volta che la pressione si ferma cadere, vicino Stopcock 1 (figura 4) e registrare la pressione letta dal manometro. Questo valore rappresenta la pressione all'interno del pallone e verrà utilizzata per calcolare le pressioni di altri gas che saranno introdotte nel collettore tardi.
- aprire la valvola 1 (figura 4) per svuotare il raccordo ad una pressione <1 mmHg.
- Chiudere la valvola 2 (Figura 4) e scollegare il cilindro NH 3 gas dal collettore.
4. Introduzione di CH 4
- Calcolare la pressione necessaria di CH 4 siano introdotti nel collettore tale che 200 mmHg di CH 4 saranno introdotti nel pallone di reazione 3 L. Calcoli di esempio sono riportati nella sezione discussione.
- Collegare il cilindro CH 4 gas al collettore.
- Aprire tutte le valvole ei rubinetti, tranne valvola 6 e Stopcock 1 (figura 4), e svuotare il raccordo ad una pressione di <1 mmHg.
- Chiusura Valvola 1 una volta che il collettore è stato evacuato (Figura 4).
- Introdurre CH 4 nel collettore fino ad ottenere una piccola pressione (circa 10 mmHg). Questo elimina la linea di eventuali gas contaminanti from precedenti passaggi. Aprire la valvola 1 (figura 4) per svuotare il raccordo a <1 mmHg. Ripetere più 2x.
- Introdurre CH 4 nel collettore finché la pressione calcolata al punto 4.1, è raggiunto.
- Aprire il rubinetto 1 (figura 4) introdurre 200 mmHg di CH 4 nel pallone di reazione 3 L.
- Chiudere il rubinetto 1 volta la pressione prevista di CH 4 è stato introdotto nel pallone di reazione 3 L (Figura 4) e registrare la pressione misurata dal manometro.
- Aprire la valvola 1 (figura 4) per svuotare il raccordo a <1 mmHg.
- Chiudere la valvola 2 (figura 4) e scollegare il CH 4 cilindri dal collettore.
5. Introduzione di altri gas (ad esempio N 2)
- A questo punto, non è necessario introdurre gas in questione. Tuttavia, se desiderato, si consiglia di aggiungere 100 mmHg di N 2. In questo caso, calcolare la pressione necessaria di N 2 ad essere introdotti nel collettore tale che 100 mmHg di N 2 saranno introdotti nel pallone di reazione 3 L. Calcoli di esempio sono riportati nella sezione discussione.
- Collegare il cilindro N 2 gas al collettore.
- Aprire tutte le valvole ei rubinetti, tranne valvola 6 e Stopcock 1 (figura 4), e svuotare il raccordo ad una pressione di <1 mmHg.
- Chiusura Valvola 1 una volta che il collettore è stato evacuato (Figura 4).
- Introdurre N 2 nel collettore fino ad ottenere una piccola pressione (circa 10 mmHg). Aprire la valvola 1 (figura 4) per svuotare il raccordo a <1 mmHg. Ripetere più 2x.
- Introdurre N 2 nel collettore fino a raggiungere la pressione calcolata nel passo 5.1.
- Aprire il rubinetto 1 (figura 4) introdurre 100 mmHg di N 2 nel pallone di reazione.
- Chiudere il rubinetto 1 volta la pressione prevista di N 2 è stato introdotto nel pallone di reazione, (figura 4) e registrare la pressione con manometro.
- Aprire la valvola 1 (figura 4) per svuotare il raccordo a <1 mmHg.
- Chiudere la valvola 2 (Figura 4) e scollegare il cilindro N 2 dal collettore.
6. Inizio dell'esperimento
- Staccare il pallone di reazione dal collettore chiudendo Stopcock 1 e valvola 1 (figura 4) una volta tutti i gas sono stati introdotti nel pallone di reazione, in modo che l'aria ambiente può entrare nel collettore e portare il collettore fino alla pressione ambiente.
- Dopo aver scollegato attentamente il pallone di reazione dal collettore, impostare il matraccio qualche non sarà disturbato (ad esempio all'interno di una cappa vuoto).
- Scollegare la pompa del vuoto e rimuovere con cautela la trappola fredda e permettere ventilazione all'interno di un pienocappa operativa.
- Fissare la bobina Tesla collegato al generatore di alta frequenza scintilla.
- Collegare l'elettrodo di tungsteno opposto a terra elettrica per consentire il passaggio efficiente della corrente elettrica attraverso lo spazio tra i due elettrodi.
- Impostare la tensione di uscita del generatore di scintille a circa 30.000 V, come indicato dai documenti disponibili presso il produttore.
- Prima di iniziare la scintilla, chiudere il battente cappa, per servire come uno schermo di sicurezza tra l'apparecchiatura e il sperimentatore. Girare la bobina di Tesla su per avviare l'esperimento, e consentire scintille proseguire per 2 settimane (o altro periodo desiderato) in 1 ora cicli on / off.
7. End of Experiment
- Interrompere l'esperimento spegnendo la bobina di Tesla.
- Aprire il rubinetto 1 (figura 4) introdurre lentamente aria ambiente nel pallone di reazione e facilitare la rimozione dell'adattatore e gli elettrodi di tungsteno così samples possono essere raccolti. Se lo si desidera, il vuoto può essere utilizzato per evacuare il pallone di reazione dei gas di reazione nocivi.
8. Raccolta campione di liquido
- Usando una pipetta di vetro pirolizzati, rimuovere campioni di liquido dal pallone di reazione, facendo attenzione a minimizzare l'esposizione ai contaminanti, come quelli che potrebbero essere introdotte toccando la pipetta al grasso vuoto o altre superfici non sterili.
- Trasferire il campione ad una plastica sterile o recipiente di vetro. Recipienti di plastica sono meno inclini alla rottura o di rottura sopra lo zero, rispetto ai recipienti di vetro.
- Contenitori dei campioni Seal e conservare in un congelatore in grado di raggiungere temperature di -20 ° C o inferiore, come prodotti insolubili possono impedire la soluzione del campione da congelamento a 0 ° C.
9. Pulizia della Apparato
- Utilizzare laboratorio pulito salviette per rimuovere con attenzione grasso per vuoto dal collo degli apparecchi, la adeguareer e rubinetto, e il vetro che circonda gli elettrodi di tungsteno.
- Pulire accuratamente le superfici stesse descritte nel punto 9.1 con toluene per rimuovere completamente grasso per vuoto organico dalla cristalleria. Se si usa grasso al silicone, il grasso alto vuoto può rimanere sul cristalleria dopo pirolisi, creando problemi futuri, come dettagliato nella sezione di discussione.
- Pulire accuratamente il pallone di reazione con un pennello e le seguenti solventi in ordine: acqua ultrapura (18,2 mW cm, <5 ppb TOC), acqua ultrapura (18,2 mW cm, <5 ppb TOC) con il 5% di detergente pulizia, metanolo, toluene, metanolo, acqua ultrapura (18,2 mW cm, <5 ppb TOC) con il 5% di detergente pulizia, e infine acqua ultrapura (18,2 mW cm, <5 ppb TOC).
- Coprire tutti gli orifizi aperti del pallone di reazione con un foglio di alluminio e avvolgere l'adattatore e dei suoi componenti in alluminio.
- Una volta che tutta la vetreria è stato avvolto in un foglio di alluminio, pyrolyze per almeno 3 ore inaria a 500 ° C.
- Elettrodi delicatamente pulite con metanolo e lasciate asciugare all'aria.
10. Analisi dei campioni
Nota: Nel preparare campioni per analisi, l'uso di un protocollo idrolisi acida come è stato descritto in dettaglio altrove 15, è utile per ottenere più aminoacidi. Idrolisi di una porzione del campione recuperato offre l'opportunità di analizzare sia aminoacidi liberi così come i loro precursori di acido-labile che vengono sintetizzati in condizioni abiotici.
- Per l'analisi degli aminoacidi, utilizzare una tecnica adatta (ad esempio cromatografia liquida e metodi basati spettrometria di massa, o con altri metodi appropriati). Tali tecniche analitiche includono cromatografia liquida ad alta prestazione con rivelazione a fluorescenza (HPLC-FD) 14, e ultra cromatografia liquida ad un rivelatore a fluorescenza in parallelo con la spettrometria di massa a ionizzazione elettrospray tempo di volo positivo (UHPLC-FD/ToF-MS) 12,13. Questo manoscritto descrive le analisi con spettrometria di massa analisi tramite uno spettrometro di massa a triplo quadrupolo (QQQ-MS), in combinato disposto con l'HPLC-FD.
Risultati
I prodotti sintetizzati in esperimenti scarica elettrica possono essere complessi, e ci sono numerosi approcci analitici che possono essere utilizzati per studiare loro. Alcune delle tecniche più comunemente utilizzate in letteratura per l'analisi di aminoacidi sono discussi qui. Metodi cromatografici e di spettrometria di massa sono tecniche altamente informativi per analizzare le miscele chimiche complesse prodotte dal tipo di Miller-Urey esperimenti di scarico scintilla. Amminoacido analisi può essere condotta ...
Discussione
Numerosi passi nel protocollo qui descritto sono fondamentali per lo svolgimento di Miller-Urey tipo di esperimenti in modo sicuro e corretto. In primo luogo, tutti gli strumenti di vetro e di manipolazione dei campioni che entrano a contatto con il pallone di reazione o campione devono essere sterilizzati. La sterilizzazione si ottiene sciacquarle accuratamente i prodotti in questione con acqua ultrapura (18,2 mW cm, <5 ppb TOC) e poi avvolgendoli in carta stagnola, prima di pirolisi a 500 ° C in aria per almeno 3 ...
Divulgazioni
Gli autori dichiarano interessi finanziari concorrenti.
Riconoscimenti
Questo lavoro è stato sostenuto congiuntamente dalla NSF e NASA Astrobiology Programma, nell'ambito del Centro NSF per Chimica Evolution, CHE-1004570, e il Centro Goddard di Astrobiologia. ETP desidera ringraziare finanziamento supplementare fornito dal Programma di Biologia Tirocinio NASA Planetary. Gli autori desiderano inoltre ringraziare il dottor Asiri Galhena per il prezioso aiuto nella creazione delle strutture di laboratorio iniziali.
Materiali
| Name | Company | Catalog Number | Comments |
| Glass Plugs for Manifold | Chemglass | CG-983-01 | N/A |
| High Vacuum Grease | Apiezon | N/A | Type M/N |
| Silicon High Vacuum Grease | Dow Corning | 1597418 | N/A |
| Teflon PFA Tubing | McMaster-Carr | 51805K54 | N/A |
| Ultra-Torr Vacuum Fittings | Swagelok | SS-4-UT-6 | N/A |
| Dry Scroll Vacuum Pump | Edwards | A72401905 | N/A |
| U-Tube Manometer | Alta-Robbins | 100SS | N/A |
| Tungsten Electrodes | Diamond Ground Products | TH2-1/16 | 2% thoriated |
| Methanol | Alfa Aesar | N/A | Ultrapure HPLC Grade |
| Teflon-Coated Magnetic Stir Bar | McMaster-Carr | 5678K127 | N/A |
| Gaseous NH3 | Airgas | AMAHLB | 99.99% purity |
| Gaseous CH4 | Airgas | ME UHP300 | 99.99% purity |
| Gaseous N2 | Airgas | NI UHP300 | 99.999% purity |
| Tesla Coil | Electro-Technic Products | 15001 | Model BD-50E |
| 24 Hour Plug-In Basic Timer | General Electric Company | 15119 | N/A |
| Cleaning Detergent | Alconox | 1104 | N/A |
| Toluene | Thermo Fisher Scientific | N/A | Optima Grade |
| Luna Phenyl-Hexyl HPLC Column | Phenomenex | 00G-4257-E0 | Brand: Luna |
| Formic Acid | Sigma-Alrich | F0507 | Used to make 50 mM ammonium formate |
Riferimenti
- Oparin, A. I. . The Origin of Life. , (1924).
- Haldane, J. B. The origin of life. Rationalist Annu. 148, 3-10 (1929).
- Garrison, W. M., Morrison, D. C., Hamilton, J. G., Benson, A. A., Calvin, M. Reduction of Carbon Dioxide in Aqueous Solutions by Ionizing Radiation. Science. 114, 416-418 (1951).
- Miller, S. L. Production of Some Organic Compounds under Possible Primitive Earth Conditions. J. Am. Chem. Soc. 77, 2351-2361 (1955).
- Miller, S. L. A Production of Amino Acids Under Possible Primitive Earth Conditions. Science. 117, 528-529 (1953).
- Heyns, H. K., Walter, W., Meyer, E. Model experiments on the formation of organic compounds in the atmosphere of simple gases by electrical discharges (Translated from German). Die Naturwissenschaften. 44, 385-389 (1957).
- Ponnamperuma, C., Woeller, F. α-Aminonitriles formed by an electric discharge through a mixture of anhydrous methane and ammonia. Biosystems. 1, 156-158 (1967).
- Oró, J. Synthesis of Organic Compounds by Electric Discharges. Nature. 197, 862-867 (1963).
- Ring, D., Wolman, Y., Friedmann, N., Miller, S. L. Prebiotic Synthesis of Hydrophobic and Protein Amino Acids. Proc. Natl. Acad. Sci. U.S.A. 69, 765-768 (1972).
- Wolman, Y., Haverland, W. J., Miller, S. L. Nonprotein Amino Acids from Spark Discharges and Their Comparison with the Murchison Meteorite Amino Acids. Proc. Natl. Acad. Sci. U.S.A. 69, 809-811 (1972).
- Roscoe, S., Miller, S. L. Energy Yields for Hydrogen Cyanide and Formaldehyde Syntheses: The HCN and Amino Acid Concentrations in the Primitive Ocean. Orig. Life. 17, 261-273 (1987).
- Johnson, A. P., et al. The Miller Volcanic Spark Discharge Experiment. Science. 322, 404 (2008).
- Parker, E. T., et al. Primordial synthesis of amines and amino acids in a 1958 Miller H2S-rich spark discharge experiment. Proc. Natl. Acad. Sci. U.S.A. 108, 5526-5531 (2011).
- Cleaves, H. J., Chalmers, J. H., Lazcano, A., Miller, S. L., Bada, J. L. A reassessment of prebiotic organic synthesis in neutral planetary atmospheres. Orig. Life Evol. Biosph. 38, 105-115 (2008).
- Glavin, D. P., et al. Amino acid analyses of Antarctic CM2 meteorites using liquid chromatography-time of flight-mass spectrometry. Meteorit. Planet. Sci. 41, 889-902 (2006).
- Zhao, M., Bada, J. L. Determination of α-dialkylamino acids and their enantiomers in geologic samples by high-performance liquid chromatography after a derivatization with a chiral adduct of o-phthaldialdehyde. J. Chromatogr. A. 690, 55-63 (1995).
- Strecker, A. About the artificial formation of lactic acid and a new Glycocoll the homologous body Justus Liebigs Annalen der Chemie. 75, 27-45 (1850).
- Miyakawa, S., Yamanashi, H., Kobayashi, K., Cleaves, H. J., Miller, S. L. Prebiotic synthesis from CO atmospheres: implications for the origins of life. Proc. Natl. Acad. Sci. U.S.A. 99, 14628-14631 (2002).
- Kobayashi, K., Kaneko, T., Saito, T., Oshima, T. Amino Acid Formation in Gas Mixtures by Particle Irradiation. Orig. Life Evol. Biosph. 28, 155-165 (1998).
- Sagan, C., Khare, B. N. Long-Wavelength Ultraviolet Photoproduction of Amino Acids on the Primitive Earth. Science. 173, 417-420 (1971).
- Harada, K., Fox, S. W. Thermal Synthesis of Natural Amino-Acids from a Postulated Primitive Terrestrial Atmosphere. Nature. 201, 335-336 (1964).
- Ponnamperuma, C., Lemmon, R. M., Mariner, R., Calvin, M. Formation of Adenine by Electron Irradiation of Methane Ammonia, and Water. Proc. Natl. Acad. Sci. USA. 49, 737-740 (1963).
- Bar-Nun, A., Bar-Nun, N., Bauer, S. H., Sagan, C. Shock Synthesis of Amino Acids in Simulated Primitive Environments. Science. 168, 470-473 (1970).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon