Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
La realización de experimentos de Miller-Urey
En este artículo
Resumen
El experimento de Miller-Urey fue un estudio pionero en cuanto a la síntesis abiótica de compuestos orgánicos con posible relevancia para los orígenes de la vida. Gases simples se introdujeron en un aparato de vidrio y se sometieron a una descarga eléctrica, simulando los efectos de un rayo en el sistema atmósfera-océano primordial de la Tierra. El experimento se llevó a cabo durante una semana, después de lo cual, se analizaron las muestras tomadas de la misma para los componentes químicos de la vida.
Resumen
En 1953, Stanley Miller reportó la producción de biomoléculas a partir de materiales de partida gaseosos simples, utilizando un aparato construido para simular el sistema atmósfera-océano primordial de la Tierra. Miller introdujo 200 ml de agua, 100 mm Hg de H 2, 200 mm Hg de CH 4, y 200 mmHg de NH 3 en el aparato, después se sometió esta mezcla, bajo reflujo, a una descarga eléctrica durante una semana, mientras que el agua era simultáneamente climatizada. El propósito de este manuscrito es proporcionar al lector un protocolo experimental general que puede ser utilizado para llevar a cabo un tipo de Miller-Urey experimento descarga de chispa, usando un matraz de reacción de 3 L simplificada. Dado que el experimento consiste en exponer los gases inflamables a una descarga eléctrica de alto voltaje, hay que destacar importantes medidas que reducen el riesgo de explosión. Los procedimientos generales descritos en este trabajo se pueden extrapolar a diseñar y llevar a cabo una amplia variedad de experimentos de descarga eléctricas simulando ambientes planetarios primitivos.
Introducción
La naturaleza de los orígenes de la vida en la Tierra sigue siendo una de las cuestiones científicas más inescrutables. En la década de 1920 el biólogo ruso Alexander Oparin y British evolutiva biólogo y genetista John Haldane propusieron el concepto de una "sopa primordial" 1,2, describiendo los océanos terrestres primitivas que contienen compuestos orgánicos que puedan haber facilitado la evolución química. Sin embargo, no fue hasta la década de 1950 cuando los químicos comenzaron a realizar estudios de laboratorio deliberadas dirigidas a la comprensión de cómo las moléculas orgánicas podrían haberse sintetizado a partir de materiales de partida simples en la Tierra primitiva. Uno de los primeros informes con este fin fue la síntesis del ácido fórmico a partir de la irradiación de soluciones acuosas de CO 2 en 1951 3.
En 1952, Stanley Miller, entonces un estudiante graduado en la Universidad de Chicago, Harold Urey acercó haciendo un experimento para evaluar la posibilidad de que los compuestos orgánicosimportante para el origen de la vida pudo haber sido formado abiologically en la Tierra primitiva. El experimento se llevó a cabo utilizando un aparato de vidrio hecha a la medida (Figura 1A) diseñado para simular la Tierra primitiva. El experimento de Miller imitaba un rayo por la acción de una descarga eléctrica en una mezcla de gases que representan a la atmósfera primitiva, en presencia de un depósito de agua en estado líquido, en representación de los océanos primitivos. El aparato también simula la evaporación y la precipitación a través del uso de una manta de calefacción y un condensador, respectivamente. Detalles específicos sobre el aparato de Miller utiliza se pueden encontrar en otros lugares 4. Después de una semana de la formación de chispas, el contenido en el matraz se transforman visiblemente. El agua se volvió un color rojizo turbio 5 y el material de color amarillo-marrón acumulada en los electrodos 4. Este innovador trabajo es considerado como la primera síntesis deliberada y eficiente de biomoléculas en condiciones de la Tierra primitiva simulados.
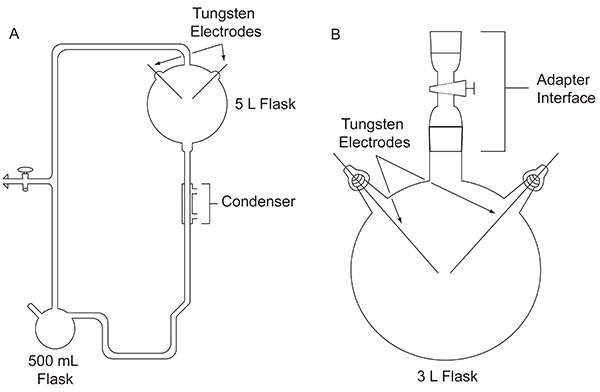
Figura 1. La comparación entre los dos tipos de aparatos discutidos en este documento. El aparato clásico usado para el experimento de Miller-Urey original (A) y el aparato simplificado utilizado en el protocolo descrito aquí (B). Haga clic aquí para ver la imagen más grande .
Después de la publicación 1953 de los resultados de experimento clásico de Miller, numerosas variaciones del experimento descarga de chispa, por ejemplo el uso de otras mezclas de gases, se llevaron a cabo para explorar la plausibilidad de la producción de compuestos orgánicos importantes para la vida bajo una variedad de condiciones posibles principios de la Tierra. Por ejemplo, un CH 4 / H 2 O / NH 3 / H 2 S mezcla de gas fue probado por su capacidad para producir los ácidos α-amino que contienen azufre codificados, aunque estos no se detectaron 6. Cromatografía de gas-espectrometría de masa (GC-MS) análisis de un CH 4 / NH mezcla 3 se somete a una descarga eléctrica mostró la síntesis de α-aminonitrilos, que se precursores de ácido 7 amino. En 1972, el uso de un aparato sencillo, primero introducido por Oró 8 (Figura 1B), Miller y sus colegas demostraron la síntesis de todos los ácidos α-amino codificados 9 y aminoácidos no proteicos 10 que habían sido identificados en el meteorito Murchison hasta la fecha, sometiendo CH 4, N 2, y pequeñas cantidades de NH 3 a una descarga eléctrica. Más tarde, con este mismo diseño experimental simplificado, mezclas de gases que contienen H 2 O, N 2 y CH 4, CO 2 o CO fueron provocados para estudiantesdy el rendimiento de cianuro de hidrógeno, formaldehído, y aminoácidos como una función del estado de oxidación de las especies de carbono en la atmósfera 11.
Además de la exploración de diseños experimentales alternativos en los últimos años, los avances analíticos significativos han ocurrido desde experimento clásico de Miller, que recientemente ayudó a investigaciones más de sondeo de muestras experimentales de descarga eléctrica archivados por Miller, que se hubiera facilitado por las técnicas Miller tenía acceso a en la década de 1950. El experimento de Miller volcánica 12, por primera vez en 1955 4, y un 1958 de H 2 S que contienen experimento 13 se demostró que han formado una variedad más amplia y mayor abundancia, de numerosos aminoácidos y aminas que el experimento clásico, incluyendo muchos de los cuales que no habían sido identificados previamente en experimentos de descarga de chispa.
El experimento descrito en este documento puede llevarse a cabo utilizandouna variedad de mezclas de gases. Típicamente, por lo menos, tales experimentos contendrán un gas de soporte de C, un gas N-cojinete, y agua. Con un poco de planificación, casi cualquier mezcla de gases puede ser explorado, sin embargo, es importante tener en cuenta algunos aspectos químicos del sistema. Por ejemplo, el pH de la fase acuosa puede tener un impacto significativo en la química que se produce allí 14.
El método descrito aquí se ha adaptado para instruir a los investigadores cómo llevar a cabo experimentos de descarga de chispa que se asemejan al experimento de Miller-Urey usando un recipiente de reacción 3 L simplificada, como se describe en las publicaciones de 1972 Miller 9,10. Desde este experimento consiste en un arco eléctrico de alta tensión que actúa sobre los gases inflamables, es crucial para eliminar O 2 del matraz de reacción para eliminar el riesgo de explosión, que puede ocurrir tras la combustión de los gases que contienen carbono reducidas tales como metano o monóxido de carbono, o o reacciónf H 2 con oxígeno.
Hay detalles adicionales que deben tenerse en cuenta cuando se prepara para realizar el experimento discutido aquí. En primer lugar, cuando el trabajo con líneas de vacío de vidrio y gases a presión, existe el peligro inherente tanto de implosión y el exceso de presionar. Por lo tanto, las gafas de seguridad deben ser usados en todo momento. En segundo lugar, el experimento se realiza típicamente a una presión inferior a la atmosférica. Esto minimiza el riesgo de sobre-presión sobre el colector y matraz de reacción. Cristalería puede estar clasificado en o por encima de la presión atmosférica, sin embargo, no se recomiendan presiones superiores a 1 atm. Las presiones pueden aumentar en estos experimentos como insoluble en agua H 2 se libera de gases reducidos (como el CH 4 y NH 3). El exceso de presionar puede conducir a la fuga por el sello, que puede permitir que la atmósfera de O 2 para entrar en el matraz de reacción, por lo que es posible para inducir la combustión, dando como resultado una explosión. En tercer lugar,hay que tener en cuenta que la modificación de este protocolo para llevar a cabo las variaciones del experimento requiere una planificación cuidadosa para garantizar condiciones de inseguridad no se crean. En cuarto lugar, es muy recomendable que el experimentador prospectivo leer a través de todo el protocolo cuidadosamente varias veces antes de intentar este experimento para asegurarse de que él o ella está familiarizado con los peligros potenciales y que todo el hardware necesario está disponible y en su lugar. Por último, la realización de experimentos que involucran gases combustibles requieren el cumplimiento de Salud y Seguridad Ambiental directrices departamentales de la institución anfitriona del experimentador. Tenga en cuenta estas recomendaciones antes de proceder con cualquier experimento. Todos los pasos que se detallan en el protocolo que aquí están en conformidad con las directrices del centro de acogida de Salud y Seguridad Ambiental de los autores.
Protocolo
1. Configuración de un sistema colector de vacío /
- Utilice un colector de vidrio para introducir los gases en el matraz de reacción. Este colector puede ser comprado o construido por una instalación de soplado de vidrio, pero debe incluir puertos estanca al vacío que se pueden conectar a un sistema de vacío, los cilindros de gas, un manómetro de vacío, y el recipiente de reacción.
- Utilice juntas de vidrio esmerilado y tapones de vidrio con válvulas en el colector. Asegúrese de que todas las juntas tóricas de los tapones son capaces de hacer los sellos necesarios. Si el uso de juntas de vidrio, una cantidad suficiente de grasa de vacío se puede aplicar para ayudar a hacer un sello, si es necesario. Grasa de vacío de silicona se puede utilizar para evitar la contaminación orgánica potencial.
- Utilice las llaves de paso de vidrio en el colector. Aplique la cantidad mínima de grasa de vacío necesario para hacer un sello.
- Mida el volumen del colector. Este volumen será utilizado para cálculos relacionados con presiones de gas finales en el matraz de reacción de 3 L y debe ser conocido con la mayor precisión posible.
- A menos que el colector tiene suficientes conexiones para dar cabida a todos los cilindros de gas al mismo tiempo, conectar un cilindro a la vez en el bloque. Incluir en esta conexión, un grifo que permite el colector a ser aislado de la atmósfera ambiente.
- Utilice adecuado, limpio e inerte, y química y de fugas de tubos resistentes y accesorios de vacío ultratorr para conectar los cilindros de gas en el bloque. Accesorios Ultratorr, cuando se usen, deben ser apretado con los dedos.
- Conecte al colector, una bomba de vacío capaz de establecer un vacío de <1 mm Hg. El escape de la bomba de vacío debe estar situado dentro de la campana de humos o ventilados adecuadamente por otros medios.
- Para garantizar la rápida consecución de vacío y para proteger la bomba, inserte una trampa entre el colector y la bomba de vacío. Se recomienda un nitrógeno para los dedos de líquido ya que evitará que las sustancias volátiles tales como NH 3, CO 2 y H 2 O en la bomba. Se debe tener cuidado, ya que los volátiles atrapados, al warmando, puede sobrepresión del colector y provocar la rotura del vidrio.
- Conecte al colector, un manómetro u otro indicador de vacío capaz de resolución 1 mmHg o superior. Mientras que varios dispositivos pueden ser utilizados, un manómetro de mercurio, o medidor de MacLeod, es preferible como el mercurio es bastante no reactivo.
- Mida y registre la temperatura ambiente usando un termómetro adecuado.
2. Preparación de matraz de reacción
- Calentar el material de vidrio a 500 ° C durante al menos 3 horas en el aire antes de su uso, para eliminar los contaminantes orgánicos.
- Limpiar los electrodos de tungsteno lavando suavemente con toallitas de laboratorio limpias y metanol, y el secado en el aire.
- Verter 200 ml de agua ultrapura (18,2 MΩ cm, <5 ppb TOC) en el matraz de reacción de 3 l.
- Introducir una barra de agitación magnética prefiltrado y esterilizado, lo que garantizará la rápida disolución de los gases solubles y mezcla de reactivos durante la exexperimento.
- Fije los electrodos de tungsteno a la 3 L matraz de reacción utilizando una cantidad mínima de grasa de vacío, con puntas separadas por aproximadamente 1 cm dentro del matraz. Fijar con clips.
- Inserte un adaptador con una llave de paso integrada en el cuello del matraz de reacción de 3 L y seguro con un clip.
- Una el matraz de reacción de 3 L al colector de gas a través del adaptador. Utilice un clip o una pinza para ayudar a asegurar el matraz.
- Engrase ligeramente todas las conexiones para asegurar un buen sellado al vacío.
- Abra todas las válvulas y llaves de paso del colector, a excepción de la válvula 6 y 1 llave de paso (Figura 4), y encienda la bomba de vacío para evacuar el colector. Una vez que una lectura de vacío estable de <1 mm Hg se ha alcanzado, cerca de la válvula 1 y permitir que el colector se siente durante ~ 15 min para comprobar si hay fugas de vacío. Si no se detecta, vaya al paso 2.8. De lo contrario, solucionar las diferentes conexiones hasta las fugas pueden ser identificados y corregidos.
- Lapply agitación magnética al recipiente de reacción. Abrir la válvula 1 y la llave de paso 1 (Figura 4) para evacuar el espacio superior del frasco de reacción de 3 l hasta que ha alcanzado la presión <1 mmHg.
- Cerrar la válvula 1 (Figura 4) y controlar la presión dentro del matraz de reacción de 3 l. La presión medida debe aumentar a la presión de vapor de agua. Para asegurarse de que no existen fugas, espere ~ 5 min en esta etapa. Si la presión (como se lee en el manómetro) aumenta, mientras que la válvula 1 se cierra durante este paso, compruebe si hay fugas en la llave de paso 1 y las diferentes conexiones del matraz de reacción. Si no se encuentra ninguna fuga, continúe con el siguiente paso.
3. La introducción de NH3 gaseoso
- Calcular la presión necesaria de NH3 gaseoso a introducir en el colector de tal manera que 200 mm Hg de NH 3 se introducen en el matraz de reacción. Los detalles sobre cómo hacer esto se proporcionan en la sección de debate.
- Cierre las válvulas1 y 6, y la llave de paso 1 (Figura 4) antes de introducir cualquier gas en el colector. Deje las otras válvulas y abierta la llave de paso.
- Introducir NH 3 en el colector hasta que se alcanza una pequeña presión (aproximadamente 10 mmHg) y luego evacuar el colector a una presión de <1 mm de Hg mediante la apertura de la válvula 1 (Figura 4). Repita 3 veces.
- Introducir NH 3 en el colector para alcanzar la presión determinada en el paso 3.1.
- Abrir la llave de paso 1 (Figura 4) para introducir 200 mmHg de NH 3 en el matraz de reacción de 3 l. El NH 3 se disolverá en el agua en el matraz de reacción y la presión caerá lentamente.
- Una vez que la presión deja de caer, cerca Llave de paso 1 (Figura 4) y registrar la presión leída por el manómetro. Este valor representa la presión dentro del matraz y se utilizará para calcular las presiones para otros gases que se introducirán en el colector más tarde.
- Abrir la válvula 1 (Figura 4) para evacuar el colector a una presión de <1 mm de Hg.
- Cierre la válvula 2 (Figura 4) y desconecte el cilindro de gas NH3 del colector.
4. Introducción de CH 4
- Calcular la presión necesaria de CH 4 a ser introducidos en el colector de tal manera que 200 mm Hg de CH 4 se introducen en el matraz de reacción de 3 l. Ejemplo de cálculos se muestran en la sección de Discusión.
- Conecte el cilindro de CH4 gas al colector.
- Abrir todas las válvulas y llaves de paso, a excepción de la válvula 6 y la llave de paso 1 (Figura 4), y evacuar el colector a una presión de <1 mm de Hg.
- Cerrar la válvula de 1 una vez que el colector ha sido evacuada (Figura 4).
- Introducir CH 4 en el colector hasta que se obtiene una pequeña presión (aproximadamente 10 mmHg). Esto purga la línea de ningún fr gases contaminantesOM pasos anteriores. Abra la válvula 1 (Figura 4) para evacuar el colector de <1 mm Hg. Repita 2x más.
- Introducir CH 4 en el colector hasta que, se alcanza la presión calculada en el paso 4.1.
- Abrir la llave de paso 1 (Figura 4) para introducir 200 mmHg de CH 4 en el matraz de reacción de 3 l.
- Cerrar la llave de paso 1 una vez que la presión prevista de CH 4 se ha introducido en el matraz de reacción de 3 L (Figura 4) y registrar la presión medida por el manómetro.
- Abra la válvula 1 (Figura 4) para evacuar el colector de <1 mm Hg.
- Cierre la válvula 2 (Figura 4) y desconecte el CH 4 cilindros del colector.
5. La introducción de otros gases (por ejemplo, N 2)
- En este punto, no es necesario introducir gases adicionales. Sin embargo, si se desea, se recomienda añadir 100 mm de Hg de N 2. En este caso, el cálculo de la presión necesaria de N 2 a ser introducidos en el colector de tal manera que 100 mm Hg de N 2 se introducen en el matraz de reacción de 3 l. Ejemplo de cálculos se muestran en la sección de Discusión.
- Conecte el cilindro de gas N2 al colector.
- Abrir todas las válvulas y llaves de paso, a excepción de la válvula 6 y la llave de paso 1 (Figura 4), y evacuar el colector a una presión de <1 mm de Hg.
- Cerrar la válvula de 1 una vez que el colector ha sido evacuada (Figura 4).
- Introducir N 2 en el colector hasta que se obtiene una pequeña presión (aproximadamente 10 mmHg). Abra la válvula 1 (Figura 4) para evacuar el colector de <1 mm Hg. Repita 2x más.
- Introducir N 2 en el colector hasta que se alcanza la presión calculada en el paso 5.1.
- Abrir la llave de paso 1 (Figura 4) para introducir 100 mmHg de N 2 en el matraz de reacción.
- Cerrar la llave de paso 1 una vez que la presión prevista de N 2 se ha introducido en el matraz de reacción, (Figura 4) y registrar la presión mediante el manómetro.
- Abra la válvula 1 (Figura 4) para evacuar el colector de <1 mm Hg.
- Cierre la válvula 2 (Figura 4) y desconecte el cilindro N 2 del colector.
6. A partir del experimento
- Separar el matraz de reacción desde el colector mediante el cierre de llave de paso 1 y de la válvula 1 (Figura 4) una vez que todos los gases se han introducido en el matraz de reacción, de manera que el aire ambiente puede entrar en el colector y llevar el colector hasta la presión ambiente.
- Después de desconectar con cuidado el matraz de reacción desde el colector, ajuste el frasco en algún lugar que no se verá afectado (por ejemplo, dentro de una campana de extracción vacío).
- Desconecte la bomba de vacío y retirar con cuidado la trampa fría y dejar ventilar el interior de una completacampana de humos en funcionamiento.
- Fije la bobina de Tesla conectado al generador de chispa de alta frecuencia.
- Conectar el electrodo de tungsteno opuesta a una tierra eléctrica para permitir el paso eficiente de la corriente eléctrica a través de la brecha entre los dos electrodos.
- Ajuste la tensión de salida del generador de chispas de aproximadamente 30.000 V, como se detalla en los documentos disponibles por el fabricante.
- Antes de iniciar la chispa, cerrar la hoja campana de humos, para servir como un escudo de seguridad entre el aparato y el experimentador. Gire la bobina de Tesla en para iniciar el experimento, y permitir la formación de chispas para continuar durante 2 semanas (o cualquier otro período deseado) en 1 hr ciclos de encendido / apagado.
7. Fin del Experimento
- Detenga el experimento desactivando la bobina de Tesla.
- Abrir la llave de paso 1 (Figura 4) para introducir aire ambiente lentamente en el matraz de reacción y facilitar la extracción del adaptador y los electrodos de tungsteno de manera samples se pueden recoger. Si se desea, el vacío se puede utilizar para evacuar el matraz de reacción de los gases de reacción nocivos.
8. Recolección de la muestra líquida
- Usando una pipeta de vidrio pirolizado, extraer muestras de líquido del matraz de reacción, teniendo cuidado de minimizar la exposición a los contaminantes, como las que podrían ser introducidos al tocar la pipeta a la grasa de vacío u otras superficies no estériles.
- Transferir la muestra a un plástico estéril o recipiente de vidrio. Recipientes de plástico son menos propensos a la formación de grietas o romper al congelarse, en comparación con los recipientes de vidrio.
- Contenedores de muestras Seal y almacenar en un congelador capaz de alcanzar temperaturas de -20 ° C o menos, como los productos insolubles pueden evitar que la solución de la muestra de la congelación a 0 ° C.
9. Limpieza de la instalación
- Utilice laboratorio limpio toallitas para quitar cuidadosamente la grasa de vacío desde el cuello del aparato, la adaptaciónER y llave de paso, y el cristal que rodea los electrodos de tungsteno.
- Limpiar a fondo las mismas superficies descritas en el paso 9.1 con tolueno para eliminar completamente la grasa de vacío orgánica de la cristalería. Si se utiliza grasa de silicona, la grasa de alto vacío puede permanecer en el material de vidrio después de la pirólisis, creando problemas en el futuro, como se detalla en la sección de Discusión.
- Limpiar a fondo el matraz de reacción con un cepillo y los disolventes siguientes en orden: agua ultrapura (18,2 MΩ cm, <5 ppb TOC), agua ultrapura (18,2 MΩ cm, <5 ppb TOC) con 5% de detergente de limpieza, metanol, tolueno, metanol, agua ultrapura (18.2 MΩ cm, <5 ppb TOC) con 5% de detergente de limpieza, y por último con agua ultrapura (18.2 MΩ cm, <5 ppb TOC).
- Cubra todos los orificios abiertos del matraz de reacción con papel de aluminio y envolver el adaptador y sus componentes en papel de aluminio.
- Una vez que todo el material de vidrio ha sido envuelto en papel de aluminio, pirolizar durante al menos 3 horas enaire a 500 ° C.
- Electrodos suavemente limpias con metanol y deje que se seque al aire.
10. Análisis de las muestras
Nota: En la preparación de muestras para el análisis, el uso de un protocolo de hidrólisis de ácido tal como se ha descrito en detalle en otra parte 15, es útil para la obtención de más aminoácidos. La hidrólisis de una porción de la muestra recuperada ofrece la oportunidad de analizar tanto los aminoácidos libres, así como sus precursores lábiles en medio ácido que se sintetizan bajo condiciones abióticas.
- Para el análisis de aminoácidos, utilizar una técnica adecuada (tal como cromatografía líquida y métodos basados en espectrometría de masas, u otros métodos apropiados). Tales técnicas de análisis incluyen cromatografía líquida de alto rendimiento con detección de fluorescencia (HPLC-FD) 14, y la cromatografía de líquidos de ultra alta con detección de fluorescencia en paralelo con la espectrometría de masas de ionización por electrospray positivo tiempo-de-vuelo (UHPLC-FD/ToF-MS) 12,13. Este manuscrito describe el análisis de espectrometría de masas usando análisis a través de un espectrómetro de masas de triple cuadrupolo (QqQ-MS) en conjunción con HPLC-FD.
Resultados
Los productos sintetizados en los experimentos de descarga eléctrica puede ser bastante complejo, y hay numerosos enfoques analíticos que se pueden utilizar para estudiar ellos. Algunas de las técnicas más comúnmente utilizadas en la literatura para el análisis de aminoácidos se discuten aquí. Los métodos de espectrometría de masas y cromatográficos son técnicas altamente informativos para analizar las mezclas químicas complejas producidas por tipo de Miller-Urey experimentos de descarga de chispa. Los aná...
Discusión
Numerosos pasos en el protocolo descrito aquí son fundamentales para la realización de experimentos de tipo Miller-Urey forma segura y correcta. En primer lugar, todas las herramientas de cristalería y de manipulación de muestras que entrarán en contacto con el matraz de reacción o de la muestra deben ser esterilizados. La esterilización se consigue de aclarar a fondo los artículos en cuestión con agua ultrapura (18,2 MΩ cm, <5 ppb TOC) y luego envolver en papel de aluminio, antes de la pirólisis de a 500 ...
Divulgaciones
Los autores declaran no tener intereses financieros en competencia.
Agradecimientos
Esta obra fue financiada en forma conjunta por el Programa de Astrobiología de la NASA NSF y, bajo el Centro NSF para la evolución química, CHE-1004570, y el Centro Goddard de Astrobiología. ETP desea agradecer la financiación adicional proporcionada por el Programa de Prácticas de Biología Planetaria de la NASA. Los autores también desean agradecer al Dr. Asiri Galhena de inestimable ayuda en el establecimiento de las instalaciones iniciales de laboratorio.
Materiales
| Name | Company | Catalog Number | Comments |
| Glass Plugs for Manifold | Chemglass | CG-983-01 | |
| High Vacuum Grease | Apiezon | N/A | Type M/N |
| Silicon High Vacuum Grease | Dow Corning | 1597418 | |
| Teflon PFA Tubing | McMaster-Carr | 51805K54 | |
| Ultra-Torr Vacuum Fittings | Swagelok | SS-4-UT-6 | |
| Dry Scroll Vacuum Pump | Edwards | A72401905 | |
| U-Tube Manometer | Alta-Robbins | 100SS | |
| Tungsten Electrodes | Diamond Ground Products | TH2-1/16 | 2% thoriated |
| Methanol | Alfa Aesar | N/A | Ultrapure HPLC Grade |
| Teflon-Coated Magnetic Stir Bar | McMaster-Carr | 5678K127 | |
| Gaseous NH3 | Airgas | AMAHLB | 99.99% purity |
| Gaseous CH4 | Airgas | ME UHP300 | 99.99% purity |
| Gaseous N2 | Airgas | NI UHP300 | 99.999% purity |
| Tesla Coil | Electro-Technic Products | 15001 | Model BD-50E |
| 24 hr Plug-in Basic Timer | General Electric Company | 15119 | |
| Cleaning Detergent | Alconox | 1104 | |
| Toluene | Thermo Fisher Scientific | N/A | Optima Grade |
| Luna Phenyl-Hexyl HPLC Column | Phenomenex | 00G-4257-E0 | Brand: Luna |
| Formic Acid | Sigma-Alrich | F0507 | Used to make 50 mM ammonium formate |
Referencias
- Oparin, A. I. . The Origin of Life. , (1924).
- Haldane, J. B. The origin of life. Rationalist Annu. 148, 3-10 (1929).
- Garrison, W. M., Morrison, D. C., Hamilton, J. G., Benson, A. A., Calvin, M. Reduction of Carbon Dioxide in Aqueous Solutions by Ionizing Radiation. Science. 114, 416-418 (1951).
- Miller, S. L. Production of Some Organic Compounds under Possible Primitive Earth Conditions. J. Am. Chem. Soc. 77, 2351-2361 (1955).
- Miller, S. L. A Production of Amino Acids Under Possible Primitive Earth Conditions. Science. 117, 528-529 (1953).
- Heyns, H. K., Walter, W., Meyer, E. Model experiments on the formation of organic compounds in the atmosphere of simple gases by electrical discharges (Translated from German). Die Naturwissenschaften. 44, 385-389 (1957).
- Ponnamperuma, C., Woeller, F. α-Aminonitriles formed by an electric discharge through a mixture of anhydrous methane and ammonia. Biosystems. 1, 156-158 (1967).
- Oró, J. Synthesis of Organic Compounds by Electric Discharges. Nature. 197, 862-867 (1963).
- Ring, D., Wolman, Y., Friedmann, N., Miller, S. L. Prebiotic Synthesis of Hydrophobic and Protein Amino Acids. Proc. Natl. Acad. Sci. U.S.A. 69, 765-768 (1972).
- Wolman, Y., Haverland, W. J., Miller, S. L. Nonprotein Amino Acids from Spark Discharges and Their Comparison with the Murchison Meteorite Amino Acids. Proc. Natl. Acad. Sci. U.S.A. 69, 809-811 (1972).
- Roscoe, S., Miller, S. L. Energy Yields for Hydrogen Cyanide and Formaldehyde Syntheses: The HCN and Amino Acid Concentrations in the Primitive Ocean. Orig. Life. 17, 261-273 (1987).
- Johnson, A. P., et al. The Miller Volcanic Spark Discharge Experiment. Science. 322, 404 (2008).
- Parker, E. T., et al. Primordial synthesis of amines and amino acids in a 1958 Miller H2S-rich spark discharge experiment. Proc. Natl. Acad. Sci. U.S.A. 108, 5526-5531 (2011).
- Cleaves, H. J., Chalmers, J. H., Lazcano, A., Miller, S. L., Bada, J. L. A reassessment of prebiotic organic synthesis in neutral planetary atmospheres. Orig. Life Evol. Biosph. 38, 105-115 (2008).
- Glavin, D. P., et al. Amino acid analyses of Antarctic CM2 meteorites using liquid chromatography-time of flight-mass spectrometry. Meteorit. Planet. Sci. 41, 889-902 (2006).
- Zhao, M., Bada, J. L. Determination of α-dialkylamino acids and their enantiomers in geologic samples by high-performance liquid chromatography after a derivatization with a chiral adduct of o-phthaldialdehyde. J. Chromatogr. A. 690, 55-63 (1995).
- Strecker, A. About the artificial formation of lactic acid and a new Glycocoll the homologous body Justus Liebigs Annalen der Chemie. 75, 27-45 (1850).
- Miyakawa, S., Yamanashi, H., Kobayashi, K., Cleaves, H. J., Miller, S. L. Prebiotic synthesis from CO atmospheres: implications for the origins of life. Proc. Natl. Acad. Sci. U.S.A. 99, 14628-14631 (2002).
- Kobayashi, K., Kaneko, T., Saito, T., Oshima, T. Amino Acid Formation in Gas Mixtures by Particle Irradiation. Orig. Life Evol. Biosph. 28, 155-165 (1998).
- Sagan, C., Khare, B. N. Long-Wavelength Ultraviolet Photoproduction of Amino Acids on the Primitive Earth. Science. 173, 417-420 (1971).
- Harada, K., Fox, S. W. Thermal Synthesis of Natural Amino-Acids from a Postulated Primitive Terrestrial Atmosphere. Nature. 201, 335-336 (1964).
- Ponnamperuma, C., Lemmon, R. M., Mariner, R., Calvin, M. Formation of Adenine by Electron Irradiation of Methane Ammonia, and Water. Proc. Natl. Acad. Sci. USA. 49, 737-740 (1963).
- Bar-Nun, A., Bar-Nun, N., Bauer, S. H., Sagan, C. Shock Synthesis of Amino Acids in Simulated Primitive Environments. Science. 168, 470-473 (1970).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados