Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Miller-Urey Durchführung von Experimenten
In diesem Artikel
Zusammenfassung
Die Miller-Urey-Experiment war eine bahnbrechende Studie über die abiotischen Synthese von organischen Verbindungen mit möglicher Relevanz für die Entstehung des Lebens. Einfache Gase wurden in einer Glasapparatur eingeführt und mit einer elektrischen Entladung ausgesetzt ist, simulieren die Wirkung von Blitz im Atmosphäre-Ozean-System des Ur-Erde. Das Experiment wurde für eine Woche durchgeführt, wonach die entnommene Proben wurden für die chemischen Bausteine des Lebens analysiert.
Zusammenfassung
Im Jahr 1953, berichtete Stanley Miller die Produktion von Biomolekülen aus einfachen gasförmigen Ausgangsstoffe, mit einer Vorrichtung gebaut, um Atmosphäre-Ozean-System des Ur-Erde zu simulieren. Miller wurden 200 ml Wasser, 100 mmHg von H 2, 200 mmHg von CH 4 und 200 mmHg von NH 3 in die Vorrichtung, dann einer dieser Mischung unter Rückfluss, um eine elektrische Entladung für eine Woche, während das Wasser gleichzeitig erhitzt. Der Zweck dieses Manuskript ist, um dem Leser ein allgemeines experimentelles Protokoll, das verwendet werden kann, um eine Funkenentladung Experiment Miller-Urey Typ durchzuführen, unter Verwendung einer vereinfachten 3 l-Reaktionskolben werden. Da das Experiment beinhaltet die Exposition brennbare Gase zu einer Hochspannungsentladung, ist es erwähnenswert wichtige Schritte, die das Risiko von Explosionen zu reduzieren. Die in dieser Arbeit beschriebenen allgemeinen Verfahren kann hochgerechnet zu entwerfen und führen eine Vielzahl von elektrischen Entladungsexperiment werdens simuliert primitive Planetenumgebungen.
Einleitung
Die Art der Entstehung des Lebens auf der Erde bleibt eines der unergründlichen wissenschaftlichen Fragen. In den 1920er Jahren russische Biologe Alexander Oparin und britische Evolutionsbiologe und Genetiker John Haldane vorgeschlagen, das Konzept einer "Ursuppe" 1,2, beschreibt die primitiven irdischen Ozeane, die organische Verbindungen, die chemische Evolution erleichtert haben kann. Allerdings war es nicht bis in die 1950er Jahre, als Chemiker begann bewusste Laborstudien zu verstehen, wie organische Moleküle aus einfachen Ausgangsmaterialien wurden auf der frühen Erde synthetisiert Ziel zu führen. Einer der ersten Berichte zu diesem Zweck war die Synthese von Ameisensäure aus der Bestrahlung der wässrigen Lösungen CO 2 1951 3.
Im Jahr 1952, Stanley Miller, dann ein Student an der Universität von Chicago, näherte Harold Urey über ein Experiment, um die Möglichkeit zu bewerten, dass organische Verbindungenwichtig für die Entstehung des Lebens wurde möglicherweise abiologically auf der frühen Erde gebildet haben. Das Experiment wurde mit einem speziell angefertigten Glasapparatur (Abbildung 1A) entwickelt, um die primitive Erde zu simulieren, durchgeführt. Miller Experiment nachgeahmt Blitz durch Einwirkung einer elektrischen Entladung auf einer Mischung von Gasen in die Atmosphäre der darstellt, in Gegenwart eines flüssigen Wasserbehälter, die die frühen Ozeane. Die Vorrichtung simuliert die Verdampfung und Fällung durch die Verwendung von einem Heizmantel und einem Kühler verbunden. Konkrete Angaben über das Gerät Miller verwendet werden können, an anderer Stelle 4 gefunden werden. Nach einer Woche der Funkenbildung wurde der Inhalt im Kolben sichtbar transformiert. Das Wasser drehte sich eine trübe, rötliche Farbe 5 und auf den Elektroden angesammelt 4 gelb-braun Material. Diese bahnbrechende Arbeit gilt als die erste bewusste, effiziente Synthese von Biomolekülen unter simulierten primitiven Erde Bedingungen.
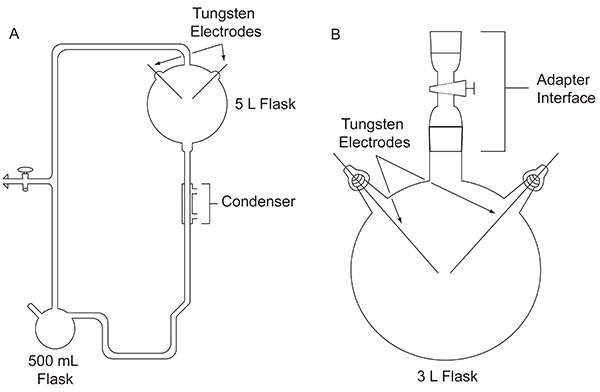
Fig. 1 ist. Vergleich zwischen den beiden Arten von Geräten in diesem Papier diskutiert. Die klassische Gerät für den ursprünglichen Miller-Urey-Experiment (A) und der vereinfachte Vorrichtung in dem Protokoll hier (B) beschrieben verwendet. Klicken Sie hier für eine größere Ansicht .
Nach der Veröffentlichung der Ergebnisse 1953 von der klassischen Experiment Miller, zahlreiche Variationen der Funkenentladung Experiment, zum Beispiel mit anderen Gasgemischen, wurden durchgeführt, um die Plausibilität der Herstellung von organischen Verbindungen, die für das Leben unter einer Vielzahl von möglichen frühen Erde Bedingungen zu erforschen. Zum Beispiel kann ein CH 4 / H 2 O / NH 3 / H 2 S-Gas-Gemisch wurde auf seine Fähigkeit, um die codierten schwefelhaltigen α-Aminosäuren zu produzieren getestet, obwohl diese nicht erkannt 6. Gaschromatographie-Massenspektrometrie (GC-MS)-Analyse einer CH 4 / NH 3-Mischung auf einer elektrischen Entladung unterworfen zeigte die Synthese von α-Aminonitrile, die Aminosäurevorstufen 7 sind. 1972, mit einer einfacheren Vorrichtung, die zuerst von Oró 8 (Fig. 1B) eingebracht, Miller und Kollegen zeigten die Synthese aller kodierten α-Aminosäuren 9 und Nichtprotein-Aminosäuren, die in der 10 Murchison Meteoriten bisher identifiziert wurden, indem CH 4, N 2, und kleine Mengen an NH 3, um eine elektrische Entladung. Später, mit dem gleichen Versuchsaufbau vereinfacht, Gasgemische H 2 O, N 2 und CH 4, CO 2 oder CO wurden stu löstedy die Ausbeute an Blausäure, Formaldehyd und Aminosäuren in Abhängigkeit von der Oxidationsstufe des atmosphärischen Kohlenstoffspezies 11.
Neben der Erforschung alternativer experimentelle Designs im Laufe der Jahre wurden erhebliche analytische Fortschritte seit klassisches Experiment Miller, die vor kurzem geholfen mehr Sondierungs Untersuchungen der elektrischen Entladung experimentellen Proben von Miller archiviert aufgetreten ist, als es durch die Techniken erleichtert worden Miller Zugang hatte in den 1950er Jahren. Müllervulkan Experiment 12, erstmals 1955 4 angegeben, und 1958-H 2 S-haltigen Experiment 13 wurde gezeigt, dass eine größere Vielfalt und größere Häufigkeit von zahlreichen Aminosäuren und Amine als das klassische Experiment gebildet haben, einschließlich von denen viele, dass hatte zuvor nicht in Funkenentladung Experimenten identifiziert.
Die in diesem Papier beschriebene Experiment kann durchgeführt werden unter Verwendung voneine Vielzahl von Gasgemischen. Typischerweise wird zumindest solche Experimente eine C Trägergas, über ein N-tragende Gas und Wasser enthalten. Mit etwas Planung können nahezu beliebige Mischung von Gasen untersucht werden, jedoch ist es wichtig, einige chemischen Aspekte des Systems zu betrachten. Beispielsweise kann der pH-Wert der wässrigen Phase einen erheblichen Einfluss auf die Chemie, die dort 14 auftritt.
Die hier beschriebene Methode wurde speziell auf die Forscher, wie man Funkenentladung Experimente, die die Miller-Urey-Experiment ähneln einem vereinfachten 3 L-Reaktionsgefäß, wie in Miller 1972 Publikationen 9,10 beschrieben durchführen zu unterrichten. Da dieses Experiment beinhaltet einen Hochspannungslichtbogen über brennbare Gase wirken, ist es wichtig, O 2 aus dem Reaktionskolben zu entfernen, um die Explosionsgefahr, die bei der Verbrennung von Kohlenstoff reduziert haltigen Gasen wie Methan oder Kohlenmonoxid auftreten können, zu beseitigen, oder Reaktions of H 2 mit Sauerstoff.
Es gibt noch weitere Details, die in die Vorbereitung, um das Experiment durchzuführen hier diskutiert gehalten werden sollte. Erstens, wenn die Arbeit mit Glas Vakuumleitungen und Druckgase besteht die inhärente Gefahr der Implosion und sowohl über-Druck. Daher muss eine Schutzbrille getragen werden. Zweitens wird das Experiment in der Regel bei weniger als der Atmosphärendruck durchgeführt. Dies minimiert die Gefahr der Über Druck auf den Verteiler und Reaktionskolben. Glaswaren bei oder über Atmosphärendruck abgegeben werden, jedoch sind Drücke oberhalb von 1 atm nicht empfohlen. Drücke können in diesen Experimenten erhöhen als wasserunlösliche H 2 freigesetzt wird aus reduzierten Gase (wie CH 4 und NH 3). Over-Druck kann zu Leckage, die es erlauben kann atmosphärischen O 2 den Reaktionskolben zu geben, so dass es möglich ist, um die Verbrennung zu induzieren, was zu einer Explosion führen. Drittenses sollte bedacht werden, dass die Änderung dieses Protokoll, um Variationen des Experiment durchzuführen erfordert eine sorgfältige Planung, um sicherzustellen unsicheren Bedingungen nicht erstellt werden. Viertens ist es sehr empfehlenswert, dass der potenzielle Experimentator lesen Sie die gesamte Protokoll sorgfältig mehrmals vor dem Versuch, dieses Experiment zu sein, dass er oder sie ist mit möglichen Gefahren vertraut und dass alle notwendige Hardware zur Verfügung steht und an Ort und Stelle. Schließlich, die Durchführung von Versuchen mit brennbaren Gasen erfordern die Einhaltung der Umwelt-und Gesundheitsabteilungsrichtlinien des Experimentators Gastinstitution. Bitte beachten Sie diese Empfehlungen, bevor Sie mit Experimenten fortfahren. Alle Schritte in dem Protokoll hier beschrieben sind in Übereinstimmung mit der Autoren-Host institutionelle Umwelt, Gesundheit und Sicherheit Richtlinien.
Protokoll
1. Einrichten eines Manifold / Vakuumsystem
- Verwenden Sie ein Glas Verteiler zu Gase in den Reaktionskolben einzuführen. Dieser Verteiler kann durch eine Glasbläsereinrichtung erworben werden oder ausgebildet, sondern müssen vakuumdichte Anschlüsse, die mit einem Vakuumsystem, Gaszylinder, ein Vakuummeter, und das Reaktionsgefäß angeschlossen werden kann, umfassen.
- Verwenden Schliffe und Glasstöpsel mit Ventilen am Verteiler. Stellen Sie sicher, dass alle O-Ringe an den Steckern sind in der Lage, die notwendigen Dichtungen. Bei Verwendung von Glasverbindungen kann eine ausreichende Menge von Vakuumfett aufgebracht werden, um eine Dichtung zu bilden, falls erforderlich. Silizium Vakuumfett kann verwendet werden, um potentielle organische Verunreinigung zu vermeiden.
- Verwenden Sie Glas Hähne auf dem Verteiler. Wenden Sie den Mindestbetrag von Vakuumfett notwendig, um eine Dichtung zu machen.
- Messen Sie die vielfältigen Lautstärke. Dieses Volumen wird für Berechnungen zur endgültigen Gasdrücke in der 3-L-Reaktionskolben Zusammenhang verwendet werden und sollte so genau wie möglich bekannt sein.
- Es sei denn, der Verteiler hat genug Anschlüsse, um alle Gasflaschen gleichzeitig aufnehmen, schließen einen Zylinder zu einem Zeitpunkt an dem Verteiler. Umfassen in diesem Zusammenhang einen Wasserhahn so dass der Verteiler von der Umgebungsatmosphäre isoliert werden.
- Verwenden Sie geeignete, sauber, inert, sowie chemische und auslaufsicher Schläuche und Armaturen ultratorr Vakuum, um die Gasflaschen an den Verteiler angeschlossen werden. Ultratorr Armaturen, wo verwendet werden, sind um den Finger fest angezogen werden.
- Verbinden Sie mit dem Verteiler, eine Vakuumpumpe, die ein Vakuum von <1 mmHg. Die Vakuumpumpe sollte im Abgasabzugshaube befinden oder durch andere Mittel richtig entlüftet.
- Um ein schnelles Erreichen des Vakuums zu sichern und um die Pumpe zu schützen, eine Falle zwischen dem Verteiler und der Vakuumpumpe einzuführen. Ein Flüssigstickstofffingerfalle empfehlenswert, da es flüchtigen Stoffen, wie NH 3, CO 2 und H 2 O in die Pumpe zu verhindern. Es sollte darauf geachtet werden, wie gefangen flüchtigen, auf warming, kann das vielfältige Überdruck und führen zu Glasbruch.
- Verbinden Sie mit dem Verteiler, einem Manometer oder andere Vakuum-Messgerät in der Lage, 1 mmHg Auflösung oder besser. Während verschiedene Vorrichtungen verwendet werden, ist ein Quecksilbermanometer oder MacLeod Gauge, vorzugsweise als Quecksilber ist relativ nicht-reaktiv.
- Messen und speichern Sie die Umgebungstemperatur mit Hilfe eines geeigneten Thermometers.
2. Herstellung von Reaktionskolben
- Erhitzen Sie alle Glaswaren bei 500 ° C für mindestens 3 Stunden in der Luft vor der Verwendung, um organische Verunreinigungen zu entfernen.
- Reinigen Sie die Wolfram-Elektroden durch vorsichtiges Waschen mit sauberem Laborwischtücher und Methanol und Trocknen an der Luft.
- Gießen Sie 200 ml Reinstwasser (18,2 MOhm cm, <5 ppb TOC) in den drei L-Reaktionskolben.
- Einführung eines vorgereinigt und sterilisiert Magnetrührstab, die eine schnelle Auflösung der löslichen Gase und Mischen der Reaktanten bei der Ex gewährleistenExperiment.
- Bringen Sie die Wolframelektroden in den 3 l-Reaktionskolben unter Verwendung einer minimalen Menge von Vakuumfett, mit Spitzen von ca. 1 cm innerhalb des Kolbens getrennt. Befestigung mit Clips.
- Einfügen eines Adapters mit einem integrierten Hahn in den Hals des 3 l-Reaktionskolben und mit einem Clip.
- Die 3-L-Reaktionskolben Befestigen an den Gasverteiler über den Adapter. Verwenden Sie einen Clip oder eine Klemme zu helfen, die Flasche zu sichern.
- Fetten Sie alle Anschlüsse, um eine gute Vakuumdichtung zu gewährleisten.
- Öffnen Sie alle Ventile und Hähne auf dem Verteiler, mit Ausnahme Ventil 6 und Absperrhahn 1 (Abbildung 4), und schalten Sie die Vakuumpumpe, um den Verteiler zu evakuieren. Sobald ein stabiles Vakuum Lesen von <1 mmHg erreicht wurde, in der Nähe Ventil 1 und lassen Sie die vielfältigen, für ~ 15 min sitzen, um für Vakuumlecks überprüfen. Wenn keine gefunden werden, gehen Sie zu Schritt 2.8. Andernfalls beheben die verschiedenen Verbindungen, bis die Lecks erkannt und behoben werden.
- Apply magnetischem Rühren in das Reaktionsgefäß. Offene Ventil 1 und Absperrhahn 1 (Fig. 4), um den Kopfraum der 3 l Reaktionskolben evakuiert, bis der Druck 1 mmHg erreicht hat <.
- Zu-Ventil 1 (Fig. 4) und den Druck innerhalb der 3 L Reaktionskolben überwachen. Der gemessene Druck sollte der Dampfdruck des Wassers zu erhöhen. Um sicherzustellen, dass keine Lecks vorhanden sind, warten Sie ca. 5 Min. in diesem Stadium. Wenn der Druck (wie auf dem Manometer abgelesen) erhöht, während Ventil 1 wird in diesem Schritt geschlossen, auf Dichtheit prüfen in Hahn 1 und der verschiedenen Reaktionskolben-Verbindungen. Wenn kein Leck festgestellt wird, zu dem nächsten Schritt fort.
3. Einleitung von gasförmigem NH 3
- Berechnen der erforderlichen Druck des gasförmigen NH 3 in dem Verteiler, so dass 200 mmHg von NH 3 werden in den Reaktionskolben eingeführt einzuführen. Details darüber, wie dies zu tun sind in der Diskussion Abschnitt.
- Schließen Ventile1 und 6, und Absperrhahn 1 (Fig. 4) vor dem Einführen kein Gas in den Verteiler. Lassen Sie die anderen Ventile und Absperrhahn geöffnet.
- Einführung von NH 3 in dem Verteiler, bis ein geringer Druck (etwa 10 mmHg) erreicht ist, und dann den Verteiler zu evakuieren, um einen Druck von <1 mmHg durch Öffnen des Ventils 1 (Fig. 4). 3x wiederholen.
- Einführung von NH 3 in dem Verteiler, um den Druck im Schritt 3.1 bestimmt, zu erreichen.
- Absperrhahn geöffnet 1 (Fig. 4) bis 200 mmHg von NH 3 in den 3 l-Reaktionskolben eingeführt. Die NH 3 wird im Wasser in den Reaktionskolben lösen und der Druck wird langsam sinken.
- Sobald der Druck stoppt fallen, in der Nähe Absperrhahn 1 (Abbildung 4) und notieren Sie den Druck, der durch das Manometer lesen. Dieser Wert stellt den Druck im Inneren des Kolbens und wird verwendet, um die Drücke für andere Gase, die später in den Verteiler eingeführt wird, zu berechnen.
- Ventil 1 öffnen (Fig. 4), um den Verteiler zu einem Druck von <1 mmHg evakuiert.
- Schließen Sie Ventil 2 (Abbildung 4) und ziehen Sie das NH 3 Gasflasche aus dem Verteiler.
4. Einführung von CH 4
- Berechnen der erforderlichen Druck von CH 4 in den Verteiler, so dass 200 mmHg von CH 4 wird in den 3 l-Reaktionskolben eingeführt werden, eingeführt werden. Beispielrechnungen sind in der Diskussion Schnitt gezeigt.
- Verbinden CH &sub4;-Gas Zylinder an dem Verteiler.
- Öffnen Sie alle Ventile und Hähne, außer Ventil 6 und Absperrhahn 1 (Abbildung 4), und räumen den Verteiler mit einem Druck von <1 mmHg.
- Zu-Ventil 1, wenn der Verteiler evakuiert worden ist (Abbildung 4).
- Einführung CH 4 in den Verteiler bis ein kleiner Druck (etwa 10 mmHg) erhalten. Dies löscht die Zeile aller Schadgase from vorhergehenden Schritte. Öffnen Sie Ventil 1 (Abbildung 4), um den Verteiler auf <1 mmHg zu evakuieren. Repeat 2x mehr.
- Einführung CH 4 in den Verteiler bis der Druck in Schritt 4.1 berechnet, erreicht wird.
- Absperrhahn geöffnet 1 (Fig. 4) bis 200 mmHg von CH 4 in den 3 l-Reaktionskolben eingeführt.
- Schließen Hahn 1, wenn die vorgesehenen Druck von CH 4 in die 3 L Reaktionskolben (Abbildung 4) eingeführt, und notieren Sie den Druck, der durch das Manometer gemessen.
- Öffnen Sie Ventil 1 (Abbildung 4), um den Verteiler auf <1 mmHg zu evakuieren.
- Schließen Sie Ventil 2 (Abbildung 4) und ziehen Sie den CH 4-Zylinder aus dem Verteiler.
5. Einführung weiterer Gase (zB N 2)
- An diesem Punkt ist es nicht erforderlich, zusätzliche Gase einzuführen. Jedoch, wenn gewünscht, ist es empfehlenswert, auf 100 mmHg N 2 hinzugefügt. In diesem Fall berechnet die notwendige Druck von N 2 in die Sammelleitung 100 mmHg, so dass der N 2 in die 3 l-Reaktionskolben eingeführt werden, eingeführt werden. Beispielrechnungen sind in der Diskussion Schnitt gezeigt.
- Verbinden der N 2-Gasflasche mit dem Verteiler.
- Öffnen Sie alle Ventile und Hähne, außer Ventil 6 und Absperrhahn 1 (Abbildung 4), und räumen den Verteiler mit einem Druck von <1 mmHg.
- Zu-Ventil 1, wenn der Verteiler evakuiert worden ist (Abbildung 4).
- Einführen N 2 in den Verteiler bis ein kleiner Druck (etwa 10 mmHg) erhalten. Öffnen Sie Ventil 1 (Abbildung 4), um den Verteiler auf <1 mmHg zu evakuieren. Repeat 2x mehr.
- Einführen N 2 in die Sammelleitung, bis der Druck in Schritt 5.1 berechnet erreicht ist.
- Absperrhahn geöffnet 1 (Fig. 4) bis 100 mmHg von N 2 in den Reaktionskolben eingeführt.
- Schließen Hahn 1, wenn die vorgesehenen Druck von N 2 wurde in den Reaktionskolben, (Abbildung 4) eingeführt, und notieren Sie den Druck mit dem Manometer.
- Öffnen Sie Ventil 1 (Abbildung 4), um den Verteiler auf <1 mmHg zu evakuieren.
- Schließen Sie Ventil 2 (Abbildung 4) und ziehen Sie das N 2-Zylinder aus dem Verteiler.
6. Versuchsbeginn
- Nehmen Sie den Reaktionskolben aus dem Verteiler durch Schließen Hahn 1 und Ventil 1 (Abbildung 4), sobald alle Gase in den Reaktionskolben eingeführt, so dass Umgebungsluft den Verteiler ein und bringen den Verteiler bis auf Umgebungsdruck.
- Nach sorgfältiger Trennen der Reaktionskolben aus dem Verteiler, stellen Sie die Flasche irgendwo wird es nicht gestört werden (z. B. in einem leeren Abzug).
- Trennen Sie die Vakuumpumpe und entfernen Sie vorsichtig die Kühlfalle und lassen Entlüftung in einem vollBetriebs Abzug.
- Sichern Sie die Tesla-Spule, um die Hochfrequenz-Funkengenerator verbunden.
- Verbinden der gegenüberliegenden Wolfram-Elektrode mit einer elektrischen Masse, um die effiziente Stromdurchgang durch den Spalt zwischen den beiden Elektroden zu ermöglichen.
- Stellen Sie die Ausgangsspannung der Funkengenerator auf etwa 30.000 V, wie Dokumente vom Hersteller beschrieben.
- Vor Beginn der Funke, schließen Sie den Abzug Schärpe, als Schutzschild zwischen dem Gerät und dem Experimentator zu dienen. Drehen Sie die Tesla-Spule auf, um das Experiment zu starten, und lassen Funkenbildung für 2 Wochen (oder anderen gewünschten Zeitraum) in 1 h Ein / Aus-Zyklen fortzusetzen.
7. Ende des Experiments
- Beenden Sie den Test durch Abschalten der Tesla-Spule.
- Absperrhahn geöffnet 1 (Fig. 4) langsam einführen Umgebungsluft in den Reaktionskolben und erleichtern das Entfernen des Adapters und die Wolframelektroden so samples gesammelt werden können. Falls gewünscht, kann ein Vakuum verwendet, um das Reaktionskolben schädliche Reaktionsgase zu evakuieren.
8. Sammeln flüssige Probe
- Mit einem pyrolisierten Glaspipette, entfernen flüssigen Proben aus dem Reaktionskolben, wobei darauf geachtet, die Exposition gegenüber Verunreinigungen, wie diejenigen, die durch Berühren der Pipette auf die Vakuumfett oder andere nicht sterile Oberflächen eingebracht werden können, zu minimieren.
- Die Probe in einem sterilen Plastik-oder Glasbehälter. Kunststoffbehältnisse sind weniger anfällig für Rissbildung oder Brechen beim Einfrieren im Vergleich zur Glasgefäße.
- Seal Probenbehältern und an einem Gefrierschrank der Lage zu erreichen Temperaturen von -20 ° C oder niedriger, als unlösliche Produkte können die Probenlösung gefriert bei 0 ° C zu verhindern
9. Reinigung der Geräte
- Verwenden Sie saubere Labor wischt sorgfältig entfernen Vakuumfett aus dem Hals des Geräts, die AnpassungER und Hahn, und das Glas umgebenden Wolframelektroden.
- Die gleichen in Schritt 9.1 mit Toluol beschriebenen Oberflächen gründlich zu reinigen, um vollständig zu entfernen organische Vakuumfett aus der Glaswaren. Bei der Verwendung von Silikonfett kann die Hochvakuumfett auf der Glaswaren nach der Pyrolyse bleiben, die Schaffung künftiger Probleme, wie in der Diskussion Abschnitt beschrieben.
- Gründlich Reaktionskolben mit einem Pinsel und der folgenden Lösungsmittel zu säubern: Reinstwasser (18,2 MOhm cm, <5 ppb TOC), Reinstwasser (18,2 MOhm cm, <5 ppb TOC) mit 5% Reinigungsmittel, Methanol, Toluol, Methanol, Reinstwasser (18,2 MOhm cm, <5 ppb TOC) mit 5% Reinigungsmittel und schließlich Reinstwasser (18,2 MOhm cm, <5 ppb TOC).
- Decken Sie alle offenen Öffnungen der Reaktionskolben mit Aluminiumfolie und wickeln Sie den Adapter und seiner Komponenten in Aluminiumfolie.
- Sobald alle Glaswaren in Aluminiumfolie eingewickelt wurde, zu pyrolysieren für mindestens 3 Stunden inLuft bei 500 ° C.
- Vorsichtig sauber Elektroden mit Methanol und Luft trocknen lassen.
10. Probenanalyse
Anmerkung: Bei der Herstellung von Proben für die Analyse ist die Verwendung einer sauren Hydrolyse Protokoll wie an anderer Stelle 15 beschrieben worden ist, ist nützlich für den Erhalt mehrerer Aminosäuren. Hydrolyse eines Teils des wiedergewonnenen Probe die Möglichkeit bietet, sowohl freie Aminosäuren sowie deren Säure-labilen Vorläufer, die unter abiotischen Bedingungen synthetisiert werden, zu analysieren.
- Für Aminosäureanalyse, verwenden Sie eine geeignete Technik (wie Flüssig-Chromatographie und Massenspektrometrie-basierte Methoden oder andere geeignete Ansätze). Solche Analysetechniken gehören Hochleistungs-Flüssigkeits-Chromatographie mit Fluoreszenzdetektion (HPLC-FD) 14 und Ultrahochleistungsflüssigkeits-Chromatographie mit Fluoreszenzdetektion parallel mit Time-of-Flight-positiven Elektrospray-Ionisations-Massenspektrometrie (UHPLC-FD/ToF-MS) 12,13. Dieses Manuskript beschreibt Analyse mit massenspektrometrischer Analysen über ein Triple-Quadrupol-Massenspektrometer (QqQ-MS) in Verbindung mit HPLC-FD.
Ergebnisse
Die elektrische Entladung in Experimenten synthetisierten Produkte können ziemlich komplex sein, und es gibt zahlreiche analytische Ansätze, die verwendet werden können, um sie zu untersuchen. Einige der am häufigsten verwendeten Techniken, die in der Literatur für die Analyse von Aminosäuren werden hier diskutiert. Chromatographischen und massenspektrometrischen Methoden sind sehr informativ Techniken für die Analyse der von Miller-Urey Funkenentladung Experimente produziert komplexe chemische Gemische. Aminosä...
Diskussion
Zahlreiche Schritte in der hier beschriebenen Protokoll sind entscheidend für die Durchführung von Miller-Urey-Typ Experimente sicher und korrekt. Zuerst werden alle Glasgeräte und Probenbearbeitungswerkzeuge, die in Kontakt mit dem Reaktionsgefäß oder der Probe kommen müssen sterilisiert werden. Die Sterilisation wird durch gründliches Spülen der Gegenstände in Frage, mit Reinstwasser (18.2 MOhm cm, <5 ppb TOC) und dann wickelte sie in Aluminium-Folie, vor der Pyrolyse bei 500 ° C in Luft für mindestens 3...
Offenlegungen
Die Autoren erklären, keine finanziellen Interessen konkurrieren.
Danksagungen
Diese Arbeit wurde von der NSF und der NASA Astrobiology im Rahmen des NSF-Zentrum für Chemisch Evolution, CHE-1004570, und dem Zentrum für Astrobiologie Goddard unterstützt. ETP möchten, um zusätzliche Mittel von der NASA Planetary Biology Internship Program vorgesehen anzuerkennen. Die Autoren wollen auch Dr. Asiri Galhena für unschätzbare Hilfe bei der Einrichtung der ersten Laboreinrichtungen danken.
Materialien
| Name | Company | Catalog Number | Comments |
| Glass Plugs for Manifold | Chemglass | CG-983-01 | |
| High Vacuum Grease | Apiezon | N/A | Type M/N |
| Silicon High Vacuum Grease | Dow Corning | 1597418 | |
| Teflon PFA Tubing | McMaster-Carr | 51805K54 | |
| Ultra-Torr Vacuum Fittings | Swagelok | SS-4-UT-6 | |
| Dry Scroll Vacuum Pump | Edwards | A72401905 | |
| U-Tube Manometer | Alta-Robbins | 100SS | |
| Tungsten Electrodes | Diamond Ground Products | TH2-1/16 | 2% thoriated |
| Methanol | Alfa Aesar | N/A | Ultrapure HPLC Grade |
| Teflon-Coated Magnetic Stir Bar | McMaster-Carr | 5678K127 | |
| Gaseous NH3 | Airgas | AMAHLB | 99.99% purity |
| Gaseous CH4 | Airgas | ME UHP300 | 99.99% purity |
| Gaseous N2 | Airgas | NI UHP300 | 99.999% purity |
| Tesla Coil | Electro-Technic Products | 15001 | Model BD-50E |
| 24 hr Plug-in Basic Timer | General Electric Company | 15119 | |
| Cleaning Detergent | Alconox | 1104 | |
| Toluene | Thermo Fisher Scientific | N/A | Optima Grade |
| Luna Phenyl-Hexyl HPLC Column | Phenomenex | 00G-4257-E0 | Brand: Luna |
| Formic Acid | Sigma-Alrich | F0507 | Used to make 50 mM ammonium formate |
Referenzen
- Oparin, A. I. . The Origin of Life. , (1924).
- Haldane, J. B. The origin of life. Rationalist Annu. 148, 3-10 (1929).
- Garrison, W. M., Morrison, D. C., Hamilton, J. G., Benson, A. A., Calvin, M. Reduction of Carbon Dioxide in Aqueous Solutions by Ionizing Radiation. Science. 114, 416-418 (1951).
- Miller, S. L. Production of Some Organic Compounds under Possible Primitive Earth Conditions. J. Am. Chem. Soc. 77, 2351-2361 (1955).
- Miller, S. L. A Production of Amino Acids Under Possible Primitive Earth Conditions. Science. 117, 528-529 (1953).
- Heyns, H. K., Walter, W., Meyer, E. Model experiments on the formation of organic compounds in the atmosphere of simple gases by electrical discharges (Translated from German). Die Naturwissenschaften. 44, 385-389 (1957).
- Ponnamperuma, C., Woeller, F. α-Aminonitriles formed by an electric discharge through a mixture of anhydrous methane and ammonia. Biosystems. 1, 156-158 (1967).
- Oró, J. Synthesis of Organic Compounds by Electric Discharges. Nature. 197, 862-867 (1963).
- Ring, D., Wolman, Y., Friedmann, N., Miller, S. L. Prebiotic Synthesis of Hydrophobic and Protein Amino Acids. Proc. Natl. Acad. Sci. U.S.A. 69, 765-768 (1972).
- Wolman, Y., Haverland, W. J., Miller, S. L. Nonprotein Amino Acids from Spark Discharges and Their Comparison with the Murchison Meteorite Amino Acids. Proc. Natl. Acad. Sci. U.S.A. 69, 809-811 (1972).
- Roscoe, S., Miller, S. L. Energy Yields for Hydrogen Cyanide and Formaldehyde Syntheses: The HCN and Amino Acid Concentrations in the Primitive Ocean. Orig. Life. 17, 261-273 (1987).
- Johnson, A. P., et al. The Miller Volcanic Spark Discharge Experiment. Science. 322, 404 (2008).
- Parker, E. T., et al. Primordial synthesis of amines and amino acids in a 1958 Miller H2S-rich spark discharge experiment. Proc. Natl. Acad. Sci. U.S.A. 108, 5526-5531 (2011).
- Cleaves, H. J., Chalmers, J. H., Lazcano, A., Miller, S. L., Bada, J. L. A reassessment of prebiotic organic synthesis in neutral planetary atmospheres. Orig. Life Evol. Biosph. 38, 105-115 (2008).
- Glavin, D. P., et al. Amino acid analyses of Antarctic CM2 meteorites using liquid chromatography-time of flight-mass spectrometry. Meteorit. Planet. Sci. 41, 889-902 (2006).
- Zhao, M., Bada, J. L. Determination of α-dialkylamino acids and their enantiomers in geologic samples by high-performance liquid chromatography after a derivatization with a chiral adduct of o-phthaldialdehyde. J. Chromatogr. A. 690, 55-63 (1995).
- Strecker, A. About the artificial formation of lactic acid and a new Glycocoll the homologous body Justus Liebigs Annalen der Chemie. 75, 27-45 (1850).
- Miyakawa, S., Yamanashi, H., Kobayashi, K., Cleaves, H. J., Miller, S. L. Prebiotic synthesis from CO atmospheres: implications for the origins of life. Proc. Natl. Acad. Sci. U.S.A. 99, 14628-14631 (2002).
- Kobayashi, K., Kaneko, T., Saito, T., Oshima, T. Amino Acid Formation in Gas Mixtures by Particle Irradiation. Orig. Life Evol. Biosph. 28, 155-165 (1998).
- Sagan, C., Khare, B. N. Long-Wavelength Ultraviolet Photoproduction of Amino Acids on the Primitive Earth. Science. 173, 417-420 (1971).
- Harada, K., Fox, S. W. Thermal Synthesis of Natural Amino-Acids from a Postulated Primitive Terrestrial Atmosphere. Nature. 201, 335-336 (1964).
- Ponnamperuma, C., Lemmon, R. M., Mariner, R., Calvin, M. Formation of Adenine by Electron Irradiation of Methane Ammonia, and Water. Proc. Natl. Acad. Sci. USA. 49, 737-740 (1963).
- Bar-Nun, A., Bar-Nun, N., Bauer, S. H., Sagan, C. Shock Synthesis of Amino Acids in Simulated Primitive Environments. Science. 168, 470-473 (1970).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten