Method Article
指南现代荧光定量免疫印迹与故障排除策略
摘要
The advancement of western blotting using fluorescence has allowed detection of subtle changes in protein expression enabling quantitative analyses. Here we describe a robust methodology for detection of a range of proteins across a variety of species and tissue types. A strategy to overcome common technical problems is also provided.
摘要
20世纪70年代末看到的第一个公开报道使用免疫印迹,评估的存在和复杂生物样品中的特定蛋白质的相对丰度的技术的。此后,免疫印迹方法已成为分子生物学家的实验剧目的共同组成部分。表明,超过22万的手稿出版已在2014年取得了重要的应用这一技术的考研用的术语"免疫印迹"粗略搜索,在过去十年里,再加上技术的发展进步成像敏感的荧光标记物具有改进的灵敏度,并且得到线性检测的更大的范围。其结果是基于西方的印迹(QFWB)现在一个真正可量化的荧光,使生物学家进行对比分析,表达与更高的灵敏度和精确度比以往任何时候。很多"优化"印迹方法存在,被用于不同的实验室。这些通常难以实现,由于微妙的,但没有证件的程序修正的要求。该协议提供了一个既定的和强大的QFWB方法的全面描述,完整的故障排除策略。
引言
Western印迹法(WB)是最初在20世纪70年代后期,以确定所关注的蛋白的存在或不存在下在一个复杂的生物样品,如组织匀浆1的分析技术。通常被称为该蛋白质的免疫印迹中,由于密钥抗体 - 抗原相互作用,该方法包括5个不同的步骤:蛋白质通过等电点为1)电泳分离; 2)转移到硝酸纤维素或聚偏二氟乙烯(PVDF)膜; 3)使用特异于目的蛋白质的初级抗体标记; 4)培养用针对第一抗体的第二抗体;和5)的可视化。
可视化的方法已演变随着时间的推移,以提高安全性和灵敏度。一些第一转债的进行了使用放射性标记的标签,然后进展到比色,然后更广泛使用的化学发光(ECL)方法。 Radioactivi一节被直接标记到探针的特异性抗原,而比色和ECL方法使用用酶记者间接标记技术,如碱性磷酸酶或链霉抗辣根过氧化物酶(HRP)2。的发色或发光产物的标记的强度是使用光密度测定,由此,信号强度,或强或弱,表明样品中目的蛋白质的或多或少的存在下进行测定。 ECL是比较敏感的,所以青睐的方法2,但所有的3种方法最初开发于X射线胶片与随后成立3更先进的数码影像技术。 WB的数字成像的进步不仅允许研究者来确定感兴趣的蛋白的存在或不存在的,但也允许一个推理到一个选定的蛋白质的表达水平,当与其他样品相比,因此可被称为"半定量&#8221 ;.最近,一个真正的定量和更灵敏的免疫印迹技术已经发展,由此进行荧光测定的水平,直接关系到一个样品中的量和单个蛋白的表达:定量的荧光蛋白质印迹(QFWB)。
当与ECL标记比较QFWB,利用荧光第二抗体的产生线性检测曲线4。这是相对于电致化学发光技术,其中,信号的线性度通常发生在低于5微克和信号饱和度低的蛋白质负载直接相关的蛋白的表达, 即,与遍在表达的持家基因5,6。这种差异很可能是由一个更大数量的结合位点,可用于抗生物素蛋白ECL底物结合到生物素化的次级,导致潜在的信号饱和的较高可能性引起的。这是被称为外核层的ECL基础免疫的重要原因之一Y"半定量"7。测定的表达水平的细微差异时,可能导致不准确的测量信号的饱和点是至关重要的。近年来广泛蛋白质组技术细节不断增加的敏感性和鉴别的微妙表达差异的出现,导致了日益增加的依赖真正的定量免疫印迹法进行验证实验,8,9。敏感,稳健和真正的定量方法的应用是至关重要的。
很多"优化"免疫印迹方法已经使用了独立的实验室,这经常被证明难以成立或复制,由于可能无法在正式的文件协议明显微妙的方法上的调整。这是一个既定的和强大的协议QFWB并另外提供了宝贵的战略,解决常见问题THA实现在t可能出现。
该协议最初是为与鼠脑匀浆进行了优化,但已经被在广泛的组织样本和物种4,9,10的有效利用。需要具体问题进行故障排除潜在协议的变化都包括在内。
研究方案
该协议已经使用商业化生产的缓冲器,凝胶和转印栈,以减少可变性,并提高一致性进行优化。参阅材料清单所需的消耗品的完整列表。
使用I-Blot检测快速传输和LI-COR的奥德赛成像系统,荧光白平衡协议
1.样品的制备
- 缓冲区选择/制备
- 选择用于样品均质化的适当的提取缓冲液,并确保该缓冲器是适用于所有的下游的技术来使用。制备的提取缓冲液:RIPA缓冲液(25mM的Tris-HCl(pH为7.6),150 mM氯化钠,1%NP-40,1%脱氧胆酸钠,0.1%SDS)中含有样品分离前5%的蛋白酶抑制剂混合物。
注意:有许多不同类型的提取缓冲液可与这取决于细胞内目的蛋白质的位置被选择。这些包括但不仅限于RIPA缓冲液(全细胞,线粒体和核部件),NP-40裂解液(全细胞或膜结合)和三海卫(细胞质骨骼绑定)。但是,提取缓冲液中的一些化学清洁剂可能有助于溶解,甚至停用蛋白质,但蛋白质测定使用特定的蛋白质测定法时, 即二喹啉酸(BCA)检测的干扰。检查关于与测定的化学相容性的制造商的指导方针。
- 选择用于样品均质化的适当的提取缓冲液,并确保该缓冲器是适用于所有的下游的技术来使用。制备的提取缓冲液:RIPA缓冲液(25mM的Tris-HCl(pH为7.6),150 mM氯化钠,1%NP-40,1%脱氧胆酸钠,0.1%SDS)中含有样品分离前5%的蛋白酶抑制剂混合物。
- 蛋白提取/溶
- 采用使用一个DOUNCE或手持式电动匀浆与聚丙烯尖端在所制备的提取缓冲液,在大约1点10重量/体积(组织重量/缓冲液体积),随后均化剪刀和/或手术刀直到手动浸软的组织样本平滑/一致的匀浆制备。
注:对于较小的,珍贵的/很难获得样本,基于洗涤剂提取CAÑ仍然是有效降低到1:5。 - 发表均质,离心样品以20,000×g离心20分钟,在4℃下。直到需要除去含有溶解的蛋白质和商店的上清液在-80℃下。保留不溶性的颗粒,以允许进一步更严格的提取,如果以后需要。继续进行蛋白质测定步骤1.3。
- 采用使用一个DOUNCE或手持式电动匀浆与聚丙烯尖端在所制备的提取缓冲液,在大约1点10重量/体积(组织重量/缓冲液体积),随后均化剪刀和/或手术刀直到手动浸软的组织样本平滑/一致的匀浆制备。
- 蛋白质测定
- 确定通过使用一个BCA,布拉德福德或相似的测定提取的各样品中蛋白质的浓度。当计算的标准曲线,确保了确定比,R平方值的系数,是大于或等于0.99,反映了样品15内的最准确的测定蛋白质丰度。
注:由QFWB被比较的所有样品必须检测对同一标准曲线。
- 确定通过使用一个BCA,布拉德福德或相似的测定提取的各样品中蛋白质的浓度。当计算的标准曲线,确保了确定比,R平方值的系数,是大于或等于0.99,反映了样品15内的最准确的测定蛋白质丰度。
- 样品的制备
- 规划和记录梯子和样品的加载顺序2相同克埃尔斯:凝胶1用于转移和凝胶2作为上样对照。负载的控制和"治疗"的样品依次以避免可能出现的不良或明确转让任何偏见。
- 计算所需的各样品的蛋白量。一个标准的蛋白质负荷检测蛋白质在神经元分离是15微克。使每个样本高达10微升体积用卫生署2 O.加入5微升加样缓冲液,涡旋和热,在98℃下进行2分钟。
- 包括一个阳性对照样品,如重组蛋白以辅助识别感兴趣的正确频带。但是正确制备阳性对照样品按照制造商的指导原则,避免选择错误的频带。参见图1。
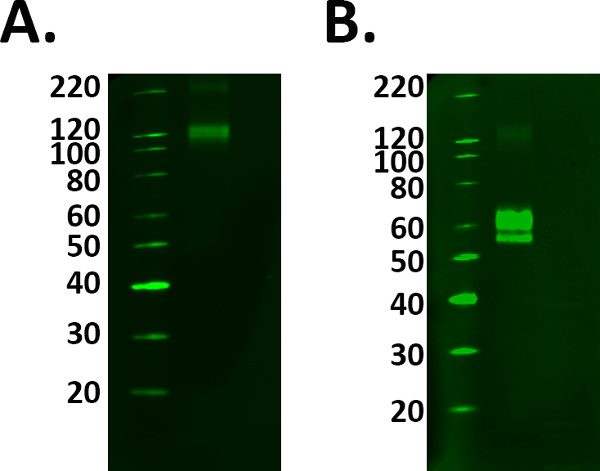
图1:Positive控制选择。一个实验中加入的阳性对照的确认检测到的标签是真实的。但是,一定要小心,以确保您的控制工作正常之前,用实验样品A)融合蛋白TREM 2在制造商的1微克/毫升指引加载,但是在110 kDa的与数据表的冲突中观察到的标记预测分子重量的60-70 kDa的。B)的加法和温育与还原剂后,将融合蛋白标记物在预测的分子量检测。然而,这意味着更大的蛋白负荷所需的还原方法减少该蛋白质的信号。
蛋白质2.电泳分离
- 4-12%双/三凝胶制剂(1.0毫米)
注释:梯度凝胶被用来在宽分子量范围内,以产生更大的蛋白质的分离。- 选择并准备MES或MOPS电泳缓冲液(每罐1升)通过与卫生署2 O稀释MES缓冲液中产生更好的分辨率的蛋白质内3.5-160 kDa的而MOPS运行缓冲液是优选的,以检测的较高分子量的蛋白质高于200 kDa的但是将具有低于15 kDa的低分子量蛋白质的较差的分辨率。
- 取出梳子和胶带条,覆盖凝胶的脚。轻轻冲洗各孔用使用1ml移液器在运行缓冲液中。填充井用运行缓冲液中,并确保没有气泡残留在凝胶中。
- 凝胶制备和装载
- 将凝胶放入水箱,并填补了凝胶间舱室与电泳缓冲液,以确保所有密封件均有效地工作。
- 加入3微升的分子量标准到第一口井凝胶1和凝胶2.将10微升每个样品到后来的水井。
注:除梯子,凝胶1&2凝胶必须相同。当务之急是日在使用凝胶2预染分子量标准,以便使用总蛋白染色是在奥德赛成像仪的700通道时可见的蓝色和可见的。 - 一旦被加载两种凝胶,填充剩余的运行缓冲罐和固定盖子。
- 电泳
- "运行"的凝胶在80伏进行4分钟,以确保样品进入以均匀的方式在聚丙烯酰胺凝胶基质。其后增加电压和时间设置为180 V 50分钟,分别或直至样品染料可以看出,在凝胶的脚。
注:较高的电压可被施加以实现更短的运行时间。然而,这可能会导致"笑脸"的凝胶,其中所述凝胶的中间样本的运行速度比所造成的温度上升14的外车道的样品要快。
- "运行"的凝胶在80伏进行4分钟,以确保样品进入以均匀的方式在聚丙烯酰胺凝胶基质。其后增加电压和时间设置为180 V 50分钟,分别或直至样品染料可以看出,在凝胶的脚。
在加载控制凝胶3.总蛋白染色
- 从磁带盒使用释放凝胶2凝胶刀。除去孔中,凝胶的脚。凝胶上标记,以帮助定向。
- 倒出大约30毫升的蛋白质染色成方形培养皿(尺寸约12×12厘米)。放置凝胶2入蛋白质污点,从而确保该溶液覆盖整个凝胶,然后搅拌该凝胶1小时,最小值在室温下进行染色。
- 倒出蛋白染色和在蒸馏水中之前可视洗凝胶3倍。继续执行步骤6.3可视化。
4. I-印迹半干快速蛋白转移
注意:需要使用I-Blot检测机蛋白转移的所有试剂都是专门针对我印迹方法设计的商业产品和所用的材料清单中找到。
- 准备"底"转让协议栈。取下铝箔盖和预湿用电泳缓冲液直接从胶罐。预湿滤纸,用蒸馏水。
- 重复步骤3.1和地点凝胶1到准备"底"转栈。
- 放置在凝胶预湿滤纸。滚动滤纸和凝胶,以确保没有气泡的各层之间的残留。
- 从顶部传送栈中取出铝箔盖和铺设在滤纸上和底部堆栈的顶部的顶部堆叠。滚动转栈"三明治",以消除任何气泡。
- 从传输堆栈套件的海绵插入到I-Blot检测机的盖子。将转栈三明治到I-Blot检测机上的专用空间,然后盖上盖子固定。启动I-Blot和转移8.5分钟的节目3。
- 如果有一个低蛋白信号或高不均匀:低分子量蛋白质之比,使用半干燥的"快速"的转移方法时,测试该制造商的传输时间。运行使用相同的负载的样本重复序列,以确定理想的转移电压/时间组合的简单优化协议如在图2中看到的 。
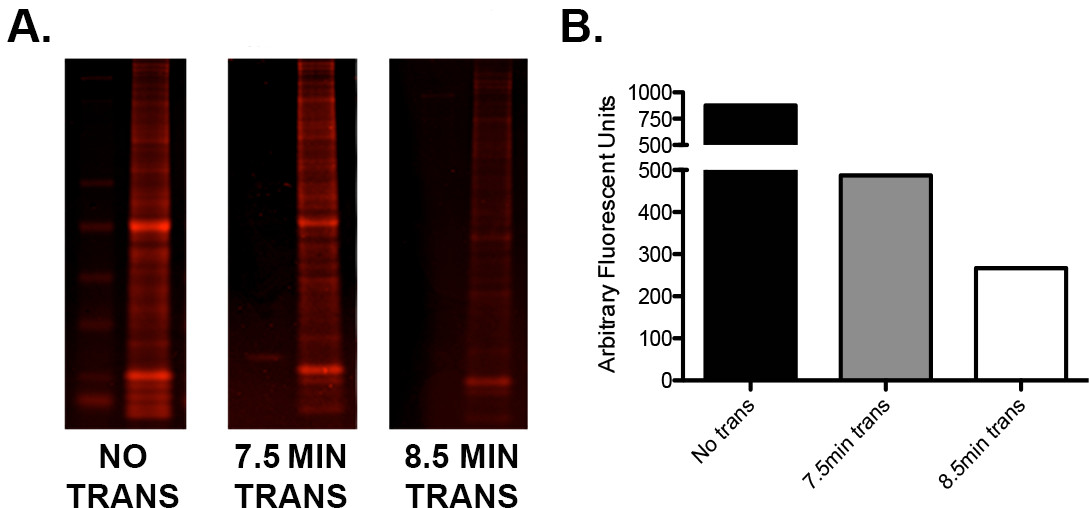
图2.优化装载有阶梯的单一凝胶转移使用I-Blot法A)和15的三个串联重复序列的小鼠全脑匀浆微克切成三部分。一部分未被转印,1被转移为7.5分钟(按照制造商的指导方针),一个用于8.5分钟。凝胶切片,然后用即时蓝蛋白染色剂染色,扫描上的680通道的红外成像和量化。B)的量化值,表明在每个凝胶的残留蛋白质含量的差异的图形表示后面的0,7.5,和8.5分转移。注意,传送时间的额外分钟造成了大约45%的额外蛋白质转移。e.com/files/ftp_upload/52099/52099fig2large.jpg"TARGET ="_空白">请点击这里查看该图的放大版本。
5.抗体检测蛋白
- 膜的制备及阻塞
- 从I-Blot检测机除去转印堆栈。除去顶部和滤纸层暴露在底部传送栈中的凝胶。
- 切断周围的凝胶用手术刀,并确保一个三角形切向定位是表示在该膜。下面的膜裁剪,蛋白质染色凝胶来检查传输效率和/或丢弃。
- 迅速将膜放入干净的50ml管中(或等值插座)含有5ml 1X PBS中,并放置到一个机械滚轮(或轨道平台)的不断搅拌。
注意:这是至关重要的,所述膜是不允许干。在半干转印膜将成为热点。等待2分钟打开转栈,因为这将允许我之前吨冷却,并在堆栈解构缓慢的干燥时间。使用的辊筒和用于在洗涤和孵育搅拌允许显著减少所需的溶液的量。 - 洗膜3×5分钟,在1×PBS中。丢弃的1×PBS和块与未稀释的封闭缓冲液的膜为至少30分钟,在室温下进行。
- 一抗准备。
- 根据制造商的在5ml封闭缓冲液中含0.1%吐温20的指引制备第一抗体。孵育制备的第一抗体过夜,在4℃下以恒定的搅拌的膜。
注:封闭缓冲液,通常使用未稀释的,而是可以稀释到1:4,用PBS如果初级抗体具有足够高的特异性。 - 弃去第一抗体和洗膜6次,每次5分钟,用1×PBS。
- 根据制造商的在5ml封闭缓冲液中含0.1%吐温20的指引制备第一抗体。孵育制备的第一抗体过夜,在4℃下以恒定的搅拌的膜。
- 二抗的选择和准备
- 山高ndary只标注评估控制的目的,省略步骤5.2.1和5.2.2以上,并继续执行步骤5.3,以确定具体的抽样二次带型。参见图3。
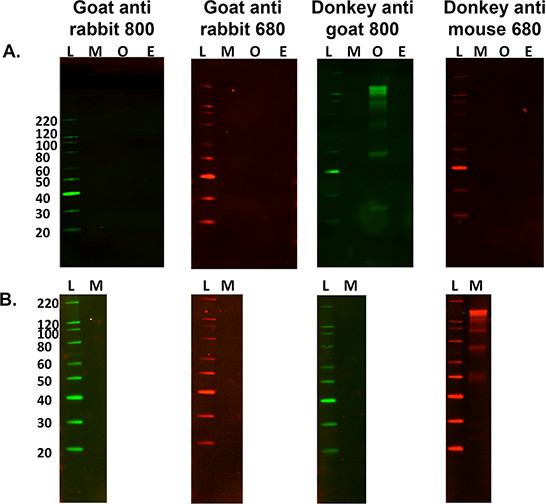
图3.优化二次抗体。A)二次唯一的非特异性标记的抗鼠15微克(M)多品种比较,羊(O)和马(E)神经组织匀浆与各种荧光标记的二抗。 L是分子量阶梯。绵羊组织匀浆是唯一的样品与次级标记用驴抗山羊800抗体。 乙当交叉反应)也很重要,如果使用不同的组织样本时出现的非特异性标记,以确定, 例如 ,鼠腓肠肌(15 _6克负荷)。该样品的交叉反应与驴抗小鼠680的二级抗体,但用小鼠脑匀浆时,这并没有发生。
- 制备荧光标记的第二抗体680或800(红色或绿色通道),按照生产商推荐的浓度在封闭缓冲液中含0.1%吐温20。孵育在黑暗中的膜用90分钟在室温下持续搅拌制备的二级抗体。
- 丢弃的二级抗体和洗膜6次,每次洗涤5分钟,用1×PBS。继续执行第6步 - 可视化。
- 如果标记的可视化工作不正常,检查梯子射程二次抗体作为一个合适的附加步骤。不是所有的二抗允许所有标记带的可视化市场上所有的梯子。
- 如果预期的频段是不可见的,使用其他辅助主机, 也就是说,反主动安永抗兔抗山羊抗兔表示合适的协议修改。参见图4。用于提高二抗宿主物种有时会导致一个问题,可视化,由于缺乏特异性针对特定初级抗体。
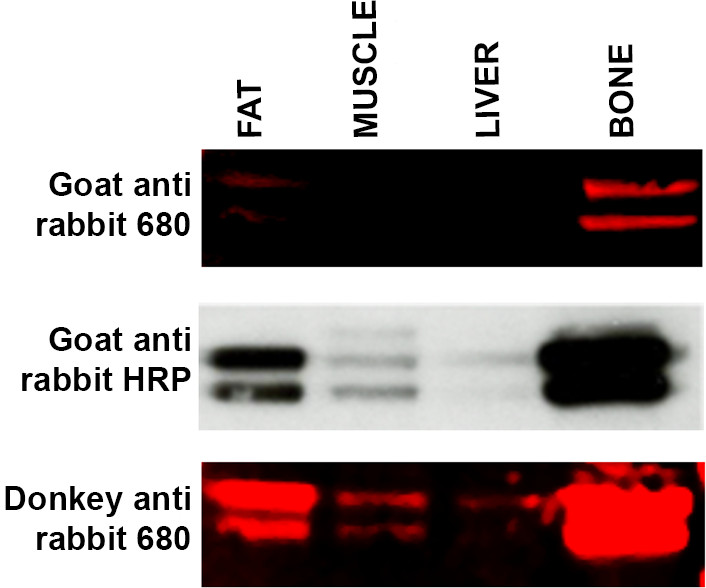
图4.故障的第二抗体特异性的范围组织样品的Western印迹(每泳道15微克蛋白) -脂肪,肌肉,肝脏和骨-孵育ERK的初级抗体孵育用三种不同的二抗。顶板:WB标记LI-COR的山羊抗兔680第二抗体产生的脂肪和骨弱的标签和在肝脏和肌肉样品中没有检测到信号。中间面板:膜(从顶部面板)进行剥离和再版俄别用ECL方法和山羊抗兔HRP连接的次级。频带是现在在肌肉和肝脏样品可见和标签出现的脂肪和骨样品中更加强烈。底部面板:膜(从顶部和中间面板)进行剥离,并使用LI-COR的驴抗兔已经示出了ERK的初级抗体具有更大的亲和力680的二级抗体再次探测。标签的肌肉和肝脏现已与来自脂肪和骨骼样本增加信号强度显示。 请点击这里查看该图的放大版本。
6.可视化
注:所有图片均采用LI-COR的奥德赛经典成像仪和相关的专业图像分析软件(3.1.4版本)获得的。
- 打开并登录到计算机和成像。打开成像软件并创建一个新的文件。 见图5。
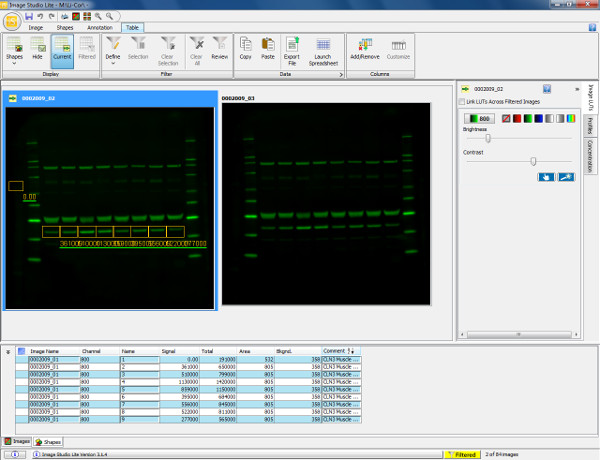
图5.可视化和Western blot定量分析。扫描免疫印迹显示小鼠腓肠肌(30微克负载)的探测与膜联蛋白V一抗(36 kDa的)和羊抗兔800的第二抗体。膜进行扫描,并可视化中的800信道。量化蛋白质(膜联蛋白V),一个矩形框,从样品1周围绘制的感兴趣的频带这随后被复制和粘贴在剩余样品泳道,以确保在同一区域的测量。背景自动占周围绘制的形状,但这是可以改变的,以确保在后台测量是精确限定的。下面的表格显示绘制包括信号与背景相减得到的总信号,背景和每个形状的量化测量。这些信息可以被导出到一个电子表格程序来计算的表达率(相对于荧光强度来确定),并允许进行后续的统计分析。 请点击这里查看该图的放大版本。
- 打开热像仪的盖子。倒入少量的1×PBS对上的左下角的玻璃,然后将膜在PBS中的顶部。确保膜是正方形与成像器的轴和1厘米的间隙被留在膜和网格轴之间。
- 滚动膜,以确保无气泡的玻璃和膜之间困住。
- 算膜占据的x和y轴的正方形的数目。关闭成像仪的盖子。进入膜占据的计算机软件的正方形的数目。
- 选择合适的信道进行扫描,将依赖于荧光标记的膜二次抗体,的即 700信道或当一个680或800的荧光标记的抗体已被分别用于800信道。当双标记被执行时,扫描在两个通道。
注:优化单一的蛋白标记进行双标记之前。 - 选择的强度来扫描该膜,如果一个高丰度蛋白使用低强度的扫描。另外,如果第一抗体对目的蛋白选择更高强度的扫描亲和性差, 即 5级按启动键开始扫描。请转至步骤6.4。
- 装载控制凝胶的可视化( 图6)。
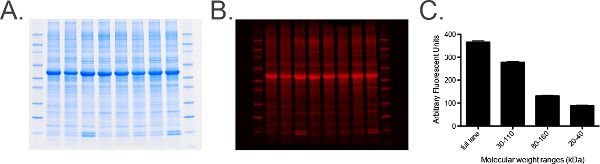
图6.总蛋白标记和分析。A)含有20微克每车道。B马颈椎神经节匀浆总蛋白凝胶标记的照片),从面板凝胶利用成像软件扫描中从总蛋白质染色的凝胶的680信道。C)的图形图像的量化测量获得。一系列的测量,由分子量标记物来确定, 即,30-110 kDa的,采取以提供测量值的直方图,以确保标准误(SEM)为低(被分组的试样的),这表明总蛋白水平在每个样品中是均匀整个凝胶。 请点击这里查看这个数字的放大版本。- 按照步骤6.1和6.2。
- 倒入蒸馏水在玻璃制的网格中的轴开始处的成像器的底部角落。
- 将凝胶上的水的顶部和操纵这样的车道垂直于任一x或网格的y轴方向。离开网格的y和x轴和凝胶之间1cm的间隙并计算凝胶占据在网格轴线方格的数目。近热像仪的盖子。
- 进入凝胶占据的计算机软件的正方形的数目。
- 选择的700信道扫描的总蛋白质染色的凝胶。
注:蓝色荧光,在700频道。 - 强度设置为5,然后按开始。
- 扫描图像的量化
- 调整亮度和对比度的按钮,以产生最佳的图像质量。如果似乎存在高背景噪声,重新扫描该膜在较低的强度,并使用高质量的扫描设置。
注:任何调整都不会改变扫描时获得的荧光数据。 - 旋转图像90°,180°和270°,以查看在所期望的方向,没有修改所获取的数据。然而,使取向"自由旋转"的小调整,以大于3°时,在像素化值采集的数据可以被扭曲,从而影响定量结果。
- 然后从菜单形状的形状 - 使用一个矩形在大多数情况下 - 与周围绘制的感兴趣的频带(WB)或在样品泳道1的整个车道(总蛋白胶)。
- 复制并粘贴跨越的利益或整个车道样品2道带的形状。对面的对每一取样兴趣各个频带和各车道总蛋白凝胶重复。
- 检查背景测量不包含的信号,在未来的车道。背景可以通过软件自动扣除,并包括周围绘制的形状的整个边缘或它可被指定为顶/底部或左和形状的右边。或者,指定一个用户自定义的背景框。
- 显示形状表中的任意荧光单位绘制每个形状的信号。背景将自动从该信号中扣除。
- 图像导出为TIF文件,查看不同的软件。不导出图像和操纵USI纳克非图像pro软件,因为这会改变由成像器生成虚假数据中获取的原始数据。
- 重复步骤6.4.3-6.4.7量化双标记或进行多次测量的装载控制凝胶生成和整理标准错误数据时。
- 调整亮度和对比度的按钮,以产生最佳的图像质量。如果似乎存在高背景噪声,重新扫描该膜在较低的强度,并使用高质量的扫描设置。
7.邮政可视化
- 保持膜在1×PBS或干出用于长期储存以供将来重复探测和剥离膜的对于感兴趣的其他蛋白质。
- 剥离和重新探测膜。 见图7。
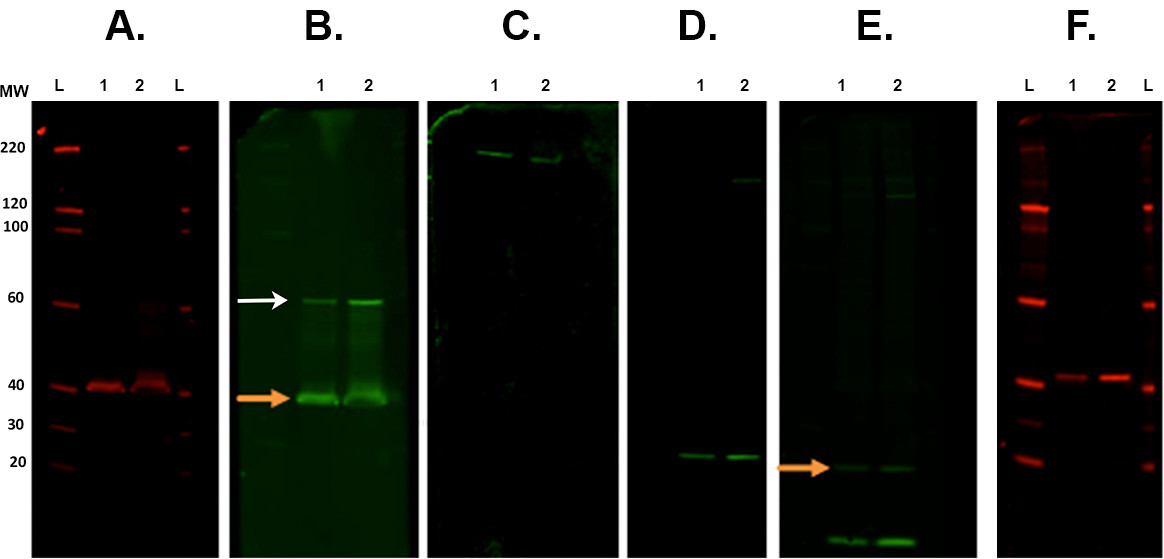
图7.膜剥离和再杂交,膜下扫描红外成像系统, 一个不同的剥离步骤代表性的例子。第一免疫检测,进行与CSP的第一抗体(兔)和扫描在700路; B。首先剥离和ROCK2(兔)与800路再杂交。橙色箭头指示剩余的条和重新探头后,目前CSP的主要抗体。这并不影响ROCK2的测量作为带处存在较高分子量(白色箭头)。13 C。第二次剥离,并与β-血影蛋白抗体(山羊)再次探测和可视化的800通道。ð。第三剥离,并与α突触核蛋白抗体(兔) 的 E再杂交。第四剥离,并与泛素抗体(小鼠)与800路再杂交。还有从最后抗体剩余信号(α突触核蛋白。橙色箭头)。F。第五剥离和CALB2抗体(兔)成像在700路再杂交。所用的二抗是:山羊抗小鼠800CW,山羊抗兔680rd,山羊抗兔800CW,驴抗山羊800CW(见材料清单)。巷标签:L - 梯1/260; -样品的1/2。 请点击这里查看该图的放大版本。- 地方膜(多个)中的正方形培养皿中含有大约30毫升Revitablot剥离缓冲液,并在室温下恒定搅拌5-20分钟之间温育。
- 洗膜(多个)在PBS中的3次,然后重新扫描成像器,以确保完全除去荧光的发生 - 此步骤,每一个条带后重复进行。
- 孵育膜(S)的时间较长,如果荧光仍然存在。重新扫描每个膜带后,确认有没有剩余的二次信号。
注意:膜(多个)应只剥离并再次探测最多3次,以确保膜的完整性没有被破坏从而导致不期望的高背景信号比。
结果
作为QFWB灵敏度和检测的线性范围大于常规ECL检测,也有一些地方是至关重要,以确保精确的数据收集的控制措施,从而有助于有效的解释。首先,包含阳性对照样品, 如图1;其次,转移的优化,以保证从凝胶向膜的高和低分子量蛋白质的等效运动为展示在图2中 ,第三,抗体的优化,特别是二次抗体的优化往往被忽视,但它可以产生非特异性条带能够与感兴趣的蛋白(S)的正确解释干扰。参见图3。第四,它也可能是这种情况,当一个蛋白似乎检测不到的,但预计将存在,这也可以是次级抗体的问题,可以通过简单地使用一个次级rais的被校正编在不同的寄主。参见图4。第五,总蛋白标记和分析是相比于使用传统的单一蛋白(多个)被普遍表达作为内部参考标准3的一个更为健壮的,可量化的方法。许多这些单个的蛋白质被发现差异表达在神经退行性疾病的模型以及与不同的组织样本和表达的均匀性可以在相同的组织中3改变。因此,生产上样对照凝胶的将确认样品负荷的均匀性,总蛋白分析,通过比较和定量蛋白质负荷在每个泳道下,在对每一个样品测定不同分子量范围的组合时,表示标准误差为展示图6中的。重要的是,所有这些故障排除技术和控制是只一样有效的分析吨的灵敏度和一致性由操作者( 图5)施加ools。最后这种技术适合于汽提和再探测膜具有比ECL更多灵活性因包括但不限于增加的敏感性,降低的背景,双色检测和膜稳定性长期储存条件下的因素。 见图7。
讨论
由于考虑和计划是之前的任何实验必不可少,并且可以最终确定所使用的技术的成功。用WB可以呈现过多的潜在绊脚石试图选择合适的抗体,转移和可视化方法使用时,在蛋白质检测的进步。幸运的是,通过仔细的检查表和QFWB可常规用于确定蛋白质的存在和样品之间日益微妙的表达差异适当的控制措施。该协议提供了一个全面的指南,以荧光定量免疫印迹以及一些解决问题的策略,以避免和/或克服一些与此相关的许多常见的陷阱。
用来维持灵敏度,将获得的关键步骤真正量化和可比较的测量包括:1)鲁棒蛋白提取自组织样品; 2)样品制备; 3)准确的蛋白质插件中克以总蛋白质分析测定; 4)优化利用I-Blot检测蛋白的转移; 5)使用红外成像器和相关联的软件准备一级和二级抗体在阻断含0.1%吐温20缓冲液,和6)正确的可视化和分析。
红外荧光检测是真正的量化,并与更传统的电化学发光检测技术3,11相比提供了更高的灵敏度。该检测系统是多面性的,因此并不限定于QFWB。该系统能够免疫组化标记成像在低功耗,允许可视化的整个组织切片12和量化。这是未来发展潜力的一个区域在分辨率方面可能远远看见红色的成像媲美常规免疫捕获与传统的显微镜定量评估方面。
然而,与在P微妙的变化更加敏感rotein表达关键的是要确保变性保持在最低限度和控制措施是严格的具有强大的协议。这开始于严谨蛋白提取组织样本随后生产总蛋白质染色的凝胶以提供保证样品装载是均匀的,第一和第二抗体,以确定是否检测是真实的,对于测试制造商的指导方针来传输优化次,以获得有效的蛋白转移。
然而,即使当用于白平衡的条件进行了优化,但仍然可以使用运行西部片可能未得到充分这里探讨了相关的问题。这些包括但不限于因素,包括蛋白质溶解和选择的提取缓冲液。某些缓冲剂能与蛋白质浓度测定干扰,和一些组织中是特别难以溶解,因此需要更强大的技术,例如利用自动macera鼎密封容器如M管连同Mac机离解。此外,对于存储提取和非萃取材料在-80℃下的简单的控制措施可以是提取后立即获得最佳标记和具有较差的结果周后之间的差。
现代QFWB方法被证明是用于捕获在蛋白质表达的细微差别更敏感,更通用的允许同时双标记3时相比,如ECL旧的技术。至关重要的是,免疫印迹协议是强大和易于重复进行准确的定量和统计分析。这个协议是敏感的和强大到足以被常规用于检测蛋白的跨各种不同的组织样本和物种3,并且允许低和高丰度蛋白质的定量相同QFWB内,因此减少了耗材使用以及每个实验1时间1此外,该技术的敏感性增加使得越来越流行的验证- 组学研究9,14然而精度是至关重要的,并包含合适的控制措施,必须遵守从而避免错误的数据采集。
披露声明
The authors have nothing to disclose.
致谢
我们想感谢下列人员或资金支持:BBSRC研究所战略方案基金 - CF&TMW; BBSRC东生物DTP资金 - LG;爱丁堡的达尔文信托 - MLH。我们还要感谢巴里·麦科尔医生的许可,包括在这个手稿的TREM2优化。
材料
| Name | Company | Catalog Number | Comments |
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| RIPA Buffer | Fisher Scientific UK Ltd | 10230544 | |
| M Tubes | Miltenyi Biotec Inc. | 130-093-236 | |
| iBlot Transfer Stack, PVDF Regular | Life technologies, UK | IB401001 | |
| MagicMark XP Western Protein Standard (20-220 kDa) | Life technologies, UK | LC5602 | Use in gel 1 for Western blotting |
| SeeBlue Pre-stained protein standard | Life technologies, UK | LC5625 | Use in gel 2 Total protein stained gel |
| NuPAge LDS Sample buffer 4X | Life technologies, UK | NP0007 | |
| NuPAGE MES SDS Running Buffer (for Bis-Tris Gels only) (20X) | Life technologies, UK | NP0002 | |
| NuPAGE Novex 4-12% Bis-Tris Gel 1.0 mm, 12 well | Life technologies, UK | NP0322BOX | |
| PHOSPHATE BUFFERED SALINE TABLET,*TRU-ME, PHOSPHATE BUFFERED SALINE TABLET | Sigma-Aldrich, UK | P4417-100TAB | |
| Micro BCA, Protein Assay Kit | Fisher Scientific UK Ltd | 10249133 | |
| Odyssey blocking buffer | Li-Cor Biosciences | P/N 927-40000 | |
| IRDye 680RD Goat anti-Rabbit IgG (H+L), 0.5 mg | Li-Cor Biosciences | 926-68071 | |
| IRDye 680RD Donkey anti-Mouse IgG (H+L), 0.5 mg | Li-Cor Biosciences | 926-68072 | |
| IRDye 800CW Goat anti-Rabbit IgG (H + L), 0.5mg | Li-Cor Biosciences | 926-32211 | |
| IRDye 800CW Donkey anti-Goat IgG (H + L), 0.5mg | Li-Cor Biosciences | 926-32214 | |
| ODYSSEY CL Infra-red imager | Li-Cor Biosciences | Call for quotation | |
| iBlot 7-Minute Blotting System | Life technologies, UK | This model is no longer in production | |
| InstantBlue Protein stain | Expedeon, UK | ISB1L | |
| Revitablot western blot stripping buffer | Rockland Immunochemicals Inc. | MB-085-0050 |
参考文献
- Towbin, H., Staehelin, T., Gordon, J. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. Biotechnology. 1992 (24), 145-149 (1979).
- Walker, J. M. . Protein Protocols on CD-ROM. , (1998).
- Gallagher, S., Winston, S. E., Fuller, S. A., Hurrell, J. G. Immunoblotting and immunodetection. Curr Protoc Mol Biol. Chapter. 10, 10 (2008).
- Eaton, S. L., et al. Total protein analysis as a reliable loading control for quantitative fluorescent Western blotting. PLoS One. 8 (8), 72457 (2013).
- Suzuki, O., Koura, M., Noguchi, Y., Uchio-Yamada, K., Matsuda, J. Use of sample mixtures for standard curve creation in quantitative Western blots. Exp. Anim. 60, 193-196 (2011).
- Colella, A. D., et al. Comparison of Stain-Free gels with traditional immunoblot loading control methodology. Anal Biochem. 430 (2), 108-110 (2012).
- Zellner, M., et al. Fluorescence-based Western blotting for quantitation of protein biomarkers in clinical samples. Electrophoresis. 29, 3621-3627 (2008).
- Kielar, C., et al. Molecular correlates of axonal and synaptic pathology in mouse models of Batten disease. Hum Mol Genet. 18, 4066-4080 (2009).
- Mutsaers, C. A., Lamont, D. J., Hunter, G., Wishart, T. M., Gillingwater, T. H. Label-free proteomics identifies Calreticulin and GRP75/Mortalin as peripherally accessible protein biomarkers for spinal muscular atrophy. Genome Med. 5 (10), 95 (2013).
- Wishart, T. M., et al. Dysregulation of ubiquitin homeostasis and β-catenin signaling promote spinal muscular atrophy. J Clin Invest. 124 (4), 1821-1834 .
- Mathews, S. T., Plaisance, E. P., Kim, T. Imaging systems for westerns: chemiluminescence vs. infrared detection. Methods Mol Biol. 536, 499-513 (2009).
- Hawes, J. J., Brunzell, D. H., Wynick, D., Zachariou, V., Picciotto, M. R. GalR1, but not GalR2 or GalR3, levels are regulated by galanin signalling in the locus coeruleus through a cyclic AMP-dependent mechanism. J Neurochem. 93 (5), 1168-1176 (2006).
- Bond, D., Primrose, D. A., Foley, E. Quantitative evaluation of signaling events in Drosophila S2 cells. Biol Proceed Online. 10 (1), 20-28 (2008).
- Wishart, T. M., et al. Differential proteomics analysis of synaptic proteins identifies potential cellular targets and protein mediators of synaptic neuroprotection conferred by the slow Wallerian degeneration (Wlds) gene. Mol Cell Proteomics. 6, 1318-1330 (2007).
- Silva, J. M., McMahon, M. The fastest western in town: a contemporary twist on the classic western blot analysis. J. Vis. Exp. (84), 51149 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。