Method Article
A Guide to Modern quantitativa fluorescente Western Blotting com estratégias de resolução de problemas
Neste Artigo
Resumo
The advancement of western blotting using fluorescence has allowed detection of subtle changes in protein expression enabling quantitative analyses. Here we describe a robust methodology for detection of a range of proteins across a variety of species and tissue types. A strategy to overcome common technical problems is also provided.
Resumo
O final da década de 1970 viu o primeiro relato do uso público do western blot, uma técnica para avaliar a presença e abundância relativa de proteínas específicas dentro de amostras biológicas complexas. Desde então, a metodologia blotting ocidental tornou-se um componente comum da biólogos moleculares repertório experimental. Uma pesquisa superficial da PubMed usando o termo "western blot" sugere que, em excesso de 220.000 manuscritos publicados têm feito uso desta técnica até o ano de 2014. É importante ressaltar que nos últimos dez anos temos visto avanços técnicos de imagem, juntamente com o desenvolvimento marcadores fluorescentes de sensíveis que melhoraram a sensibilidade e renderam ainda maiores gamas de detecção linear. O resultado é uma fluorescência agora verdadeiramente quantificáveis, com base Western Blot (QFWB) que permite que os biólogos para realizar análise de expressão comparativa com maior sensibilidade e precisão do que nunca. Muitos western blotting "otimizado"existem metodologias e são utilizados em diferentes laboratórios. Estes, muitas vezes revelar-se difícil de implementar devido à exigência de alterações processuais sutis, mas sem documentos. Este protocolo fornece uma descrição detalhada de um método QFWB estabelecida e robusta, com estratégias de resolução de problemas.
Introdução
Transferência de Western (WB) é uma técnica analítica desenvolvida originalmente na década de 1970 para determinar a presença ou ausência de uma proteína de interesse numa amostra biológica complexa, tal como um homogeneizado de tecido 1. Normalmente referido como o de imunomarcação de proteínas, devido à interacção anticorpo-antigénio chave, a metodologia consiste em 5 etapas distintas: 1) a separação electroforética das proteínas por seu ponto isoeléctrico; 2) a transferência para uma membrana de nitrocelulose ou de difluoreto de polivinilideno (PVDF) da membrana; 3) marcação usando um anticorpo primário específico para a proteína de interesse; 4) a incubação com um anticorpo secundário dirigido contra o anticorpo primário; e 5) de visualização.
Metodologia Visualization evoluiu com o tempo para melhorar a segurança e sensibilidade. Alguns dos primeiros PEP foram realizadas utilizando rádio etiquetas marcadas que depois progrediram para colorimétrico e, em seguida, os mais amplamente utilizados quimioluminescência (ECL) métodos. Radioactivity foi marcado directamente para sondas para antigénios específicos enquanto que as metodologias colorimétricos e de ECL utilizar uma técnica de marcação indirecta com um repórter enzima, tal como fosfatase alcalina ou peroxidase de estreptavidina de rábano (HRP) 2. A intensidade de etiquetagem do produto cromagénio ou luminescente é medido por densitometria em que a intensidade do sinal, forte ou fraco, mais ou menos indica a presença da proteína de interesse na amostra. ECL é a metodologia mais sensível e, portanto, favorecido 2, mas todos os três métodos foram desenvolvidos inicialmente em filme de raios-x com técnicas de imagem digital mais sofisticadas posteriormente estabelecidas três. O avanço da imagem digital de WB não só é permitido um investigador para determinar a presença ou ausência da sua proteína de interesse, mas também permitiu uma inferência com o nível de expressão de uma proteína seleccionada, quando comparada com outras amostras e, portanto, pode ser referido como "semi-quantitativa & #8221 ;. Recentemente, uma tecnologia verdadeiramente quantitativo e mais sensível western blotting foi desenvolvida através do qual o nível de fluorescência medido está directamente relacionado com a quantidade e expressão de uma única proteína dentro de uma amostra: quantitativo fluorescente western blot (QFWB).
Quando se compara com QFWB rotulagem de ECL, a utilização de um anticorpo secundário fluorescente gera um perfil linear de detecção 4. Isto está em contraste com as técnicas de ECL em que a linearidade do sinal geralmente ocorre com baixas cargas de proteínas inferiores a 5 pg e saturação de sinal directamente relacionadas com a expressão da proteína, ou seja, com ubiquamente expressos genes housekeeping 5,6. Esta disparidade é provavelmente causada por um maior número de locais de ligação disponíveis para um substrato de ECL avidina para se ligar a um secundário biotinilado, resultando em uma maior probabilidade de saturação de sinal potencial. Esta é uma das principais razões para a base de ECL immunoblotting sendo referido como only "semi-quantitativa" 7. O ponto de saturação de sinal é de importância crítica ao medir diferenças sutis nos níveis de expressão e pode levar a medições imprecisas. Nos últimos anos, o advento das técnicas de proteómica generalizados detalhando cada vez maior sensibilidade e identificação das diferenças subtis de expressão resultou em uma dependência crescente em western blotting verdadeiramente quantitativo para experiências de validação 8,9. A aplicação da metodologia sensível, robusto e verdadeiramente quantitativa é, portanto, crucial.
Muitas metodologias de Western blotting "otimizados" têm sido utilizados por laboratórios independentes, que frequentemente provam difícil de configurar ou replicar devido a ajustes metodológicos sutis que podem não ser aparente em protocolos documentados formais. Este é um protocolo estabelecido e robusto para QFWB e, adicionalmente, fornece valiosas estratégias para solução de problemas comuns that podem surgir durante a implementação.
Este protocolo foi originalmente otimizado para uso com homogeneizados de cérebro murino, mas desde então tem sido utilizada de forma eficaz em uma ampla gama de amostras de tecidos e espécies 4,9,10. Variações de protocolo potenciais necessários para a solução de problemas específicos estão incluídos.
Protocolo
Este protocolo foi optimizado utilizando tampões produzidos comercialmente, géis e pilhas de transferência, a fim de reduzir a variabilidade e melhoram a consistência. Consulte a Lista de Materiais para uma lista completa de consumíveis necessários.
Protocolo WB fluorescente usando I-Blot sistema de imagem Odyssey LI-COR transferência rápida e
1. Preparação da Amostra
- Tampão de selecção / preparação
- Escolher um tampão de extracção apropriado para homogeneização da amostra e assegurar que o tampão é compatível com todas as técnicas de jusante para ser empregue. Preparar um tampão de extracção: tampão RIPA (25 mM Tris-HCl (pH 7,6), NaCl 150 mM, 1% de NP-40, desoxicolato de sódio a 1%, SDS a 0,1%) contendo 5% de cocktail inibidor de protease à amostra antes do isolamento.
NOTA: Existem muitos tipos diferentes de tampões de extracção disponíveis e são seleccionados dependendo da localização da proteína de interesse dentro da célula. Estas incluem, mas não estãolimitado a tampão RIPA (célula inteira, mitocondrial e componentes nucleares), NP-40 a tampão de lise (de células inteiras ou ligados à membrana) e Tris-Triton (citoplasmática ligado esquelético). No entanto, alguns detergentes químicos dentro buffers de extração pode ajudar a solubilizar ou até mesmo desativar uma proteína, mas pode interferir com a determinação de proteína ao usar um ensaio de determinação de proteínas específicas, ou seja, ácido bicinconínico (BCA) ensaio. Confira as orientações do fabricante quanto à compatibilidade química com o ensaio.
- Escolher um tampão de extracção apropriado para homogeneização da amostra e assegurar que o tampão é compatível com todas as técnicas de jusante para ser empregue. Preparar um tampão de extracção: tampão RIPA (25 mM Tris-HCl (pH 7,6), NaCl 150 mM, 1% de NP-40, desoxicolato de sódio a 1%, SDS a 0,1%) contendo 5% de cocktail inibidor de protease à amostra antes do isolamento.
- Extracção de proteínas / solubilização
- Macerar manualmente a amostra de tecido com uma tesoura e / ou bisturi, seguido de homogeneização utilizando quer um dounce ou um homogeneizador elétrico portátil com uma ponta de polipropileno no tampão de extração preparada em aproximadamente 1:10 w v (volume de peso de tecido / tampão) / até um homogeneizado lisa / consistente é produzido.
NOTA: Para menores, precioso / difícil obter amostras, extrações de detergente com base can ainda ser eficaz para baixo para 1: 5. - Poste homogeneização, centrifugação de amostras a 20.000 xg durante 20 min a 4 ° C. Retirar o sobrenadante contendo as proteínas solubilizadas e armazenar a -80 ° C até serem necessárias. Guarde pelotas insolúveis para permitir a extracção ainda mais rigorosa, se necessário mais tarde. Proceder à proteína determinação passo 1.3.
- Macerar manualmente a amostra de tecido com uma tesoura e / ou bisturi, seguido de homogeneização utilizando quer um dounce ou um homogeneizador elétrico portátil com uma ponta de polipropileno no tampão de extração preparada em aproximadamente 1:10 w v (volume de peso de tecido / tampão) / até um homogeneizado lisa / consistente é produzido.
- Determinação de proteínas
- Determinar a concentração de proteína no interior de cada amostra extraída usando qualquer um BCA, Bradford ou ensaio semelhante. Ao calcular a curva padrão, garantir que o coeficiente de determinação de relação, o valor de R-quadrado, é maior do que ou igual a 0,99, que reflecte a determinação mais precisa da abundância de proteínas dentro das amostras 15.
Observação: Todas as amostras a ser comparadas por QFWB deve ser ensaiada contra a mesma curva padrão.
- Determinar a concentração de proteína no interior de cada amostra extraída usando qualquer um BCA, Bradford ou ensaio semelhante. Ao calcular a curva padrão, garantir que o coeficiente de determinação de relação, o valor de R-quadrado, é maior do que ou igual a 0,99, que reflecte a determinação mais precisa da abundância de proteínas dentro das amostras 15.
- Preparação da amostra
- Planejar e registrar a ordem de carregamento de escadas e amostras de 2 g idênticoels: 1 de gel de sílica para transferência e 2 como um controlo de carga. Carregue o controle e amostras "tratados" sequencialmente para evitar qualquer viés que poderia surgir com a transferência de pobre ou inequívoca.
- Calcula-se o volume de proteína necessária para cada amostra. Uma carga de proteína padrão para detectar proteínas neuronais em isolados é de 15 ug. Faça de cada amostra para um volume de 10 mL com dH 2 O. Adicionar 5 uL de tampão de carga, de vórtice e aquecimento a 98 ° C durante 2 min.
- Incluir uma amostra de controlo positivo, tal como uma proteína recombinante para auxiliar na identificação da banda correcta de interesse. No entanto preparar a amostra de controlo positivo correctamente a seguir as orientações do fabricante para evitar a selecção das bandas erradas. Veja a Figura 1.
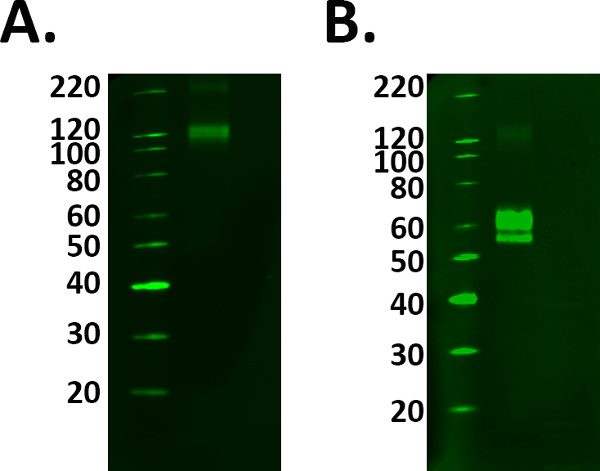
Figura 1. Pseleção de controle ositive. A adição de controlos positivos para uma experiência confirma a rotulagem detectado é real. No entanto, deve ser tomado cuidado para assegurar seu controle está funcionando corretamente antes de usar amostras experimentais. TREM A) proteína Fusion 2 foi carregado em as orientações do fabricante de 1 mg / ml, no entanto, a rotulagem observado em 110 kDa conflitos com a folha de dados previsto molecular peso de 60-70 kDa. B) Após a adição e incubação com o agente redutor, a marcação de proteínas de fusão foi detectada no peso molecular previsto. No entanto, isso significou uma carga maior de proteína foi necessária como o processo de redução diminuiu o sinal da proteína.
2. Separação eletroforética de proteínas
- Preparação de 4-12% de gel de Bis / Tris (1,0 mm)
NOTA: géis de gradiente são usados para produzir uma maior separação de proteínas através de uma ampla faixa de peso molecular.- Selecionar e preparar MESou MOPS tampão de corrida (1 L por tanque), diluindo com dH 2 O. Tampão MES produz melhor resolução de proteínas dentro de 3,5-160 kDa enquanto MOPs tampão de corrida é o preferido para detectar proteínas de maior peso molecular acima de 200 kDa porém terá mais pobre resolução de proteínas de baixo peso molecular abaixo de 15 kDa.
- Remover o pente e tira de fita adesiva que cobre o pé do gel. Delicadamente, lave os poços com tampão de corrida utilizando uma pipeta de 1 ml. Preencha os poços com tampão de corrida e garantir que não haja bolhas de permanecer no gel.
- Gel preparação e carregamento
- Insira os géis para o tanque e encher o compartimento de gel, entre com tampão de corrida para garantir todos os selos estão a funcionar eficazmente.
- Adicione 3 mL de padrão de peso molecular para o primeiro poço em gel e um gel 2. Coloque 10 ml de cada amostra em poços subsequentes.
NOTA: Com exceção das escadas, gel 1 & 2 gel devem ser idênticos. É imperativo thno padrão de peso molecular pré-corado usado para gel 2 é azul e visíveis ao usar uma mancha de proteína total, a fim de ser visível no canal 700 da Odyssey imager. - Uma vez que ambos os géis são carregados, encher o tanque com o restante tampão de corrida e fixar a tampa.
- Eletroforese
- "Run" o gel a 80 V durante 4 minutos para assegurar que a amostra entra na matriz de gel de poliacrilamida de uma forma uniforme. Depois disso aumentar a tensão e tempo para 180 V durante 50 min, respectivamente, ou até que o corante de amostra pode ser visto no pé do gel.
NOTA: Superior tensões pode ser aplicada para alcançar tempos de execução curtos. No entanto, isto pode resultar em géis de "sorriso", onde as amostras médias dos géis rodam mais rapidamente do que as amostras de pista exteriores causadas por um aumento da temperatura de 14.
- "Run" o gel a 80 V durante 4 minutos para assegurar que a amostra entra na matriz de gel de poliacrilamida de uma forma uniforme. Depois disso aumentar a tensão e tempo para 180 V durante 50 min, respectivamente, ou até que o corante de amostra pode ser visto no pé do gel.
3. Stain total de proteínas no gel Carregando Controle
- Gel Release 2 da cassete usandouma faca de gel. Remover os poços e o pé do gel. Marque o gel para auxiliar orientação.
- Decantar aproximadamente 30 ml da mancha de proteína numa placa de Petri quadrado (tamanho aproximado de 12 x 12 cm). Coloque gel 2 na mancha de proteína, garantindo a solução cobre todo o gel, em seguida, agitar o gel por um mínimo de 1 hora à temperatura ambiente para corar.
- Decantar a mancha de proteína e lavar as 3x gel em água destilada antes de visualização. Avance para o passo 6.3 para visualizar.
4. I-Blot Semi Dry Transferência rápida Protein
NOTA: Todos os reagentes necessários para a transferência de proteína usando a máquina I-Blot produtos comerciais são especificamente concebidos para a metodologia I-Blot e pode ser encontrado na Lista de Materiais.
- Prepare a pilha de transferência "fundo". Retire a tampa de alumínio e pré-molhado com tampão de corrida direto do tanque de gel. Papel de filtro pré-molhado com água destilada.
- Repita o passo 3.1 e lugar para um gela pilha preparado transferência "fundo".
- Coloque o papel de filtro pré-molhada sobre o gel. Enrole o papel filtro e gel para garantir que não haja bolhas estão presos entre as camadas.
- Retire a tampa da folha da pilha de transferência superior e colocar a pilha superior em cima do papel de filtro e pilha de fundo. Role a transferência pilha "sanduíche" para eliminar as bolhas de ar.
- Inserir a esponja a partir do kit de transferência da pilha sobre a tampa da máquina I-Blot. Coloque o sanduíche de transferência de pilha para o espaço dedicado na máquina I-Blot, em seguida, feche a tampa firmemente. Comece o I-Blot e transferir para 8,5 min no programa 3.
- Se houver um sinal de proteína de baixo ou de alto desiguais: relações de proteínas de baixo peso molecular, testar o tempo de transferência do fabricante ao utilizar um método de transferência semi seca "rápido". Executar um protocolo de optimização simples usando repetições de amostra de carga idêntica para determinar a combinação ideal de tensão / tempo de transferência como pode ser visto na Figura 2 .
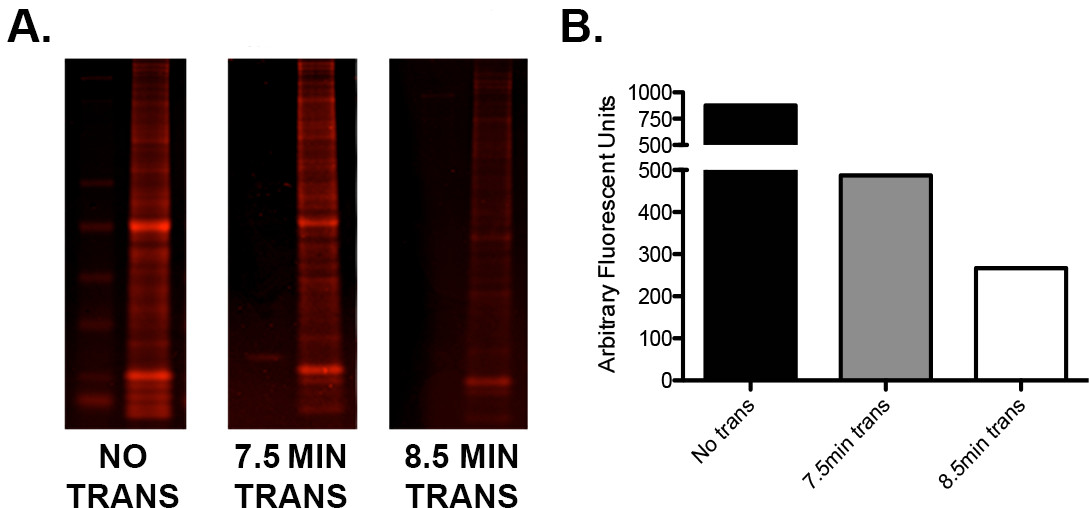
Figura 2. Optimização de transferência usando o I-Blot. A) Uma única carregada com gel de escada e 15 ug de homogeneizado de cérebro inteiro de murino em três repetições em tandem foi cortada em três secções. Uma seção não foi transferido, um foi transferido para 7,5 min (de acordo com as orientações do fabricante) e um para 8,5 min. As secções de gel foram então coradas com o corante azul de proteína instantâneo, um gerador de imagens digitalizadas no infravermelho no canal 680 e quantificados. B) Representação gráfica dos valores de quantificação que demonstram a diferença no teor de proteína residual de cada gel seguinte 0, 7,5, e 8,5 min da transferência. Note-se que um minuto adicional de tempo de transferência resultou na transferência de proteína adicional de cerca de 45%."target =" _ e.com/files/ftp_upload/52099/52099fig2large.jpg blank "> Clique aqui para ver uma versão maior desta figura.
5. Detecção de Anticorpos de Proteínas
- Preparação da membrana e bloqueando
- Remover de transferência da pilha a partir da máquina I-Blot. Retirar a camada superior de papel de filtro e expondo o gel sobre a pilha de transferência inferior.
- Corte em torno do gel com um bisturi e assegurar que um corte triangular para fins de orientação é representada sobre a membrana. Após corte de membrana, proteínas manchar o gel para verificar a eficiência da transferência e / ou descartar.
- Rapidamente mover a membrana para um tubo de 50 ml limpo (ou recipiente equivalente) contendo 5 ml de PBS 1x e colocar sobre um rolo mecânico (ou plataforma orbital) durante agitação constante.
NOTA: É fundamental que a membrana não é permitida a secar. Durante a transferência semi-seca a membrana vai ficar quente. Espere 2 minutos antes de abrir a pilha de transferência, pois isso vai permitir que eut para esfriar e tempo de secagem lento durante pilha desconstrução. Uso de um rolo de tubo e para a agitação durante lavagens e incubações permite a redução significativa dos volumes de soluções requeridas. - Lava-se a membrana 3 x 5 min em PBS 1x. Descartar o 1x PBS e bloquear a membrana com tampão de bloqueio não diluído por um período mínimo de 30 min à temperatura ambiente.
- Preparação de anticorpo primário.
- Prepare o anticorpo primário de acordo com as orientações do fabricante em 5 ml de tampão de bloqueio com 0,1% de Tween 20. Incubar a membrana com o anticorpo primário preparado durante a noite a 4 ° C com agitação constante.
NOTA: O tampão de bloqueio é geralmente utilizado não diluído mas pode ser diluído até 1: 4 com PBS, se o anticorpo primário tem elevada especificidade suficiente. - Descartar o anticorpo primário e lava-se a membrana 6 vezes durante 5 min cada com PBS 1x.
- Prepare o anticorpo primário de acordo com as orientações do fabricante em 5 ml de tampão de bloqueio com 0,1% de Tween 20. Incubar a membrana com o anticorpo primário preparado durante a noite a 4 ° C com agitação constante.
- Secundária seleção anticorpo & preparação
- Para secoNdary apenas rotular avaliação para fins de controle, omitir as etapas 5.2.1 e 5.2.2 acima e siga para o passo 5.3 para determinar os padrões de bandas secundárias específicas de amostra. Veja a Figura 3.
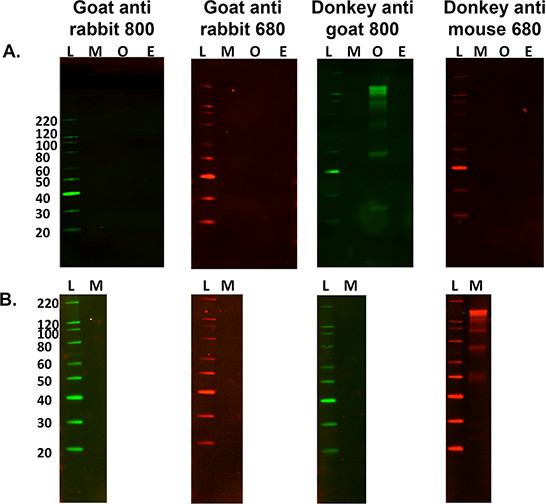
Figura 3. Optimização de anticorpos secundários. A) Uma comparação múltiplas espécies de rotulagem única secundária não específica contra 15 ug de murino (M), ovinos (O) e (E) Equine homogeneizados de tecidos nervosos com uma variedade de anticorpos secundários etiquetados fluorescentes . L é a escada de peso molecular. Homogeneizado de tecido ovina foi a única amostra para reagir de forma cruzada com a rotulagem secundário quando se utiliza burro anti-cabra anticorpo 800. B) É também importante averiguar se marcação não-específica ocorre quando se utiliza uma amostra de tecido diferente, ou seja, músculo do gastrocnémio de murino (15 _6; carga g). Esta cruz amostra reage com o anticorpo secundário anti-rato burro 680, no entanto isso não ocorrer ao usar homogeneizado cérebro do rato.
- Prepare o fluorescente etiquetado anticorpo secundário 680 ou 800 (vermelho ou canal verde) após fabricante recomenda concentrações em tampão de bloqueio com 0,1% de Tween 20. Incubar a membrana no escuro com o anticorpo secundário preparado durante 90 minutos à temperatura ambiente com agitação constante.
- Descartar o anticorpo secundário e lava-se a membrana 6 vezes durante 5 minutos por lavagem com PBS 1x. Prossiga para a etapa 6 - visualização.
- Se a visualização de marcadores não está funcionando como esperado, escadas exame com uma gama de anticorpos secundários como um passo adicional adequado. Nem todos os anticorpos secundários permitir a visualização de todas as faixas marcadas em todas as escadas disponíveis no mercado.
- Se as bandas esperadas não são visíveis, use um host secundário alternativa, ou seja, donkcoelho anti ey versus anti coelho de cabra representa uma modificação do protocolo adequado. Ver Figura 4. Espécies hospedeiras utilizadas para levantar um anticorpo secundário pode ocasionalmente causar um problema com a visualização devido à falta de especificidade para os anticorpos primários específicos.
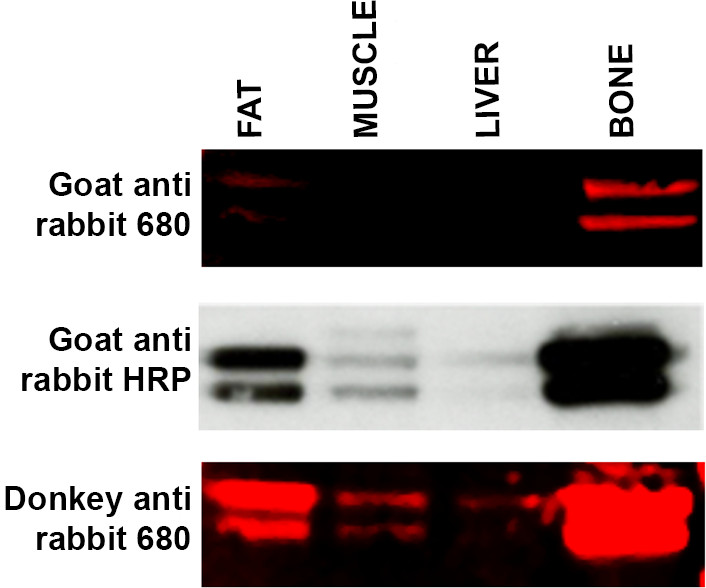
Figura 4. Solução de especificidade de anticorpo secundário de Western blot de uma gama de amostras de tecido (15 ug de proteína por pista) -. Gordo, músculo, fígado e nos ossos - incubadas com anticorpo primário de ERK e incubadas com três anticorpos secundários diferentes. Painel superior: WB cabra marcado com LI-COR anti-anticorpo secundário de coelho 680 produzido fraca marcação de gordura e ossos e nenhum sinal foi detectado nas amostras de fígado e músculo. Painel central: Membrana (a partir do painel superior) foi despido e reprObede utilizando metodologia ECL e cabra HRP anti-coelho ligado secundário. Bandas são agora visíveis em amostras de músculo e fígado e rotulagem parece mais intenso nas amostras de gordura e osso. Painel inferior: Membrana (a partir do painel superior e médio) foi despido e sondado utilizando LI-COR Donkey anti-coelho 680 anticorpo secundário que tem mostrado uma maior afinidade com o anticorpo primário ERK. Rotulagem de músculo e no fígado é agora visível com o aumento da intensidade do sinal a partir de amostras tanto de gordura e osso. Por favor clique aqui para ver uma versão maior desta figura.
6. Visualization
NOTA: Todas as imagens são adquiridas usando o gerador de imagens LI-COR Odyssey clássico e Imagem associada software de análise Pro (versão 3.1.4).
- Ligue e faça logon no computador e imager. Abra o software de imagem e criar um novo arquivo. Veja a Figura 5.
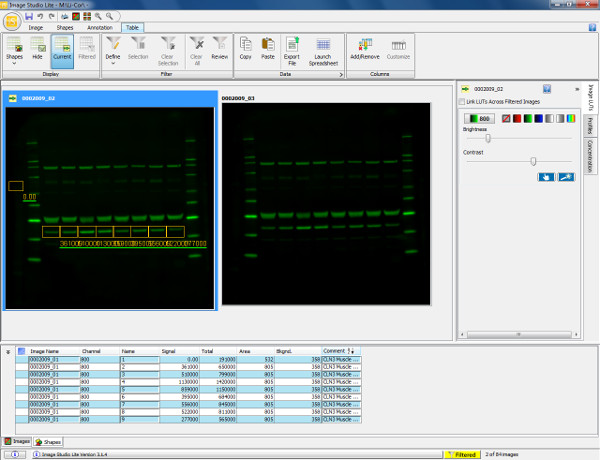
Figura 5. A visualização e quantificação de western blot. Digitalização de um western blot mostrando músculo do gastrocnémio de murino (30 ug de carga) sondado com anexina V de anticorpo primário (36 kDa) e de cabra anti-coelho 800 de anticorpo secundário. A membrana foi digitalizado e visualizado no canal 800. Para quantificar a proteína (anexina V), uma caixa retangular é desenhada em torno da banda de interesse da amostra 1. Este é então copiado e colado sobre as pistas de amostras restantes para assegurar a medição da mesma área. O fundo é automaticamente representaram em torno da forma desenhada, mas isto pode ser alterado para garantir a medição do fundo é definida com precisão. A tabela abaixo mostra as medições quantificáveis de cada forma desenhada incluindo sinal total obtido, fundo e sinal com fundo subtraído. Esta informação pode então ser exportados para umprograma de planilha para calcular índices de expressão (como determinado pela intensidade de fluorescência relativa) e permite análises estatísticas subseqüentes a serem realizadas. Por favor clique aqui para ver uma versão maior desta figura.
- Abra a tampa do gerador de imagens. Despeje uma pequena quantidade de PBS 1x para o vidro no canto inferior esquerdo e em seguida, coloque a membrana no topo da PBS. Assegurar a membrana é um quadrado com o eixo sobre o gerador de imagens e de 1 cm lacuna é deixado entre a membrana e o eixo de grade.
- Role a membrana para assegurar não haja bolhas entre o vidro e a membrana.
- Contar o número de quadrados da membrana ocupa no eixo x e y. Fechar a tampa do gerador de imagens. Digite o número de quadrados da membrana ocupa no software de computador.
- Escolher o canal apropriado para digitalizar a membrana que irá depender da etiqueta fluorescentedo anticorpo secundário, ou seja, 700 de canal ou canal 800, quando um anticorpo fluorescente marcado com 680 ou 800 tenha sido usado respectivamente. Quando etiquetagem dupla é levada a cabo, digitalizar em ambos os canais.
NOTA: Otimizar rotulagem proteína única antes da realização rotulagem dupla. - Selecione a intensidade a varredura da membrana, se uma proteína de alta abundância usar uma digitalização de baixa intensidade. Alternativamente, se o anticorpo primário tem pouca afinidade para a proteína de interesse selecionar uma varredura maior intensidade, ou seja, o nível 5. Prima start para iniciar a digitalização. Avance para o passo 6.4.
- A visualização do gel de controlo de carga (Figura 6).
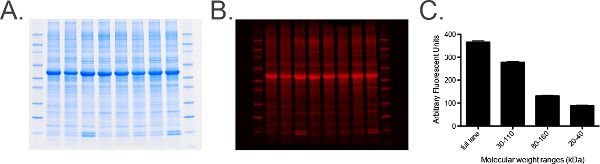
Figura 6. A proteína total rotulagem e análise. A) fotografia de um gel de proteína total marcado contendo 20 ug de homogeneizado de gânglios cervicais equina por pista. B) Gel de painel Adigitalizado no Gráfico 680 canais. C) das medições quantificados a partir do gel de proteína total manchado obtido usando software de imagem. Uma gama de medições determinadas por meio de marcadores de peso molecular, ou seja, 30-110 kDa, são levados para proporcionar um histograma de medições para assegurar o erro padrão (SEM) é baixo (das amostras agrupadas), indicando que os níveis de proteína total em cada amostra são uniformes em todo o gel. Por favor clique aqui para ver uma versão maior desta figura.- Siga os passos 6.1 e 6.2.
- Despeje água destilada sobre o vidro no canto inferior do gerador de imagens onde o eixo da grade começa.
- Colocar o gel no topo da água e assim por manobrar as pistas são perpendiculares a qualquer dos eixos x ou y da grade. Deixar o intervalo de 1 cm entre a parte x e eixo y da grelha e do gel e contar o número de quadrados que ocupa o gel sobre o eixo da grade. Pertoda tampa do gerador de imagens.
- Digite o número de quadrados o gel ocupa no software de computador.
- Selecione o canal 700 para digitalizar o gel de proteína total manchada.
NOTA: azul fluorescente no canal 700. - Defina a intensidade de 5 e começar a pressionar.
- Quantificação da imagem digitalizada
- Ajuste os botões de brilho e contraste para produzir a melhor qualidade de imagem. Se parece haver elevado ruído de fundo, verificar novamente a membrana em uma intensidade menor e usar a configuração de varredura de alta qualidade.
NOTA: Quaisquer ajustes não irá alterar os dados fluorescentes adquiridas durante a digitalização. - Gire imagens de 90 °, 180 ° e 270 °, a fim de visualizar na orientação desejada sem alteração para os dados adquiridos. No entanto, ao fazer pequenos ajustes de orientação em "rotação livre", por maior que 3 °, os dados adquiridos em valores pixilation pode ficar distorcida e, portanto, afetar os resultados de quantificação.
- Selecione uma forma no menu de formatos - use um retângulo na maioria dos casos - e desenhar em torno da banda de interesse (WB) ou toda a pista (gel de proteína total) na amostra pista 1.
- Copie e cole a forma em toda a amostra pista 2 banda de interesse ou toda pista. Repita em cada banda individual de interesse para cada amostra e cada pista para géis de proteínas totais.
- Verifique se a medida de fundo não incorpora um sinal na pista ao lado. O fundo pode ser deduzido automaticamente pelo software e abranger borda inteira em torno da forma desenhada ou pode ser especificado para ser superior / inferior ou à esquerda e à direita da forma. Como alternativa, designar uma caixa de fundo definida pelo usuário.
- Apresentar o sinal para a mesa formas para cada forma desenhada em unidades fluorescentes arbitrárias. O fundo será automaticamente deduzido do sinal.
- Exporte a imagem como um arquivo TIF para ver em software diferente. Não exportar a imagem e manipular using não imagem pro software pois isso irá alterar os dados originais adquiridos pelo imager gerar dados falsos.
- Repita os passos 6.4.3-6.4.7 ao quantificar rotulagem dupla ou a realização de múltiplas medições em géis de controle de carga para gerar e ordenar os dados de erro padrão.
- Ajuste os botões de brilho e contraste para produzir a melhor qualidade de imagem. Se parece haver elevado ruído de fundo, verificar novamente a membrana em uma intensidade menor e usar a configuração de varredura de alta qualidade.
7. Pós Visualization
- Manter as membranas em 1x PBS ou secar para armazenamento a longo prazo para o futuro re-sondagem das membranas de separação e para outras proteínas de interesse.
- Decapagem e re-sondagem de membranas. Veja a Figura 7.
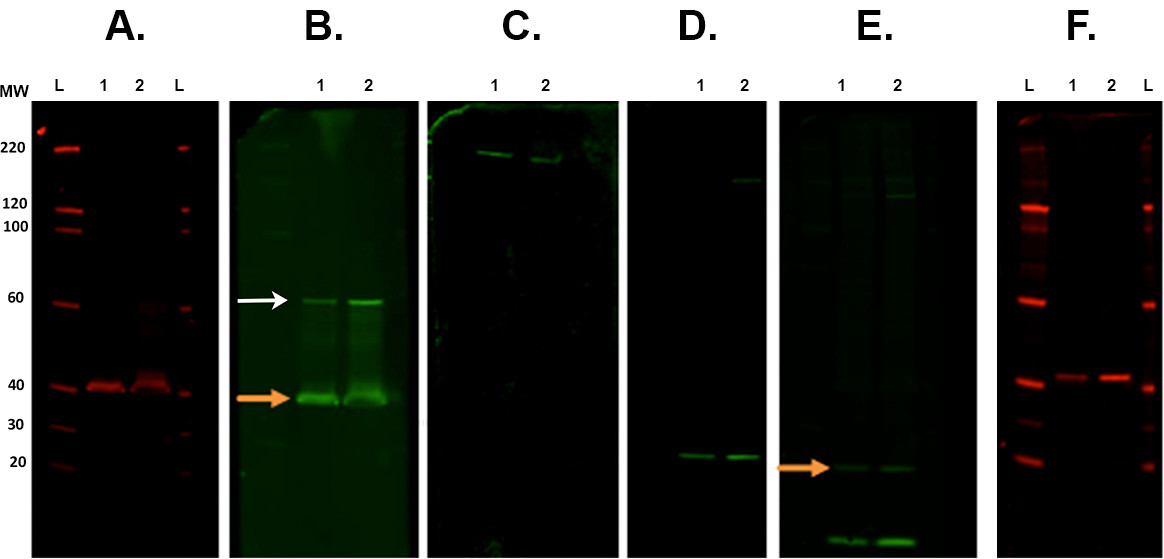
Figura 7. Membrana decapagem e reprobing. Exemplos representativos de membranas seguintes várias etapas de decapagem digitalizados com um sistema de imagem por infravermelho. A. O primeiro imunodetecção foi realizada com CSP anticorpo primário (coelho) e digitalizado em 700 canais. B. Primeira decapagem e reprobing com rock2 (coelho) com 800 canais. Seta laranja indica restante CSP anticorpo primário presente após a tira e re-sonda. Isto não afecta a medição de rock2 como a banda está presente com um peso molecular mais elevado (seta branca). C. Segundo decapagem e sondado com β-Espectrina anticorpo (cabra) e visualizado no canal 800. D. Terceiro decapagem e reprobing com anticorpo α-sinucleína (coelho). E. Quarta decapagem e reprobing com anticorpo ubiquitina (mouse) com 800 canais. Ainda há sinal remanescente a partir do último anticorpo (α-sinucleína. Seta laranja). F. Quinta decapagem e reprobing com anticorpo CALB2 (coelho) fotografada em 700 canais. Anticorpos secundários utilizados foram: cabra anti-rato 800cw, cabra 680rd anti-coelho, cabra 800cw anti-coelho, burro 800cw anti-cabra (ver Lista de Materiais). Rótulos Lane: L - escada, 1/260; - a amostra 1/2. Por favor clique aqui para ver uma versão maior desta figura.- Ponto de membrana (s) num prato de Petri quadrado que contêm cerca de 30 ml de tampão de extracção e Revitablot são incubadas entre 5-20 min à temperatura ambiente com agitação constante.
- Lava-se a membrana (s) 3 vezes em PBS, em seguida, verificar novamente sobre o gerador de imagens para assegurar a remoção completa de fluorescência ocorreu - este passo deve ser repetido depois de cada tira.
- Incubar membrana (s) por períodos mais longos se fluorescência permanece. Digitalize novamente a membrana depois de cada faixa para confirmar que não há nenhum sinal secundário restante.
NOTA: Membrana (s) só deverá ser descascado e sondado um máximo de 3 vezes, a fim de garantir que a integridade da membrana não foi comprometida, resultando em alta fundo indesejável a relação sinal.
Resultados
Como a sensibilidade QFWB ea faixa linear de detecção é maior do que a detecção ECL convencional, há uma série de medidas de controle que são cruciais para garantir que os dados precisos são coletadas, auxiliando, assim, a interpretação eficaz. Em primeiro lugar, a inclusão de amostras de controlo positivo, como mostrado na Figura 1. Em segundo lugar, a optimização da transferência para garantir a circulação equivalente de proteínas de alto e baixo peso molecular a partir do gel para a membrana como exibido na Figura 2. Em terceiro lugar, a optimização de anticorpos, especialmente secundário anticorpos cuja otimização é muitas vezes esquecido, mas que pode produzir não-específico de bandas capazes de interferir com a interpretação correta de proteína (s) de interesse. Ver Figura 3. Em quarto lugar, pode também ser o caso quando uma proteína que aparece indetectável mas espera-se estar presente, este também pode ser um problema de anticorpo secundário, que pode ser corrigido simplesmente usando um rais secundáriased em uma série de espécies diferentes. Ver Figura 4. Em quinto lugar, a rotulagem de proteína total e análise é um método muito mais robusta e quantificáveis, em comparação com a utilização de proteína única tradicional (s) que são ubiquamente expresso para os padrões internos de referência 3. Muitas destas proteínas individuais foram encontrados para ser diferencialmente expressos em modelos de doenças neurodegenerativas, bem como entre diferentes amostras de tecido e a uniformidade de expressão pode alterar dentro do mesmo tecido 3. Por conseguinte, a produção de um gel de controlo de carga irá confirmar a uniformidade da carga de amostra, quando combinada com uma análise de proteína total por comparação e quantificação da carga de proteína em cada pista em várias gamas de pesos moleculares medidos contra cada amostra para indicar o erro padrão como demonstrado na Figura 6 . É importante ressaltar que todas essas técnicas e controles de resolução de problemas são apenas tão eficazes quanto a sensibilidade e coerência da análise tools aplicadas pelo operador (Figura 5). Finalmente esta técnica presta-se a extracção e re-sondagem das membranas com mais flexibilidade do que a ECL devido a factores incluindo, mas não limitado a sensibilidade aumentada, reduzida fundo, detecção dupla de cor e a estabilidade da membrana em condições de armazenagem a longo prazo. Veja a Figura 7.
Discussão
Consideração e planejamento Devido é essencial antes de qualquer experiência e pode, finalmente, determinar o sucesso da técnica utilizada. Os avanços na detecção de proteínas utilizando WB pode apresentar uma infinidade de potenciais obstáculos ao tentar escolher os anticorpos, métodos de transferência e visualização apropriado para uso. Felizmente, usando uma lista de verificação cuidadosa e medidas de controlo adequadas QFWB pode ser usado rotineiramente para determinar a presença de proteínas e diferenças de expressão cada vez mais sutis entre amostras. Este protocolo fornece um guia completo para transferência western quantitativa fluorescente, bem como algumas estratégias de resolução de problemas para evitar e / ou superar algumas das muitas armadilhas comuns associados.
As etapas críticas empregadas para manter a sensibilidade e obter medições verdadeiramente quantificáveis e comparáveis incluem: 1) a extração de proteínas a partir de amostras de tecido robusto; 2) a preparação da amostra; 3) loadin proteína precisasg determinada por análise das proteínas totais; 4) transferência óptima de proteínas, utilizando I-Blot; 5) a preparação de anticorpos primários e secundários em tampão contendo 0,1% de Tween 20 de bloqueio, e 6) correcta visualização e de análise utilizando um gerador de imagens de infravermelhos e software associado.
Detecção fluorescente no infravermelho é verdadeiramente quantitativa e proporciona maior sensibilidade em comparação com técnicas de detecção mais tradicionais ECL 3,11. Este sistema de detecção é multi facetada, e como tal não está limitado a QFWB. Este sistema é capaz de imagens de rotulagem imuno em baixa potência, permitindo a visualização e quantificação de seções inteiras de tecidos 12. Esta é uma área de desenvolvimento potencial futuro em termos de resolução, que podia ver imagens muito vermelho rivalizando com captura de imunofluorescência convencional com microscópios convencionais em termos de avaliação quantitativa.
No entanto, com maior sensibilidade a mudanças sutis na protein expressão é fundamental para garantir a variabilidade é mantido a uma série de medidas mínimas e controle são rigorosos com os protocolos robustos. Isto começa com a extracção de proteínas rigorosa a partir da amostra de tecido seguido de produção de proteína total géis corados para proporcionar uma garantia de que o carregamento da amostra é uniforme, a optimização de anticorpos primários e secundários, a fim de determinar se a detecção é real e testando as orientações do fabricante no que diz respeito à transferência vezes para se obter a proteína de transferência eficiente.
No entanto, mesmo quando são otimizadas condições para a WB, pode ainda problemas associados à execução westerns que podem não ter sido totalmente exploradas aqui. Estas incluem, mas não estão limitados a factores incluindo a solubilização e escolha de tampão de extracção de proteína. Alguns buffers possam interferir com os ensaios de concentração de proteína, e alguns tecidos são particularmente difíceis de solubilizar, exigindo técnicas mais robustos, tais como o uso de macera automatizadoting selados recipientes, como tubos M, juntamente com um Dissociator Macs. Além disso, medidas de controlo simples, para o armazenamento de material extraído e não extraído à temperatura de -80 ° C pode ser a diferença entre a obtenção de rotulagem óptimo imediatamente depois da extracção e tendo resultados pobres semanas mais tarde.
Métodos QFWB modernos são provou ser mais sensível para captar sutis diferenças na expressão de proteínas e são mais versáteis permitindo dupla marcação simultânea 3 quando comparado às técnicas mais antigas, como ECL. É vital que os protocolos de transferência Western são robustos e facilmente reproduzíveis para a quantificação exata e análise estatística. Este protocolo é sensível e robusto o suficiente para ser usado rotineiramente para a detecção de proteínas através de uma variedade de amostras de tecido diferentes espécies e 3 e permite a quantificação de proteínas de baixa e alta abundância no interior da mesma QFWB, por conseguinte, reduzindo o uso de consumíveis, bem como o tempo por um experimento. 1 Além disso, o aumento da sensibilidade desta técnica permite a validação de cada vez mais popular - estudos econó- 9,14 porém a precisão é crucial e inclusão de medidas de controlo adequadas devem ser respeitados evitando assim a aquisição de dados errôneos.
Divulgações
The authors have nothing to disclose.
Agradecimentos
Gostaríamos de agradecer a seguinte para o apoio financeiro: Instituto BBSRC Financiamento Programa Estratégico - CF & TMW; Financiamento BBSRC Leste Bio DTP - LG; O Darwin Trust of Edinburgh - MLH. Gostaríamos também de agradecer o Dr. Barry McColl permissão para incluir a otimização TREM2 neste manuscrito.
Materiais
| Name | Company | Catalog Number | Comments |
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| RIPA Buffer | Fisher Scientific UK Ltd | 10230544 | |
| M Tubes | Miltenyi Biotec Inc. | 130-093-236 | |
| iBlot Transfer Stack, PVDF Regular | Life technologies, UK | IB401001 | |
| MagicMark XP Western Protein Standard (20-220 kDa) | Life technologies, UK | LC5602 | Use in gel 1 for Western blotting |
| SeeBlue Pre-stained protein standard | Life technologies, UK | LC5625 | Use in gel 2 Total protein stained gel |
| NuPAge LDS Sample buffer 4X | Life technologies, UK | NP0007 | |
| NuPAGE MES SDS Running Buffer (for Bis-Tris Gels only) (20X) | Life technologies, UK | NP0002 | |
| NuPAGE Novex 4-12% Bis-Tris Gel 1.0 mm, 12 well | Life technologies, UK | NP0322BOX | |
| PHOSPHATE BUFFERED SALINE TABLET,*TRU-ME, PHOSPHATE BUFFERED SALINE TABLET | Sigma-Aldrich, UK | P4417-100TAB | |
| Micro BCA, Protein Assay Kit | Fisher Scientific UK Ltd | 10249133 | |
| Odyssey blocking buffer | Li-Cor Biosciences | P/N 927-40000 | |
| IRDye 680RD Goat anti-Rabbit IgG (H+L), 0.5 mg | Li-Cor Biosciences | 926-68071 | |
| IRDye 680RD Donkey anti-Mouse IgG (H+L), 0.5 mg | Li-Cor Biosciences | 926-68072 | |
| IRDye 800CW Goat anti-Rabbit IgG (H + L), 0.5mg | Li-Cor Biosciences | 926-32211 | |
| IRDye 800CW Donkey anti-Goat IgG (H + L), 0.5mg | Li-Cor Biosciences | 926-32214 | |
| ODYSSEY CL Infra-red imager | Li-Cor Biosciences | Call for quotation | |
| iBlot 7-Minute Blotting System | Life technologies, UK | This model is no longer in production | |
| InstantBlue Protein stain | Expedeon, UK | ISB1L | |
| Revitablot western blot stripping buffer | Rockland Immunochemicals Inc. | MB-085-0050 |
Referências
- Towbin, H., Staehelin, T., Gordon, J. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. Biotechnology. 1992 (24), 145-149 (1979).
- Walker, J. M. . Protein Protocols on CD-ROM. , (1998).
- Gallagher, S., Winston, S. E., Fuller, S. A., Hurrell, J. G. Immunoblotting and immunodetection. Curr Protoc Mol Biol. Chapter. 10, 10 (2008).
- Eaton, S. L., et al. Total protein analysis as a reliable loading control for quantitative fluorescent Western blotting. PLoS One. 8 (8), 72457 (2013).
- Suzuki, O., Koura, M., Noguchi, Y., Uchio-Yamada, K., Matsuda, J. Use of sample mixtures for standard curve creation in quantitative Western blots. Exp. Anim. 60, 193-196 (2011).
- Colella, A. D., et al. Comparison of Stain-Free gels with traditional immunoblot loading control methodology. Anal Biochem. 430 (2), 108-110 (2012).
- Zellner, M., et al. Fluorescence-based Western blotting for quantitation of protein biomarkers in clinical samples. Electrophoresis. 29, 3621-3627 (2008).
- Kielar, C., et al. Molecular correlates of axonal and synaptic pathology in mouse models of Batten disease. Hum Mol Genet. 18, 4066-4080 (2009).
- Mutsaers, C. A., Lamont, D. J., Hunter, G., Wishart, T. M., Gillingwater, T. H. Label-free proteomics identifies Calreticulin and GRP75/Mortalin as peripherally accessible protein biomarkers for spinal muscular atrophy. Genome Med. 5 (10), 95 (2013).
- Wishart, T. M., et al. Dysregulation of ubiquitin homeostasis and β-catenin signaling promote spinal muscular atrophy. J Clin Invest. 124 (4), 1821-1834 .
- Mathews, S. T., Plaisance, E. P., Kim, T. Imaging systems for westerns: chemiluminescence vs. infrared detection. Methods Mol Biol. 536, 499-513 (2009).
- Hawes, J. J., Brunzell, D. H., Wynick, D., Zachariou, V., Picciotto, M. R. GalR1, but not GalR2 or GalR3, levels are regulated by galanin signalling in the locus coeruleus through a cyclic AMP-dependent mechanism. J Neurochem. 93 (5), 1168-1176 (2006).
- Bond, D., Primrose, D. A., Foley, E. Quantitative evaluation of signaling events in Drosophila S2 cells. Biol Proceed Online. 10 (1), 20-28 (2008).
- Wishart, T. M., et al. Differential proteomics analysis of synaptic proteins identifies potential cellular targets and protein mediators of synaptic neuroprotection conferred by the slow Wallerian degeneration (Wlds) gene. Mol Cell Proteomics. 6, 1318-1330 (2007).
- Silva, J. M., McMahon, M. The fastest western in town: a contemporary twist on the classic western blot analysis. J. Vis. Exp. (84), 51149 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados