Method Article
A Guide to Modern Quantitative Fluoreszenz Western Blot mit Strategien zur Fehlersuche
In diesem Artikel
Zusammenfassung
The advancement of western blotting using fluorescence has allowed detection of subtle changes in protein expression enabling quantitative analyses. Here we describe a robust methodology for detection of a range of proteins across a variety of species and tissue types. A strategy to overcome common technical problems is also provided.
Zusammenfassung
Die Ende der 1970er Jahre sah die erste öffentlich berichtet Nutzung des Western-Blot, eine Technik für die Beurteilung des Vorliegens und relative Häufigkeit bestimmter Proteine in komplexen biologischen Proben. Seitdem hat Western Blot Methode sich zu einem gemeinsamen Komponente des Molekularbiologen experimentellen Repertoire. Eine oberflächliche Suche in PubMed mit dem Begriff "Western-Blot" legt nahe, dass mehr als 220.000 veröffentlichten Manuskripte Verwendung dieser Technik bis zum Jahr 2014. Wichtig ist gemacht, haben die letzten zehn Jahre technische Bild Fortschritte gekoppelt mit der Entwicklung gesehen empfindlicher Fluoreszenzmarkierungen, die Empfindlichkeit verbessert und lieferte noch größere Bereiche der linearen Detektion. Das Ergebnis ist ein jetzt wirklich quantifizierbare Fluoreszenz Western Blot (QFWB), die Biologen die Durchführung vergleichender Expressionsanalyse mit größerer Empfindlichkeit und Genauigkeit als je zuvor ermöglicht. Viele "optimiert" Western-BlotMethoden existieren und werden in verschiedenen Laboratorien verwendet. Diese erweisen sich oft als schwierig zu implementieren aufgrund der Anforderung der subtilen, aber nicht dokumentierte Verfahrensänderungen. Dieses Protokoll stellt eine umfassende Beschreibung eines etablierten und robusten QFWB Verfahren, komplett mit Fehlersuchstrategien.
Einleitung
Western Blot (WB) ist eine analytische Technik, die ursprünglich in den späten 1970er Jahren entwickelt, um die Anwesenheit oder Abwesenheit eines Proteins von Interesse in einer komplexen biologischen Probe zu bestimmen, wie ein Gewebe-Homogenat 1. Gemeinhin als Protein Immunoblot bezeichnet, aufgrund der Schlüssel Antikörper-Antigen-Wechselwirkung, die Methode besteht aus 5 Einzelschritten: 1) elektrophoretische Trennung der Proteine nach ihrem isoelektrischen Punkt; 2) Übertragung auf eine Nitrocellulose oder Polyvinylidendifluorid (PVDF) Membran; 3) Markieren mit einem primären Antikörper, der spezifisch an das Protein von Interesse; 4) Inkubation mit einem gegen den primären Antikörper gerichtet sekundären Antikörper; und 5) Visualisierung.
Visualisierung Methodik wurde mit der Zeit, um die Sicherheit und die Empfindlichkeit zu verbessern entwickelt. Einige der ersten WB wurden mit radioaktiv markierten Tags, die dann fortgeschritten, kolorimetrische und dann die weitere Verbreitung chemilluminescent (ECL) Verfahren durchgeführt. Radioactivity wurde direkt auf Sonden für spezifische Antigene markiert und ECL wohin kolorimetrische Methoden verwenden eine indirekte Markierungstechnik mit einem Enzym-Reporter, wie alkalische Phosphatase oder Meerrettich-Peroxidase-Streptavidin (HRP) 2. Die Intensität der Markierung des Chromagen oder lumineszierende Produkt wird mit Densitometrie, wobei die Signalstärke, stark oder schwach, zeigt mehr oder weniger das Vorhandensein des Proteins von Interesse in der Probe gemessen. ECL ist die empfindlicher und daher favorisierte Methode 2, aber alle drei Verfahren wurden zunächst auf einem Röntgenfilm mit anspruchsvolleren digitalen bildgebenden Verfahren nachträglich herausstellt, 3 entwickelt. Die Weiterentwicklung der digitalen Abbildung von WB nicht nur erlaubt, einen Forscher, um die Anwesenheit oder Abwesenheit der Protein von Interesse zu bestimmen, sondern auch erlaubt einen Rückschluss auf das Niveau der Expression eines ausgewählten Proteins, als gegen andere Proben verglichen und daher bezeichnet als "semi-quantitative & #8221 ;. Kürzlich wurde ein wirklich quantitative und empfindlichere Western Blotting Technik entwickelt worden, die das Niveau der Fluoreszenz gemessen wird, direkt auf die Menge und die Expression eines einzelnen Proteins in einer Probe bezogen werden: quantitative Fluoreszenz Western Blot (QFWB).
Beim Vergleich QFWB mit ECL Kennzeichnung, die Verwendung eines fluoreszierenden sekundären Antikörper erzeugt ein lineares Erfassungsprofil 4. Dies steht im Gegensatz zu ECL Techniken, bei denen Signallinearität tritt in der Regel mit niedrigen Proteinlasten unter 5 ug und Signalsättigung direkt auf Proteinexpression bezogen, dh mit ubiquitär exprimierten Housekeeping-Gene 5,6. Diese Ungleichheit wird wahrscheinlich durch eine höhere Anzahl von Bindungsstellen zur Verfügung für eine Avidin-ECL-Substrat, der einen biotinylierten sekundären binden, was zu einer höheren Wahrscheinlichkeit möglicher Signalsättigung verursacht. Dies ist einer der Hauptgründe für die ECL Basis Immunoblotting ist als ONL bezeichnety "semi-quantitative" 7. Der Sättigungspunkt des Signals ist von entscheidender Bedeutung bei der Messung von feinen Unterschieden in Expressionsniveaus und zu ungenauen Messungen führen. In den vergangenen Jahren das Aufkommen von verbreiteten Proteomiktechniken Detaillierung immer höheren Empfindlichkeit und Identifizierung von subtilen Expressionsunterschiede hat eine ständig zunehmende Abhängigkeit von wirklich quantitative Western-Blotting-Experimente zur Validierung 8,9 resultierte. Die Anwendung von empfindlichen, robust und wirklich quantitative Methodik ist daher von entscheidender Bedeutung.
Viele "optimiert" Western-Blot-Methoden wurden von unabhängigen Labors, die häufig als schwierig erweisen aufgrund subtiler methodische Anpassungen, die nicht offensichtlich in der formalen dokumentierten Protokolle sein kann zum Einrichten oder replizieren genutzt. Dies ist eine etablierte und robustes Protokoll für QFWB und zusätzlich wertvolle Strategien für die Problembehandlung gemeinsame Probleme that kann bei der Umsetzung entstehen.
Dieses Protokoll wurde ursprünglich zur Verwendung mit murinen Gehirnhomogenaten optimiert, aber seitdem effektiv über einen weiten Bereich von Gewebeproben und Arten 4,9,10 verwendet. Mögliche Protokollvarianten für spezifische Problembehandlung erforderlich sind, enthalten.
Protokoll
Dieses Protokoll wurde optimiert unter Verwendung von kommerziell hergestellten Puffer, Gele und Transferstapel, um die Variabilität zu reduzieren und die Konsistenz. Siehe Materialliste für eine vollständige Liste der Verbrauchsmaterialien benötigt.
Fluoreszierende WB-Protokoll mit I-Blot schnellen Transfer und LI-COR Odyssey-Bildgebungssystem
1. Herstellung der Probe
- Buffer Auswahl / Vorbereitung
- Wählen Sie einen geeigneten Extraktionspuffer für die Proben Homogenisierung und sicherzustellen, dass der Puffer kompatibel mit allen nachgeschalteten Techniken eingesetzt werden. Vorbereitung eines Extraktionspuffer: RIPA-Puffer (25 mM Tris-HCl (pH 7,6), 150 mM NaCl, 1% NP-40, 1% Natriumdesoxycholat, 0,1% SDS), enthaltend 5% Protease-Inhibitor-Cocktail vor der Isolierung abzutasten.
HINWEIS: Es gibt viele verschiedene Arten von Extraktionspuffer verfügbar und werden abhängig von der Stelle des Proteins von Interesse in der Zelle ausgewählt. Diese umfassen, sind aber nichtbegrenzt auf RIPA-Puffer (ganze Zelle, mitochondriale und nukleare Komponenten), NP-40 Lysispuffer (ganze Zelle oder membrangebunden) und Tris-Triton (zytoplasmatische Skelett gebunden). Jedoch können einige chemische Reinigungsmittel im Extraktionspuffer helfen, löslich oder sogar ein Protein zu deaktivieren, kann aber mit Proteinbestimmung bei Verwendung eines bestimmten Proteinbestimmung Assay, dh Bicinchoninsäure (BCA) Assay stören. Überprüfen Sie die Richtlinien des Herstellers in Bezug auf chemische Kompatibilität mit dem Test.
- Wählen Sie einen geeigneten Extraktionspuffer für die Proben Homogenisierung und sicherzustellen, dass der Puffer kompatibel mit allen nachgeschalteten Techniken eingesetzt werden. Vorbereitung eines Extraktionspuffer: RIPA-Puffer (25 mM Tris-HCl (pH 7,6), 150 mM NaCl, 1% NP-40, 1% Natriumdesoxycholat, 0,1% SDS), enthaltend 5% Protease-Inhibitor-Cocktail vor der Isolierung abzutasten.
- Proteinextraktion / Solubilisierung
- Manuell Mazerat der Gewebeprobe mit einer Schere und / oder Skalpell, gefolgt von einer Homogenisierung unter Verwendung entweder eines Dounce oder ein Elektrohand Homogenisator mit einer Polypropylenspitze in die vorbereitete Extraktionspuffer bei ungefähr 1.10 w / v (Gewebegewicht / Puffervolumen) bis eine glatte / konsistente Homogenat hergestellt wird.
HINWEIS: Für kleinere, Edel / schwer zu Proben zu erhalten, ca Waschmittel basierend Extraktionenn noch wirksam bis auf 1: 5. - Post Homogenisierung Zentrifuge Proben bei 20.000 × g für 20 min bei 4 ° C. Entfernen des Überstandes der solubilisierten Proteine und Speicher enthält, bei -80 ° C bis zur Verwendung. Bewahren unlöslichen Pellets weiter strengere Extraktion wenn höher erforderlich ermöglichen. Weiter zur Proteinbestimmung Schritt 1.3.
- Manuell Mazerat der Gewebeprobe mit einer Schere und / oder Skalpell, gefolgt von einer Homogenisierung unter Verwendung entweder eines Dounce oder ein Elektrohand Homogenisator mit einer Polypropylenspitze in die vorbereitete Extraktionspuffer bei ungefähr 1.10 w / v (Gewebegewicht / Puffervolumen) bis eine glatte / konsistente Homogenat hergestellt wird.
- Proteinbestimmung
- Bestimmen Sie die Konzentration des Proteins in jeder entnommenen Probe entweder durch Verwendung einer BCA, Bradford oder ähnlichen Test. Bei der Berechnung der Standardkurve, zu gewährleisten, dass der Bestimmungskoeffizient-Verhältnis, R-Quadrat-Wert größer als oder gleich 0,99, die die genaueste Bestimmung der Proteinmenge in den Proben 15 reflektiert.
HINWEIS: Alle Proben von QFWB Vergleich muss gegen den gleichen Standardkurve untersucht werden.
- Bestimmen Sie die Konzentration des Proteins in jeder entnommenen Probe entweder durch Verwendung einer BCA, Bradford oder ähnlichen Test. Bei der Berechnung der Standardkurve, zu gewährleisten, dass der Bestimmungskoeffizient-Verhältnis, R-Quadrat-Wert größer als oder gleich 0,99, die die genaueste Bestimmung der Proteinmenge in den Proben 15 reflektiert.
- Vorbereitung der Probe
- Planen und notieren Sie die Ladereihenfolge der Treppen und Proben für 2 identische gels: Gel 1 für die Übertragung und Gel 2 als Ladekontrolle. Laden Sie die Kontrolle und "behandelt" Proben nacheinander, jede Voreingenommenheit, die mit schlechter oder eindeutige Transfer entstehen könnten, zu vermeiden.
- Berechnung der Proteinvolumen für jede Probe erforderlich. Ein Standard-Proteinlast, um Proteine in neuronalen Isolate erkennen ist 15 ug. Bilden jede Probe bis zu einem Volumen von 10 ul mit dH 2 O. Mit 5 & mgr; l Ladepuffer, Wirbel und Wärme bei 98 ° C für 2 min.
- Fügen Sie eine positive Kontrollprobe wie ein rekombinantes Protein mit Kennzeichnung der richtigen Band von Interesse zu unterstützen. Doch die positive Kontrollprobe ordnungsgemäß vorbereitet folgenden Richtlinien des Herstellers, um die Auswahl der falschen Bands zu vermeiden. Siehe Abbildung 1.
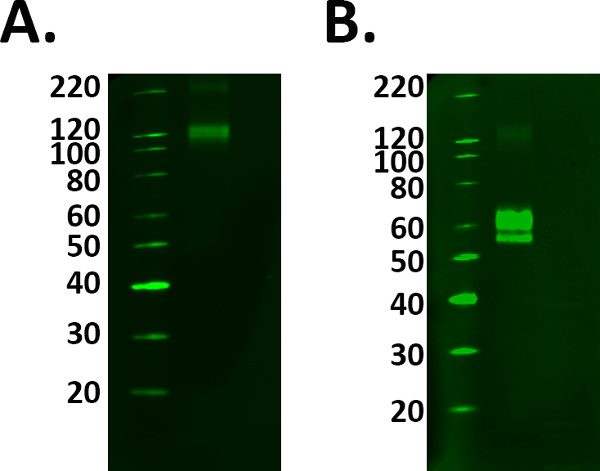
Abbildung 1. Positive Steuer Auswahl. Die Zugabe von positiven Kontrollen auf ein Experiment bestätigt die erfasste Kennzeichnung ist real. Allerdings muss darauf geachtet werden, sicherzustellen, dass Ihre Steuer arbeitet korrekt, vor der Verwendung experimentellen Proben. A) Fusionsprotein TREM 2 wurde bei Richtlinien von 1 ug / ml des Herstellers geladen, aber die bei 110 kDa Konflikte mit dem Datenblatt beobachtet Kennzeichnung vorhergesagten Molekular Gewicht von 60-70 kDa. B) Nach Zugabe und Inkubation mit dem Reduktionsmittel, wurde das Fusionsprotein Kennzeichnung auf dem vorhergesagten Molekulargewicht nachgewiesen. Allerdings bedeutete dies eine höhere Proteinbeladung wurde erforderlich, da das Reduktionsverfahren verringert das Signal des Proteins.
2. Elektrophoretische Trennung von Proteinen
- Herstellung 4-12% Bis / Tris-Gel (1,0 mm)
Hinweis: Gradient Gele werden verwendet, um größere Proteintrennung in einem breiten Molekulargewichtsbereich zu produzieren.- Auswahl und Vorbereitung MESoder MOPS-Laufpuffer (1 l pro Tank) durch Verdünnen mit dH 2 O. MES-Puffer produziert bessere Auflösung von Proteinen innerhalb von 3,5 bis 160 kDa wohin MOPS-Laufpuffer wird bevorzugt zu erkennen höheren Molekular Proteine Gewicht über 200 kDa wird jedoch schlechtere Auflösung mit niedrigerem Molekulargewicht Proteine unter 15 kDa haben.
- Nehmen Sie den Kamm und Klebestreifen, die den Fuß des Gels abdeckt. Behutsam die Brunnen mit Laufpuffer mit einer 1 ml Pipette. Füllen Sie die Taschen mit Laufpuffer und sicherzustellen, dass keine Luftblasen im Gel bleiben.
- Gel Vorbereitung und Beladung
- Legen Sie die Gele in den Tank und füllen Sie den inter Gelkammer mit Laufpuffer, um sicherzustellen, alle Dichtungen wirksam sind.
- In 3 ul Molekulargewichtsstandard in den ersten gut in Gel 1 und Gel 2. Laden 10 ul jeder Probe in nachfolgende Brunnen.
Anmerkung: Mit Ausnahme von den Leitern muß gel 1 gel & 2 identisch sein. Es ist zwingend notwendig than der vorgefärbten Molekulargewichtsstandard für Gel 2 verwendet wird, ist blau und sichtbar, wenn mit einem Gesamtprotein Fleck, um in der 700 Kanal des Odyssey Imager sichtbar zu sein. - Sobald beide Gele geladen werden, füllen den Tank mit der restlichen Laufpuffer und sichern Sie den Deckel.
- Elektrophorese
- "Run" das Gel bei 80 V für 4 min, um die Probe zu gewährleisten in den Polyacrylamid-Gel-Matrix in einheitlicher Weise. Die Spannung und die Zeit danach zu erhöhen, um 180 V für 50 min jeweils, oder bis die Probe Farbstoff kann am Fuße des Gels sichtbar.
HINWEIS: Höhere Spannungen können angewendet werden, um kürzere Laufzeiten zu erreichen. Jedoch kann dies in "Smiley" Gele, wo die mittleren Abtastwerte der Gele laufen schneller als die äußeren Fahrbahn Proben durch eine Temperaturerhöhung 14 verursacht werden.
- "Run" das Gel bei 80 V für 4 min, um die Probe zu gewährleisten in den Polyacrylamid-Gel-Matrix in einheitlicher Weise. Die Spannung und die Zeit danach zu erhöhen, um 180 V für 50 min jeweils, oder bis die Probe Farbstoff kann am Fuße des Gels sichtbar.
3. Total Protein Stain des Loading Control Gel
- Erscheinungs Gel 2 aus der Kassette mitein Gel Messer. Entfernen Sie die Brunnen und den Fuß des Gels. Kennzeichnen Sie das Gel auf die Orientierung zu erleichtern.
- Dekantieren ca. 30 ml des Proteins Fleck in eine quadratische Petrischale (ungefähre Größe 12 x 12 cm). Platzieren gel 2 in die Proteinflecken, wodurch die Lösung umfasst das gesamte Gel, dann bewegen das Gel für mindestens 1 h bei Raumtemperatur zu färben.
- Dekantiert man die Protein-Färbung und waschen Sie die Gel 3x in destilliertem Wasser vor der Visualisierung. Fahren Sie mit Schritt 6.3 zu visualisieren.
4. I-Blot Semi Dry Fast Proteintransfer
HINWEIS: Alle Reagenzien für die Proteinübertragung mit dem I-Blot-Maschine erforderlich sind kommerzielle Produkte, die speziell für das I-Blot-Methodik entwickelt und kann in der Materialliste zu finden.
- Bereiten Sie den "Boden" Transferstapel. Entfernen Folienabdeckung und Pre-nass mit Laufpuffer direkt aus dem Gel Tank. Pre-feuchtem Filterpapier mit destilliertem Wasser.
- Wiederholen Sie Schritt 3.1 und Ort Gel 1 aufdie vorbereitete "unten" Transferstapel.
- Legen Sie den Pre-feuchtem Filterpapier über das Gel. Rollen Sie das Filterpapier und Gel, um sicherzustellen, zwischen den Schichten keine Blasen gefangen.
- Entfernen Sie den Foliendeckel von oben Transfer Stapel und legen den oberen Stapel oben auf dem Filterpapier und unten Stack. Rollen Sie den Transfer-Stack "Sandwich", um Luftblasen zu beseitigen.
- Legen Sie den Schwamm aus der Übertragung Stack-Kit auf den Deckel des I-Blot-Maschine. Legen Sie das Transferstapel Sandwich auf dem dedizierten Speicherplatz auf der I-Blot Maschine schließen Sie dann Deckel sicher. Starten Sie den I-Blot und Transfer für 8,5 min auf Programm 3.
- Wenn es eine niedrige Proteinsignal oder unebenen Hoch: niedermolekulare Protein-Verhältnisse, testen Übertragungszeiten des Herstellers bei der Verwendung eines halbtrocken "schnell" Übertragungsmethode. Führen Sie eine einfache Optimierung Protokoll mit Proben Wiederholungen identischer Last, um die ideale Übertragungsspannung / Zeit-Kombination zu bestimmen, wie in Abbildung 2 zu sehen .
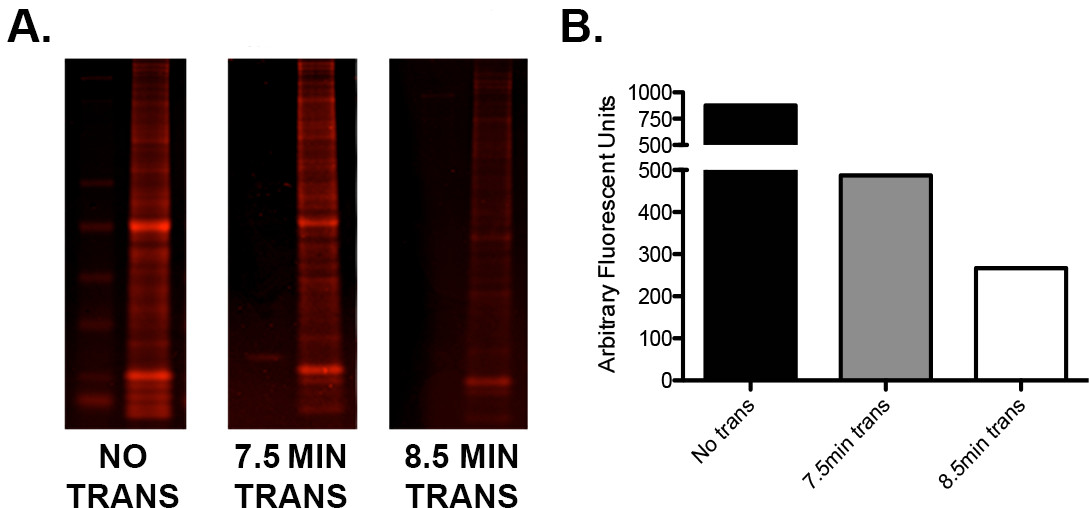
Abbildung 2. Optimierung der Übertragung mit Hilfe des I-Blot. A) eine einzige Gel mit Leiter geladen und 15 ug von murinen ganze Hirnhomogenat in drei Tandem-Wiederholungen wurde in drei Teile geschnitten. Ein Abschnitt wurde nicht übertragen wurde eine für 7,5 min übertragen (nach Herstellerrichtlinien) und für 8,5 min. Die Gel-Schnitte wurden dann mit Instant Blau Protein-Färbung gefärbt, gescannt auf einer Infrarotkamera in der 680-Kanal und quantifiziert. B) Grafische Darstellung der Quantifizierung Werte zeigen den Unterschied in der Restproteingehalt von jedem Gel folgenden 0, 7,5, und 8,5 min der Übertragung. Beachten Sie, dass eine zusätzliche Minute der Übertragungszeit zu zusätzlichen Proteintransfer von ca. 45%.e.com/files/ftp_upload/52099/52099fig2large.jpg "target =" _ blank "> Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
5. Antikörper Detektion von Proteinen
- Membranpräparation und Blockieren
- Entfernen Übertragungsstapel aus dem I-Blot-Maschine. Entfernen Sie die obere und Filterpapierschicht Aussetzen des Gels auf der Unterseite Transferstapel.
- Schnitt um das Gel mit einem Skalpell und sicherzustellen, dass eine dreieckige Schnitt zur Orientierung auf der Membran dargestellt. Nach Membran Trimmen, Eiweiß färben das Gel auf Transfereffizienz zu überprüfen und / oder zu verwerfen.
- Rasch die Membran in einen sauberen 50-ml-Tube (oder gleichwertig Aufnahme), das 5 ml 1x PBS bewegen und auf eine mechanische Walze (oder Orbital-Plattform) für ständigem Rühren.
Hinweis: Es ist wichtig, dass die Membran nicht austrocknet. Während halbtrockenen Transfer die Membran wird heiß werden. Warten Sie 2 Minuten vor dem Öffnen des Transferstapel da dies i erlaubent zu kühlen und zu langsame Trocknungszeit während Stapel Dekonstruktion. Verwendung einer Walze und Rohr zum Rühren während der Waschungen und Inkubationen können signifikante Reduktion der Volumina der Lösungen benötigt. - Die Membran 3 x 5 min in 1x PBS waschen. Verwerfen die 1x PBS und Blockieren der Membran mit unverdünntem Blockierungspuffer für mindestens 30 min bei Raumtemperatur.
- Primäre Antikörper-Präparat.
- Bereiten Sie den primären Antikörper nach den Richtlinien des Herstellers in 5 ml Blockierungspuffer mit 0,1% Tween 20. Inkubieren der Membran mit dem hergestellten primären Antikörper über Nacht bei 4 ° C unter konstantem Rühren.
HINWEIS: Blocking-Puffer wird im allgemeinen unverdünnt verwendet, kann aber bis zu 1 verdünnt werden: 4 mit PBS, wenn der primäre Antikörper eine Spezifität hoch genug. - Entsorgen Sie den primären Antikörper und waschen Sie die Membran 6 Mal für jeweils 5 min mit 1x PBS.
- Bereiten Sie den primären Antikörper nach den Richtlinien des Herstellers in 5 ml Blockierungspuffer mit 0,1% Tween 20. Inkubieren der Membran mit dem hergestellten primären Antikörper über Nacht bei 4 ° C unter konstantem Rühren.
- Sekundärantikörperselektion & Vorbereitung
- Für secoNdary nur Beschriftungs Beurteilung zu Kontrollzwecken weglassen Schritte 5.2.1 und 5.2.2 oben und fahren Sie mit Schritt 5,3 bis Probe spezifischen sekundären Bandenmuster zu bestimmen. Siehe Abbildung 3.
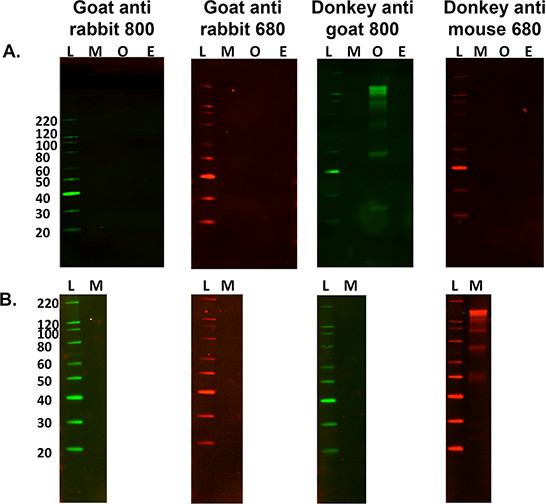
Abbildung 3. Optimierung der Sekundärantikörper. A) Ein Multispeziesvergleich von Sekundär nur unspezifische Kennzeichnung gegen 15 ug von murinen (M), Schafe (O) und Equine (E) Nerven Gewebehomogenaten mit einer Vielzahl von Fluoreszenz getaggt Sekundärantikörper . L ist die Molekulargewichtsleiter. Schafen Gewebehomogenat war die einzige Probe, um eine Kreuzreaktion mit dem sekundären Kennzeichnung bei Verwendung von Esel-anti-Ziege-800-Antikörper. B) Es ist auch wichtig, um festzustellen, ob bei der Verwendung einer unterschiedlichen Gewebeprobe unspezifische Kennzeichnung erfolgt, dh, murinen M. gastrocnemius (15 _6; g Last). Diese Probenquer reagiert mit dem Esel-anti-Maus-680 sekundären Antikörper, was jedoch nicht bei der Verwendung der Maus Hirnhomogenat auftreten.
- Herstellung des fluoreszierenden markierten sekundären Antikörpers 680 oder 800 (rot oder grün-Kanal) nach Hersteller empfohlenen Konzentrationen in Blocking-Puffer mit 0,1% Tween-20. Inkubieren der Membran in der Dunkelheit mit der hergestellten sekundären Antikörper für 90 min bei Raumtemperatur unter konstantem Rühren.
- Entsorgen Sie die sekundären Antikörper und waschen Sie die Membran 6 mal 5 min pro Waschgang mit 1x PBS. Fahren Sie mit Schritt 6 - Visualisierung.
- Wenn Visualisierung von Markern wird nicht wie erwartet funktioniert, Prüfungsleitern mit einer Reihe von Sekundärantikörper als geeigneter zusätzlicher Schritt. Nicht alle Sekundärantikörper ermöglichen Visualisierung aller Markierungsbänder in allen handelsüblichen Leitern.
- Wenn erwarteten Banden nicht sichtbar sind, verwenden Sie eine Alternative sekundären Host, dh donkey anti Kaninchen gegen Ziegen anti Kaninchen für eine geeignete Protokollmodifikation. Siehe Fig. 4 verwendet, um einen sekundären Antikörper zu erhöhen Wirtsart können ein Problem mit Visualisierungs verursachen gelegentlich wegen des Mangels an Spezifität für bestimmte primäre Antikörper.
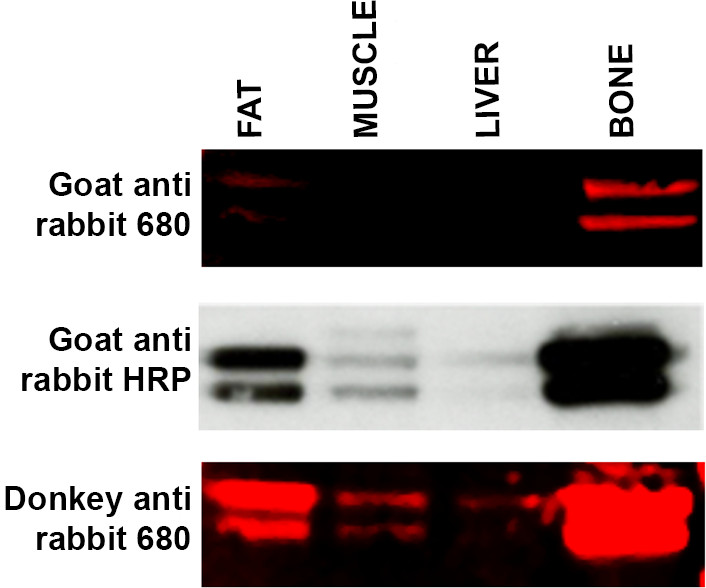
Abbildung 4. Fehlerbehebung sekundären Antikörperspezifität Western-Blot von einer Reihe von Gewebeproben (15 ug Protein pro Spur) -. Fett, Muskel, Leber und Knochen - mit ERK primären Antikörper inkubiert und mit drei verschiedenen Sekundärantikörper inkubiert. Deckplatte: WB mit LI-COR Ziegen-Anti-Kaninchen-680 sekundären Antikörper markiert produziert schwache Kennzeichnung von Fett und Knochen und kein Signal in der Leber und Muskelproben nachgewiesen. Mitteltafel: Membran (von oben Platte) wurde gestrippt und reprobed mit ECL Methodik und Ziege anti-Kaninchen-HRP verlinkt zweitrangig. Bands sind nun in Muskel- und Leberproben sichtbar und Kennzeichnung erscheint intensiver in den Fett- und Knochenproben. Bodenplatte: Membrane (von oben und Mitte) wurde abgestreift und sondiert mit LI-COR Esel anti-Kaninchen 680 sekundäre Antikörper, die eine größere Affinität für den ERK primären Antikörper gezeigt hat. Kennzeichnung für Muskeln und Leber ist jetzt mit erhöhter Signalintensität sowohl von Fett und Knochenproben sichtbar. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
6. Visualisierung
HINWEIS: Alle Bilder sind mit der LI-COR Odyssey Klassische Imager und zugehörige Bild Pro-Analyse-Software (Version 3.1.4) erworben.
- Drehen Sie sich und melden Sie sich auf dem Computer und Imager. Öffnen Sie die Imaging-Software und erstellen Sie eine neue Datei. Siehe Abbildung 5.
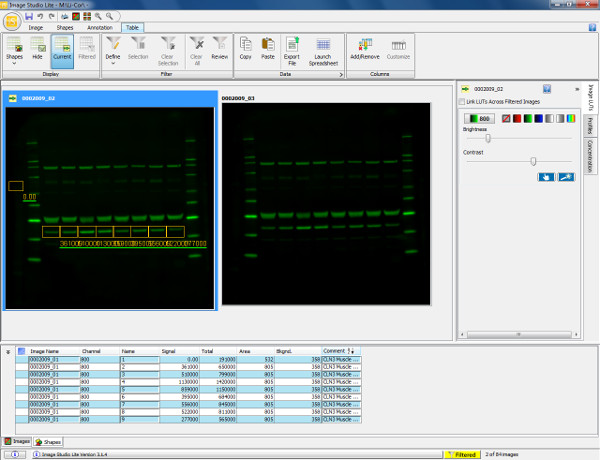
Abbildung 5. Visualisierung und Quantifizierung der Western-Blot. Scan eines Western-Blot zeigt murinen M. gastrocnemius (30 ug Last) mit Annexin V primären Antikörper (36 kDa) und Ziegen-Anti-Kaninchen-800 sekundären Antikörper sondiert. Die Membran wurde gescannt und in der 800-Kanal visualisiert. Um das Protein (Annexin V) zu quantifizieren, wird ein rechteckiger Rahmen um das interessierende Band gezogen von der Probe 1. Diese wird dann kopiert und über die restliche Probenbahnen geklebt, um die Messung der Umgebung zu gewährleisten. Hintergrund automatisch für rund um die Form gezogen entfielen aber dies kann geändert werden, um die Hintergrundmessung wird genau definiert zu gewährleisten. Die nachstehende Tabelle zeigt die quantifizierten Messungen jeder Form gezogen einschließlich erhaltene Gesamtsignal, Hintergrund und Signal mit Hinter subtrahiert. Diese Information kann dann in eine exportiertTabellenkalkulationsprogramm, um Expressionsverhältnisse berechnen (wie durch relative Fluoreszenzintensität bestimmt wird) und erlaubt spätere statistische Auswertungen durchgeführt werden. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
- Öffnen Sie den Deckel des Imagers. Gießen Sie eine kleine Menge von 1x PBS auf das Glas auf der linken unteren Ecke und dann die Membran auf der Oberseite des PBS. Sicherzustellen, dass die Membran quadratisch mit der Achse der Abbildungsvorrichtung und ein 1 cm Spalt zwischen der Membran und der Gitterachse verlassen.
- Rollen die Membran zu gewährleisten, zwischen dem Glas und der Membran keine Blasen eingefangen.
- Die Anzahl der Quadrate der Membran nimmt auf der x- und y-Achse. Schließen Sie den Deckel des Imagers. Geben Sie die Anzahl der Quadrate die Membran nimmt auf der Computer-Software.
- Wählen Sie den entsprechenden Kanal, um die Membran, die auf der Fluoreszenzmarkierung abhängt scannendes Sekundärantikörpers, dh 700 oder 800 Kanal, wenn ein Kanal 680 oder 800 fluoreszierende getaggte Antikörper wurde jeweils verwendet. Wenn Doppelmarkierungen durchgeführt wird, scannen in beiden Kanälen.
HINWEIS: Optimieren einzelner Proteinmarkierung vor der Durchführung Doppelmarkierungen. - Wählen Sie die Intensität, um die Membran zu scannen, wenn eine hohe Fülle Protein verwenden eine niedrige Intensität Scan. Alternativ, wenn der primäre Antikörper hat schlechte Affinität für das Protein von Interesse wählen Sie eine höhere Intensität Scan, dh Ebene 5. Drücken Sie Start, um den Scanvorgang zu starten. Fahren Sie mit Schritt 6.4.
- Visualisierung des Ladesteuer Gel (Abbildung 6).
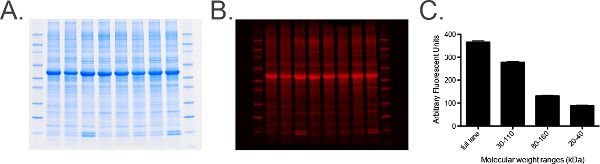
Abbildung 6. Gesamtproteinmarkierung und Analyse. A) Fotografie einer Gesamt Protein markiert Gel mit 20 ug Pferde Cervicalganglien Homogenat pro Bahn. B) Gel aus Tafel Ain der 680-Kanal. C) Grafik der quantifizierte Messungen aus dem Gesamtprotein gefärbten Gel gescannt unter Verwendung Imaging-Software. Eine Reihe von Messungen, die von Molekulargewichtsmarker bestimmt, dh 30-110 kDa, getroffen werden, um ein Histogramm der Messungen liefern die Standardfehler sicherzustellen (SEM) ist gering (der gruppierten Proben), das anzeigt, dass die Gesamtproteinspiegel in jeder Probe einheitlich sind über das Gel. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.- Führen Sie die Schritte 6.1 und 6.2.
- Pour destilliertem Wasser auf das Glas in der unteren Ecke des Bildgebers in dem die Gitterachse beginnt.
- Das Kieselgel wird auf der Oberseite des Wassers und zu manövrieren, so dass die Bahnen senkrecht zu der x- oder y-Achse des Rasters sind. Hinterlasse einen 1 cm Spalt zwischen y und x-Achse des Gitters und dem Gel und zählen die Anzahl der Plätze das Gel nimmt auf der Gitterachse. Schließender Deckel der Imager.
- Geben Sie die Anzahl der Quadrate das Gel nimmt auf der Computer-Software.
- Wählen Sie das 700-Kanal, um die Gesamtprotein gefärbten Gel zu scannen.
HINWEIS: Blau fluoresziert im 700-Kanal. - Stellen Sie die Intensität bis 5 und drücken Sie Start.
- Quantifizierung des gescannten Bildes
- Stellen Sie die Helligkeit und den Kontrast Tasten, um die beste Bildqualität zu erzeugen. Wenn es scheint, hohe Hintergrundrauschen sein, erneut zu scannen die Membran mit einer geringeren Intensität und verwenden Sie den hochwertigen Scaneinstellung.
HINWEIS: Alle Einstellungen werden die erworbenen beim Scannen Fluoreszenzdaten nicht ändern. - Bilder drehen 90 °, 180 ° und 270 °, um in der gewünschten Orientierung ohne Änderung der erfassten Daten anzuzeigen. Wenn jedoch kleine Anpassungen der Orientierung in "freie Rotation", um mehr als 3 °, Pixilation Werte erfassten Daten verzerrt werden kann und damit Einfluss auf die Quantifizierungsergebnisse.
- Wählen Sie eine Form aus der Formen-Menü - Verwenden Sie ein Rechteck in den meisten Fällen - und um das Band von Interesse (WB) oder das gesamte Fahrspur (Gesamtprotein-Gel) in Proben Spur 1 zu ziehen.
- Kopieren Sie die Form über den Proben Spur 2 Band von Interesse oder ganze Spur. Wiederholen Sie für jeden einzelnen Band von Interesse für jede Probe und jede Bahn für Gesamtprotein Gele.
- Überprüfen Sie, dass die Hintergrundmessung kein Signal übernehmen in der nächsten Spur. Der Hintergrund kann durch die Software automatisch abgezogen und umfassen gesamte Kante um die Form gezogen oder es kann angegeben werden, nach oben / unten oder links und rechts von der Form sein. Alternativ bezeichnen einen benutzerdefinierten Hintergrund Feld.
- Zeigen Sie das Signal für die Formen-Tabelle für jede Form in willkürlichen Fluoreszenzeinheiten gezeichnet. Der Hintergrund wird automatisch aus dem Signal abgezogen.
- Exportieren Sie das Bild als TIF-Datei in unterschiedliche Software anzuzeigen. , Das Bild nicht zu exportieren und zu manipulieren using nicht Bild Profi-Software, da dies die ursprüngliche von der Kamera Erzeugen falscher Daten erfassten Daten zu ändern.
- Wiederholen Sie die Schritte 6.4.3-6.4.7 bei der Quantifizierung Dual Etikettierung oder die Durchführung mehrerer Messungen an Ladekontrolle Gele zu erzeugen und zu sammeln Standardfehlerdaten.
- Stellen Sie die Helligkeit und den Kontrast Tasten, um die beste Bildqualität zu erzeugen. Wenn es scheint, hohe Hintergrundrauschen sein, erneut zu scannen die Membran mit einer geringeren Intensität und verwenden Sie den hochwertigen Scaneinstellung.
7. Beitrag Visualisierung
- Halten Membranen in 1x PBS oder Austrocknen für die Langzeitspeicherung für zukünftige Wieder Sondieren und Strippen von Membranen für die anderen Proteine von Interesse.
- Entkleiden und neu Sondieren von Membranen. Siehe Abbildung 7.
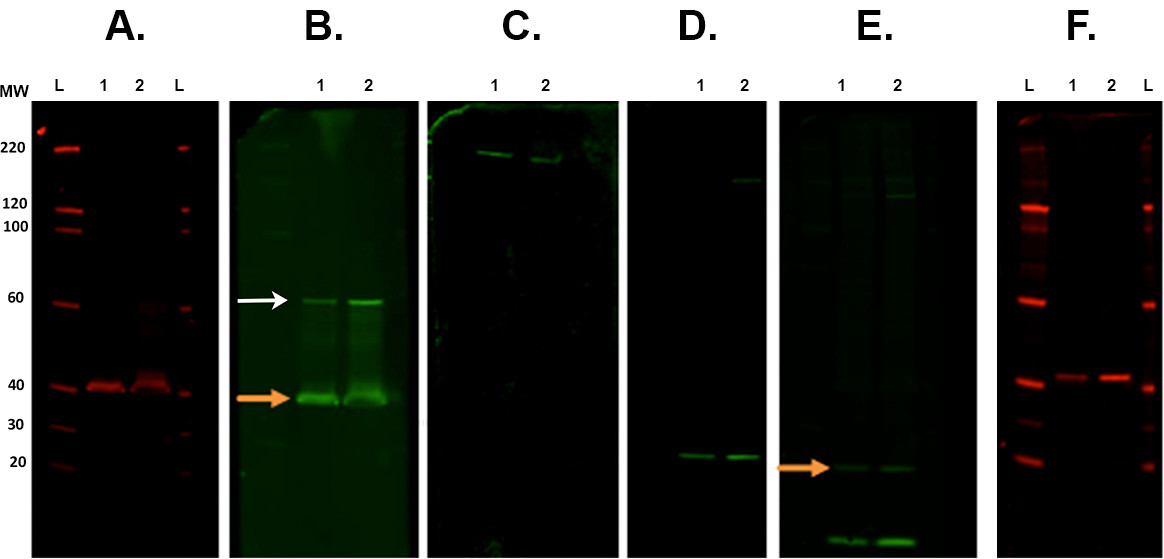
Abbildung 7. Membran Strippen und Western Blot. Repräsentative Beispiele für Membranen folgenden verschiedenen Strippen Schritte mit einem Infrarot-Imaging-System. Ein gescannt. Die erste Immundetektion wurde mit CSP primären Antikörper (Kaninchen) durchgeführt und in 7 gescannt00-Kanal. B. Erste Strippen und Western Blot mit Rock2 (Kaninchen) mit 800-Kanal. Orange Pfeil zeigt die verbleibende CSP nach dem Streifen und Re-Sonde vorhanden primären Antikörper. Dies hat keinen Einfluss auf die Messung der Rock2 als die Bande bei höherem Molekulargewicht (weißer Pfeil). C vorliegt. Zweiten Strippen und sondiert mit β-Spektrin-Antikörper (Ziege) und in der 800-Kanal. D visualisiert. Drittens Strippen und Western Blot mit α-Synuclein-Antikörper (Kaninchen). E. Vierte Strippen und Western Blot mit Ubiquitin-Antikörper (Maus) mit 800-Kanal. Es gibt immer noch verbleibende Signal aus der letzten Antikörper (α-Synuclein. Oranger Pfeil). F. Fünfte Strippen und Western Blot mit CALB2 Antikörper (Kaninchen) in 700-Kanal abgebildet. Sekundärantikörper wurden verwendet: Ziege anti-Maus 800cw, Ziege-Anti-Kaninchen 680rd, Ziege-Anti-Kaninchen 800cw, Esel anti-Ziege 800cw (siehe Materialliste). Lane Etiketten: L - Leiter, 1/260; - Probe 1/2. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.- Ort Membran (en) in einem quadratischen Petrischale, die etwa 30 ml Revitablot Stripping-Puffer enthalten und 5-20 min bei Raumtemperatur unter konstantem Rühren inkubiert.
- Waschen Sie die Membran (en) 3 mal in PBS dann erneut scannen auf dem Imager um die vollständige Entfernung der Fluoreszenz zu gewährleisten aufgetreten - sollte dieser Schritt nach jedem Streifen wiederholt werden.
- Inkubieren Membran (en) für längere Zeiträume, wenn Fluoreszenz bleibt. Rescan der Membran nach jedem Streifen, um zu bestätigen, dass es noch keine Sekundärsignal.
Anmerkung: Membran (en) sollte nur abgezogen und erneut sondiert maximal 3-mal, um zu gewährleisten, daß die Integrität der Membran nicht beeinträchtigt wurde, was zu unerwünscht hohen Hintergrund-Signal-Verhältnis werden.
Ergebnisse
Als QFWB Empfindlichkeit und den linearen Bereich der Erfassung größer ist als herkömmliche ECL-Nachweis, gibt es eine Reihe von Kontrollmaßnahmen, die von entscheidender Bedeutung, um sicherzustellen, daß genaue Daten gesammelt werden, wodurch eine effektive Auslegung unterstützt wird. Erstens die Aufnahme von positiven Kontrollproben, wie in 1 gezeigt ist. Zweitens, die Optimierung der Übertragung auf äquivalente Bewegung der hohen und niedrigen Molekulargewichts-Proteine aus dem Gel auf die Membran zu gewährleisten, wie in Figur 2 gezeigt wird. Drittens, die Optimierung der Antikörper, insbesondere Sekundär Antikörper, deren Optimierung wird oft übersehen, die aber können unspezifische produzieren Banding in der Lage, sich störend auf korrekte Interpretation der Protein (e) von Interesse. Siehe 3. Viertens kann es auch der Fall sein, dass, wenn ein Protein scheint nicht nachweisbar, aber voraussichtlich anwesend zu sein, kann dies auch ein sekundärer Antikörper Frage, die durch die Verwendung eines sekundären rais korrigiert werden kannin einer anderen Spezies Host ed. Siehe 4. Fünftens ist die Gesamtproteinmarkierung und Analyse eine weitaus robuster und quantifizierbare Verfahren im Vergleich zu der Verwendung von herkömmlichen, Protein (e), die ubiquitär internen Referenzstandards 3 ausgedrückt werden. Viele dieser Einzelproteine gefunden wurden differentiell in Modellen neurodegenerativer Erkrankungen sowie zwischen verschiedenen Gewebeproben ausgedrückt werden und die Gleichförmigkeit des Ausdrucks innerhalb des gleichen Gewebes 3 ändern. Daher wird die Produktion eines Ladesteuer Gel die Gleichförmigkeit der Probenbeladung zu bestätigen, wenn mit einer Gesamtproteinanalyse durch Vergleichen und Quantifizierung der Proteinbelastung in jeder Spur in verschiedenen Molekulargewichten im Bereich vor jedem Muster kombiniert werden, um Standard-Fehler anzuzeigen, wie in 6 gezeigt, . Wichtig ist, dass alle diese Techniken zur Fehlerbehebung und Kontrollen sind nur so effektiv wie die Sensitivität und Konsistenz der Analyse tools durch den Betreiber (5) aufgebracht wird. Schließlich eignet sich dieses Verfahren zum Abziehen und Wieder Sondieren von Membranen mit mehr Flexibilität als ECL aufgrund von Faktoren, einschließlich, aber nicht zu einer erhöhten Empfindlichkeit, verringert Hintergrund, dual Farberkennung und Membranstabilität unter Langzeitlagerungsbedingungen beschränkt. Siehe Abbildung 7.
Diskussion
Berücksichtigung und Planung ist wichtig vor jeder Experiment und kann letztlich bestimmen den Erfolg der verwendeten Technik. Die Fortschritte in Proteindetektion mit WB kann eine Fülle von potenziellen Stolpersteine darstellen, wenn sie versuchen zu entscheiden, die entsprechenden Antikörper, Transfer und Visualisierungsmethoden zu bedienen. Glücklicherweise mit einer sorgfältigen Checkliste und geeignete Kontrollmaßnahmen QFWB kann routinemäßig verwendet werden, um die Protein Präsenz und immer subtiler Expressionsunterschiede zwischen den Proben zu bestimmen. Dieses Protokoll bietet einen umfassenden Leitfaden für fluoreszierende quantitativen Western Blot sowie ein paar Fehlersuchstrategien zur Vermeidung und / oder zu überwinden einige der vielen Fallstricke mit ihm verbunden.
Die kritischen Schritte verwendet, um die Empfindlichkeit zu erhalten und zu erhalten wirklich quantifizierbare und vergleichbare Messungen umfassen: 1) robuste Proteinextraktion aus Gewebeproben; 2) Probenvorbereitung; 3) genaue Protein loading bestimmt durch die Gesamtproteinanalyse; 4) eine optimale Übertragung von Proteinen unter Verwendung von I-Blot; 5) Herstellung von primären und sekundären Antikörper in Blockierungspuffer, enthaltend 0,1% Tween 20, und 6) richtige Visualisierung und Analyse unter Verwendung eines Infrarot-Bildwandler und der zugehörigen Software.
Infrarot-Fluoreszenzdetektion ist wirklich quantitative und bietet eine höhere Empfindlichkeit gegenüber traditionelleren ECL-Nachweistechniken 3,11. Dieses Erfassungssystem ist mit mehreren Facetten, und als solche ist nicht auf QFWB beschränkt. Dieses System ist in der Lage Bildgebung von immunhistologischen Kennzeichnung bei niedriger Leistung ermöglicht die Visualisierung und Quantifizierung der gesamten Gewebeabschnitte 12. Dies ist ein Bereich von möglichen zukünftigen Entwicklung hinsichtlich der Auflösung, die weit roten Bildgebung sehen konnte rivalisierenden herkömmlichen Immunfluoreszenz Capturing mit herkömmlichen Mikroskopen im Hinblick auf quantitative Bewertung.
Jedoch mit größerer Empfindlichkeit, um feine Änderungen in protein Ausdruck es entscheidend, Variabilität zu gewährleisten wird auf ein Minimum und Kontrollmaßnahmen gehalten sind streng mit robuster Protokolle. Dies beginnt mit strengen Proteinextraktion aus der Gewebeprobe, gefolgt von Produktion von Gesamtprotein gefärbten Gelen die Gewähr zu bieten, dass der Probenbeladung ist einheitlich, Optimierung der Primär- und Sekundärantikörper, um festzustellen, ob Erkennung ist real und Richtlinien des Herstellers testen bezüglich übertragen Zeiten, um eine effiziente Proteintransfer erhalten.
Dennoch, auch wenn die Bedingungen für WB optimiert sind, kann es immer noch Probleme mit fließendem Western, die hier nicht vollständig erforscht worden sind, können assoziiert. Diese umfassen, sind aber nicht auf Faktoren einschließlich Protein Solubilisierung und Wahl der Extraktionspuffer begrenzt. Einige Puffer mit Proteinkonzentration Assays stören und einige Gewebe sind besonders schwierig zu solubilisieren, erfordern robustere Techniken wie die Verwendung von automatisierten macerating verschlossenen Behältnissen wie M Rohre zusammen mit einem Macs Dissociator. Zusätzlich können einfache Maßnahmen zur Kontrolle der Speicherung von nicht-extrahierten und extrahierten Materials bei -80 ° C der Unterschied zwischen den Erhalt optimaler Kennzeichnung direkt nach der Extraktion und mit schlechten Ergebnissen Wochen später.
Moderne QFWB Methoden sind nachweislich für die Erfassung feine Unterschiede in der Proteinexpression empfindlicher zu sein und sind vielseitiger die gleichzeitige Doppelmarkierungen 3 im Vergleich zu älteren Techniken wie ECL. Es ist lebenswichtig, dass Western-Blot-Protokolle sind robust und leicht wiederholbaren für genaue Quantifizierung und statistische Analyse. Dieses Protokoll ist empfindlich und robust genug ist, um routinemäßig für den Nachweis von Proteinen in einer Vielzahl von verschiedenen Gewebeproben und 3 Arten verwendet werden und ermöglicht die Quantifizierung von niedrigen und hohen Fülle Proteine innerhalb derselben QFWB daher reduziert Verbrauchs Nutzung sowie Zeit pro Experiment 1. 1 Darüber hinaus ist die erhöhte Empfindlichkeit dieser Technik ermöglicht die Validierung von immer beliebter - schaftlichen Studien 9,14 aber Genauigkeit ist entscheidend und Aufnahme geeigneter Kontrollmaßnahmen müssen eingehalten werden, um dadurch eine fehlerhafte Datenerfassung vermieden.
Offenlegungen
The authors have nothing to disclose.
Danksagungen
Wir würden dank mag die folgenden für die finanzielle Unterstützung: BBSRC Institut Strategische Programmfinanzierung - CF & TMW; BBSRC East Bio DTP Finanzierung - LG; Die Darwin Trust of Edinburgh - MLH. Wir möchten auch an Dr. Barry McColl für die Erlaubnis, die TREM2 Optimierung in diesem Manuskript gehören danken.
Materialien
| Name | Company | Catalog Number | Comments |
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| RIPA Buffer | Fisher Scientific UK Ltd | 10230544 | |
| M Tubes | Miltenyi Biotec Inc. | 130-093-236 | |
| iBlot Transfer Stack, PVDF Regular | Life technologies, UK | IB401001 | |
| MagicMark XP Western Protein Standard (20-220 kDa) | Life technologies, UK | LC5602 | Use in gel 1 for Western blotting |
| SeeBlue Pre-stained protein standard | Life technologies, UK | LC5625 | Use in gel 2 Total protein stained gel |
| NuPAge LDS Sample buffer 4X | Life technologies, UK | NP0007 | |
| NuPAGE MES SDS Running Buffer (for Bis-Tris Gels only) (20X) | Life technologies, UK | NP0002 | |
| NuPAGE Novex 4-12% Bis-Tris Gel 1.0 mm, 12 well | Life technologies, UK | NP0322BOX | |
| PHOSPHATE BUFFERED SALINE TABLET,*TRU-ME, PHOSPHATE BUFFERED SALINE TABLET | Sigma-Aldrich, UK | P4417-100TAB | |
| Micro BCA, Protein Assay Kit | Fisher Scientific UK Ltd | 10249133 | |
| Odyssey blocking buffer | Li-Cor Biosciences | P/N 927-40000 | |
| IRDye 680RD Goat anti-Rabbit IgG (H+L), 0.5 mg | Li-Cor Biosciences | 926-68071 | |
| IRDye 680RD Donkey anti-Mouse IgG (H+L), 0.5 mg | Li-Cor Biosciences | 926-68072 | |
| IRDye 800CW Goat anti-Rabbit IgG (H + L), 0.5mg | Li-Cor Biosciences | 926-32211 | |
| IRDye 800CW Donkey anti-Goat IgG (H + L), 0.5mg | Li-Cor Biosciences | 926-32214 | |
| ODYSSEY CL Infra-red imager | Li-Cor Biosciences | Call for quotation | |
| iBlot 7-Minute Blotting System | Life technologies, UK | This model is no longer in production | |
| InstantBlue Protein stain | Expedeon, UK | ISB1L | |
| Revitablot western blot stripping buffer | Rockland Immunochemicals Inc. | MB-085-0050 |
Referenzen
- Towbin, H., Staehelin, T., Gordon, J. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. Biotechnology. 1992 (24), 145-149 (1979).
- Walker, J. M. . Protein Protocols on CD-ROM. , (1998).
- Gallagher, S., Winston, S. E., Fuller, S. A., Hurrell, J. G. Immunoblotting and immunodetection. Curr Protoc Mol Biol. Chapter. 10, 10 (2008).
- Eaton, S. L., et al. Total protein analysis as a reliable loading control for quantitative fluorescent Western blotting. PLoS One. 8 (8), 72457 (2013).
- Suzuki, O., Koura, M., Noguchi, Y., Uchio-Yamada, K., Matsuda, J. Use of sample mixtures for standard curve creation in quantitative Western blots. Exp. Anim. 60, 193-196 (2011).
- Colella, A. D., et al. Comparison of Stain-Free gels with traditional immunoblot loading control methodology. Anal Biochem. 430 (2), 108-110 (2012).
- Zellner, M., et al. Fluorescence-based Western blotting for quantitation of protein biomarkers in clinical samples. Electrophoresis. 29, 3621-3627 (2008).
- Kielar, C., et al. Molecular correlates of axonal and synaptic pathology in mouse models of Batten disease. Hum Mol Genet. 18, 4066-4080 (2009).
- Mutsaers, C. A., Lamont, D. J., Hunter, G., Wishart, T. M., Gillingwater, T. H. Label-free proteomics identifies Calreticulin and GRP75/Mortalin as peripherally accessible protein biomarkers for spinal muscular atrophy. Genome Med. 5 (10), 95 (2013).
- Wishart, T. M., et al. Dysregulation of ubiquitin homeostasis and β-catenin signaling promote spinal muscular atrophy. J Clin Invest. 124 (4), 1821-1834 .
- Mathews, S. T., Plaisance, E. P., Kim, T. Imaging systems for westerns: chemiluminescence vs. infrared detection. Methods Mol Biol. 536, 499-513 (2009).
- Hawes, J. J., Brunzell, D. H., Wynick, D., Zachariou, V., Picciotto, M. R. GalR1, but not GalR2 or GalR3, levels are regulated by galanin signalling in the locus coeruleus through a cyclic AMP-dependent mechanism. J Neurochem. 93 (5), 1168-1176 (2006).
- Bond, D., Primrose, D. A., Foley, E. Quantitative evaluation of signaling events in Drosophila S2 cells. Biol Proceed Online. 10 (1), 20-28 (2008).
- Wishart, T. M., et al. Differential proteomics analysis of synaptic proteins identifies potential cellular targets and protein mediators of synaptic neuroprotection conferred by the slow Wallerian degeneration (Wlds) gene. Mol Cell Proteomics. 6, 1318-1330 (2007).
- Silva, J. M., McMahon, M. The fastest western in town: a contemporary twist on the classic western blot analysis. J. Vis. Exp. (84), 51149 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten