Method Article
문제 해결 전략 현대 양적 형광 웨스턴 블로 팅에 가이드
요약
The advancement of western blotting using fluorescence has allowed detection of subtle changes in protein expression enabling quantitative analyses. Here we describe a robust methodology for detection of a range of proteins across a variety of species and tissue types. A strategy to overcome common technical problems is also provided.
초록
1970 년대 말은 웨스턴 블롯, 존재와 복잡한 생체 시료 내 특정 단백질의 상대적인 풍요 로움을 평가하는 기술의 첫 번째 공식보고 사용을 보았다. 그 이후로, 웨스턴 블로 팅 방법은 분자 생물학 실험적인 레퍼토리의 공통 요소가있다. 용어는 "웨스턴 블롯"을 사용하여 PubMed에의 피상적 검색 이십이만 출판 원고를 초과 중요한 것은 2014 년에이 기술의 사용을 만든 것을 제안, 지난 10 년은 개발과 함께 기술 이미징의 발전을 보았다 감도 개선 및 선형 검출 더 큰 범위를 산출 한 민감한 형광 라벨. 결과는 생물 학자들이 이전보다 민감도와 정확도를 비교 발현 분석을 수행 할 수 있습니다 웨스턴 블롯 (Western Blot) (QFWB)을 기반으로 지금 진정으로 계량화 형광입니다. 많은 "최적화"서양 블롯방법론이 존재하고 서로 다른 실험실에서 사용된다. 이들은 종종 인해 미묘하지만 문서화되지 않은 절차 개정의 요구에 구현하기 어려울. 이 프로토콜은 문제 해결 전략을 완성 설립하고 강력한 QFWB 방법의 포괄적 인 설명을 제공합니다.
서문
웨스턴 블롯 (WB)는 원래 같은 조직 파쇄 한 바와 같이, 복잡한 생물학적 샘플에서 목적 단백질의 존재 여부를 결정하기 위해 1970 년대 후반에 개발 된 분석 기술이다. 일반적으로 인해 키 항체 - 항원 상호 작용, 단백질 면역라고, 방법론은 5 별개의 단계로 구성되어 자신의 등전점에 의한 단백질의 1) 전기 영동 분리; 2) 니트로 셀룰로오스 또는 폴리 비닐 리덴 디 플루오 라이드 (PVDF) 멤브레인로 전송; 3) 관심 단백질에 특이 차 항체를 사용하여 라벨링; 차 항체에 대항 차 항체 4) 배양; 5) 시각화.
시각화 방법론은 안전과 감도를 개선하기 위해 시간이 진화하고있다. 첫 번째 WBS의 일부는 더 널리 사용 chemilluminescent (ECL) 방법 색채와에 진행 라디오 라벨 태그를 사용하여 수행되었다. Radioactivi비색과 ECL 방법은 알칼리 포스 파타 아제 또는 스트렙 타비 딘 고추 냉이 과산화 효소 (HRP) 2 등의 효소 기자와 간접 라벨링 기술을 사용하는 반면 타이 직접 특정 항원에 대한 프로브에 표지 하였다. 크로마 또는 발광 제품 라벨의 강도가 강하거나 약한 신호 강도는, 샘플에 관심 단백질의 다소간 존재를 나타내고있다 농도계를 사용하여 측정한다. ECL은 더욱 민감하고, 따라서이 방법론 선호되지만 3 방법은 초기에이어서 3 확립보다 정교한 디지털 이미징 기술로 엑스레이 필름이 개발되었다. WB의 디지털 이미징의 발전뿐만 아니라 그들의 관심 단백질의 존재 여부를 결정하기 위해 연구를 허용하지만, 다른 샘플과 비교할 때, 또한 선택된 단백질의 발현 수준에 대한 추론을 허용하고, 따라서로 지칭 될 수있다 "반 정량적 & #8221 ;. 측정 된 형광의 레벨을 직접 시료 내의 수량 및 단일 단백질의 발현과 관련된다 최근 진정한 정량적 더 민감 웨스턴 블럿 기술이 개발되었다 : 정량적 (QFWB) 웨스턴 블로 팅 형광등.
ECL 표지와 QFWB를 비교하면, 형광 이차 항체의 사용은 선형 검출 프로파일 (4)를 생성한다. 이것은 신호 선형성 일반적 도처 발현 하우스 키핑 유전자 5,6로, 즉, 직접 단백질 발현과 관련된 5 μg의 신호 포화 아래 낮은 단백질 부하 발생 ECL 기법 대조적이다. 이 불균형은 대부분 전위 신호 포화의 높은 가능성의 결과로, 보조 바이오틴에 결합하는 아비딘 ECL 기판에 사용할 결합 부위의 수에 의해 크게 유발된다. 이것은 같은 ONL 지칭되는 ECL베이스 면역의 주된 이유 중 하나이다Y "반 정량적"7. 발현 수준에서의 미묘한 차이를 측정하고 측정에 부정확을 초래할 수있는 경우 신호의 포화 점은 매우 중요하다. 최근 몇 년 동안 계속 증가하는 민감도와 미묘한 표현 차이의 식별을 자세히 널리 프로테오믹스 기술의 출현은 검증 실험 8,9에 대한 진정한 양적 웨스턴 블로 팅에 계속 증가하는 의존 가져왔다. 민감한 강력한 진정 정량적 방법론의 적용은 따라서 중요하다.
많은 "최적화"서양 블롯 방법은 자주 인해 공식적인 문서화 된 프로토콜에서 쉽게 보이지는 미묘한 방법론 조정을 설정하거나 복제하기 어려울 독립적 인 실험실에 의해 이용되어왔다. 이 QFWB에 설립하고 강력한 프로토콜이며 추가로 일반적인 문제 그쪽으로 문제 해결을위한 유용한 전략을 제공합니다T 구현시 발생할 수 있습니다.
이 프로토콜은 원래 쥐의 뇌 균질 물과 함께 사용하기 위해 최적화되어 있지만, 이후 조직 샘플과 종 4,9,10의 넓은 범위에 걸쳐 효과적으로 사용되어왔다. 특정 문제를 해결하기 위해 필요한 잠재적 인 프로토콜의 변화가 포함되어 있습니다.
프로토콜
이 프로토콜은 변동성을 감소시키고 일관성을 개선하기 위해 상업적으로 생산 완충제, 겔 및 전송 스택을 사용하여 최적화되었다. 필요한 소모품의 전체 목록 자료 목록을 참조하십시오.
I-얼룩 고속 전송 및 LI-COR 오디세이 이미징 시스템을 사용하여 형광 WB 프로토콜
예제 1. 준비
- 버퍼 선택 / 준비
- 샘플 균질화를위한 적절한 추출 버퍼를 선택하고 모든 다운 스트림 기술이 사용되어야과 버퍼가 호환되는지 확인하십시오. 추출 완충액을 준비 : RIPA 완충액 (25 mM 트리스 - 염산 (pH를 7.6), 150 mM의 염화나트륨, 1 % NP-40, 1 % 나트륨 데 옥시 콜레이트, 0.1 % SDS) 분리를 샘플링하기 전에 5 % 프로테아제 억제제 칵테일을 함유.
주 : 거기 추출 버퍼의 다양한 종류가 가능하고 세포 내의 관심있는 단백질의 위치에 따라 선택된다. 여기에는 다음이 포함되지 않지만,RIPA 버퍼 (전 세포, 미토콘드리아 및 핵 요소), NP-40 용해 버퍼 (전 세포 또는 막 결합)과 트리스 트리톤 제한 (세포질 바운드 골격). 그러나, 추출 버퍼 내의 일부 화학 세제 용해 또는 단백질을 비활성화 할 수 있으나, 예 Bicinchoninic 산 (BCA) 분석을 특정 단백질 결정 분석을 사용할 때의 단백질 결정을 방해 할 수있다. 분석과 화학적 호환성에 대한 제조업체의 지침을 확인하십시오.
- 샘플 균질화를위한 적절한 추출 버퍼를 선택하고 모든 다운 스트림 기술이 사용되어야과 버퍼가 호환되는지 확인하십시오. 추출 완충액을 준비 : RIPA 완충액 (25 mM 트리스 - 염산 (pH를 7.6), 150 mM의 염화나트륨, 1 % NP-40, 1 % 나트륨 데 옥시 콜레이트, 0.1 % SDS) 분리를 샘플링하기 전에 5 % 프로테아제 억제제 칵테일을 함유.
- 단백질 추출 / 가용화
- 수동까지 다운스 또는 대략 1시 10분 / V (조직 무게 / 버퍼 볼륨) w 준비된 추출 완충액 폴리 프로필렌 팁 휴대용 전기 모지 나이저를 사용하여 균질화 하였다 가위 및 / 또는 메스를 사용하여 조직 샘플을 담가서 부드럽게 부드러운 / 일관된 균질 생산된다.
참고 : 작은, / 소중한 어려운 샘플을 얻기 위해, 세제를 기반으로 추출은 캘리포니아N 여전히 1 다운 효과 : 5. - 4 ℃에서 20 분 동안 20,000 XG에서, 원심 분리기 샘플을 균질화를 게시. 필요한 때까지 -80 ° C에서 용해 단백질과 저장소를 포함하는 상층 액을 제거합니다. 나중에 필요하면 추가로 더 엄격한 추출 할 수 있도록 불용성 펠렛을 유지합니다. 단백질 결정 단계 1.3로 진행합니다.
- 수동까지 다운스 또는 대략 1시 10분 / V (조직 무게 / 버퍼 볼륨) w 준비된 추출 완충액 폴리 프로필렌 팁 휴대용 전기 모지 나이저를 사용하여 균질화 하였다 가위 및 / 또는 메스를 사용하여 조직 샘플을 담가서 부드럽게 부드러운 / 일관된 균질 생산된다.
- 단백질 결정
- BCA, 브래드 포드 또는 유사한 분석을 사용하여 추출 된 각 시료 내 단백질의 농도를 결정합니다. 표준 곡선을 산출 할 때, 판정 비율 R 제곱 값의 계수는, 샘플 (15) 내의 단백질 풍부 가장 정확한 결정을 반영 0.99 이상인지 확인.
참고 : 모든 샘플이 QFWB에 의해 비교되는 같은 표준 곡선에 대해 분석해야합니다.
- BCA, 브래드 포드 또는 유사한 분석을 사용하여 추출 된 각 시료 내 단백질의 농도를 결정합니다. 표준 곡선을 산출 할 때, 판정 비율 R 제곱 값의 계수는, 샘플 (15) 내의 단백질 풍부 가장 정확한 결정을 반영 0.99 이상인지 확인.
- 시료의 준비
- 계획 및이 동일한 g 대해 사다리와 샘플의 로딩 순서를 기록ELS : 부하 제어와 같은 전송 및 젤이 젤 1. 가난한 또는 명백한 전송 발생할 수있는 편견을 방지하기 위해 순차적으로 제어하고 "처리"샘플을로드합니다.
- 각 샘플에 필요한 단백질 량을 계산한다. 신경 균주에서 단백질을 탐지하는 표준 단백질 15 μg의 부하이다. dH보다 2 O와 10 μL 볼륨으로 각 샘플을 확인 2 분 동안 98 ° C에서 로딩 버퍼, 소용돌이와 열 5 μl를 추가합니다.
- 이러한 관심의 올바른 밴드의 식별에 도움이되는 재조합 단백질로 양성 대조 샘플을 포함합니다. 그러나 잘못 대역 선택을 피하기 위해 제조사의 지침에 따라 올바르게 양성 대조군 샘플을 준비한다. 그림 1을 참조하십시오.
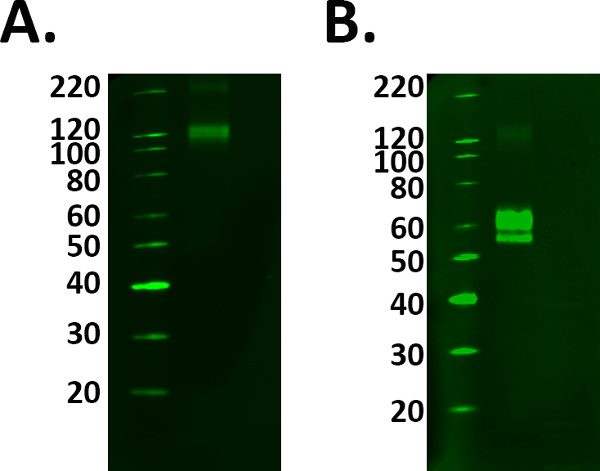
그림 1. Positive 제어 선택. 실험에 양성 대조군의 추가는 검출 라벨은 진짜 확인합니다. 그러나,주의는 컨트롤 실험 샘플을 사용하여 올바르게 이전에 작동 할 수 있도록주의해야합니다.) 융합 단백질 TREM 2가 1 ㎍ / ㎖로 제조 업체의 지침에로드 된, 그러나 데이터 시트 110 kDa의 충돌에서 관찰 라벨 분자 예측 60-70 kDa의. B) 환원제 첨가하고 인큐베이션 한 후 중량이 융합 단백질 라벨링 예측 분자량이 검출되었다. 그러나, 이는 환원 공정은 단백질의 신호를 감소로서 큰 단백질 부하가 필요 의미했다.
단백질 2. 전기 영동 분리
- 4~12% 비스 / 트리스 겔의 제조 (1.0 mm)
NOTE : 그라디언트 겔이 넓은 분자량 범위에서 큰 단백질 분리를 생산하는 데 사용된다.- 선택 및 MES를 준비또는 MOPS는 dH보다 2 O. 희석하여 (1 조 당 1 L) 완충액을 실행 MES 버퍼 kDa의 활발히 반면 런닝 버퍼가 단 15 kDa의 아래 저 분자량 단백질의 불량한 해상도를 가질 것이다 200 kDa의 상기 고 분자량의 단백질을 검출하는 것이 바람직하다 3.5-160 내 단백질의 더 나은 해상도를 생성한다.
- 겔의 발을 커버 빗 테이프의 스트립을 제거합니다. 부드럽게 1 ML의 피펫을 사용하여 버퍼를 실행하는 우물을 세척 할 것. 버퍼를 실행하는 우물을 채우고 기포가 젤에 남아 확인합니다.
- 젤 준비 및로드
- 탱크에 젤을 삽입하고 모든 바다 표범이 효과적으로 작동하고 있는지 버퍼를 실행하는 간 젤 칸을 채 웁니다.
- 이후 우물에 젤 1 젤 2.로드의 첫 번째 우물에 각 시료 10 μl를 분자량 표준의 3 μl를 추가합니다.
참고 : 사다리를 제외하고, 겔 1 젤 (2)가 동일해야합니다. 이 필수적 일 것입니다오디세이 이미 저 (700)의 채널에 표시하기 위해 총 단백질 염색을 사용하는 경우에 사용되는 겔이 미리 염색 분자량 표준에서 파란색과 볼. - 두 젤이로드되면, 나머지 실행 버퍼 탱크를 채우고 뚜껑을 고정합니다.
- 전기 영동
- "실행"샘플을 보장하기 위해 4 분 80 V에서 젤 균일 한 방식으로 폴리 아크릴 아미드 겔 매트릭스를 입력합니다. 그 후 각각 또는 샘플 염료 겔의 발에서 볼 수있을 때까지 50 분 동안 180 V의 전압과 시간을 증가시킨다.
NOTE : 높은 전압들은 짧은 실행 시간을 달성하기 위해 적용될 수있다. 그러나,이 겔의 중간 샘플 14 빠른 온도 증가에 의한 외측 차선 샘플보다 실행 "웃는"겔을 초래할 수있다.
- "실행"샘플을 보장하기 위해 4 분 80 V에서 젤 균일 한 방식으로 폴리 아크릴 아미드 겔 매트릭스를 입력합니다. 그 후 각각 또는 샘플 염료 겔의 발에서 볼 수있을 때까지 50 분 동안 180 V의 전압과 시간을 증가시킨다.
로드 컨트롤 젤의 3. 총 단백질 얼룩
- 사용 카세트로부터 릴리스 겔이젤 칼. 우물과 겔의 발을 제거합니다. 방향을 돕기 위해 젤을 표시합니다.
- 사각형 페트리 접시 (대략적인 크기 12 X 12cm)에 단백질 얼룩의 약 30 ml에 가만히 따르다. 용액을 보장하는 것은 전체 겔을 커버 단백질 염색으로 겔이를 배치 한 후 염색을 실온에서 1 시간 최소 겔 선동.
- 단백질 얼룩을 가만히 따르다 전에 시각화에 증류수에 겔 3 배 씻는다. 시각화 6.3 단계로 진행합니다.
4. I-얼룩 세미 드라이 빠른 단백질 전송
NOTE : I-블롯 기계를 사용하여 단백질의 전송을 위해 필요한 모든 시약은 특히 I-블롯 방법론 설계된 시판품이고 자재 목록에서 발견 될 수있다.
- "바닥"전송 스택을 준비합니다. 호일 커버와 젤 탱크에서 직접 버퍼를 실행하는 사전 젖은를 제거합니다. 증류수로 사전 젖은 종이 필터.
- 단계를 반복 3.1 및 장소 젤 1 위에준비된 "바닥"전송 스택.
- 젤을 통해 사전에 젖은 종이 필터를 놓습니다. 기포가 층 사이에 포획되지 보장 여과지 겔 롤.
- 최고 전송 스택에서 호일 뚜껑을 제거하고 필터 종이와 바닥 스택 맨 위에 상단 스택을 마련. 공기 방울을 제거하기 위해 전송 스택 "샌드위치"롤.
- I-얼룩 기계의 뚜껑에 전송 스택 키트에서 스폰지를 삽입합니다. 닫아서 안전하게 I-얼룩 기계에 전용 공간에 전송 스택 샌드위치를 놓습니다. I-얼룩을 시작하고 프로그램 3 8.5 분 동안 전송할 수 있습니다.
- 낮은 단백질 신호 또는 불균일 높은없는 경우, 저 분자량의 단백질 비율이 반 건조 "빠른"전송 방법을 사용하는 경우, 제조자의 전송 시간을 테스트. 도 2에 도시 된 바와 같이 이상적인 전사 전압 / 시간 조합을 결정하기 위해 동일한 하중의 반복 샘플을 사용하여 간단한 최적화 프로토콜을 실행 .
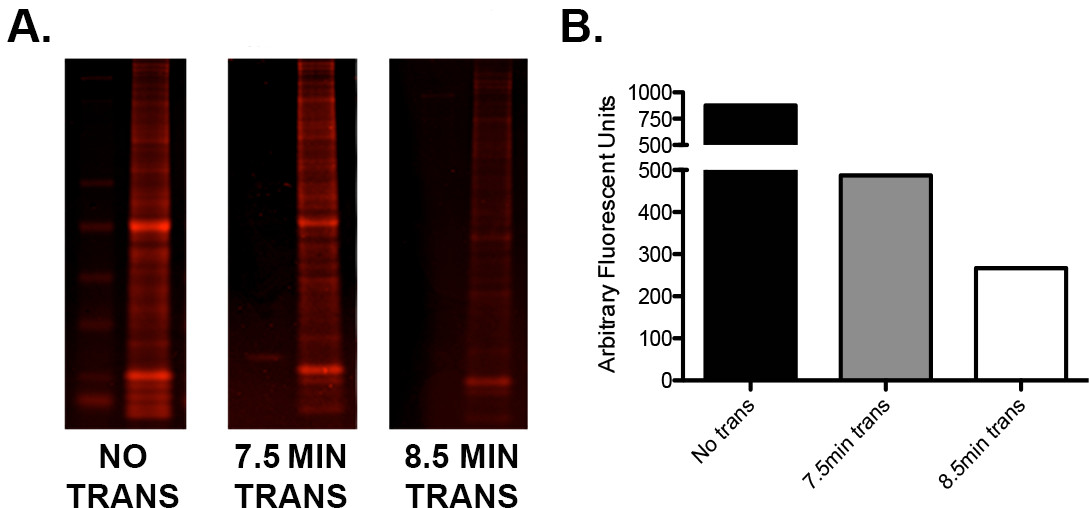
그림 2. I-오.을 사용하여 전송) 사다리와 함께로드 하나의 젤의 최적화 및 세 탠덤 반복에서 쥐의 뇌 전체를 균질의 15 μg의 세 부분으로 절단되었다. 섹션 중 하나가 전송되지 않은, 하나는 (제조업체의 지침에 따라) 7.5 분 동안 전송 8.5 분이었다. 겔 다음이 섹션 (680) 채널에서의 열전달에 스캔 정량화. B) 각 겔의 잔류 단백질 함량의 차이를 보여주는 정량 값의 그래픽 표시가 0, 7.5, 및 8.5 분 다음, 인스턴트 블루 단백질 염색으로 염색 하였다 전송. 전송 시간의 추가 분은 약 45 %의 추가 단백질 전송 결과합니다.e.com/files/ftp_upload/52099/52099fig2large.jpg "대상 ="_ 빈 ">이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
단백질 5. 항체 검출
- 막 제조 및 차단
- I-얼룩 컴퓨터에서 전송 스택을 제거합니다. 하단 전송 스택에 젤을 노출 상단과 여과지 층을 제거합니다.
- 메스 젤 주위 잘라 및 방향을 위해 삼각형 컷이 막에 표시되어 있는지 확인합니다. 막 트리밍에 따라, 단백질은 전송 효율을 확인 및 / 또는 폐기 할 수있는 젤 얼룩.
- 신속 1X PBS 5 mL를 함유 한 깨끗한 50 ML 튜브 (또는 이에 상응하는 소켓)로 막 이동하고 일정한 교반을위한 기계 롤러 (또는 궤도 플랫폼)에 배치합니다.
참고 : 막 건조 할 수 없습니다하는 것이 중요합니다. 세미 드라이 전송하는 동안 막 뜨거워집니다. 이 난을 허용으로 전송 스택을 열기 전에 2 분을 기다립니다t가 냉각 스택 해체 동안 느린 건조 시간입니다. 세척 및 배양 동안 교반을위한 롤러와 튜브의 사용은 필요한 솔루션의 볼륨이 크게 감소 할 수 있습니다. - 1X PBS에 막 3 × 5 분을 씻으십시오. 1X PBS를 폐기하고, 실온에서 30 분 이상 동안 희석 블로킹 완충액으로 막을 차단.
- 차 항체 준비.
- 0.1 % 트윈 20 블로킹 완충액으로 5 ㎖의 제조사의 지침에 따라 차 항체를 준비한다. 일정한 교반과 함께 4 ℃에서 하룻밤 준비된 차 항체와 멤브레인을 품어.
참고 : 버퍼를 차단하는 것은 일반적으로 원액을 사용하지만 1까지 희석 될 수있다 (4) PBS로 차 항체가 충분히 높은 특이성이있는 경우. - 일차 항체를 버리고 1X PBS로 5 분 각각의 막 6 회 반복한다.
- 0.1 % 트윈 20 블로킹 완충액으로 5 ㎖의 제조사의 지침에 따라 차 항체를 준비한다. 일정한 교반과 함께 4 ℃에서 하룻밤 준비된 차 항체와 멤브레인을 품어.
- 이차 항체의 선택 및 준비
- 세코의 경우ndary는 위의 단계 5.2.1와 5.2.2을 생략하고 샘플의 특정 보조 밴딩 패턴을 결정하기 위해 5.3 단계로 진행, 제어 목적에 대한 평가 레이블. 그림 3을 참조하십시오.
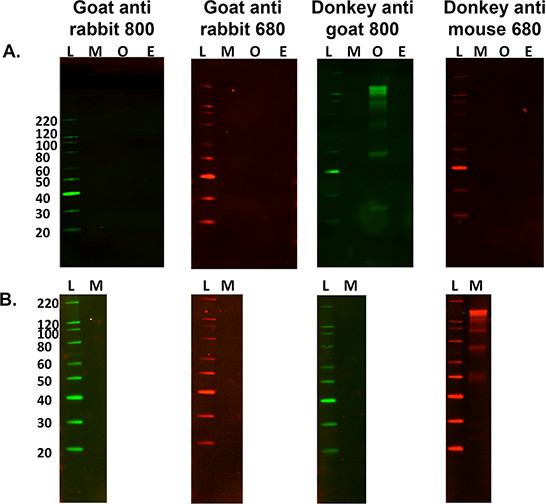
이차 항체의 그림 3. 최적화.) 쥐의 15 μg의 (M)에 대한 보조 만이 아닌 특정 라벨의 멀티 종 비교, 네이쳐스 (O)과 형광의 다양한 말 (E) 신경 조직 균질 이차 항체를 태그 . L은 분자량 사다리이다. 양의 조직 파쇄 당나귀 항 - 염소 800 항체. B를 사용할 때에 단지 샘플 이는 상이한 조직 샘플을 사용하는 경우, 비특이적 라벨링 발생시 확인하는 것이 중요하다) 보조 라벨과 교차 - 반응이었다 즉, 쥐의 비복근 근육 (15 _6; g 부하). 이 샘플 간 마우스 뇌 파쇄 액을 사용하는 경우가 있지만이 발생하지 않은, 당나귀 항 마우스 680 이차 항체와 반응한다.
- 형광 0.1 % 트윈 20로 버퍼를 차단에서 농도를 권장 제조 업체 다음 이차 항체 (680) 또는 800 (적색 또는 녹색 채널) 태그 준비합니다. 일정하게 교반하면서 실온에서 90 분 동안 제조 된 이차 항체로 어둠 막을 인큐베이션.
- 이차 항체를 버리고 1X PBS로 세척 당 5 분 동안 막 6 회 반복한다. 시각화 - 6 단계로 진행합니다.
- 적절한 추가 단계로 이차 항체의 범위 마커의 가시화가 예상대로 작동하지 않는 경우, 시험 사다리. 모든 차 항체는 시중에서 판매하는 모든 사다리의 모든 마커 밴드의 시각화 할 수 있습니다.
- 예상 밴드가 표시되어 있지 않으면, 즉, 동크 대안 보조 호스트를 사용염소 항 토끼 대 도망 안티 토끼는 적절한 프로토콜 변경을 나타냅니다. 그림 4를 참조하십시오. 이차 항체를 발생하는 데 사용 호스트 종은 때때로 인해 특정 기본 항체 특이성의 부족으로 시각화에 문제가 발생할 수 있습니다.
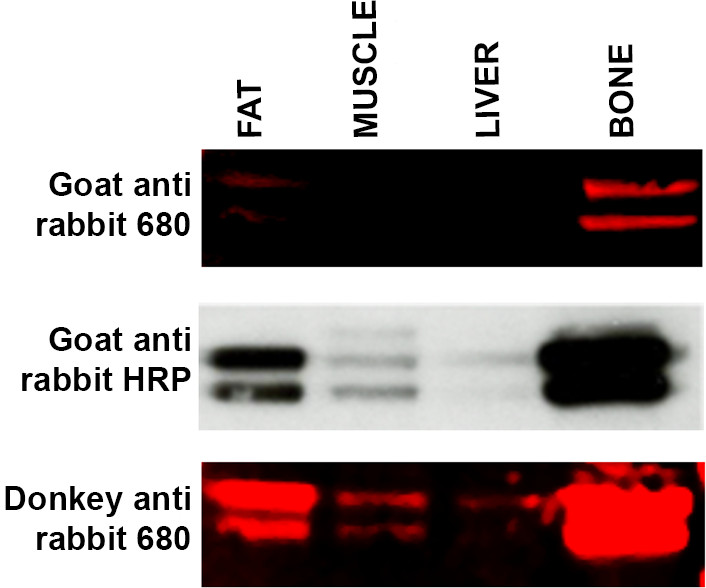
뼈 지방, 근육, 간, - - ERK 차 항체와 함께 배양 세 가지 다른 이차 항체와 함께 배양 그림 4. 문제 해결 차 항체 특이성 조직 샘플의 범위의 웨스턴 블롯 (레인 당 15 μg의 단백질).. 상단 패널 : LI-COR의 염소 항 - 토끼와 함께 680 차 항체를 표지 WB는 지방과 뼈의 약한 라벨을 생산하고 신호가 간과 근육 샘플에서 검출되지 않았다. 가운데 패널 : 멤브레인 (상단 패널)을 벗겨에 repr했다보조 링크 ECL 방법론 및 염소 항 - 토끼 HRP를 사용 오벳. 밴드는 근육과 간 샘플에서 지금 볼 수 있습니다 및 라벨은 지방과 뼈 표본에서 더 강렬 나타납니다. 하단 패널 : (상단과 중간 패널) 멤브레인 제거와 LI-COR 당나귀 안티 - 토끼에게 ERK 차 항체에 대한 더 큰 친화력을 보여 주었다 680 차 항체를 사용하여 reprobed했다. 근육과 간을위한 라벨링 지금 지방과 뼈 모두 샘플에서 증가 된 신호 강도를 볼 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
6. 시각화
참고 : 모든 이미지는 LI-COR 오디세이 클래식 이미 저와 관련된 이미지 프로 분석 소프트웨어 (버전 3.1.4)를 사용하여 획득된다.
- 전원을 켜고 컴퓨터와 화상 카메라에 로그온합니다. 이미징 소프트웨어를 열고 새 파일을 만듭니다. 그림 5를 참조하십시오.
: FO "jove_content" 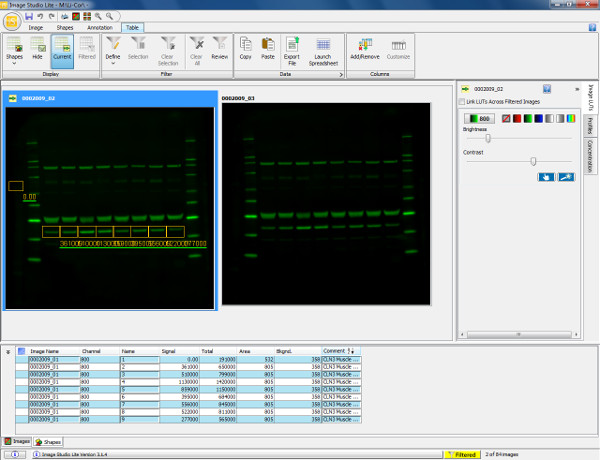
그림 5. 시각화 및 웨스턴 블롯의 정량화. 쥐의 비복근 근육 (30 μg의 부하)를 나타낸 웨스턴 블롯의 스캔 넥신 V 일차 항체 (36 kDa의)과 염소 항 - 토끼 800 차 항체 프로브. 막 스캔 및 800 채널에서 가시화되었다. 단백질 (아 넥신 V)를 정량화하기 위하여, 직사각형 박스는이 후 복사와 같은 면적의 측정을 보장하기 위해 나머지 샘플 차선 위에 붙여 시료 1에서 관심있는 주파수 대역의 주위에 그려진다. 배경 자동적 그려진 형상 주위 회계 있지만 정확하게 정의 배경 측정을 보장하기 위해 변경 될 수있다. 아래의 표는 차감 배경으로 총 얻은 신호, 배경 및 신호를 포함 그려 각 모양의 정량화 된 측정 값을 표시합니다. 이 정보는 다음에 내보낼 수 있습니다스프레드 시트 프로그램 (상대 형광 강도에 의해 결정)의 발현 비율을 계산하고 이후의 통계 분석을 수행 할 수있게합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 열 화상 카메라의 뚜껑을 엽니 다. 왼쪽 하단의 유리에 1X PBS 소량 붓고 후 PBS 위에 막을 배치. 멤브레인은 멤브레인과 그리드 축 사이에 남아있는 열 화상 카메라의 축과 1cm 간격으로 사각형 확인하십시오.
- 기포가 유리와 막 사이에 갇혀 있지 보장 막을 롤.
- 멤브레인은 x 및 y 축 상에 점유 된 사각형의 수를 계산. 이미 저 뚜껑을 닫습니다. 멤브레인은 컴퓨터 소프트웨어에 차지하는 사각형의 수를 입력한다.
- 형광 태그에 따라 달라집니다 막를 스캔하고 해당 채널을 선택차 항체의 즉, 700 채널 또는 680 또는 800 형광 태그 항체를 각각 사용 된 800 채널입니다. 이중 라벨링이 실행될 때, 양쪽 채널 스캔.
참고 : 이전에 이중 라벨을 수행하기에 하나의 단백질 라벨링을 최적화합니다. - 높은 풍부한 단백질이 저 강도 스캔을 사용하는 경우, 멤브레인을 스캔 강도를 선택합니다. 차 항체가 관심의 단백질이 더 높은 강도의 스캔을 선택에 대한 가난한 친화력이 다른 경우, 즉, 레벨 5를 눌러 검사를 시작합니다 시작합니다. 6.4 단계로 진행합니다.
- 로드 제어 겔 시각화 (도 6).
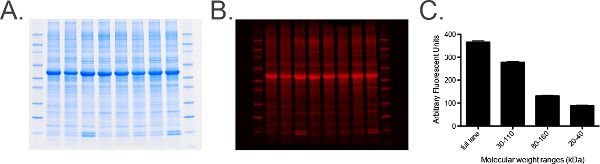
패널에서 그림 6. 총 단백질 라벨링 및 분석.) 레인. B 당 말의 자궁 신경 균질의 20 μg의를 포함하는 총 단백질 표지 젤의 사진) 젤총 단백질 염색 겔로부터 정량화 된 측정 채널 (680). C) 그래프에서 스캔 이미징 소프트웨어를 이용하여 획득. 분자량 마커에 의해 결정된 측정 범위, 즉, 30 내지 110 kDa의는, 표준 오차를 보장하기 측정치의 히스토그램을 제공하기 위해 수행된다 (SEM)는 각 샘플의 전체 단백질 농도가 균일 한 것을 나타내는 (그룹화 된 샘플의) 낮은 젤에 걸쳐. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.- 팔로우 6.1 및 6.2 단계를 반복합니다.
- 그리드 축이 시작되는 화상 카메라의 하단 모서리에 유리에 증류수를 부어.
- 물 위에 젤을 놓고 그래서 차선 X 또는 그리드의 Y 축 중 하나에 수직으로 이동합니다. 그리드의 y 및 x 축을과 겔 사이 1cm 간격을두고 겔 그리드 축 차지하는 사각형의 개수를 카운트. 가까운열 화상 카메라의 뚜껑.
- 겔은 컴퓨터 소프트웨어에 차지하는 사각형의 수를 입력한다.
- 총 단백질 염색 젤을 스캔하는 700 채널을 선택합니다.
참고 : 블루 700 채널 형광. - 5 눌러 시작 강도를 설정합니다.
- 스캔 한 이미지의 정량화
- 최상의 이미지 품질을 생산하기 위해 밝기와 대비 버튼을 조정합니다. 높은 배경 잡음이있을 나타나는 경우, 낮은 강도에서 막를 다시 검사하고 고품질의 스캔 설정을 사용합니다.
참고 : 모든 조정을 스캔 할 때 인수 형광 데이터를 변경하지 않습니다. - 획득 한 데이터없이 변경으로 원하는 방향으로보기 위해 이미지를 90 °, 180 ° 및 270 ° 회전합니다. 보다 3 °로 "자유 회전"에서 방향의 작은 조정을 할 때 그러나함으로써 픽셀 값에 수집 된 데이터가 왜곡 될 수있어 정량 결과에 영향을 미친다.
- 모양 메뉴에서 모양을 선택합니다 - 대부분의 경우 사각형을 사용 - 관심의 밴드 (WB) 또는 샘플 레인 1의 전체 차선 (총 단백질 젤)의 주위에 그립니다.
- 복사 및 관심 분야와 전체 차선의 샘플 레인 2 대역에 걸쳐 모양을 붙여 넣습니다. 모든 샘플에 대한 관심의 각 밴드와 총 단백질 젤에 대한 각 레인에 걸쳐 반복합니다.
- 배경 측정은 다음 차선에서 신호를 포함하지 않음을 확인합니다. 배경은 소프트웨어에 의해 자동으로 공제 그려 모양을 바탕으로 전체 가장자리를 포함되거나 위 / 아래 또는 왼쪽과 모양의 권리로 지정 될 수있다 할 수있다. 대안 적으로, 사용자 정의 배경 상자를 나타낸다.
- 임의의 형광 단위로 그려 각 모양의 모양 테이블에 대한 신호를 표시합니다. 배경은 자동으로 신호에서 공제됩니다.
- 다른 소프트웨어에서 볼 수있는 TIF 파일로 이미지를 내 보냅니다. 이미지를 내보내고 USI를 조작하지 마십시오이 같은 NG가 아닌 이미지 Pro 소프트웨어는 잘못된 데이터를 생성하는 화상 카메라에 의해 획득 된 원래의 데이터를 변경합니다.
- 단계를 반복 6.4.3-6.4.7 이중 라벨을 정량화 또는 생성 및 표준 오류 데이터를 대조하는 부하 제어 젤에 다수의 측정을 수행 할 때.
- 최상의 이미지 품질을 생산하기 위해 밝기와 대비 버튼을 조정합니다. 높은 배경 잡음이있을 나타나는 경우, 낮은 강도에서 막를 다시 검사하고 고품질의 스캔 설정을 사용합니다.
7. 포스트 시각화
- 1X PBS에서 세포막을 유지 또는 미래의 재 프로빙과 관심의 다른 단백질 막 제거에 대한 장기 보관을 위해 건조.
- 스트리핑 및 막 다시 프로빙. 그림 7을 참조하십시오.
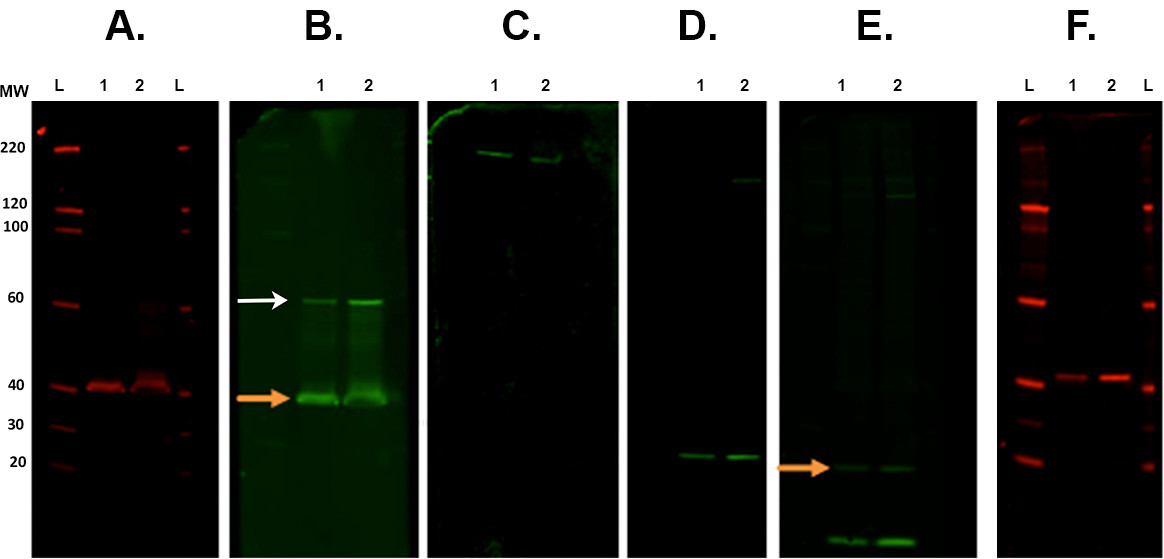
그림 7. 막 제거와 reprobing. 적외선 영상 시스템. 스캔 다양한 제거 단계에 따라 막의 대표적인 예. 처음 면역은 CSP 차 항체 (토끼)로 수행하고 7에서 스캔 하였다00 채널. B. 먼저 제거 및 800 채널 ROCK2 (토끼)와 reprobing. 오렌지 화살표는 스트립 재 프로브 후 현재 CSP 차 항체 남아 나타냅니다. 밴드가 더 높은 분자량 (흰색 화살표). C에 존재 이것은 ROCK2의 측정에 영향을 미치지 않는다. 두 번째 제거 및 800 채널. D에 β-스펙 트린 항체 (염소)와 reprobed 및 시각화. 셋째 제거 및 α-시누 클레인 항체 (토끼). E와 reprobing. 넷째 제거 및 800 채널 유비퀴틴 항체 (마우스)와 reprobing. 마지막 항체에서 나머지 신호 여전히있다 (α-시누 클레인은. 주황색 화살표). F. 다섯 번째 제거 및 700 채널 군데 CALB2 항체 (토끼)와 reprobing. 사용 된 차 항체는 있었다 : 염소 항 - 마우스 800cw, 염소 항 - 토끼 680rd, 염소 항 - 토끼 800cw, 당나귀 방지 염소 800cw (자료 목록 참조). 레인 라벨 : L - 사다리, 1/260 - 샘플 1/2. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.- Revitablot 제거 버퍼의 약 30 ml의를 포함하는 일정한 교반과 함께 실온에서 5 ~ 20 분 사이에 배양되는 사각형 페트리 접시에 넣어 막 (들).
- 발생한 막 (들) PBS에서 3 회 후 형광의 완전한 제거를 확인하기 위해 이미 저에 다시 검색 세척 -이 단계는 모든 스트립 후 반복해야합니다.
- 형광가 남아있는 경우 오랜 기간 동안 막 (들)을 품어. 남아있는 보조 신호가없는 것을 확인하기 위해 각 스트립 후에 막을 재검색.
NOTE : 멤브레인 (들)만을 벗겨 막의 무결성 비를 알리기 위해 바람직하지 않은 높은 배경 결과 손상되지 않았 음을 보장하기 위하여 3 회 최대 reprobed한다.
결과
QFWB 감도 및 검출의 선형 범위를 기존의 ECL 검출보다 큰으로하여 효율적인 해석을 돕는 정확한 데이터가 수집되는 것을 보장하기 위해 매우 중요하다 통제 조치의 숫자가 있습니다. 첫째로, 양성 대조군 샘플의 포함은도 1에 도시 된 바와 같이. 둘째, 전송 최적화 멤브레인 겔로부터 고 분자량 및 저 분자량 단백질의 상응하는 이동을 보장하기 위하여도 2에 나타나는 바와 같이. 셋째, 항체의 최적화, 특히 이차 그 최적화 종종 간과되지만, 항체는 관심 단백질 (들)의 정확한 해석을 방해 할 밴딩 비특이적 생산할 수있다. 도 3 참조. 넷째, 또한 수있다 경우 단백질이 검출되지 나타나지만 존재할 것으로 예상되는 경우, 이는 단순히 보조 RAIS를 사용하여 보정 될 수 이차 항체 문제가 될 수 있다는다른 종의 호스트에 에드. 도 4를 참조. 다섯째, 총 단백질 라벨 및 분석 도처 내부 참조 표준 3 표현 전통적인 단일 단백질 (들)의 사용에 비해 훨씬 더 견고하고 정량화 방법이다. 이러한 단일 단백질의 대부분은 차동 퇴행성 신경 질환의 모델 간에는 물론 다른 조직 샘플에서 발현되는 것으로 밝혀졌다 표현의 균일 성이 동일한 조직 내 3 변경할 수있다. 표준 오차를 나타내는 비교하고, 각 샘플에 대해 측정 된 다양한 분자량 범위에서 각 레인에서 단백질 부하를 정량함으로써 총 단백질 분석과 결합 될 때,도 6에서 입증 된 바와 같이 따라서로드 제어 겔의 제조는 시료 하중의 균일 성을 확인한다 . 중요한 것은, 이러한 문제 해결 기술 및 모든 컨트롤 만 분석 t의 민감도 일관성만큼 효과적운영자 (그림 5)에 의해 적용 ools. 마지막으로이 기술은 스트리핑과 같은 요인을 포함하지만 장기간 저장 조건 하에서 감도 증가, 감소 된 배경, 이중 색상 검출 및 막 안정성에 한정되지으로 ECL보다 더 유연성을 가진 멤브레인의 재 프로빙라는 것으로. 그림 7을 참조하십시오.
토론
등을 고려해서 계획은 실험에 앞서 필수적이며 궁극적으로 사용 된 기술의 성공 여부를 확인할 수 있습니다. 적절한 항체, 전송 및 시각화 방법을 사용하기로 선택하려고 할 때 잠재적 인 장애물의 과다를 제공 할 수 WB를 사용하여 단백질 검출 발전. 다행히, 단백질의 존재와 샘플 사이 점점 더 미묘한 표현의 차이를 결정하기 위해 일상적으로 사용할 수있는 QFWB주의 깊게 점검하고 적절한 통제 수단을 사용. 이 프로토콜은 방지 및 / 또는 그와 관련된 많은 일반적인 함정 중 일부를 극복하기 위해 형광 양적 서부 모래 바닥뿐만 아니라 몇 가지 문제 해결 전략에 포괄적 인 가이드를 제공합니다.
감도를 유지하고 획득하기 위해 사용되는 중요한 단계는 진정으로 정량화 및 비교 측정은 다음과 같습니다 : 조직 샘플에서 1) 강력한 단백질 추출; 2) 샘플 준비; 3) 정확한 단백질 loading는 총 단백질 분석에 의해 측정; I-의 얼룩을 사용하여 단백질의 4) 최적의 전송; 열전달 및 관련 소프트웨어를 사용하여 0.1 % 트윈 20을 포함하는 버퍼를 차단하는 일차 및 이차 항체의 5) 준비, 6) 올바른 시각화 및 분석.
적외선 형광 검출은 진정으로 정량적이고 전통적인 ECL 검출 기법 3,11에 비해 민감도를 제공한다. 이 검출 시스템은 여러면 처리이며, 같은 QFWB에 한정되지 않는다. 이 시스템은 전체 조직 절편 (12)의 시각화 및 정량화를 허용 저전력 면역 조직 라벨링 촬상 할 수있다. 이 정량적 평가의 측면에서 기존의 현미경과 기존의 면역 캡처 필적까지 빨간색 영상을 볼 수 있었다 해상도의 측면에서 잠재적 인 미래 개발의 한 영역이다.
그러나, P의 미묘한 변화에 대한 민감도와최소 제어 조치를 유지 표현이 변동성을 보장하기 위해 매우 중요합니다 rotein하는 강력한 프로토콜과 엄격한이다. 이 샘플 로딩이 균일 검색이 현실과 관련하여 제조업체의 지침을 테스트하는 것은 전송하는 것입니다 여부를 결정하기 위해 기본 및 보조 항체의 최적화임을 보증을 제공하기 위해 총 단백질 스테인드 젤의 생산 다음에 조직 샘플에서 엄격한 단백질 추출로 시작 시간 효율적인 단백질 전달을 얻었다.
그럼에도 불구하고, WB의 조건이 최적화되는 경우에도, 여전히 문제가 완전히 여기에 탐험되지 않았을 수 있습니다 서부 실행과 관련이있다. 이들은 다음을 포함하지만, 단백질의 가용화 및 추출 완충액의 선택 등 다양한 요인에 한정되지 않는다. 일부 버퍼 단백질 농도 분석을 방해 할 수 있지만, 몇몇 조직은 자동화 macera의 사용으로 더 강력한 기술을 필요로 용해하는 것이 특히 어렵다팅은 맥의 dissociator과 함께 M 튜브 등의 용기를 밀봉. 또한, -80 ° C에서 추출 및 비 추출 된 물질의 저장을위한 간단한 제어 조치를 즉시 추출 후 최적의 라벨을 획득하고 가난한 결과 주 후 가진 사이의 차이가 될 수 있습니다.
현대 QFWB 방법은 단백질 발현에 미묘한 차이를 캡처 더 민감한 것으로 입증 및 ECL 같은 이전의 기술과 비교했을 때 더 융통성 동시 듀얼 라벨 3을 허용한다. 그것은 서양 블로 팅 프로토콜이 강력하고 정확한 정량 및 통계 분석을 위해 쉽게 반복적 것이 중요합니다. 이 프로토콜은 서로 다른 조직 샘플 종 (3)의 종류에 걸쳐 단백질의 검출을 위해 일상적으로 사용하기에 민감하고 강력한 충분히 따라서 실험 1 당 소비 사용량뿐만 아니라 시간을 감소 동일한 QFWB 내 로우 및 하이 풍부 단백질의 정량화를 허용. 9,14 그러나 정확성함으로써 잘못된 데이터 수집을 방지하기 위해 준수해야 중요하고 적절한 통제 조치의 포함이다 오믹 연구 - (1) 또한,이 기술의 증가 감도는 점점 더 인기를 검증 할 수 있습니다.
공개
The authors have nothing to disclose.
감사의 말
우리는 덕분에 금융 지원을 위해 다음과 같은 것이다 : BBSRC 연구소 전략 프로그램 기금 - CF 및 TMW을; BBSRC 동부 바이오 DTP 자금 - LG; 에딘버러의 다윈 신뢰 - MLH. 우리는 또한이 원고의 TREM2 최적화를 포함 할 수있는 권한에 대한 박사 배리 맥콜에게 감사의 말씀을 전합니다.
자료
| Name | Company | Catalog Number | Comments |
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| RIPA Buffer | Fisher Scientific UK Ltd | 10230544 | |
| M Tubes | Miltenyi Biotec Inc. | 130-093-236 | |
| iBlot Transfer Stack, PVDF Regular | Life technologies, UK | IB401001 | |
| MagicMark XP Western Protein Standard (20-220 kDa) | Life technologies, UK | LC5602 | Use in gel 1 for Western blotting |
| SeeBlue Pre-stained protein standard | Life technologies, UK | LC5625 | Use in gel 2 Total protein stained gel |
| NuPAge LDS Sample buffer 4X | Life technologies, UK | NP0007 | |
| NuPAGE MES SDS Running Buffer (for Bis-Tris Gels only) (20X) | Life technologies, UK | NP0002 | |
| NuPAGE Novex 4-12% Bis-Tris Gel 1.0 mm, 12 well | Life technologies, UK | NP0322BOX | |
| PHOSPHATE BUFFERED SALINE TABLET,*TRU-ME, PHOSPHATE BUFFERED SALINE TABLET | Sigma-Aldrich, UK | P4417-100TAB | |
| Micro BCA, Protein Assay Kit | Fisher Scientific UK Ltd | 10249133 | |
| Odyssey blocking buffer | Li-Cor Biosciences | P/N 927-40000 | |
| IRDye 680RD Goat anti-Rabbit IgG (H+L), 0.5 mg | Li-Cor Biosciences | 926-68071 | |
| IRDye 680RD Donkey anti-Mouse IgG (H+L), 0.5 mg | Li-Cor Biosciences | 926-68072 | |
| IRDye 800CW Goat anti-Rabbit IgG (H + L), 0.5mg | Li-Cor Biosciences | 926-32211 | |
| IRDye 800CW Donkey anti-Goat IgG (H + L), 0.5mg | Li-Cor Biosciences | 926-32214 | |
| ODYSSEY CL Infra-red imager | Li-Cor Biosciences | Call for quotation | |
| iBlot 7-Minute Blotting System | Life technologies, UK | This model is no longer in production | |
| InstantBlue Protein stain | Expedeon, UK | ISB1L | |
| Revitablot western blot stripping buffer | Rockland Immunochemicals Inc. | MB-085-0050 |
참고문헌
- Towbin, H., Staehelin, T., Gordon, J. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. Biotechnology. 1992 (24), 145-149 (1979).
- Walker, J. M. . Protein Protocols on CD-ROM. , (1998).
- Gallagher, S., Winston, S. E., Fuller, S. A., Hurrell, J. G. Immunoblotting and immunodetection. Curr Protoc Mol Biol. Chapter. 10, 10 (2008).
- Eaton, S. L., et al. Total protein analysis as a reliable loading control for quantitative fluorescent Western blotting. PLoS One. 8 (8), 72457 (2013).
- Suzuki, O., Koura, M., Noguchi, Y., Uchio-Yamada, K., Matsuda, J. Use of sample mixtures for standard curve creation in quantitative Western blots. Exp. Anim. 60, 193-196 (2011).
- Colella, A. D., et al. Comparison of Stain-Free gels with traditional immunoblot loading control methodology. Anal Biochem. 430 (2), 108-110 (2012).
- Zellner, M., et al. Fluorescence-based Western blotting for quantitation of protein biomarkers in clinical samples. Electrophoresis. 29, 3621-3627 (2008).
- Kielar, C., et al. Molecular correlates of axonal and synaptic pathology in mouse models of Batten disease. Hum Mol Genet. 18, 4066-4080 (2009).
- Mutsaers, C. A., Lamont, D. J., Hunter, G., Wishart, T. M., Gillingwater, T. H. Label-free proteomics identifies Calreticulin and GRP75/Mortalin as peripherally accessible protein biomarkers for spinal muscular atrophy. Genome Med. 5 (10), 95 (2013).
- Wishart, T. M., et al. Dysregulation of ubiquitin homeostasis and β-catenin signaling promote spinal muscular atrophy. J Clin Invest. 124 (4), 1821-1834 .
- Mathews, S. T., Plaisance, E. P., Kim, T. Imaging systems for westerns: chemiluminescence vs. infrared detection. Methods Mol Biol. 536, 499-513 (2009).
- Hawes, J. J., Brunzell, D. H., Wynick, D., Zachariou, V., Picciotto, M. R. GalR1, but not GalR2 or GalR3, levels are regulated by galanin signalling in the locus coeruleus through a cyclic AMP-dependent mechanism. J Neurochem. 93 (5), 1168-1176 (2006).
- Bond, D., Primrose, D. A., Foley, E. Quantitative evaluation of signaling events in Drosophila S2 cells. Biol Proceed Online. 10 (1), 20-28 (2008).
- Wishart, T. M., et al. Differential proteomics analysis of synaptic proteins identifies potential cellular targets and protein mediators of synaptic neuroprotection conferred by the slow Wallerian degeneration (Wlds) gene. Mol Cell Proteomics. 6, 1318-1330 (2007).
- Silva, J. M., McMahon, M. The fastest western in town: a contemporary twist on the classic western blot analysis. J. Vis. Exp. (84), 51149 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유