Method Article
Руководство по современной количественной Люминесцентная Вестерн-блоттинга с устранения неисправностей стратегий
В этой статье
Резюме
The advancement of western blotting using fluorescence has allowed detection of subtle changes in protein expression enabling quantitative analyses. Here we describe a robust methodology for detection of a range of proteins across a variety of species and tissue types. A strategy to overcome common technical problems is also provided.
Аннотация
Конец 1970-х увидел первый публично сообщил использования вестерн, методики для оценки присутствия и относительное обилие специфических белков внутри сложных биологических образцов. С тех пор, западная блоттинга методология стала общим компонентом в молекулярных биологов экспериментальной репертуара. Беглый поиск PubMed использовать термин "Вестерн-блот" предполагает, что сверх 220 000 опубликованных рукописей сделали использование этой техники в 2014 году главное, за последние десять лет наблюдается технические достижения визуализации в сочетании с развитием чувствительных флуоресцентные метки, которые улучшили чувствительность и принес еще большую диапазоны линейного обнаружения. В результате в настоящее время по-настоящему Количественное флуоресценции основе Вестернблоттинг (QFWB), что позволяет биологам провести сравнительный анализ экспрессии с большей чувствительностью и точностью, чем когда-либо прежде. Многие "оптимизированы" Вестерн-блоттингаМетодологии существуют и используются в различных лабораторий. Они часто оказываются трудно реализовать из-за требования тонких, но без документов процедурных изменений. Этот протокол обеспечивает всестороннее описание установленной и надежный метод QFWB, в комплекте с стратегий по устранению неполадок.
Введение
Вестерн-блоттинг (WB) является аналитический метод, первоначально разработана в конце 1970-х годов, чтобы определить наличие или отсутствие интересующего белка в сложной биологической пробе, такой как гомогената ткани 1. Обычно называют белкового иммуноблоттинга, из-за ключевого взаимодействия антитело-антиген, методика состоит из 5 различных этапов: 1) электрофоретического разделения белков по их изоэлектрической точке; 2) передача на нитроцеллюлозный или поливинилидендифторид (PVDF) мембраны; 3) маркировки с использованием первичного антитела, специфичного к интересующего белка; 4) инкубацию со вторичным антителом, направленным против первичного антитела; и 5) визуализация.
Методология Визуализация превратилась со временем повышения безопасности и чувствительность. Некоторые из первых WBS проводились с использованием меченых радио меток, которые затем продвинулись на колориметрический а затем более широко используются методы chemilluminescent (ECL). Radioactiviти непосредственно помечены на зондов для специфических антигенов в то время как колориметрические и ECL методологии использовать косвенную технологии маркировки с ферментом репортера, например, щелочной фосфатазы или стрептавидин пероксидазы хрена (HRP) 2. Интенсивность мечения хромоген или люминесцентного продукта измеряется с помощью денситометрии в результате чего мощность сигнала, сильным или слабым, указывает более или менее присутствие интересующего белка в образце. ECL является более чувствительным, и поэтому выступает методология 2, но все 3 метода были изначально разработаны на рентгеновской пленке с более изощренных методов цифровой обработки изображений впоследствии установленных 3. Продвижение цифровых изображений ВБ не только позволил исследователю, чтобы определить наличие или отсутствие их интерес белка, но также позволил вывод на уровне экспрессии выбранного белка по сравнению с другими образцами и, следовательно, могут быть отнесены к "полуколичественная & #8221 ;. В последнее время, действительно количественный и более чувствительны вестерн-блоттинга технология была разработана в результате чего уровень флуоресценции измеряется непосредственно связана с количеством и экспрессии одного белка в образце: количественный флуоресцентное вестерн-блоттинга (QFWB).
При сравнении с QFWB ECL маркировки, использование флуоресцентной вторичного антитела генерирует линейный профиль обнаружения 4. Это в отличие от методик ECL, где сигнал линейность как правило, происходит при низких нагрузках белка ниже 5 мкг и насыщения сигнала, непосредственно связанных с экспрессии белка, то есть, с повсеместно экспрессируемых генов домашнего хозяйства 5,6. Это несоответствие, скорее всего, обусловлено большим числом сайтов связывания для авидин ECL субстрата связывается с биотинилированным вторичным, приводит к более высокой вероятности потенциального насыщения сигнала. Это является одной из основных причин ECL базовой иммуноблоттинга именуются ONLу "полуколичественная" 7. Точка насыщения сигнала имеет решающее значение при измерении тонкие различия в уровне экспрессии и может привести к неточным измерениям. В последние годы с появлением распространенных протеомическим методов, подробно все большее чувствительность и идентификацию тонких различий экспрессии привело к все возрастающей зависимостью от действительно количественного вестерн-блоттинга для экспериментов валидации 8,9. Применение чувствительной, надежной и действительно количественного методологии Поэтому крайне важно.
Многие "оптимизированные" вестерн-блоттинга методологии были использованы независимыми лабораториями, которые часто доказывают трудно установить или скопировать из-за тонких методологических корректировок, которые не могут быть очевидны в формальных документированных протоколов. Это установлено и надежный протокол для QFWB и дополнительно обеспечивает ценные стратегии для устранения общих проблем -гот может возникнуть в ходе реализации.
Этот протокол был первоначально оптимизирован для использования с мышиными гомогенатах мозга, но с тех пор были эффективно использованы в широком диапазоне образцов тканей и видов 4,9,10. Потенциальные изменения протокола, необходимые для конкретных вопросов по устранению неполадок входят.
протокол
Этот протокол был оптимизирован с использованием коммерчески произведенные буферы, гели и передачи стеки для того, чтобы уменьшить изменчивость и улучшить консистенцию. См Список материалов для получения полного списка расходных необходимых.
Люминесцентная WB протокол с помощью I-блот быструю передачу и систему формирования изображения Odyssey LI-COR
1. Приготовление образца
- Выбор буфера / подготовка
- Выбор соответствующего буфера для экстракции образца для гомогенизации и гарантировать, что буфер совместим со всеми вниз по течению методы должны быть использованы. Подготовка буфера для экстракции: РИПА буфер (25 мМ Трис-HCl (рН 7,6), 150 мМ NaCl, 1% NP-40, 1% дезоксихолат натрия, 0,1% SDS), содержащей 5% ингибитор протеазы коктейль до образца изоляцию.
Примечание: Есть много различных типов экстракции буферов доступны и их выбирают в зависимости от расположения интересующего белка в клетке. Они включают, но неограничивается RIPA буфера (целой клетки, митохондрий и ядерных компонентов), NP-40 буфера для лизиса (целой клетки или мембраны граница) и Трис-Triton (цитоплазматическая скелетных граница). Тем не менее, некоторые химические моющие средства в пределах извлечения буферов может помочь для растворения или даже отключить белок, но может помешать определения белка при использовании определенных определения белка анализа, т.е. бицинхониновой кислоты (BCA) анализа. Проверьте руководящие производителя относительно химической совместимости с анализа.
- Выбор соответствующего буфера для экстракции образца для гомогенизации и гарантировать, что буфер совместим со всеми вниз по течению методы должны быть использованы. Подготовка буфера для экстракции: РИПА буфер (25 мМ Трис-HCl (рН 7,6), 150 мМ NaCl, 1% NP-40, 1% дезоксихолат натрия, 0,1% SDS), содержащей 5% ингибитор протеазы коктейль до образца изоляцию.
- Экстракции белка / растворение
- Вручную вымачивать образца ткани не с помощью ножниц и / или скальпель с последующей гомогенизацией с использованием либо Даунса или переносной электрической гомогенизатора с наконечником из полипропилена в подготовленную буфера для экстракции при температуре приблизительно 1:10 вес / объем (вес / объем ткани буфера) до тех пор, гладкая / согласуется гомогенат производится.
ПРИМЕЧАНИЕ: Для меньше, драгоценные / трудно получить образцы, моющие основе извлечений чан-прежнему быть эффективными вплоть до 1: 5. - Дать гомогенизации, образцы центрифуг на 20000 мкг в течение 20 мин при 4 ° С. Удалить супернатант, содержащий растворенные белки и хранить при -80 ° С до использования. Сохраните нерастворимые гранулы, чтобы в дальнейшем более жесткое добычу при необходимости позже. Перейдите к белковой этапе определения 1.3.
- Вручную вымачивать образца ткани не с помощью ножниц и / или скальпель с последующей гомогенизацией с использованием либо Даунса или переносной электрической гомогенизатора с наконечником из полипропилена в подготовленную буфера для экстракции при температуре приблизительно 1:10 вес / объем (вес / объем ткани буфера) до тех пор, гладкая / согласуется гомогенат производится.
- Определение белка
- Определить концентрацию белка в каждой добытой образца с использованием либо ДСС, Брэдфорд или аналогичный анализ. При расчете стандартной кривой, гарантировать, что коэффициент соотношения определения, R-квадрат значение, больше или равен 0,99, который отражает наиболее точное определение белка изобилии в течение 15 образцов.
Примечание: Все образцы сравнивают с QFWB должны быть проанализированы в отношении одной и той же стандартной кривой.
- Определить концентрацию белка в каждой добытой образца с использованием либо ДСС, Брэдфорд или аналогичный анализ. При расчете стандартной кривой, гарантировать, что коэффициент соотношения определения, R-квадрат значение, больше или равен 0,99, который отражает наиболее точное определение белка изобилии в течение 15 образцов.
- Подготовка образца
- Планируйте и записать загрузочный порядок лестниц и образцов для 2 идентичных гELS: гель 1 для передачи и гель 2 в качестве контроля загрузки. Загрузите контроль и «лечил» образцы последовательно, чтобы избежать каких-либо предубеждений, которые могут возникнуть при плохом или однозначного перевода.
- Рассчитать объем белка, необходимое для каждого образца. Стандартная нагрузка белок для обнаружения белков в нервных изолятов 15 мкг. Сделайте каждый образец до объема 10 мкл с дН 2 O. Добавить 5 мкл загрузочного буфера, вихря и тепла при 98 ° С в течение 2 мин.
- Включить положительный контрольный образец, такой как рекомбинантный белок, чтобы помочь с идентификации правильного интересующей полосе частот. Однако подготовить положительный контрольный образец правильно и соответствует руководящим указаниям производителя, чтобы избежать выбора неправильных полос. Смотрите рисунок 1.
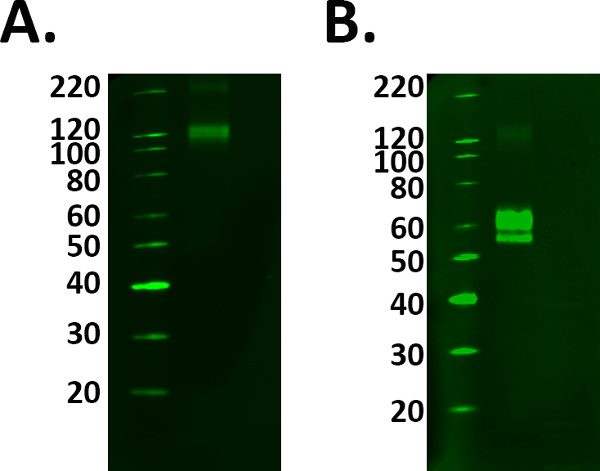
Рисунок 1. Positive выбор управления. Добавление положительного контроля в эксперименте подтверждает маркировка обнаружены реально. Тем не менее, должны быть предприняты меры, чтобы гарантировать, что ваш контроль работает правильно, прежде чем использовать экспериментальные образцы.) Гибридный белок ТРЭМ 2 был загружен на руководящих изготовителя от 1 мкг / мл, однако маркировка наблюдается при 110 кДа конфликтов с спецификации предсказал молекулярной вес 60-70 кДа. б) после того и инкубации с восстанавливающим агентом, мечение слитый белок был обнаружен в предсказанной молекулярной массой. Тем не менее, это означало большую нагрузку белок необходим как восстановительный процесс уменьшению сигнала белка.
2. электрофоретического разделения белков
- Подготовка 4-12% Bis / трис гель (1,0 мм)
ПРИМЕЧАНИЕ: Градиент гели используются для производства большее разделение белка в широком диапазоне молекулярных масс.- Выберите и подготовить МЧСили МОПС работает буфер (1 л на баке) путем разбавления дН 2 O. MES буфера производит лучшее разрешение белков в 3.5-160 кДа, тогда как МОПа работает буфер является предпочтительным для обнаружения более высокие рные протеины выше 200 кДа однако будет иметь худшее разрешение нижних белков молекулярной массой ниже 15 кДа.
- Снимите гребень и полоску ленты, которая охватывает ногу геля. Осторожно промыть лунки с рабочим буфером, используя 1 мл пипетки. Заполните скважин с рабочим буфером и убедиться в отсутствии пузырьков остаются в геле.
- Подготовка гель и загрузка
- Вставьте гели в бак и заполнить в том гель отсек с рабочим буфером для обеспечения все уплотнения работают эффективно.
- Добавить 3 мкл стандарта молекулярного веса в первой скважины в гель 1 и гель 2. Нагрузка 10 мкл каждого образца в последующих скважин.
Примечание: За исключением лестниц, гель 1 & 2 гель должен быть идентичным. Крайне важно йна предварительно окрашенных стандартов молекулярной массы, используемой для геля 2 является синий и видимым при использовании общего пятно белка для того, чтобы быть видимым в 700 канала Odyssey томографа. - После того, как оба гели загружаются, заполнить бак с оставшейся под управлением буфера и закрепите крышку.
- Электрофорез
- "Run" гель при 80 V в течение 4 мин, чтобы обеспечить образец поступает в матрицу полиакриламидном геле в единой манере. После повышения напряжения и времени до 180 V в течение 50 мин, соответственно, или пока образец красителя можно увидеть у подножия геля.
ПРИМЕЧАНИЕ: высшее напряжение, которое может быть применено для достижения более короткое время прогонов. Тем не менее, это может привести к "смайлик" гелей, где средние образцов гелей работать быстрее, чем внешние образцов полосами, вызванных повышением температуры 14.
- "Run" гель при 80 V в течение 4 мин, чтобы обеспечить образец поступает в матрицу полиакриламидном геле в единой манере. После повышения напряжения и времени до 180 V в течение 50 мин, соответственно, или пока образец красителя можно увидеть у подножия геля.
3. Общий белок пятен геля Загрузка Control
- Выпуск гель 2 из кассеты с использованиемГель нож. Удалите скважин и ногу геля. Отметить гель для помощи ориентацию.
- Декантируйте приблизительно 30 мл белкового пятна в квадратную чашку Петри (приблизительный размер 12 х 12 см). Поместите гель 2 в белкового пятна, обеспечивая решение охватывает весь гель, затем перемешивание геля в течение 1 часа минимуму при комнатной температуре, чтобы окрасить.
- Слейте белка пятно и промыть гель 3 раза в дистиллированной воде до визуализации. Перейдите к шагу 6,3 визуализировать.
4. Я-Клякса полусухое быстрая передача Белок
ПРИМЕЧАНИЕ: Все реагенты, необходимые для переноса белков с помощью машины я-блот являются коммерческими продуктами, специально разработанные для методологии Я-блот и могут быть найдены в список материалов.
- Подготовить «дно» передачи стек. Снимите фольгу и предварительного увлажнения с рабочим буфером прямой из бака гель. Предварительно мокрой фильтровальной бумаги с дистиллированной водой.
- Повторите шаг 3.1 и место гель 1 наготовы «снизу» передачи стек.
- Положите предварительно влажную фильтровальную бумагу над геля. Раскатать фильтровальную бумагу и гель для обеспечения не быть пузырьков между слоями.
- Снимите крышку из фольги сверху стека передачи и заложить верхнюю пачку поверх фильтровальной бумаги и нижней стопки. Раскатайте передачи стека «сэндвич», чтобы устранить пузырьки воздуха.
- Вставьте губку из комплекта передачи стека на крышку машины я-Клякса. Поместите бутерброд передачи стека на выделенном пространстве на машине я-Клякса то закрывают крышкой надежно. Запустите I-пятно и передать 8,5 мин на программе 3.
- Если есть сигнал низкого белок или неровные высокие: низкая отношения молекулярные массы белков, проверить время передачи изготовителя при использовании полусухого "быстрый" способ передачи. Запуск простой протокол оптимизации, используя примеры повторов одинаковой нагрузке определить идеальный передачи напряжения / времени сочетание как видно на рисунке 2 ,
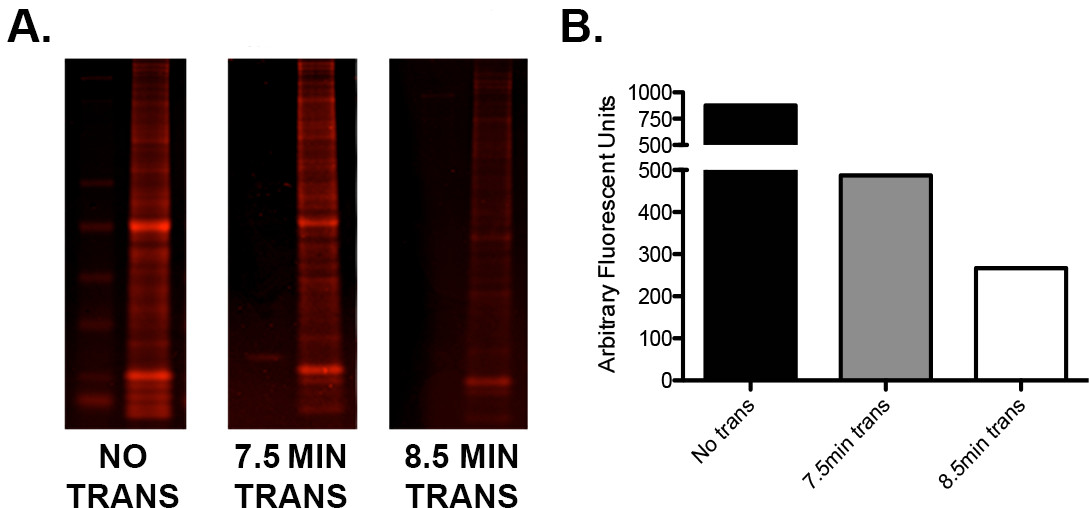
Рисунок 2. Оптимизация передачи с помощью I-Клякса. А) одного геля загруженной с лестницы и 15 мкг мышиного всей гомогената мозга в трех тандемных повторов разрезали на три части. Одна секция не была передана, один был переведен на 7,5 мин (в соответствии с руководящими принципами изготовителя) и один для 8,5 мин. Срезы были гель затем окрашивали Instant Голубой белка пятна, сканируется на тепловизора в канале 680 и количественно. Б) Графическое представление значений количественного демонстрирующих разницу в остаточным содержанием белка каждого геля следующие 0, 7,5, и 8,5 мин передачи. Следует отметить, что дополнительное минута времени передачи привело к дополнительному переноса белков из приблизительно 45%.e.com/files/ftp_upload/52099/52099fig2large.jpg "цель =" _ пустой "> Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
5. Антитела Обнаружение белков
- Получение мембран и блокировки
- Удалить передачи стек из машины я-Клякса. Снимите верхнюю и фильтр бумажный слой, раскрывающую гель на нижней стопки передачи.
- Сокращение вокруг геля скальпелем и гарантировать, что треугольный вырез для ориентационное представлена на мембране. После мембраны обрезки, белок окрасить гель для проверки эффективности переноса и / или отменить.
- Быстро перемещаться через мембрану в чистую пробирку 50 мл (или эквивалентного) сосуда, содержащего 5 мл 1х PBS и поместить на механической ролика (или орбитальной платформе) для постоянном перемешивании.
ПРИМЕЧАНИЕ: Очень важно, чтобы мембрана не высыхать. Во полусухого переноса мембрана нагревается. Подождите 2 минуты, прежде чем открывать пачку передачи, поскольку это позволит Iт остыть и медленное время сушки в течение стека деконструкции. Использование валика и трубки для агитации во время мытья и инкубации позволяет значительное снижение объемов решений, необходимых. - Вымойте мембрана 3 х 5 мин в 1х PBS. Отменить 1X PBS и блокируют мембрану с неразбавленной блокирующего буфера в течение как минимум 30 мин при комнатной температуре.
- Первичная подготовка антитела.
- Подготовка первичного антитела согласно предписаниям производителя в 5 мл блокирующего буфера с 0,1% Tween20. Инкубируйте мембраны с подготовленной первичным антителом в течение ночи при 4 ° С при постоянном перемешивании.
Примечание: блокирующем буфере, как правило, используется в неразбавленном виде, но могут быть разбавлены до 1: 4 с PBS, если первичное антитело имеет достаточно высокую специфичность. - Откажитесь от первичного антитела и промыть мембраны 6 раз в течение 5 мин каждый с 1x PBS.
- Подготовка первичного антитела согласно предписаниям производителя в 5 мл блокирующего буфера с 0,1% Tween20. Инкубируйте мембраны с подготовленной первичным антителом в течение ночи при 4 ° С при постоянном перемешивании.
- Вторичная выбор антитела и подготовка
- Для SECOndary только маркировка оценку для целей контроля, опустить шаги 5.2.1 и 5.2.2 выше и перейдите к шагу 5,3 для определения выборки конкретных вторичных набора полос. Смотрите рисунок 3.
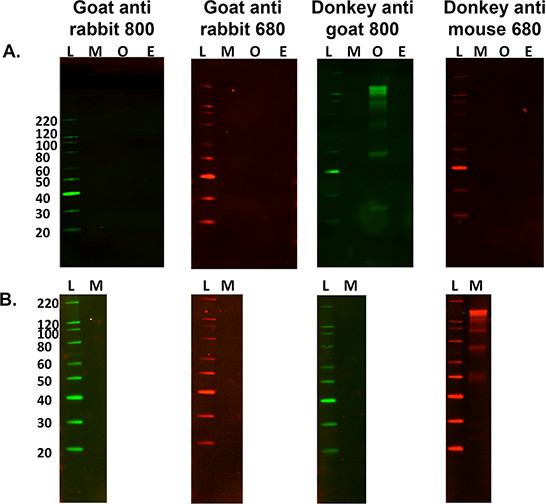
Рисунок 3. Оптимизация вторичными антителами.) Сравнение нескольких видов вторичного только неспецифической маркировки против 15 мкг мышиного (М), баранину (O) и Коневодство (E) нервные гомогенаты ткани с различными флуоресцентными помечены вторичные антитела , L является молекулярная масса лестницы. Овец гомогената ткани был единственным образец дает перекрестную реакцию с вторичной маркировки при использовании осла анти-козел 800 антитела. B) Кроме того, важно, чтобы выяснить, если неспецифический маркировки происходит при использовании другой образец ткани, то есть, мышиный икроножной мышцы (15 _6; г нагрузки). Этот крест образец реагирует с осла антимышиным 680 вторичного антитела, однако этого не произошло при использовании мыши гомогената мозга.
- Подготовка флуоресцентный помечены вторичного антитела 680 или 800 (красный или зеленый канал) следующий рекомендованы производителем концентрации в блокирующем буфере с 0,1% Tween20. Инкубируйте мембраны в темноте с подготовленной вторичным антителом в течение 90 мин при комнатной температуре при постоянном перемешивании.
- Откажитесь от вторичного антитела и промыть мембраны 6 раз в течение 5 мин на автомойку с 1x PBS. Перейдите к шагу 6 - визуализация.
- Если визуализация маркеров не работает, как ожидалось, экзаменационные лестницы с диапазоном вторичными антителами в качестве подходящего дополнительного шага. Не все вторичные антитела позволяют визуализацию всех маркеров групп во всех коммерчески доступных лестниц.
- Если не видны ожидаемые диапазоны, используйте альтернативный вторичный узел, то есть, осёлEY анти кролика против козьего анти кролика представляет собой подходящую модификацию протокола. Смотрите рисунок 4. Видов хозяев, используемые для повышения вторичного антитела могут иногда вызывать проблемы с визуализацией из-за отсутствия специфичности конкретных первичных антител.
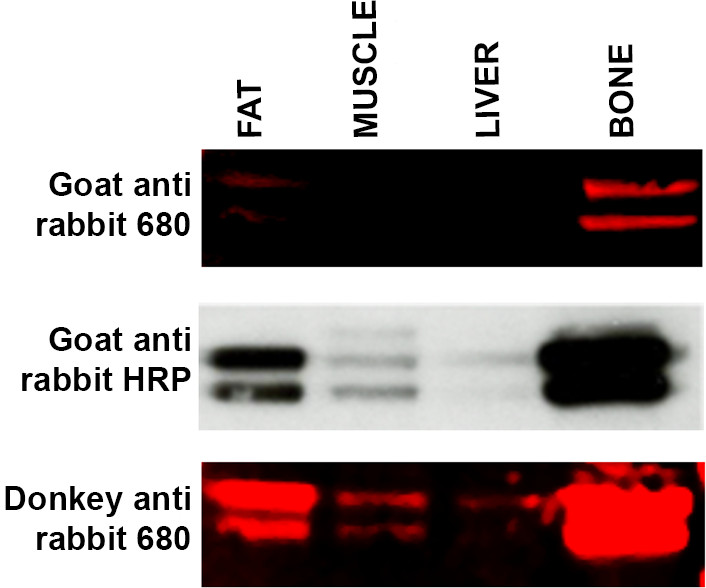
Рисунок 4. Устранение вторичное антитело специфичность Вестерн-блот из диапазона образцов ткани (15 мкг белка на полосу) -. Жир, мышцы, печень и костный - инкубировали с первичным антителом ERK и инкубировали с тремя различными вторичными антителами. Верхняя панель: WB помечены LI-COR козьих антител против кроличьего 680 вторичного антитела получают слабое мечение жира и костей, и никакой сигнал не был обнаружен в печени и мышечных образцов. Средняя панель: Мембранная (от верхней панели) был лишен и магнезииОбеда с использованием методологии ECL и козы к антителам кролика HRP, связанный вторичный. Полосы теперь видны в образцах мышц и печени и маркировка появится более интенсивным в жировых и костных образцов. Нижняя панель: Мембрана (от верхней и средней панели) был лишен и повторно зондировали с использованием LI-COR осел анти-кроличий 680 вторичное антитело, которое показало большее сродство к первичным антителом ERK. Маркировка для мышцах и печени теперь видны с увеличением интенсивности сигнала от обоих жира и костей образцов. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
6. Визуализация
ПРИМЕЧАНИЕ: Все изображения получены с помощью тепловизора LI-COR Odyssey Классический и связанные изображения программное обеспечение Pro анализа (версия 3.1.4).
- Поверните и войти в систему на компьютере и тепловизор. Откройте для обработки изображений и создания нового файла. Смотрите рисунок 5.
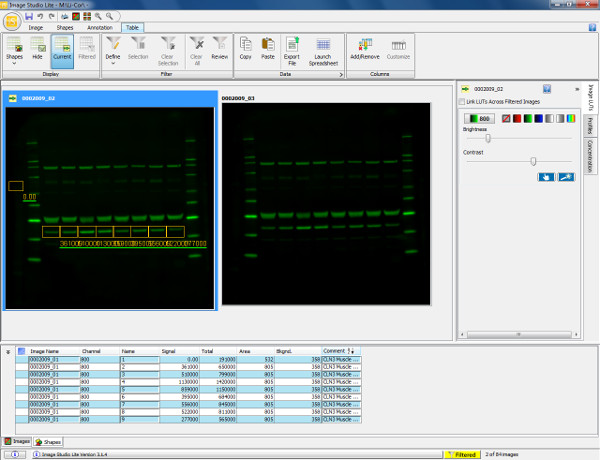
Рисунок 5. Визуализация и количественное определение вестерн-блоттинга. Сканирование из вестерн-блоттинга, показывающий мышиный икроножной мышцы (30 мкг нагрузки) зондировали аннексина V первичным антителом (36 кДа) и козьих антител против кроличьего 800 вторичного антитела. Мембрана была отсканирована и визуализируется в 800 канала. Для количественной оценки белка (Аннексин V), прямоугольная коробка обращается вокруг группы интересов от образца 1. Это то скопировал и вставил в течение оставшихся образцов полос для обеспечения измерения одной и той же области. Предпосылки автоматически приходилось вокруг формы, изображенной но это может быть изменено, чтобы обеспечить измерение фона точно определено. В приведенной ниже таблице показаны количественные измерения каждой формы, изображенной в том числе общего сигнала, полученного, фона и сигнала с фоном вычитается. Эта информация может быть экспортирована втаблица программа для расчета коэффициентов выражения (как определено относительной интенсивности флуоресценции) и позволяет последующие статистические анализы должны быть выполнены. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
- Откройте крышку томографа. Налейте небольшое количество 1x PBS на стекло в нижнем левом углу, а затем поместить мембрану поверх PBS. Обеспечить мембрана имеет квадратную форму с осью на томографа и 1 см зазор остается между мембраной и оси сетки.
- Раскатайте мембрану для обеспечения не быть пузырьков между стеклом и мембраной.
- Подсчитайте количество квадратов мембрана занимает на оси х и у. Закройте крышку томографа. Введите число квадратов мембрана занимает на компьютере программного обеспечения.
- Выберите подходящий канал для сканирования мембрану, которая будет зависеть от флуоресцентной меткииз вторичного антитела, то есть, 700 или 800 каналов, когда канал флуоресцентный меченого антитела 680 или 800 была использована соответственно. При двойной маркировки осуществляется, сканирование в обоих каналах.
ПРИМЕЧАНИЕ: Оптимизация одного маркировки белка до проведения двойной маркировки. - Выберите интенсивность сканирования мембрану, если с высоким содержанием белка обилие использовать сканирование низкой интенсивности. В качестве альтернативы, если первичное антитело имеет низкое сродство к представляющий интерес белок выбрать более высокую сканирование интенсивности, то есть, уровень 5. Нажмите Пуск, чтобы начать сканирование. Перейдите к шагу 6.4.
- Визуализация контрольной нагрузки геля (фиг.6).
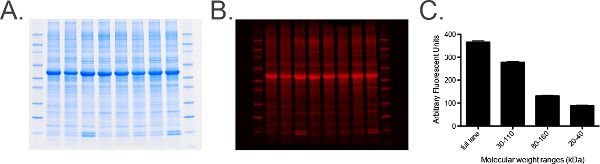
Рисунок 6. Общая маркировка белка и анализ.) Фотография общей белковой меткой гель, содержащий 20 мкг лошадиного шейки ганглиев гомогената на пер. B) Гель от панели Асканируются в 680 канала. С) График количественных измерений от общего белка окрашенных гель, полученный с помощью обработки изображений. Диапазон измерений определяется маркеров молекулярной массы, т.е. 30-110 кДа, которые приняты для обеспечения гистограмму измерений, чтобы обеспечить стандартную ошибку (SEM) является низким (сгруппированных выборок), указывающий, что уровень общего белка в каждом образце являются однородными по геля. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.- Выполните шаги 6.1 и 6.2.
- Налейте дистиллированную воду на стекло в нижнем углу томографа, где начинается ось сетки.
- Поместите гель на поверхности воды и маневрировать таким образом, что полосы расположены перпендикулярно либо осям Х и Y. сетки. Оставить 1 см между у и х оси сетки и геля и подсчитать количество квадратов гель занимает на оси сетки. Близкокрышка томографа.
- Введите число квадратов гель занимает на компьютере программного обеспечения.
- Выберите канал 700 для сканирования общего белка окрашивали гель.
ПРИМЕЧАНИЕ: Синий флуоресцирует в 700 канала. - Установите интенсивность до 5 и нажать старт.
- Количественная оценка отсканированном изображении
- Настройте кнопки яркости и контрастности для получения наилучшего качества изображения. Если, как представляется, высокий фоновый шум, повторное сканирование мембрану при более низкой интенсивности и использовать параметры сканирования высокого качества.
ПРИМЕЧАНИЕ: Любые изменения не изменит люминесцентные данные, полученные при сканировании. - Поворот изображения на 90 °, 180 ° и 270 ° для того, чтобы просмотреть в нужной ориентации, не изменения в полученных данных. Однако, когда, делая небольшие корректировки ориентации в "свободное вращение", более чем на 3 °, данные, полученные в значениях пикселизации может деформироваться и таким образом повлиять на результаты количественной.
- Выберите форму из меню фигур - использовать прямоугольник в большинстве случаев - и нарисовать вокруг группы интересов (ВБ) или всей полосе (всего гель белка) в образце переулок 1.
- Скопируйте и вставьте форму через к выборке переулок 2 группы интересов или всей полосе. Повторите по каждой отдельной полосе интерес для каждого образца и каждой полосы для общего гелей белков.
- Проверьте, что измерение фона не включает сигнал в следующем переулке. Фон может быть автоматически снята с помощью программного обеспечения и охватывают весь край вокруг формы, изображенной или он может быть указан как сверху / снизу или слева и справа от формы. С другой стороны, назначить определенный пользователем фона окна.
- Отображение сигнала для таблицы формы для каждой формы, проведенной в произвольных люминесцентных единиц. Фон будет автоматически вычтена из сигнала.
- Экспорт изображения в виде TIF файл для просмотра в различного программного обеспечения. Не экспортировать изображение и управлять USIнг не имидже программное обеспечение, так как это приведет к изменению исходных данных, полученных с помощью тепловизора, генерирующего ложные данные.
- Повторите шаги 6.4.3-6.4.7 когда количественного двойную маркировку или проведения нескольких измерений на гелях контроля загрузки для создания и сопоставления стандартных данных об ошибках.
- Настройте кнопки яркости и контрастности для получения наилучшего качества изображения. Если, как представляется, высокий фоновый шум, повторное сканирование мембрану при более низкой интенсивности и использовать параметры сканирования высокого качества.
7. Сообщение Визуализация
- Хранить мембраны в 1х PBS или высохнуть в течение длительного хранения для будущего повторного зондирования и зачистки мембран для других белков, представляющих интерес.
- Зачистка и вновь зондирования мембран. Смотрите рисунок 7.
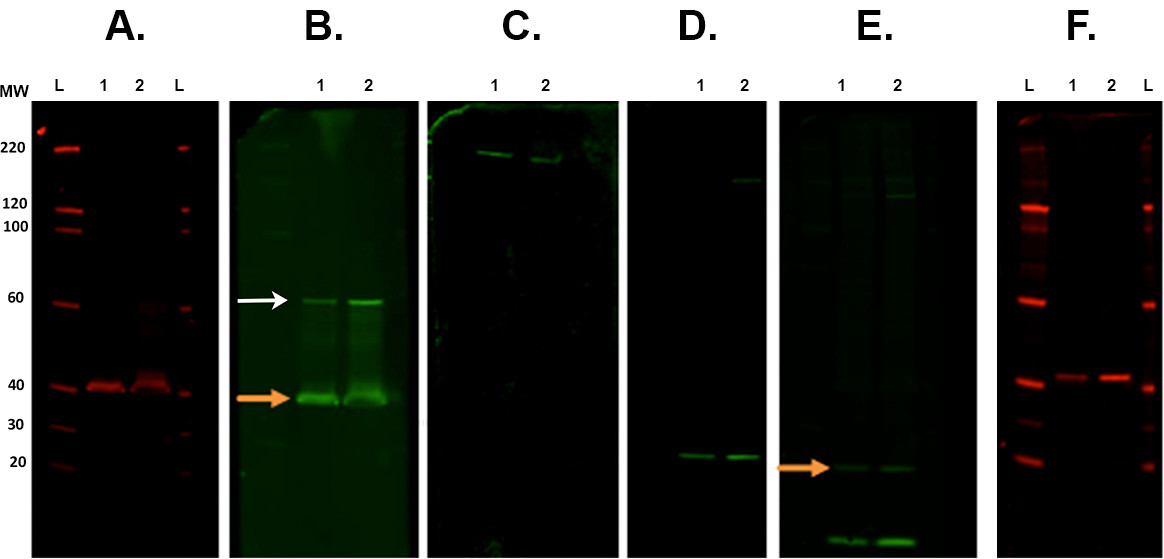
Рисунок 7. Мембрана зачистки и reprobing. Типичные примеры мембран следующие различных вскрышных шагов отсканированных с инфракрасным системы формирования изображения. А. Первый иммунологического проводили с первичным антителом CSP (кролик) и сканируют на 700 канал. В. Во-первых зачистки и reprobing с ROCK2 (кролик) с 800 канала. Оранжевая стрелка означает оставаясь CSP первичное антитело настоящего после полосы и повторного зонда. Это не влияет на измерение ROCK2 как группа присутствует в более высокой молекулярной массой (белые стрелки). С. Во-вторых зачистки и зондировали с β-спектрина антитела (козы) и визуализируется в 800 канала. D. В-третьих зачистки и reprobing с α-синуклеина антитела (кролик). E. В-четвертых зачистки и reprobing с убиквитиновой антитела (мыши) с 800 канала. Существует еще оставаясь сигнал от последнего антитела (α-синуклеина. Оранжевая стрелка). F. Пятый зачистки и reprobing с CALB2 антитела (кролик), изображенного на 700 канале. Вторичные антитела были использованы: козы против мышиного 800cw, козьих антител против кроличьего 680rd, козьих антител против кроличьего 800cw, осла анти-козел 800cw (см список материалов). Lane этикетки: L - лестничные, 1/260; - образец 1/2. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.- Место мембрана (ы) в квадратной чашке Петри, которые содержат примерно 30 мл буфера Revitablot отгонки и инкубируют между 5-20 мин при комнатной температуре при постоянном перемешивании.
- Вымойте мембрана (ы) 3 раза в PBS затем повторную проверку на тепловизор для обеспечения полного удаления флуоресценции произошло - этот шаг должен быть повторен после каждой полосе.
- Выдержите мембрану (ы) для более длительных периодов, если флуоресценции остается. Пересканировать мембраны после каждой полосе, чтобы подтвердить, что не существует вторичный сигнал оставшейс.
Примечание: Мембрана (ы) должны быть удалены только и повторно зондировали максимум 3 раза с тем, чтобы гарантировать, что целостность мембраны не были скомпрометированы в результате нежелательного высокого фона соотношение для сигнализации.
Результаты
Как чувствительности QFWB и линейного диапазона обнаружения больше, чем обычного обнаружения ECL, существует ряд мер контроля, которые имеют решающее значение для обеспечения того, чтобы точным данные собираются, тем самым помогающих эффективному интерпретацию. Во-первых, включение образцов положительных контрольных, как показано на рисунке 1. Во-вторых, оптимизация передачи, чтобы гарантировать эквивалентный движение высоких и низкомолекулярных белков из геля на мембрану, как выставлены на рисунке 2. В-третьих, оптимизация антител, особенно вторичный антитела, у которых оптимизация часто забывают, но которые могут производить неспецифические полосы способны мешать правильной интерпретации белка (белков), представляющего интерес. Рисунок 3. В-четвертых, он также может быть так, что, когда появляется белок не обнаруживается, но, как ожидается, будет присутствовать, это также может быть проблемой вторичное антитело, которое может быть исправлено, просто с помощью вторичных РАИСред в другом хосте видов. Смотрите рисунок 4. В-пятых, общая маркировка и анализ белок является гораздо более надежным и количественному метод по сравнению с использованием традиционных одного белка (ов), которые экспрессируются повсеместно для внутренних эталонов 3. Многие из этих отдельных белков было обнаружено, что быть дифференциально экспрессируются в моделях нейродегенеративных заболеваний, а также между разными образцами тканей и равномерность экспрессии может изменить пределах одной и той же ткани 3. Таким образом, производство контрольной нагрузки геля подтвердит однородность образца нагрузки в сочетании с общей анализа белка путем сравнения и количественной оценки нагрузки белка в каждой дорожке в различных диапазонах молекулярных масс, измеренных в отношении каждого образца, чтобы указать, стандартную ошибку, как показано на рисунке 6 . Важно отметить, что все эти диагностике неисправностей, методов и средств управления являются только же эффективным, как чувствительность и консистенции анализа Тools применяемые оператором (рисунок 5). Наконец эта техника поддается зачистки и повторно зондирования мембран с большей гибкостью, чем ECL-за факторов, в том числе, но не ограничиваясь повышенной чувствительности, снижение фона, двойной обнаружения цвета и стабильности мембран под долгосрочных условиях хранения. Смотрите рисунок 7.
Обсуждение
Должное внимание и планирование имеет важное значение до любого эксперимента и может в конечном итоге определяют успех используемого метода. Достижения в области обнаружения белка, используя WB можно представить множество потенциальных камней преткновения при попытке выбрать соответствующие антитела, передача и визуализации методы использовать. К счастью, с помощью тщательного перечень и соответствующие меры контроля QFWB можно использовать регулярно, чтобы определить присутствие белков и более тонкие различия экспрессии между образцами. Этот протокол обеспечивает полное руководство по флуоресцентной количественной вестерн-блоттинга, а также несколько стратегий устранения неполадок, чтобы избежать и / или преодолеть некоторые из многих распространенных ошибок, связанных с ним.
Критические шаги, используемые для поддержания чувствительности и получить по-настоящему исчисляемая и сопоставимые измерения включают: 1) надежные экстракции белка из образцов тканей; 2) подготовка образца; 3) точный белок loadinг определяется общей анализа белков; 4) оптимальная передача белков с использованием I-блоттинга; 5) подготовка первичных и вторичных антител в блокирующем буфере, содержащем 0,1% Tween 20, и 6) правильно визуализации и анализа с использованием тепловизорный и соответствующее программное обеспечение.
Инфракрасная детекция флуоресцентного действительно количественный и обеспечивает большую чувствительность по сравнению с более традиционными ECL методов обнаружения 3,11. Эта система обнаружения разносторонняя, и как таковой не ограничивается QFWB. Эта система способна визуализации иммуногистологического маркировки на малой мощности, позволяя визуализацию и количественное определение секций цельной ткани 12. Это одна из областей потенциального развития будущего с точки зрения решения, которое можно было увидеть далеко красную изображений конкурируя обычную иммунофлюоресценции захват с обычными микроскопами с точки зрения количественной оценки.
Тем не менее, с большей чувствительности к незначительным изменениям в рrotein выражение это имеет решающее значение для обеспечения изменчивости сохраняется до минимума и контрольных мер являются строгими с надежными протоколами. Это начинается с тщательного извлечения белка из образца ткани с последующей продукции общего белка окрашивали гелей, чтобы обеспечить уверенность в том, что образец нагрузка равномерна, оптимизация первичных и вторичных антител, чтобы определить, если обнаружение реальной и тестирование принципы изготовителя в отношении передачи раз, чтобы получить эффективную передачу белка.
Тем не менее, даже тогда, когда условия для ВБ оптимизированы, может еще проблемы, связанные с управлением вестерны, что, возможно, не до конца изучены здесь. Они включают, но не ограничиваются ими, в том числе факторов белковой солюбилизации и выбора экстракционного буфера. Некоторые буферы могут мешать концентрации белка анализов, и некоторые ткани особенно трудно растворить, требующих более надежные методы, такие как использование автоматизированной maceraка герметично контейнеры, такие как M труб вместе с диссоциатора Macs. Кроме того, простые меры по контролю за хранение извлечены и не добытого материала при -80 ° С может быть разница между получения оптимального маркировки непосредственно после экстракции и имеющие плохие результаты недели спустя.
Современные методы QFWB которые оказались более чувствительны для захвата тонкие различия в экспрессии белка и более универсальным позволяя одновременно двойную маркировку 3 по сравнению с более старыми методами, такими как ECL. Очень важно, чтобы западные протоколы блоттинга являются надежными и легко повторяемые для точной количественной и статистического анализа. Этот протокол является чувствительным и достаточно прочным, чтобы быть использован обычно применяемый для обнаружения белков в различных образцах тканей различных видов и 3 и позволяет количественно определить низких и высоких белков численности в пределах одной и той же самым уменьшая QFWB расходом расходных а также раз в эксперименте 1. 1 Кроме того, повышенная чувствительность этого метода позволяет проверку все более популярным - OMIC исследования 9,14, однако точность имеет решающее значение и включение соответствующих мер контроля должны соблюдаться таким образом избегая ошибочных сбора данных.
Раскрытие информации
The authors have nothing to disclose.
Благодарности
Мы хотели бы, чтобы благодаря следующее за финансовую поддержку: BBSRC институт Стратегическая программа финансирования - CF & TMW; BBSRC Восток Bio DTP финансирование - LG; Дарвин Trust Эдинбурга - MLH. Мы также хотели бы поблагодарить доктора Барри Макколл для разрешения включить оптимизацию TREM2 в этой рукописи.
Материалы
| Name | Company | Catalog Number | Comments |
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| RIPA Buffer | Fisher Scientific UK Ltd | 10230544 | |
| M Tubes | Miltenyi Biotec Inc. | 130-093-236 | |
| iBlot Transfer Stack, PVDF Regular | Life technologies, UK | IB401001 | |
| MagicMark XP Western Protein Standard (20-220 kDa) | Life technologies, UK | LC5602 | Use in gel 1 for Western blotting |
| SeeBlue Pre-stained protein standard | Life technologies, UK | LC5625 | Use in gel 2 Total protein stained gel |
| NuPAge LDS Sample buffer 4X | Life technologies, UK | NP0007 | |
| NuPAGE MES SDS Running Buffer (for Bis-Tris Gels only) (20X) | Life technologies, UK | NP0002 | |
| NuPAGE Novex 4-12% Bis-Tris Gel 1.0 mm, 12 well | Life technologies, UK | NP0322BOX | |
| PHOSPHATE BUFFERED SALINE TABLET,*TRU-ME, PHOSPHATE BUFFERED SALINE TABLET | Sigma-Aldrich, UK | P4417-100TAB | |
| Micro BCA, Protein Assay Kit | Fisher Scientific UK Ltd | 10249133 | |
| Odyssey blocking buffer | Li-Cor Biosciences | P/N 927-40000 | |
| IRDye 680RD Goat anti-Rabbit IgG (H+L), 0.5 mg | Li-Cor Biosciences | 926-68071 | |
| IRDye 680RD Donkey anti-Mouse IgG (H+L), 0.5 mg | Li-Cor Biosciences | 926-68072 | |
| IRDye 800CW Goat anti-Rabbit IgG (H + L), 0.5mg | Li-Cor Biosciences | 926-32211 | |
| IRDye 800CW Donkey anti-Goat IgG (H + L), 0.5mg | Li-Cor Biosciences | 926-32214 | |
| ODYSSEY CL Infra-red imager | Li-Cor Biosciences | Call for quotation | |
| iBlot 7-Minute Blotting System | Life technologies, UK | This model is no longer in production | |
| InstantBlue Protein stain | Expedeon, UK | ISB1L | |
| Revitablot western blot stripping buffer | Rockland Immunochemicals Inc. | MB-085-0050 |
Ссылки
- Towbin, H., Staehelin, T., Gordon, J. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. Biotechnology. 1992 (24), 145-149 (1979).
- Walker, J. M. . Protein Protocols on CD-ROM. , (1998).
- Gallagher, S., Winston, S. E., Fuller, S. A., Hurrell, J. G. Immunoblotting and immunodetection. Curr Protoc Mol Biol. Chapter. 10, 10 (2008).
- Eaton, S. L., et al. Total protein analysis as a reliable loading control for quantitative fluorescent Western blotting. PLoS One. 8 (8), 72457 (2013).
- Suzuki, O., Koura, M., Noguchi, Y., Uchio-Yamada, K., Matsuda, J. Use of sample mixtures for standard curve creation in quantitative Western blots. Exp. Anim. 60, 193-196 (2011).
- Colella, A. D., et al. Comparison of Stain-Free gels with traditional immunoblot loading control methodology. Anal Biochem. 430 (2), 108-110 (2012).
- Zellner, M., et al. Fluorescence-based Western blotting for quantitation of protein biomarkers in clinical samples. Electrophoresis. 29, 3621-3627 (2008).
- Kielar, C., et al. Molecular correlates of axonal and synaptic pathology in mouse models of Batten disease. Hum Mol Genet. 18, 4066-4080 (2009).
- Mutsaers, C. A., Lamont, D. J., Hunter, G., Wishart, T. M., Gillingwater, T. H. Label-free proteomics identifies Calreticulin and GRP75/Mortalin as peripherally accessible protein biomarkers for spinal muscular atrophy. Genome Med. 5 (10), 95 (2013).
- Wishart, T. M., et al. Dysregulation of ubiquitin homeostasis and β-catenin signaling promote spinal muscular atrophy. J Clin Invest. 124 (4), 1821-1834 .
- Mathews, S. T., Plaisance, E. P., Kim, T. Imaging systems for westerns: chemiluminescence vs. infrared detection. Methods Mol Biol. 536, 499-513 (2009).
- Hawes, J. J., Brunzell, D. H., Wynick, D., Zachariou, V., Picciotto, M. R. GalR1, but not GalR2 or GalR3, levels are regulated by galanin signalling in the locus coeruleus through a cyclic AMP-dependent mechanism. J Neurochem. 93 (5), 1168-1176 (2006).
- Bond, D., Primrose, D. A., Foley, E. Quantitative evaluation of signaling events in Drosophila S2 cells. Biol Proceed Online. 10 (1), 20-28 (2008).
- Wishart, T. M., et al. Differential proteomics analysis of synaptic proteins identifies potential cellular targets and protein mediators of synaptic neuroprotection conferred by the slow Wallerian degeneration (Wlds) gene. Mol Cell Proteomics. 6, 1318-1330 (2007).
- Silva, J. M., McMahon, M. The fastest western in town: a contemporary twist on the classic western blot analysis. J. Vis. Exp. (84), 51149 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены