需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
对无瘢痕修复鼠标胎儿皮肤模型
* 这些作者具有相同的贡献
摘要
During mammalian development, early gestational skin wounds heal without a scar. Here we detail a reliable and reproducible model of fetal scarless wound healing in the cutaneous dorsum of E16.5 (scarless) and E18.5 (scarring) mouse embryos.
摘要
Early in utero, but not in postnatal life, cutaneous wounds undergo regeneration and heal without formation of a scar. Scarless fetal wound healing occurs across species but is age dependent. The transition from a scarless to scarring phenotype occurs in the third trimester of pregnancy in humans and around embryonic day 18 (E18) in mice. However, this varies with the size of the wound with larger defects generating a scar at an earlier gestational age. The emergence of lineage tracing and other genetic tools in the mouse has opened promising new avenues for investigation of fetal scarless wound healing. However, given the inherently high rates of morbidity and premature uterine contraction associated with fetal surgery, investigations of fetal scarless wound healing in vivo require a precise and reproducible surgical model. Here we detail a reliable model of fetal scarless wound healing in the dorsum of E16.5 (scarless) and E18.5 (scarring) mouse embryos.
引言
胎儿皮肤伤口愈合迅速,scarlessly直到怀孕后期1。胎疤痕伤口修复的特征在于正常组织结构和功能的再生。从瘢痕瘢痕表型的转变发生在怀孕的人类和周围18天胚胎(E18)小鼠2,3孕晚期。相较于成人,胎儿伤口修复的特征在于快速上皮,结缔组织沉积和成纤维细胞的迁移。
在早期胎儿发育许多研究都提供了可能的解释为瘢痕伤口愈合的现象。炎症是成人创面修复的一个基本组成部分;然而,胎儿伤口的特征在于缺乏急性炎症4。这是否是免疫系统的过程中的胎儿阶段官能不成熟的结果仍不清楚。最近的一项研究表明,在丰富,垫差异urity,和肥大细胞在E15与E18的胎儿皮肤的功能可以负责从瘢痕表型的转变中,至少在小鼠3。其他的研究断定,在性能和丰富的胎儿和成人伤口巨噬细胞的差异是负责正常的细胞外基质(ECM)的过程中胎儿创伤修复5的改革。
胎儿和成人发育期间差异在环境因素也可能影响伤口修复。龙雅葛和他的同事发现,从胎儿伤口液具有较高水平的透明质酸刺激活性相比,无成人伤口流体6。因此,更高水平的透明质酸,糖胺聚糖促进有利于细胞运动和增殖的微环境,在胎儿的伤口环境的可负责的瘢痕的表型在早期胎儿发育看见。其他线路的证据指向的一个事实,即在羊升伤口环境相对低氧血症和淹没在无菌羊水丰富的生长因子,7。然而,没有明确的答案已提供用于胚胎发育过程中的关键事件或因素触发从瘢痕再生纤维变性修复的过渡。
理解的机制负责在胎儿无瘢痕愈合就必须精确和可再现的模型。在这里,我们详细胎儿无瘢痕愈合的E16.5(无疤痕)和E18.5(疤痕)的小鼠胚胎的背部可再现的模型。此外,该模型的微小变化可用于执行许多进一步的研究,如胎儿的伤口和皮肤8,9的基因表达分析。鉴于精确定时怀孕是此无瘢痕伤口愈合模式成功的关键再演,我们对超排定时怀孕也详细我们的协议。
研究方案
注:本文中所描述的所有程序都是根据斯坦福大学行政专家组对实验动物护理(APLAC)制定的准则进行。
1.定时怀孕 - 超数排卵技术(图1)
注:精确定时小鼠胚胎的孕周胎儿外科E16.5和E18.5是至关重要的。在这一节中我们详细介绍我们使用怀孕母马血清(PMS)和人绒毛膜促性腺激素(HCG)注射诱导超数排卵定时鼠标怀孕协议。
- 注射雌性小鼠(<5%笼)腹腔(IP)与3.0-5.0 PMS国际单位(IU)的100微升PBS 1:00和1天的3:00 PM之间的音量。
- 12:00至2:00 PM 3天(45至47小时PMS注射后)的,注射雌性小鼠IP与3.0-5.0 IU HCG在100微升PBS体积。
注:HCG注射诱导排卵期大约12小时后注射。 - 紧接着HCG注射,交配女性,年龄在8-16周的男性。
注:我们通常把两女成单个男性的笼子。 - 独立的女性,从第4天上午男性(6:00 - 10:00 AM),并记录为胎龄E0.5。
注:阴道塞可在此时进行检查;然而,观察阴道塞不保证怀孕,女性可以怀孕时没有插头观察。鉴于妊娠通常通过目测和/或触诊在胎龄E16.5和E18.5观察到的,检查在第4天上午阴道塞不是严格必需的。根据我们的经验,并根据不同的应变,超排卵的女性约30-50%的怀孕使用此处所描述的技术。
皮克"/>
图1.原理图超数排卵技术,对小鼠超数排卵定时怀孕示意图,显示程序。 请点击此处查看该图的放大版本。
2.小鼠胎儿手术(背伤人)在E16.5和E18.5胚胎(图2)
- 在手术前,清洁手术室和装备有70%的异丙醇的所有表面。此外,灭菌的所有外科用品和仪器将由高压灭菌它们被用于该过程。一些机构可能允许后续采用热杀菌珠。每个操作,使用无菌包,包括纱布,手术器械。
- 在每分钟之后维持麻醉,每分钟1升2升诱导麻醉孕妇(胎儿年龄E16.5或E18.5)低于2.5%异氟醚/氧气混合物。
- 昆仑坚定正确的麻醉,保证了鼠标的深踩油门反射受到抑制,然后将鼠标在俯卧位。
- 应用兽医眼药膏,如Puralube以防止在手术过程中眼睛发炎或干燥。
- 通过给予时间不超过30秒( 图2A)的脱毛霜轻应用做准备的腹部。
- 准备腹部无菌手术用聚维酮碘和醇( 图2B和2C)。
- 采用显微剪刀( 图2D和2E)显微镜下进行中线剖腹探查术。
- 轻轻地揭露子宫和胎儿选择手术( 图2F)。
- 使用一个钝头针头灌溉外科领域用温水(38℃)磷酸盐缓冲盐水(PBS)中
注意:一个可以通过仔细弯曲大口径针的尖端制成。 ( 图2G和2H)。 - 的方式,使定位胎儿s的接入背部。
- 通过用7-0尼龙线通过子宫覆打算背伤人( 图2I)的网站荷包缝合。位置荷包在背部左侧或脊髓的右边的一个区域,并在子宫壁缺乏大血管的区域。
- 使在荷包( 图2J)的中心,通过子宫壁和羊膜囊3毫米的切口。
- 冲洗切口部位用温水(38℃)PBS。
- 采用显微剪刀,切割单个全层切除伤口,大约为1毫米的长度,在胎儿的背部。
- 轻轻印迹切口部位用干棉尖涂药。
- 注3微升量墨汁皮下伤口部位标记伤口的位置( 图2K)。
- 用温水(38℃),PBS冲洗,以确保墨水一直保留在伤口部位。
- 手术有我的助手nject温暖(38°C)通过钝尖10个G注射器插入羊膜囊的钱袋PBS被关闭( 图2L)。收回的注射器作为荷包封接近完成( 图2M)。
- 轻轻返回子宫进入腹腔( 图2N)。
- 埃弗特皮肤和腹膜。
- 有手术助理灌溉腹腔用温水(38℃)PBS。
- 迅速关闭腹部被装订的皮肤和腹膜封闭( 图2O)。标准封盖在两层进行;腹膜和在一层,皮下组织和皮肤在第二层中的腹部肌肉。对于眼前的牺牲和收获的胎儿,我们的演示显示了一层封闭。
- 放置在观察所述动物在温暖的培养箱设定为37℃,30分钟,或直至动物重新获得足够意识保持胸骨斜卧。
- 不要沤瓮动物给其他动物的公司,直到它已完全从过程中回收。
- 一旦从麻醉,并在随后的48小时的觉醒,辖皮下注射丁丙诺啡(0.05毫克/千克),每12小时为镇痛根据需要基于疼痛评估。根据需要,通过皮下注射管理卡洛芬(5毫克/千克)的额外手术后疼痛减轻。
- 回到动物的笼子,并为他们提供食物和水自由采食。
- 密切留意市民对疼痛的表现。
- 48小时后手术,牺牲孕妈妈与异氟醚和收获受伤胎儿的过量。为了做到这一点,调整异氟烷浓度为5%或更高,并维持曝光呼吸停止后1分钟。确认安乐死颈椎脱位。收获的未受伤胚胎为年龄匹配的对照。后期胚胎应具有安乐死与IACUC建议,如相一致的单独的方法去人头,颈椎脱位,或化学注射。
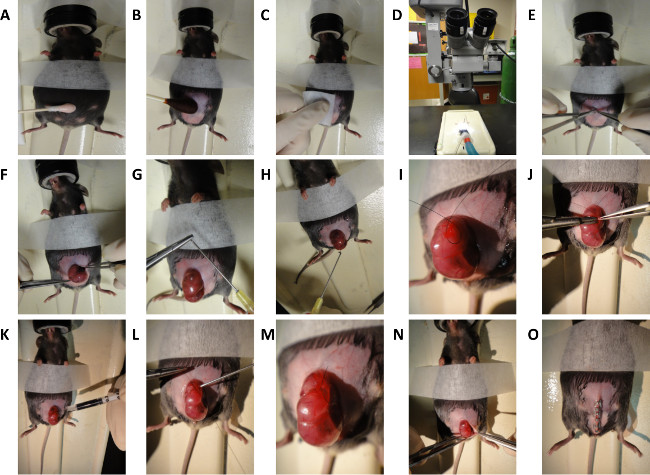
鼠标腹部图2.原理图小鼠胎儿手术。一般步骤背伤人案E16.5和E18.5小鼠胚胎。(A)脱毛。(B和C)小鼠腹部的制备。(D)显微镜用于外科手术通过子宫的过程。(E)中线剖腹探查术。(F)曝光子宫。(G)创造钝尖针头。子宫用温盐水(H)灌溉。(I)创造了荷包缝合。(J)切口墙上1毫米全层切除伤口的产生。(K)皮下注射印度墨水。(L和M)封闭的荷包缝合。(N和O)关闭腹部。 请点击此处查看该图的放大版本。
结果
对于组织学分析,皮肤伤口在E16.5和E18.5小鼠胚胎的背部皮肤,应收获后48小时伤人,固定在4%PFA和石蜡包埋。在荧光的转基因模型中,冷冻保存与十月可能是适当的。有几种污渍可以被用于可视化的细胞和结缔组织结构。苏木精和曙红是一种两色色斑,即污迹细胞核蓝色和嗜酸性结构( 即 ,细胞质和细胞外胶原)的红色,粉红色,橙色和各种色调。马洛里的三色是一个三色染色选自苯胺?...
讨论
这里介绍的手术协议描述的小鼠胎儿无瘢痕愈合首次出版于2006年,由我们的实验室10的切除模式。除了 切除伤人11等建立模型,对小鼠胎儿无瘢痕愈合的切口车型存在,以及12,13。胎儿无瘢痕愈合猴,羊,兔,负鼠,老鼠和调查的报道14-17。然而,小鼠表现为探索胎儿无瘢痕愈合的理想模型,由于其相对较低的按日补助笼的成本和良好的特点的基因组。此外,?...
披露声明
The authors have nothing to disclose.
致谢
这项工作是由美国国立卫生研究院资助R01 GM087609(以HPL),从英格丽·莱和比尔舒荣誉安东尼舒(以HPL),美国国立卫生研究院资助U01 HL099776(以MTL)的礼物,在Hagey实验室拨款部分支持小儿再生医学和橡树基金会(MTL来和HPL)。 GGW是由斯坦福大学医学院,斯坦福大学医学院科学家培训项目的支持,并NIGMS培训资助GM07365。 MSH是由CIRM临床研究员培训资助TG2-01159支持。 WXH是从萨尔诺夫心血管基金会的资助支持。
材料
| Name | Company | Catalog Number | Comments |
| 7-O MONOSOF Suture | eSuture | SN-1647G | |
| Surgical Forceps | Kent Scientific | INS650916 | |
| Micro-scissors | Kent Scientific | INS600127 | |
| Autoclip 9 mm | Texas Scientific Instruments | 205060 | |
| Insulin Syringe | Thermo Fisher Scientific | 22-272-382 | |
| Black Pigment | AIMS | 242 | |
| BD Safety-Lok 3 ml Syringe | BD Biosciences | 309596 | |
| Phosphate Buffered Saline | Life Technologies | 10010-049 | |
| OPMI-MD Surgical Microscope | Carl Zeiss Surgical Inc | ||
| Pregnant Mares Serum (PMS) | Millipore | 367222 | |
| Human Chorionic Gonadotropin (HCG) | Sigma-Aldrich | CG10 | |
| Povidone Iodine Prep Solution | Dynarex | 1415 | |
| Nair (depilatory cream) | Church and Dwight Co. | 22600267058 |
参考文献
- Larson, B. J., Longaker, M. T., Lorenz, H. P. Scarless fetal wound healing: a basic science review. Plastic and reconstructive surgery. 126, 1172-1180 (2010).
- Wilgus, T. A. Regenerative healing in fetal skin: a review of the literature. Ostomy/wound management. 53, 16-31 (2007).
- Wulff, B. C., et al. Mast cells contribute to scar formation during fetal wound healing. The Journal of investigative dermatology. 132, 458-465 (2012).
- Lorenz, H. P., Adzick, N. S. Scarless skin wound repair in the fetus. The Western journal of medicine. 159, 350-355 (1993).
- Longaker, M. T., et al. Wound healing in the fetus. Possible role for inflammatory macrophages and transforming growth factor-beta isoforms. Wound repair and regeneration : official publication of the Wound Healing Society [and] the European Tissue Repair Society. 2, 104-112 (1994).
- Longaker, M. T., et al. Studies in fetal wound healing. IV. Hyaluronic acid-stimulating activity distinguishes fetal wound fluid from adult wound fluid. Annals of surgery. 210, 667-672 (1989).
- Colombo, J. A., Napp, M., Depaoli, J. R., Puissant, V. Trophic influences of human and rat amniotic fluid on neural tube-derived rat fetal cells. International journal of developmental neuroscience : the official journal of the International Society for Developmental Neuroscience. 11, 347-355 (1993).
- Colwell, A. S., Longaker, M. T., Peter Lorenz, H. Identification of differentially regulated genes in fetal wounds during regenerative repair. Wound repair and regeneration : official publication of the Wound Healing Society [and] the European Tissue Repair Society. 16, 450-459 (2008).
- Hu, M. S., et al. Gene expression in fetal murine keratinocytes and fibroblasts. The Journal of surgical research. , (2014).
- Colwell, A. S., Krummel, T. M., Longaker, M. T., Lorenz, H. P. An in vivo mouse excisional wound model of scarless healing. Plastic and reconstructive surgery. 117, 2292-2296 (2006).
- Wilgus, T. A., et al. The impact of cyclooxygenase-2 mediated inflammation on scarless fetal wound healing. The American journal of pathology. 165, 753-761 (2004).
- Iocono, J. A., Ehrlich, H. P., Keefer, K. A., Krummel, T. M. Hyaluronan induces scarless repair in mouse limb organ culture. Journal of pediatric surgery. 33, 564-567 (1998).
- Chopra, V., Blewett, C. J., Krummel, T. M. Transition from fetal to adult repair occurring in mouse forelimbs maintained in organ culture. Wound repair and regeneration : official publication of the Wound Healing Society [and] the European Tissue Repair Society. 5, 47-51 (1997).
- Adzick, N. S., Longaker, M. T. Animal models for the study of fetal tissue repair. The Journal of surgical research. 5, 47-51 (1991).
- Block, M. Wound healing in the new-born opossum (Didelphis virginianam). Nature. 187, 340-341 (1960).
- Longaker, M. T., Dodson, T. B., Kaban, L. B. A rabbit model for fetal cleft lip repair. Journal of oral and maxillofacial surgery : official journal of the American Association of Oral and Maxillofacial Surgeons. 48, 714-719 (1990).
- Longaker, M. T., et al. A model for fetal cleft lip repair in lambs. Plastic and reconstructive surgery. 90, 750-756 (1992).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。