Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Eine Maus fetalen Hautmodell von Scarless Wound Repair
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
During mammalian development, early gestational skin wounds heal without a scar. Here we detail a reliable and reproducible model of fetal scarless wound healing in the cutaneous dorsum of E16.5 (scarless) and E18.5 (scarring) mouse embryos.
Zusammenfassung
Early in utero, but not in postnatal life, cutaneous wounds undergo regeneration and heal without formation of a scar. Scarless fetal wound healing occurs across species but is age dependent. The transition from a scarless to scarring phenotype occurs in the third trimester of pregnancy in humans and around embryonic day 18 (E18) in mice. However, this varies with the size of the wound with larger defects generating a scar at an earlier gestational age. The emergence of lineage tracing and other genetic tools in the mouse has opened promising new avenues for investigation of fetal scarless wound healing. However, given the inherently high rates of morbidity and premature uterine contraction associated with fetal surgery, investigations of fetal scarless wound healing in vivo require a precise and reproducible surgical model. Here we detail a reliable model of fetal scarless wound healing in the dorsum of E16.5 (scarless) and E18.5 (scarring) mouse embryos.
Einleitung
Fetal Haut Wunden heilen schneller und scarlessly bis spät in der Schwangerschaft ein. Fetal narben Wundheilung wird durch Regeneration der normalen Gewebearchitektur und Funktion. Der Übergang von einer narben Vernarbung Phänotyp tritt im dritten Trimester der Schwangerschaft beim Menschen und um embryonale Tag 18 (E18) in den Mäusen 2,3. Im Vergleich zu Erwachsenen ist fetalen Wundheilung durch schnelle Epithelisierung, Bindegewebsablagerung und Fibroblasten-Migration aus.
Viele Studien haben mögliche Erklärungen für das Phänomen der narbenfreien Wundheilung während der frühen fetalen Entwicklung angeboten. Die Entzündung ist eine grundlegende Komponente der Erwachsenen Wundheilung; jedoch fötalen Wunden durch einen Mangel an akuter Entzündung 4 gekennzeichnet. Ob dies eine Folge der funktionellen Unreife des Immunsystems während der fötalen Stadien bleibt unklar. Eine kürzlich durchgeführte Studie zeigte, dass die Unterschiede in der Fülle, matturity und Funktion von Mastzellen in E15 vs. E18 fötalen Haut kann für den Übergang von einer narben Phänotyp, zumindest in der Maus 3 durchgeführt wird. Andere Studien postulieren, dass Unterschiede in den Eigenschaften und Fülle von fötalen und erwachsenen Wund Makrophagen für die Reformierung von normalen extrazellulären Matrix (ECM), während der fetalen Wundheilung 5 zuständig sind.
Unterschiede in der Umweltfaktoren während der fetalen und adulten Entwicklung kann auch Auswirkungen auf die Wundheilung. Longaker und Kollegen zeigten, dass Wundflüssigkeit vom Fötus im Vergleich zu keiner in der Erwachsenenwundflüssigkeit 6 besitzt ein hohes Maß an Hyaluronsäure-stimulierende Aktivität. Folglich können höhere Niveaus von Hyaluronsäure, Glycosaminoglycan, das eine Mikroumgebung zuträglich Zellmotilität und Proliferation fördert, in der fetalen Wundumgebung zur narben Phänotyp während der frühen Entwicklung des Fötus gesehen verantwortlich. Andere Beweislinien weisen darauf hin, dass die Fetal Wundumgebung ist relativ hypoxämischen und in sterile Fruchtwasser reich an Wachstumsfaktoren 7 getaucht. Es wurde jedoch keine definitive Antwort für ein kritisches Ereignis oder Faktor während der Embryogenese, die den Übergang von der narbenfreien Regeneration fibrotische Reparatur löst vorgesehen.
Das Verständnis der Mechanismen für narbenheil im Fötus verantwortlich erfordert eine präzise und reproduzierbare Modell. Hier werden wir ausführlich ein reproduzierbares Modell der fetalen narben Wundheilung im Rücken E16.5 (narben) und E18.5 (Vernarbung) Maus-Embryonen. Zusätzlich können kleinere Abweichungen von diesem Modell verwendet werden, um eine Reihe von weiteren Untersuchungen wie Genexpressionsanalyse von fötalen Wunden und Haut 8,9 durchzuführen. Da die zeitgenaue Schwangerschaften sind entscheidend für eine erfolgreiche Wiederholung des fetalen narben Wundheilung Modell haben wir auch ausführlich unser Protokoll für die Superovulation zeitlich Schwangerschaften.
Protokoll
HINWEIS: Alle in diesem Dokument beschriebenen Verfahren werden nach den Richtlinien der Stanford Administrative Panel on Laboratory Animal Care (APLAC) errichtet wird.
1. Timed Schwangerschaften - Superovulation Technik (Abbildung 1)
HINWEIS: Präzise Zeitmessung der Schwangerschaftsdauer von Maus-Embryonen für die fetale Chirurgie an E16.5 und E18.5 ist von entscheidender Bedeutung. In diesem Abschnitt wird detailliert unser Protokoll für Zeit Maus Schwangerschaften mit trächtigen Stuten Serum (PMS) und humanes Choriongonadotropin (HCG) Injektionen Superovulation induziert.
- Injizieren weiblichen Mäusen (<5 pro Käfig) intraperitoneal (IP) mit 3,0-5,0 internationalen Einheiten (IU) des PMS in einem Volumen von 100 ul PBS 1.00 bis 3.00 für 1. Tag.
- Zwischen 00.00 und 02.00 Uhr des Tages 3 (fünfundvierzig bis 47 Stunden nach der Injektion PMS), spritzen weibliche Mäuse IP mit 3,0-5,0 IU von HCG in einem Volumen von 100 ul PBS.
HINWEIS: Die HCG-Injektion induziert Eisprung etwa 12 Stunden nach der Injektion. - Unmittelbar nach HCG-Injektionen, mate Frauen mit Männern im Alter von 8 bis 16 Wochen.
HINWEIS: Wir legen in der Regel zwei Weibchen in einen Käfig einzelner Männchen. - Separate Weibchen von Männchen am Morgen des 4. Tag (6.00 bis 10.00 Uhr) und Rekord als Fetalalter E0.5.
HINWEIS: Vaginal Stecker können zu diesem Zeitpunkt überprüft werden; Allerdings ist die Beobachtung eines Vaginalpfropf nicht garantieren, Schwangerschaft und Frauen können schwanger werden, wenn kein Stecker eingehalten wird. Da die Schwangerschaft ist typischerweise beobachtbaren durch visuelle Inspektion und / oder Abtasten in verschiedenen Schwangerschaftsstadien E16.5 und E18.5, Überprüfung auf Vaginalpfropf am Morgen des Tages 4 ist nicht unbedingt erforderlich. Nach unserer Erfahrung und in Abhängigkeit von der Belastung, etwa 30-50% der super Eisprung Frauen schwanger werden, mit der hier beschriebenen Technik.
pg "/>
Abbildung 1. Schematische für Superovulation Technik. Schema, das Verfahren für die Superovulation zeitlich Schwangerschaften bei Mäusen. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.
2. Murine Fetale Chirurgie (Rücken Verwundung) auf E16.5 und E18.5 Embryonen (Abbildung 2)
- Vor dem Eingriff, Reinigen Sie alle Oberflächen des Operationssaals und Ausrüstung mit 70% Isopropylalkohol. Zusätzlich zu sterilisieren alle chirurgisches Material und Instrumente, die im Rahmen des Verfahrens durch Autoklavieren sie verwendet werden soll. Einige Institutionen kann die anschließende Verwendung von heißen Perle Sterilisation zu ermöglichen. Pro Betrieb verwenden steril verpackt, die Gaze und chirurgische Instrumente umfassen.
- Induzieren Anästhesie in schwangere Mütter (fetale Alter E16.5 oder E18.5) unter 2,5% Isofluran / Sauerstoff-Gemisch in 2 l pro Minute, gefolgt von Wartung Anästhesie mit 1 l pro min.
- Um conFirma ordnungsgemäße Betäubung, sicherzustellen, dass die tiefen Pedal Reflexe der Maus unterdrückt werden und die Maus in der Bauchlage.
- Tragen Sie einen Tierarzt Augensalbe wie Puralube, das Augenreizungen oder Trockenheit während des Verfahrens zu verhindern.
- Bereiten Bauch durch Verabreichung einer Licht Anwendung Enthaarungscreme für nicht mehr als 30 Sekunden (Abbildung 2A).
- Bereiten Bauch für aseptische Chirurgie mit PVP-Jod und Alkohol (2B und 2C).
- Führen Mittellinie Bauchschnitt unter dem Mikroskop mit mikrochirurgischen Schere (Abbildung 2D und 2E).
- Aussetzen vorsichtig Gebärmutter und Fötus für Chirurgie (2F) ausgewählt.
- Spülen Operationsfeld mit warmem (38 ° C) phosphatgepufferte Kochsalzlösung (PBS) mit einem stumpfen Nadel-Spitze
HINWEIS: Man kann durch vorsichtiges Biegen der Spitze einer großen Injektionsnadel aus vorgenommen werden. (2G und 2H). - Positionieren Sie den Fötus in einer Weise, die ess vollen Zugriff auf Rücken.
- Übergeben Sie eine Tabaksbeutelstich mit 7-0 Nylonnaht durch die Gebärmutter, die über dem Ort der beabsichtigten Rücken Verwundung (2I). Position Schnürfaden über einen Bereich des Rückens nach links oder rechts von Rückenmark und in einem Bereich der Gebärmutterwand frei von großen Blutgefäßen.
- Machen Sie eine 3 mm Schnitt durch Gebärmutterwand und Fruchtblase in der Mitte der Tabaksbeutel (2J).
- Bewässern Inzisionsstelle mit warmem (38 ° C) PBS.
- Mit mikrochirurgischen Schere, schnitt ein einziges Vollhaut Exzisionswunde, ca. 1 mm in der Länge, in dem Rücken des Fötus.
- Sanft Blot Inzisionsstelle trocknen mit Baumwolle-Spitze-Applikator.
- Injizieren 3 ul Volumen Tusche subkutan in die Wundstelle zu Lage der Wunde (Abbildung 2 K) zu markieren.
- Bewässerung mit warmem (38 ° C) PBS sicherzustellen Tinte innerhalb Wundstelle beibehalten.
- Haben chirurgischen Assistenten inject warm (38 ° C) PBS durch stumpfen Spitze 10 G-Spritze in die Fruchtblase wie die Tabaksbeutelnaht geschlossen ist (Abbildung 2 l). Einfahren Spritze Tabaksbeutelverschluss nähert sich der Fertigstellung (Abbildung 2 M).
- Gebärmutter vorsichtig in die Bauchhöhle (Abbildung 2 N) zurück.
- Evert Haut und Bauchfell.
- Haben chirurgischen Assistenten bewässern Bauchhöhle mit warmem (38 ° C) PBS.
- Schließen Bauch schnell von Heften Haut und Bauchfell geschlossen (Abbildung 2 O). Die Standardverschluss in zwei Schichten durchgeführt wird; Peritoneum und Bauchmuskeln in einer Schicht, Unterhaut und Haut in der zweiten Schicht. Zur sofortigen Opfer und Ernte der Frucht, zeigt unsere Demonstration Schließung in einer Schicht.
- Legen Sie das Tier unter Beobachtung in einem warmen Inkubator bei 37 ° C für 30 Minuten oder bis das Tier gewinnt ausreichend Bewusstsein Brustlage zu halten einstellen.
- Ret nichtUrne das Tier an die Firma von anderen Tieren bis er vollständig von dem Verfahren zurückgewonnen.
- Nach dem Erwachen aus der Narkose und bei der anschließenden 48 Stunden, zu verwalten subkutane Injektion von Buprenorphin (0,05 mg / kg) alle 12 h für die Analgesie nach Bedarf auf Basis von Schmerzbeurteilung. Verwalten Carprofen (5 mg / kg) subkutan injiziert wird für zusätzliche postoperative Schmerzlinderung nach Bedarf.
- Zurück Tiere in den Käfig und sie mit Nahrung und Wasser ad libitum.
- Überwachen Sie sorgfältig auf Manifestationen Schmerzen.
- 48 Stunden nach der Operation, zu opfern schwangere Mutter mit einer Überdosis Isofluran und Ernte verwundet Fötus. Um dies zu tun, passen Isofluran-Konzentration auf 5% oder höher und aufrechtzuerhalten Exposition für 1 min nach dem Atemstillstand. Bestätigen Sie die Sterbehilfe mit Genickbruch. Ernten Sie einen unverletzten Embryo für altersangepassten Kontroll. Späte Embryonen eine separate Methode der Euthanasie im Einklang mit IACUC Empfehlungen, wie haben deKopfpauschale, Genickbruch oder chemische Injektion.
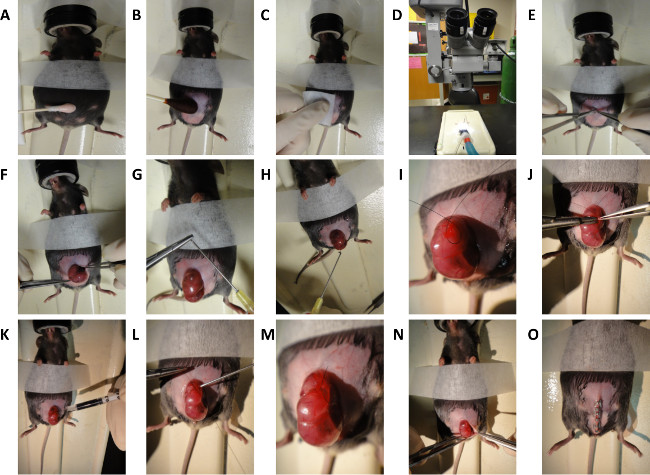
Abbildung 2. Schematische für Murine Fetale Chirurgie. Allgemeine Schritte für die Rücken Verwundung in E16.5 und E18.5 Maus-Embryonen. (A) Enthaarung der Maus Bauch. (B und C) Herstellung der Mausunterleib. (D) Mikroskop für chirurgische Verfahren. (E) Mittellinie Laparotomie. (F) Bei der Gebärmutter. (G) Erstellung von stumpfen Spitze Nadel. (H) Bewässerung der Gebärmutter mit warmer Kochsalzlösung. (I) Schaffung von Tabaksbeutelnaht. (J) Incision durch uterine Wand und 1 mm Dicke Voll Exzisionswunde Generation. (K) Die subkutane Injektion von Tusche. (L und M) Schließung der Tabaksbeutelnaht. (N und O)Schließung des Bauches. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.
Ergebnisse
Für die histologische Analyse sollte Hautwunden in die Rückenhaut von E16.5 und E18.5 Maus-Embryonen 48 h nach der Verletzung, in 4% PFA fixiert und in Paraffin eingebetteten geerntet werden. In fluoreszierende transgenen Modellen kann Kryokonservierung mit Oktober geeignet. Es gibt mehrere Flecken, die verwendet werden, um zelluläre und Bindegewebe Architektur Visualisierung verwendet werden kann. Hämatoxylin und Eosin ist ein Zwei-Farben-Fleck, Kerne blau und eosinophile Strukturen (dh., Zytoplasma und ex...
Diskussion
Das chirurgische Protokoll hier vorgestellten beschreibt eine excisional Modell des fötalen murinen narbenheil erste im Jahr 2006 von unserem Labor 10 veröffentlicht. Zusätzlich zu anderen etablierten Modelle der excisional Verwundung 11, Narben Modelle von fetalen Maus narbenheil existieren sowie 12,13. Untersuchungen des fetalen narben Wundheilung bei den Affen, Lamm, Kaninchen, Beutelratte, und Ratten wurden berichtet 14-17. Aber Mäuse sind ein ideales Modell für die E...
Offenlegungen
The authors have nothing to disclose.
Danksagungen
Diese Arbeit wurde zum Teil durch einen Zuschuss aus NIH R01 GM087609 (HPL), ein Geschenk von Ingrid Lai und Bill Shu zu Ehren von Anthony Shu (HPL), NIH Zuschusses U01 HL099776 (MTL), das Labor für Hagey unterstützt Pediatric Regenerative Medizin und der Oak Foundation (MTL und HPL). GGW wurde von der Stanford School of Medicine, der Stanford Medical Scientist Training Program unterstützt und NIGMS Ausbildungsförderung GM07365. MSH wurde von CIRM Clinical Fellow Ausbildungsförderung TG2-01159 unterstützt. WXH wurde durch Mittel aus dem Sarnoff Herz-Kreislauf-Stiftung.
Materialien
| Name | Company | Catalog Number | Comments |
| 7-O MONOSOF Suture | eSuture | SN-1647G | |
| Surgical Forceps | Kent Scientific | INS650916 | |
| Micro-scissors | Kent Scientific | INS600127 | |
| Autoclip 9 mm | Texas Scientific Instruments | 205060 | |
| Insulin Syringe | Thermo Fisher Scientific | 22-272-382 | |
| Black Pigment | AIMS | 242 | |
| BD Safety-Lok 3 ml Syringe | BD Biosciences | 309596 | |
| Phosphate Buffered Saline | Life Technologies | 10010-049 | |
| OPMI-MD Surgical Microscope | Carl Zeiss Surgical Inc | ||
| Pregnant Mares Serum (PMS) | Millipore | 367222 | |
| Human Chorionic Gonadotropin (HCG) | Sigma-Aldrich | CG10 | |
| Povidone Iodine Prep Solution | Dynarex | 1415 | |
| Nair (depilatory cream) | Church and Dwight Co. | 22600267058 |
Referenzen
- Larson, B. J., Longaker, M. T., Lorenz, H. P. Scarless fetal wound healing: a basic science review. Plastic and reconstructive surgery. 126, 1172-1180 (2010).
- Wilgus, T. A. Regenerative healing in fetal skin: a review of the literature. Ostomy/wound management. 53, 16-31 (2007).
- Wulff, B. C., et al. Mast cells contribute to scar formation during fetal wound healing. The Journal of investigative dermatology. 132, 458-465 (2012).
- Lorenz, H. P., Adzick, N. S. Scarless skin wound repair in the fetus. The Western journal of medicine. 159, 350-355 (1993).
- Longaker, M. T., et al. Wound healing in the fetus. Possible role for inflammatory macrophages and transforming growth factor-beta isoforms. Wound repair and regeneration : official publication of the Wound Healing Society [and] the European Tissue Repair Society. 2, 104-112 (1994).
- Longaker, M. T., et al. Studies in fetal wound healing. IV. Hyaluronic acid-stimulating activity distinguishes fetal wound fluid from adult wound fluid. Annals of surgery. 210, 667-672 (1989).
- Colombo, J. A., Napp, M., Depaoli, J. R., Puissant, V. Trophic influences of human and rat amniotic fluid on neural tube-derived rat fetal cells. International journal of developmental neuroscience : the official journal of the International Society for Developmental Neuroscience. 11, 347-355 (1993).
- Colwell, A. S., Longaker, M. T., Peter Lorenz, H. Identification of differentially regulated genes in fetal wounds during regenerative repair. Wound repair and regeneration : official publication of the Wound Healing Society [and] the European Tissue Repair Society. 16, 450-459 (2008).
- Hu, M. S., et al. Gene expression in fetal murine keratinocytes and fibroblasts. The Journal of surgical research. , (2014).
- Colwell, A. S., Krummel, T. M., Longaker, M. T., Lorenz, H. P. An in vivo mouse excisional wound model of scarless healing. Plastic and reconstructive surgery. 117, 2292-2296 (2006).
- Wilgus, T. A., et al. The impact of cyclooxygenase-2 mediated inflammation on scarless fetal wound healing. The American journal of pathology. 165, 753-761 (2004).
- Iocono, J. A., Ehrlich, H. P., Keefer, K. A., Krummel, T. M. Hyaluronan induces scarless repair in mouse limb organ culture. Journal of pediatric surgery. 33, 564-567 (1998).
- Chopra, V., Blewett, C. J., Krummel, T. M. Transition from fetal to adult repair occurring in mouse forelimbs maintained in organ culture. Wound repair and regeneration : official publication of the Wound Healing Society [and] the European Tissue Repair Society. 5, 47-51 (1997).
- Adzick, N. S., Longaker, M. T. Animal models for the study of fetal tissue repair. The Journal of surgical research. 5, 47-51 (1991).
- Block, M. Wound healing in the new-born opossum (Didelphis virginianam). Nature. 187, 340-341 (1960).
- Longaker, M. T., Dodson, T. B., Kaban, L. B. A rabbit model for fetal cleft lip repair. Journal of oral and maxillofacial surgery : official journal of the American Association of Oral and Maxillofacial Surgeons. 48, 714-719 (1990).
- Longaker, M. T., et al. A model for fetal cleft lip repair in lambs. Plastic and reconstructive surgery. 90, 750-756 (1992).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten