È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Un Mouse fetale Modello Skin of Wound Repair scarless
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
During mammalian development, early gestational skin wounds heal without a scar. Here we detail a reliable and reproducible model of fetal scarless wound healing in the cutaneous dorsum of E16.5 (scarless) and E18.5 (scarring) mouse embryos.
Abstract
Early in utero, but not in postnatal life, cutaneous wounds undergo regeneration and heal without formation of a scar. Scarless fetal wound healing occurs across species but is age dependent. The transition from a scarless to scarring phenotype occurs in the third trimester of pregnancy in humans and around embryonic day 18 (E18) in mice. However, this varies with the size of the wound with larger defects generating a scar at an earlier gestational age. The emergence of lineage tracing and other genetic tools in the mouse has opened promising new avenues for investigation of fetal scarless wound healing. However, given the inherently high rates of morbidity and premature uterine contraction associated with fetal surgery, investigations of fetal scarless wound healing in vivo require a precise and reproducible surgical model. Here we detail a reliable model of fetal scarless wound healing in the dorsum of E16.5 (scarless) and E18.5 (scarring) mouse embryos.
Introduzione
Ferite cutanee fetali guariscono rapidamente e scarlessly fino a tardi in gestazione 1. Fetal riparazione della ferita scarless è caratterizzata dalla rigenerazione di architettura tessuto normale e la funzione. Il passaggio da un scarless a cicatrici fenotipo avviene nel terzo trimestre di gravidanza negli esseri umani e in tutto il giorno embrionale 18 (E18) in topi 2,3. In confronto ad adulto, riparazione della ferita fetale è caratterizzata da una rapida riepitelizzazione, la deposizione di tessuto connettivo, e la migrazione dei fibroblasti.
Molti studi hanno offerto possibili spiegazioni per il fenomeno di scarless guarigione delle ferite durante le prime fasi dello sviluppo fetale. L'infiammazione è una componente fondamentale di riparazione adulti ferita; Tuttavia, ferite fetali sono caratterizzati da una mancanza di infiammazione acuta 4. Se questa è una conseguenza della immaturità funzionale del sistema immunitario durante fasi fetale rimane chiaro. Uno studio recente ha suggerito che le differenze di abbondanza, tappetourity, e la funzione dei mastociti in E15 vs. E18 cute fetale possono essere responsabili per il passaggio da un fenotipo scarless, almeno nel topo 3. Altri studi ipotizzano che le differenze nelle proprietà e abbondanza di macrofagi ferite fetali e adulti sono responsabili per la riforma della matrice extracellulare normale (ECM) durante ferita fetale riparazione 5.
Le differenze nei fattori ambientali durante lo sviluppo fetale e adulti possono anche interessare la riparazione delle ferite. Longaker e colleghi hanno dimostrato che il fluido ferita dal feto possiede alti livelli di attività acido ialuronico stimolante rispetto a nessuno in adulti ferita fluido 6. Di conseguenza, i livelli elevati di acido ialuronico, un glicosaminoglicano che promuove un microambiente favorevole alla motilità e proliferazione cellulare, nell'ambiente della ferita fetale possono essere responsabili del fenotipo scarless visto durante precoce sviluppo fetale. Altre linee di punto prova al fatto che la fetaambiente l ferita è relativamente ipossiemico e sommersa in sterile liquido amniotico ricco di fattori di crescita 7. Tuttavia, nessuna risposta definitiva è stata fornita per un evento critico o fattore durante l'embriogenesi che innesca la transizione dalla rigenerazione scarless a riparazione fibrotica.
La comprensione dei meccanismi responsabili per la guarigione scarless nel feto richiede un modello preciso e riproducibile. Qui i dettagli di un modello riproducibile di fetale scarless guarigione delle ferite nel dorso di E16.5 (scarless) ed embrioni E18.5 (cicatrici) del mouse. Inoltre, variazioni minori di questo modello può essere utilizzato per eseguire una serie di ulteriori studi, come l'analisi di espressione genica di ferite fetali e 8,9 pelle. Dato che le gravidanze a tempo proprio sono fondamentali per il successo della ricapitolazione questo scarless ferita modello guarigione fetale, abbiamo anche dettagliato il nostro protocollo superovulazione cronometrato gravidanze.
Protocollo
NOTA: Tutte le procedure descritte in questo documento vengono eseguite secondo le linee guida stabilite dal Pannello di Amministrazione Stanford on Laboratory Animal Care (APLAC).
1. Timed Gravidanze - Tecnica Superovulazione (Figura 1)
NOTA: Proprio tempi l'età gestazionale di embrioni di topo per la chirurgia fetale a E16.5 e E18.5 è di importanza fondamentale. In questa sezione abbiamo dettaglio il nostro protocollo di sincronizzazione gravidanze del mouse utilizzando mares siero incinta (PMS) e gonadotropina corionica umana (HCG) iniezioni per indurre superovulazione.
- Iniettare topi femmina (<5 per gabbia) per via intraperitoneale (IP) con 3,0-5,0 unità internazionali (UI) di PMS in un volume di 100 microlitri PBS 1:00-15:00 per il giorno 1.
- Tra le 12:00 e le 14:00 del giorno 3 (quarantacinque a 47 ore dopo l'iniezione PMS), iniettare topi femmina IP con 3,0-5,0 UI di HCG in un volume di 100 microlitri PBS.
NOTA: Le induce iniezione HCG ovulazione circa 12 ore dopo l'iniezione. - Subito dopo iniezioni di HCG, accoppiarsi con le femmine i maschi di età compresa tra 8-16 settimane.
NOTA BENE: Noi di solito poniamo due femmine in una gabbia di singoli uomini. - Femmine separati da uomini la mattina del giorno 4 (6:00-10:00) e record come fetale E0.5 età.
NOTA: tappi vaginali possono essere controllati in questo momento; Tuttavia, l'osservazione di un tappo vaginale non garantisce gravidanza e femmine può diventare incinta quando non si osserva la spina. Dato che la gravidanza è in genere osservabile mediante ispezione visiva e / o la palpazione in età gestazionale E16.5 e E18.5, controllando tappi vaginali la mattina del giorno 4 non è strettamente necessario. Nella nostra esperienza, e seconda del ceppo, circa il 30-50% delle femmine super ovulato diventa incinta utilizzando la tecnica qui descritta.
pg "/>
Figura 1. Schema di Tecnica Superovulazione. Procedura mostra Schema superovulazione cronometrato gravidanze nei topi. Cliccate qui per vedere una versione più grande di questa figura.
2. murino fetale Surgery (Dorsale Ferimento) su E16.5 e E18.5 embrioni (Figura 2)
- Prima della procedura, pulire tutte le superfici della sala operatoria e attrezzature con il 70% di alcol isopropilico. Inoltre, sterilizzare tutte le forniture chirurgiche e gli strumenti che saranno utilizzati nella procedura da essi autoclave. Alcuni istituti possono consentire il successivo utilizzo di caldo tallone sterilizzazione. Per il funzionamento, utilizzare confezioni sterili che includono la garza e strumenti chirurgici.
- Indurre l'anestesia in donne in gravidanza (fetale E16.5 età o E18.5) inferiore al 2,5% della miscela isoflurano / ossigeno a 2 L al min seguita da anestesia di mantenimento a 1 L per min.
- Per conimpresa adeguata anestesia, assicurano i riflessi pedale profondi del mouse vengono soppressi e posizionare il mouse in posizione prona.
- Applicare una pomata oftalmica veterinario come Puralube prevenire l'irritazione degli occhi o secchezza durante la procedura.
- Preparare addome somministrando una leggera applicazione di crema depilatoria per non più di 30 secondi (Figura 2A).
- Preparare addome per la chirurgia asettica con povidone-iodio e di alcol (figura 2B e 2C).
- Eseguire linea mediana laparotomia sotto il microscopio con le forbici microchirurgia (Figura 2D e 2E).
- Esporre delicatamente utero e feto selezionato per la chirurgia (Figura 2F).
- Irrigare campo chirurgico con il caldo (38 ° C) PBS (PBS) con un ago smussato punta
NOTA: Si può essere fatto piegando con cautela la punta di un ago di grosso calibro. (Figura 2G e 2H). - Posizionare il feto in modo da consentires pieno accesso a dorso.
- Passare un punto stringa di borsa utilizzando 7-0 nylon sutura attraverso l'utero che insiste sul sito di ferimento dorsale previsto (Figura 2I). Posizione stringa di borsa su una regione del dorso a sinistra oa destra del midollo spinale, e in una regione di parete uterina privo di grandi vasi sanguigni.
- Eseguire un'incisione 3 millimetri attraverso la parete uterina e sacco amniotico nel centro della stringa borsa (Figura 2J).
- Irrigare sito di incisione con acqua calda (38 ° C) PBS.
- Utilizzando forbici microchirurgiche, tagliare una sola ferita excisional tutto spessore, di circa 1 mm di lunghezza, nel dorso del feto.
- Delicatamente sito di incisione asciugare con cotone applicatore.
- Iniettare 3 ml di volume India sottocutanea inchiostro nel sito della ferita per contrassegnare posizione di ferita (Figura 2K).
- Irrigare con acqua calda (38 ° C) PBS per assicurare l'inchiostro è stato mantenuto all'interno del sito della ferita.
- Avere chirurgica assistant inject caldo (38 ° C) PBS attraverso blunt punta siringa da 10 G nel sacco amniotico, come la stringa di borsa è chiusa (Figura 2L). Ritrarre siringa come chiusura stringa di borsa si avvicina al completamento (Figura 2M).
- Ritorno delicatamente dell'utero nella cavità addominale (Figura 2N).
- Evert pelle e del peritoneo.
- Hanno assistente chirurgica irrigare cavità addominale con acqua calda (38 ° C) PBS.
- Chiudi addome rapidamente pinzatura pelle e del peritoneo chiuso (Figura 2O). La chiusura standard viene eseguita in due strati; peritoneo e muscoli addominali in uno strato, tessuto sottocutaneo e la pelle nel secondo strato. Per sacrificio immediato e la raccolta del feto, la nostra manifestazione dimostra la chiusura in un solo strato.
- Posto l'animale sotto osservazione in un incubatore calda a 37 ° C per 30 minuti o fino a quando l'animale riprende conoscenza sufficiente per mantenere decubito sternale.
- Non returna l'animale per la compagnia di altri animali fino a quando non ha pienamente recuperato dalla procedura.
- Al risveglio dall'anestesia e durante il successivo 48 hr, amministrare l'iniezione sottocutanea di buprenorfina (0,05 mg / kg) ogni 12 ore di analgesia come necessario sulla base della valutazione del dolore. Somministrare carprofen (5 mg / kg) per via sottocutanea per il sollievo del dolore post-operatorio supplementare se necessario.
- Animali Ritorno alla gabbia e di fornire loro cibo e acqua ad libitum.
- Monitorare attentamente per manifestazioni di dolore.
- Post-operatorio 48 ore, sacrificio madre incinta con una dose eccessiva di isoflurano e del raccolto feriti feto. Per fare questo, regolare la concentrazione isoflurano al 5% o superiore e mantenere l'esposizione per 1 min dopo la cessazione della respirazione. Confermare l'eutanasia con dislocazione cervicale. Raccolto un embrione illeso per il controllo di pari età. Embrioni tardivi dovrebbero avere un sistema diverso di eutanasia in linea con le raccomandazioni IACUC, come decaptazione, dislocazione cervicale, o iniezione chimica.
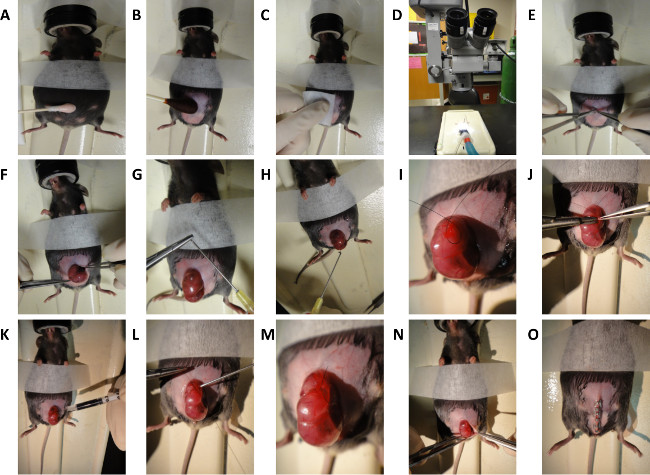
Figura 2. Schema di Murine fetale Surgery. Passi generali per la dorsale ferendo in E16.5 e E18.5 embrioni di topo. (A) Depilazione di topo dell'addome. (B e C) Preparazione di topo dell'addome. (D) microscopio utilizzato per chirurgica procedura. (E) Midline laparotomia. (F) L'esposizione dell'utero. (G) Creazione di blunt-punta dell'ago. (H) Irrigazione dell'utero con soluzione salina calda. (I) Creazione di stringa di borsa sutura. (J) incisione attraverso uterina muro e 1 mm completa generazione ferita excisional spessore. (K) L'iniezione sottocutanea di inchiostro di china. (L e M) Chiusura della stringa di borsa sutura. (N e O)Chiusura dell'addome. Cliccate qui per vedere una versione più grande di questa figura.
Risultati
Per l'analisi istologica, ferite cutanee della pelle dorsale E16.5 e E18.5 embrioni di topo dovrebbero essere raccolti 48 ore dopo il ferimento, fissati in 4% PFA, e inclusi in paraffina. Nei modelli transgenici fluorescenti, la crioconservazione di ottobre può essere appropriato. Ci sono diverse macchie che possono essere utilizzati per visualizzare architettura tessuto cellulare e connettivo. Ematossilina e eosina è una macchia a due colori che macchia nuclei blu e strutture eosinofili (es., Citoplasma ...
Discussione
Il protocollo chirurgico presentato qui descrive un modello escissionale fetale guarigione scarless murino pubblicato nel 2006 dal nostro laboratorio 10. Oltre agli altri modelli consolidati di ferimento excisional 11, esistono modelli incisionali di fetale murino scarless guarigione così 12,13. Indagini di fetale guarigione scarless nella scimmia, agnello, coniglio, opossum, e ratti sono stati segnalati 14-17. Tuttavia, i topi rappresentano un modello ideale per esplorare fe...
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
Questo lavoro è stato sostenuto in parte da una sovvenzione NIH concedere R01 GM087609 (a HPL), un regalo da Ingrid Lai e Bill Shu in onore di Anthony Shu (a HPL), NIH concedere U01 HL099776 (a MTL), il Laboratorio per Hagey Pediatrica Medicina Rigenerativa e La Fondazione Oak (a MTL e HPL). GGW è stato sostenuto dalla Stanford School of Medicine, il Programma di Formazione Stanford Medical Scientist, e borsa di formazione NIGMS GM07365. MSH è stato sostenuto da CIRM Clinical Fellow formazione di Grant TG2-01159. WXH è stato sostenuto da un finanziamento della Cardiovascular Foundation Sarnoff.
Materiali
| Name | Company | Catalog Number | Comments |
| 7-O MONOSOF Suture | eSuture | SN-1647G | |
| Surgical Forceps | Kent Scientific | INS650916 | |
| Micro-scissors | Kent Scientific | INS600127 | |
| Autoclip 9 mm | Texas Scientific Instruments | 205060 | |
| Insulin Syringe | Thermo Fisher Scientific | 22-272-382 | |
| Black Pigment | AIMS | 242 | |
| BD Safety-Lok 3 ml Syringe | BD Biosciences | 309596 | |
| Phosphate Buffered Saline | Life Technologies | 10010-049 | |
| OPMI-MD Surgical Microscope | Carl Zeiss Surgical Inc | ||
| Pregnant Mares Serum (PMS) | Millipore | 367222 | |
| Human Chorionic Gonadotropin (HCG) | Sigma-Aldrich | CG10 | |
| Povidone Iodine Prep Solution | Dynarex | 1415 | |
| Nair (depilatory cream) | Church and Dwight Co. | 22600267058 |
Riferimenti
- Larson, B. J., Longaker, M. T., Lorenz, H. P. Scarless fetal wound healing: a basic science review. Plastic and reconstructive surgery. 126, 1172-1180 (2010).
- Wilgus, T. A. Regenerative healing in fetal skin: a review of the literature. Ostomy/wound management. 53, 16-31 (2007).
- Wulff, B. C., et al. Mast cells contribute to scar formation during fetal wound healing. The Journal of investigative dermatology. 132, 458-465 (2012).
- Lorenz, H. P., Adzick, N. S. Scarless skin wound repair in the fetus. The Western journal of medicine. 159, 350-355 (1993).
- Longaker, M. T., et al. Wound healing in the fetus. Possible role for inflammatory macrophages and transforming growth factor-beta isoforms. Wound repair and regeneration : official publication of the Wound Healing Society [and] the European Tissue Repair Society. 2, 104-112 (1994).
- Longaker, M. T., et al. Studies in fetal wound healing. IV. Hyaluronic acid-stimulating activity distinguishes fetal wound fluid from adult wound fluid. Annals of surgery. 210, 667-672 (1989).
- Colombo, J. A., Napp, M., Depaoli, J. R., Puissant, V. Trophic influences of human and rat amniotic fluid on neural tube-derived rat fetal cells. International journal of developmental neuroscience : the official journal of the International Society for Developmental Neuroscience. 11, 347-355 (1993).
- Colwell, A. S., Longaker, M. T., Peter Lorenz, H. Identification of differentially regulated genes in fetal wounds during regenerative repair. Wound repair and regeneration : official publication of the Wound Healing Society [and] the European Tissue Repair Society. 16, 450-459 (2008).
- Hu, M. S., et al. Gene expression in fetal murine keratinocytes and fibroblasts. The Journal of surgical research. , (2014).
- Colwell, A. S., Krummel, T. M., Longaker, M. T., Lorenz, H. P. An in vivo mouse excisional wound model of scarless healing. Plastic and reconstructive surgery. 117, 2292-2296 (2006).
- Wilgus, T. A., et al. The impact of cyclooxygenase-2 mediated inflammation on scarless fetal wound healing. The American journal of pathology. 165, 753-761 (2004).
- Iocono, J. A., Ehrlich, H. P., Keefer, K. A., Krummel, T. M. Hyaluronan induces scarless repair in mouse limb organ culture. Journal of pediatric surgery. 33, 564-567 (1998).
- Chopra, V., Blewett, C. J., Krummel, T. M. Transition from fetal to adult repair occurring in mouse forelimbs maintained in organ culture. Wound repair and regeneration : official publication of the Wound Healing Society [and] the European Tissue Repair Society. 5, 47-51 (1997).
- Adzick, N. S., Longaker, M. T. Animal models for the study of fetal tissue repair. The Journal of surgical research. 5, 47-51 (1991).
- Block, M. Wound healing in the new-born opossum (Didelphis virginianam). Nature. 187, 340-341 (1960).
- Longaker, M. T., Dodson, T. B., Kaban, L. B. A rabbit model for fetal cleft lip repair. Journal of oral and maxillofacial surgery : official journal of the American Association of Oral and Maxillofacial Surgeons. 48, 714-719 (1990).
- Longaker, M. T., et al. A model for fetal cleft lip repair in lambs. Plastic and reconstructive surgery. 90, 750-756 (1992).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon