Method Article
线粒体的制备及透气性评估,从骨骼肌组织通过穿刺活检获得的分离
摘要
方法活检股外侧 ,准备纯化线粒体和透气性分析描述。使用小肌肉体积使得该技术适用于临床研究应用。
摘要
分离线粒体的呼吸计谱是常用来调查电子传递链的功能。我们描述了使用外通量(XF)分析方法获得人股外侧肌的样品,从骨骼肌组织中极少量隔离线粒体和板基础透气性分析。使用1.0,2.5和5.0微克线粒体获得呼吸速率曲线的比较表明,1.0微克足以测量呼吸和5.0微克提供基于标准误差比较最一致的结果。分离线粒体线粒体标记COX IV和非线粒体组织标记的GAPDH的免疫印迹分析表明,有使用该协议限定非线粒体污染。研究线粒体呼吸测量肌肉组织低至20毫克的能力,使用户能够利用在多个临床研究终点个体活检研究项目。
引言
线粒体是细胞中的主要能源生产场地和在老化的重要作用,以及各种年龄相关病症如心血管疾病,阿尔茨海默氏病,糖尿病,癌症和肥胖症。分离线粒体的呼吸计谱提供的电子传输链(ETC)的函数直接分析,并已显著我们线粒体生物学的理解和其在健康和疾病中的作用作出了贡献。分离线粒体用于研究等,基板运输,ATP合酶活性,质子泄漏等在这个手稿中描述的方法已被优化,以允许线粒体从人受试者获得骨骼肌组织活检分离的呼吸计分析生物能量学的各个方面。在这个手稿中描述的活检协议已经利用我们的工作人员在过去的12年。我们的团队已经完成了超过700程序,对不同年龄的成年人,高达90岁,和没有任何不良的安全问题的各种慢性疾病的条件。此协议的一个重要方面是,它是专门设计来利用组织的最小量,从而促进其在临床研究中使用。
各种协议已被开发用于分离线粒体。费尔南德斯-Vizarra 等 1,2-描述用于从各种大鼠组织以及培养细胞中分离线粒体的方法。加西亚Cazarin 等 3报道从骨骼肌从大鼠和小鼠中分离线粒体的方法。一种用于从鼠脑分离线粒体方法也有报道通过西亚斯-冈萨雷斯等人 4毛等人的 5报道使用barocycler和/或PCT粉碎机分离线粒体的方法。近日,弗兰科等人 6日报道隔离使用抗高浓缩铀线粒体的方法-TOM22磁珠。
而这些协议产生极好的效果,而在这个手稿中描述的方法的组织尺寸的要求是很高的。例如,Gross 等。5用1.5-1.8克腓肠肌的,并且约2g的肾脏组织。同样,佛朗哥等 6使用500毫克鼠肝组织。根据我们的经验,一般收益率从骨骼肌( 股外侧 )穿刺活检预期范围从100-200毫克。在20-50毫克使用此处描述的协议的肌肉组织的评估线粒体功能的能力允许用户每次活组织检查和存储的样本进行多次评估,以便在其他分子生物学实验将来使用。这在临床研究和其他需要勤于采用样本研究的一个关键功能。应当注意的是,先前冷冻线粒体都不好学习耦合呼吸由于OUTEř线粒体膜损伤,细胞色素C活性丧失。我们的方法已被改编及由Chappell的和佩里7公开的方法进行修改。
使用这个手稿中描述的方法,我们最近报道说,线粒体的呼吸速率曲线,从人股外侧隔离直接与体能,测量步速8相关。
研究方案
注:说明是经医学维克森林学校的机构审查委员会的协议。以书面形式获得知情同意书。所有与会者都健康老年男女的成年人(65-79岁),身体质量指数从23-35。
1.骨骼肌活检
- 如前所述,9后的O / N高速执行清晨的所有活组织切片检查。询问受试者服用阿司匹林,处方药和非处方非甾体抗炎药,或其他化合物可能影响出血,血小板,或瘀伤的一周前的活检来避免。请参与者也从任何剧烈活动为避免前活检至少36小时。
注:肌肉是从股外侧采用与1%利多卡因局部麻醉下经皮针的穿刺活检技术获得。无并发症或o疗法报道从过程的不良事件都发生在我们的临床研究单位。 - 注:所描述的活检过程是改编自该伯格斯特龙10。
- 简单地说,本地管理1%利多卡因注意不要渗入肌肉。用10分钟的等待时间按照此允许足够的麻木。
- 取活检从肌肉(插入和原点之间的肌肉的中间区域)避免筋膜和myotendonous区的腹中。
- 利用经皮针(侧切割窗口,内切汽缸吸入可重复使用的辅助装置),并跟随筋膜"啪"的招牌作为指导或阻力。
- 估计的深度与麻醉针,然后再次感觉到它与窄手术刀刀片和通过筋膜进行4-5毫米切口。通过切口推进针,直到它被插入到肌肉。
- 收集与窗口多个样品转向不同的方向。使用60毫升注射器而进退肌肉样品进经皮针两到四倍以不同方向施加连续吸力。中止吸并取出针。
注:每个通(插入和拔出针)花费时间不超过一分钟。 - 有一个助手适用于公司的压力,穿刺部位5分钟建立止血。从吸气管拔掉针头,小心地从窗口桶取出的肌肉样本。
- 使第二通如果更多的肌肉,需要通过重复上述过程。
- 使用镊子除去从肌肉样品的可见的血块,称重样品,并立即在含有冰冷的DPBS的管放置。
注:使用这种方法的平均产量为150±20毫克。
2.线粒体隔离
- 新鲜制备Chappel-佩里(CP)和线粒体测定溶液(MAS)的缓冲器( 表1)在实验中,或等分的一天,并将其存储在-20℃。制备在二甲基亚砜中的化合物为2.5毫米的浓度和等分并储存在-20℃。使用储存在-20℃下2个月内从作成日的缓冲液和化合物等分试样。
- 删除使用锋利的剪刀和镊子样品可见结缔组织;如果需要的话用解剖显微镜对这一步骤。彻底洗净标本3-4次,用冰冷的DPBS缓冲以除去血液。保持在冰冷的DPBS和过程中的样品,尽快,注意不要超过从活检超过45分钟。采取预防措施,以小心地从肌肉样本中删除任何肌腱或脂肪组织。
- 立即用无菌剪刀印章的肌肉组织成细片,并在500微升暂停含公关1毫升CPIoteinase(枯草菌),在0.2毫克/克组织的浓度。用5分钟在室温下孵育遵循这一点,然后转移到冰上。
- 均质使用自动均质与枯草菌处理的碎组织。请在此过程中冰的样本。均质每个组织样本4次,每次时间为2秒的脉冲,使用自动匀浆在10,000 rpm的速度设置。洗探针,用70%的乙醇,随后通过组织之间的蒸馏水。
- 与CP I(500微升至1毫升)和CPⅡ的2倍体积(1ml至2ml)中的等体积的洗匀浆组织,并在600×g离心,4℃收集在一个离心管中,离心分离机的内容10分钟。通过湿纱布传递上清液,收集滤液弃沉淀,从而消除了大多数非线粒体分数。
3.洗涤的线粒体
- 从上述步骤离心上清液10,000×g离心,4℃,10分钟。暂停在4ml的CP二缓冲器,并进一步离心沉淀以10,000×g离心,4℃,10分钟。
注:在极少数情况下,薄血颗粒形成如下线粒体沉淀。在这种情况下,通过温和抽吸与CPII缓冲器移除线粒体沉淀。可避免彻底洗去血液在步骤2本步骤。 - 暂停的CP I缓冲2毫升得到的粒料。在这个阶段使用一个小的等分试样,从该悬浮液中蛋白质的估计。重悬的其余样品中的CP I缓冲液和离心如上。暂停在线粒体测定溶液(MAS)的最小量(200微升)的最终的沉淀。
注:蛋白质测定是在这个阶段,因为CP I缓冲区没有BSA,而MAS其中样本将被暂停后确实有BSA在里面。
4.评估线粒体含量测定蛋白质浓度用BCA蛋白检测试剂盒
注:使用此浓度来计算用于装载线粒体的量到24孔微孔板进行呼吸计测量,或用于蛋白质印迹实验。考虑到稀释因素(10),用于蛋白质浓度的计算。5.所描述的罗杰斯,GW 等执行XF检测。12
注:可视化的O 2消耗率(OCR)在皮摩尔O 2 /分钟,或O 2,pH值在数据输出绝对水平。
- 使用1倍的MAS以制备化合物被注入。添加10倍浓度的化合物的端口的AD,得到的最终浓度如下:端口A,ADP [腺苷5'二磷酸,2mM的50微升]; B端口,寡霉素(2μM,55微升);端口C,FCCP [羰基氰4-(三氟甲氧基)苯腙,6微米,60微升]和端口D,2μM抗霉素A(65微升)。准备足够的体积为孔的所需数量的化合物。
- 通过滴定测定线粒体的最佳量。例如,负载1.0微克,2.5微克和5.0微克的含基材冰冷1X MAS 50微升体积每孔线粒体。为了尽量减少井之间变化,第一稀释10倍的线粒体在寒冷的1个MAS +基板。接着,提供50微升此悬浮液到每个孔中(除了背景校正孔)。
- 离心板在2000×g离心,20分钟,在4℃。离心后,轻轻地加入450微升1×MAS +琥珀酸盐(10毫摩尔)和鱼藤酮(2μM)(初始条件;见下文),以每孔中。查看在显微镜下的线粒体,以确保均匀的遵守现有井到板转移到XF分析器。
注意:用于将依赖于由任一ETC复合物I或复合体II的呼吸是否被驱动的初始条件。对于复杂II驱动的呼吸,用succinate(10毫米)和鱼藤酮(2μM)作为初始条件。鱼藤酮块复合物I和琥珀提供燃料复合物II(琥珀酸脱氢酶)。来研究呼吸由复合物I驱动,使用丙酮酸和苹果酸盐,各为5毫米或谷氨酸和苹果酸盐的每个的终浓度为10 mM的终浓度为初始条件。后者可以帮助区分之间的三羧酸循环和基板的运输功能障碍。为了研究通过呼吸既复杂我和复杂II驱动,包括丙酮酸和琥珀酸无鱼藤酮或苹果酸作为初始条件。使用棕榈酰肉毒碱作为底物为β氧化。 - 使用呼吸通过编程它如先前描述的12顺序地实时测量的线粒体呼吸。使用设置为表2中提供的呼吸。
注:不同的线粒体呼吸状态的简要说明如下: - 国2 =与基板结合目前的状态;国家3 =在ADP饱和的存在磷酸呼吸;国家4 O =非磷酸化呼吸诱导寡;国家3U =最大的解偶联呼吸作用的解偶联剂FCCP刺激;经过复杂的III抑制抗霉素-A的剩余非线粒体呼吸呼吸=。还应当指出的是,OCR测量的组合长度与线粒体浓度可以通过在测量期间消耗氧气影响的数据。
6.免疫印迹
注:由Western印迹确定线粒体标记COX IV和整个组织GAPDH保证线粒体富集的最终样品中
- 分离的分离的线粒体,整个组织提取物由12%十二烷基硫酸钠聚丙烯酰胺凝胶。
- 蛋白质转移到聚偏二氟乙烯(PVDF)膜。
- 孵育COX IV抗体(1:20000),其次是辣根过氧化物酶(HRP)缀合的二抗。对于GAPDH的决心,剥离印迹和探针与GAPDH单克隆抗体(1:2000)。
注:如果在ER污染差异是令人关注的,包括ER标志物如ERp72,钙联接蛋白,钙网蛋白或在分析中。
结果
图1示出了整个协议的详细流程图。
COX IV / GAPDH( 图2)的蛋白印迹分析轮廓描绘线粒体蛋白质,COX IV,和非线粒体标记的GAPDH的表达。双方COX IV和GAPDH的表达是很明显的,在整个肌肉溶解产物。经过线粒体正在使用这个协议描述的技术分离出来,COX IV频段依然明显,而GAPDH不存在相同的曝光。更长时间的曝光可能会发现一个微弱的GAPDH带。这些印迹表明,分离的线粒体具有最小非线粒体污染。此外,在分离线粒体COX IV的表达是样品之间是一致的。
图3示出了使用1.0微克,2.5微克和5.0微克线粒体由复合物II(琥珀酸和鱼藤酮)从动典型呼吸速率曲线。正如预期的那样,整个OCR增加瓦特第i个较高数额的线粒体。对于该测定计算出的呼吸控制率(RCR)为7.95,表明线粒体制剂是高质量的。此外,国家3U OCR比状态3略高,证实线粒体质量。
为了分析不同量的线粒体时,比较结果的一致性,我们进行了方差分析(方差分析)和计算出的平方(SS),为方差的实际值的使用的总和1.0微克,2.5微克,每5.0线粒体微克加载井( 图4)。 SS提出的状态2,状态3,状态3U,抗霉素A,和RCR。对于国家2和国家3次测量,单因素方差分析有统计学显著(P <0.01或P <0.05)。同样,方差分析的一种方法是为抗霉素和RCR(P <0.01或P <0.0001统计学显著,分别为无显著差异见过的群体之间的状态3U。钍ESE结果表明,5.0微克,每孔线粒体,得到最低的SS相对于其他的浓度和在24 XF系统使用与我们的人口参与者的最佳量。
图5作为一个导向,以指示多少线粒体蛋白可基于初始肌肉样本大小可以预期的。正如预期的那样有肌肉(毫克)处理的量和最终样品的总线粒体蛋白含量(mg)之间有很强的相关性。
| Chappel -佩里缓冲I(CPI) | |
| 化学 | 浓度 |
| 氯化钾 | 100毫米 |
| MOPS | 50毫米 |
| EDTA | 1毫米 |
| 硫酸镁 | 5毫米 |
| ATP | 1毫米 |
| pH值 | 7.4 |
| Chappel -佩里缓冲II(CPII) | |
| 化学 | 浓度 |
| 氯化钾 | 100毫米 |
| MOPS | 50毫米 |
| EDTA | 1毫米 |
| 硫酸镁 | 5毫米 |
| ATP | 0.2毫米 |
| 脂肪酸免费BSA | 0.50% |
| pH值 | 7.4 |
| 线粒体分析解决方案(MAS)(2X) | |
| 化学 | 浓度 |
| 蔗糖 | 35毫米 |
| 甘露醇 | 110毫米 |
| KH 2 PO 4 | 2.5毫米 |
| 氯化镁 | 2.5毫米 |
| HEPES | 1.0毫米 |
| EGTA | 0.5毫米 |
| 脂肪酸免费BSA | 0.10% |
| pH值 | 7.4 |
| 线粒体分析解决方案(MAS)与复合物II的初始条件 | |
| 化学 | 浓度 |
| 1X MAS | |
| 琥珀酸 | 10毫 |
| 鱼藤酮 | 2μM |
| pH值 | 7.4 |
| 线粒体分析解决方案(MAS)与复杂的I初始条件 | |
| 化学 | 浓度 |
| 1X MAS | |
| 丙酮酸 | 5毫米 |
| 马拉特 | 5毫米 |
| pH值 | 7.4 |
| *所有的缓冲区,以在去离子水中进行 | |
表1.解决方案和缓冲区的食谱。
| 协议的步骤 | ||
| StartProtocol | ||
| 命令 | 时间(min) | 港 |
| 校准 | 0.00 | |
| 等待 | 10.00 | |
| 混合 | 1.00 | |
| 等待 | 3.00 | |
| 混合 | 1.00 | |
| 等待 | 3.00 | |
| 混合 | 0.50 | |
| 措施 | 3.00 | |
| 混合 | 1.00 | |
| 措施 | 3.00 | |
| 混合 | 0.50 | |
| 注入 | 一 | |
| 混合 | 1.00 | |
| 措施 | 6.00 | |
| 混合 | 1.00 | |
| 注入 | B | |
| 混合 | 1.00 | |
| 措施 | 3.00 | |
| 混合 | 1.00 | |
| 注入 | Ç | |
| 混合 | 1.00 | |
| 措施 | 3.00 | |
| 混合 | 1.00 | |
| 注入 | ð | |
| 混合 | 1.00 | |
| 措施 | 3.00 | |
| EndProtocol | ||
表2.混合,测量,混合周期设置为呼吸。

图1.流程图整个协议。 请点击此处查看该图的放大版本。
/ftp_upload/52350/52350fig2highres.jpg"/>
图2.整个骨骼肌肉组织以及孤立的线粒体代表印迹。整个组织提取物以及分离的线粒体进行免疫与COX IV抗体作为标记线粒体和GAPDH抗体非线粒体控制。没有GAPDH带观察到分离线粒体表示从非线粒体来源很少或没有污染。 请点击此处查看该图的放大版本。
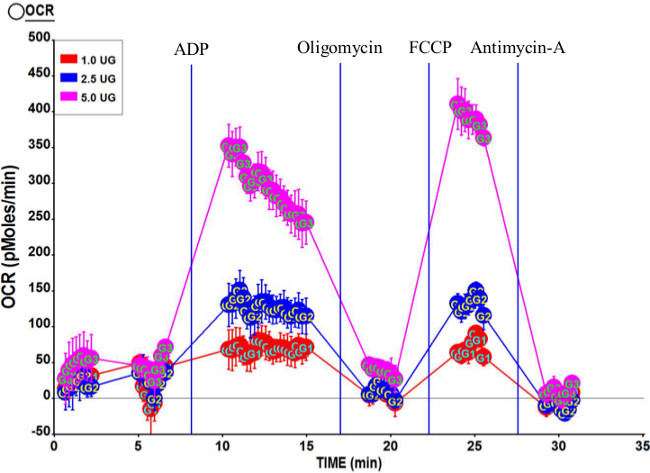
线粒体图3.代表透气性轮廓人类股外侧隔离三个孤立的浓度的线粒体,5.0微克,2.5微克和1.0微克我们重新使用在该测定。终浓度端口注射后化合物分别为2毫米ADP(A口); 2μM寡(B口); 6μMFCCP(C口); 2μM抗霉素A(D口)。 RCR计算此运行是7.95。 请点击此处查看该图的放大版本。
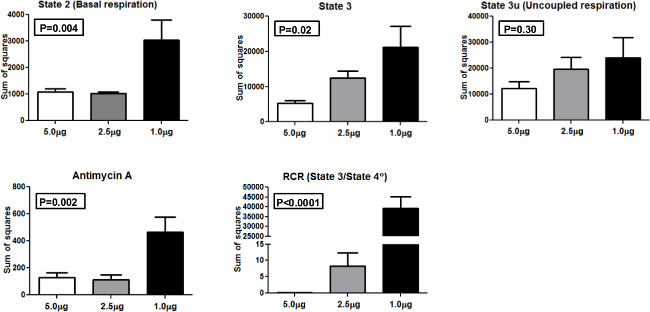
图4平方和。求和使用5.0微克,2.5微克和1.0微克线粒体广场为不同的线粒体呼吸状态和RCR的。 请点击此处查看该图的放大版本。
ig5highres.jpg"/>
图5.这可以用来作为一个导引来估计,可以基于初始肌肉样品重量回归分析可以预期的线粒体蛋白的量:肌肉(毫克)和总的线粒体蛋白质产量(毫克)的量。正如预期的那样,有肌肉的量和所得到的总的线粒体蛋白质之间的直接正相关关系。
讨论
分离线粒体通常用在该检查ETC功能的作用,以及其他线粒体活动,包括基片运输和TCA循环功能研究。用孤立的细胞器呼吸计测定允许直接检查氧化磷酸化的基本过程和等内在特性分离线粒体的相比,全细胞或透化的肌纤维呼吸计仿形具有相对简单的数据解释的优点和没有来自非线粒体过程或改变线粒体质量/生物发生"干预"的。数据标准化是基于线粒体蛋白质含量,从而使简单的交叉对比样本之间的线粒体。分离线粒体的呼吸计谱是当研究的目的是确定潜在的机制和识别特定目标,如ETC成分的优选的方法S /复合物,或线粒体转运机制。
描述的是一种协议,肌肉活检和线粒体功能的孤立小组织样本。这种方法产生因利用自动化均质用户之间可重复的结果与手工操作DOUNCE均质。线粒体的分离可以与肌肉组织的少至20毫克的执行。的,可从该样本大小来获得分离的线粒体的量是足以运行海马板为基础的呼吸测量,同时留下剩余的线粒体为其他实验和储存用于进一步分子分析。可以注意到,该方法可以被转换为XF 96中,即使少量的线粒体的可使用(每孔1-2微克)。
隔离线粒体几个协议依赖于DOUNCE均质初始组织破坏。这种方法的缺点是在实际操作上的初始组织的性质同质化。在均质杵的力量和速度运营商6之间显著不同。这可能会导致在实验对实验变异,以及实验室到实验室变化,并导致难以在实验之间进行比较的数据。这是在人类干预研究特别关注的,当从参与者数据被收集在单独的时间点,通常前和后处理,并有可能在多个位点。我们使用自动均化器进行更一致的方法能产生具有有限的人对人的变化更可再现的结果。制备的速度也使得这种方法适合于处理多个样品在同一时间。通常情况下,最多三个实验可以在一天中进行。
此处所描述的技术的潜在限制因使用分离的细胞器,并使用板为主的格式。例如,皮卡德等 。有妖strated是孤立的线粒体拥有的不同从根本上不同于完整线粒体透肌纤维的功能特性。他们提出,线粒体的分离技术导致改变的生物能的功能,例如相比于透肌纤维伴随着更大的活性氧的产生13显著增加RCR。相比透肌纤维,线粒体的隔离并需要较长的准备时间。而且,蜂窝含量损失减少生理相关性,而这被保持在全细胞和甚至透纤维。与所描述的技术允许利用板系呼吸测量复制每个样品运行。然而,线粒体必须遵守的每个孔的底部。该构造是从它们的正常环境不同,并且可能影响功能特性。此外,应当注意的是,使用该协议线粒体隔离,疗法E可以仍然是从内质网(ER)中的线粒体制剂污染。在ER污染的差异可能会影响线粒体产量和影响结果的决心。
总之,这项研究中提出的数据说明,证实线粒体从使用此过程组织中分离出有功能活性及可用于研究/需要高品质的分离线粒体骨骼肌样品的最小量的应用程序。这种方法的优点是:ⅰ)也能够从大量的骨骼肌的最小隔离线粒体,ⅱ)的方法是快速,iii)与所述基板的技术,有可能在同一时间运行多个样本,和四)有足够的富余组织和孤立的线粒体生物能量检测的样品储存及其他分子生物学研究之后。
披露声明
The author, George Rogers, is an employee of Seahorse Bioscience that produces the instrument used in this article. Open Access fees were supported by Seahorse Biosciences.
致谢
We would like to thank Dr. Marc Liesa, Boston University School of Medicine, helpful discussions; Ms. Karin Murphy, Ms. Heather Gregory, and Mr. John Stone, all from Wake Forest School of Medicine, for helpful technical assistance in the development of this protocol.
材料
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Homogenizer Bio-Gen PRO200 | BioExpress | ||
| Eppendorf Centrifuge 5804 R | Fisher Scientific | ||
| Deepwell late Rotor | Fisher Scientific | ||
| 6 mm University College Hospital Needle | Cadence | ||
| 60 cc syringe | Fisher Scientific | ||
| 96-well plate reader | Tecan (Genios-basic) | ||
| Seahorse XF 24-3 analyzer | Seahorse Biosciences, Inc. | ||
| Protein gel system | Life Technologies (Invitrogen) | ||
| Kodak Gel Logic 112 | Carestream Health, Inc | ||
| Kodak camera assembly | Carestream Health, Inc | ||
| Consumables | |||
| XF24 V7 Cell Culture Microplate and XF24 sensor cartridge | Seahorse Bioscience | 100850-001 | |
| 100867-100 | |||
| Potassium hydroxide (KOH) | Sigma-Aldrich Co | 221473 | |
| Hydrochloric acid (HCl) | Acros | 12421-0010 | |
| Dulbecco's Phosphate buffered saline | Lonza | 17-512F | |
| Potassium chloride (KCl) | Fisher Scientific | P333 | |
| MOPS | Fisher Scientific | BP308 | |
| EDTA | Fisher Scientific | BP118 | |
| Magnesium sulfate (MgSO4) | Sigma-Aldrich Co | M7506 | |
| ATP | Sigma-Aldrich Co | A9187 | |
| Fatty acid-free BSA | Calbiochem | 126575 | |
| Sucrose | Sigma-Aldrich Co | S0389 | |
| Bacterial proteinase | Sigma-Aldrich Co | P-8038 | |
| D-Mannitol | Sigma-Aldrich Co | M9546 | |
| KH2PO4 | Fisher Scientific | P284 | |
| Magnesium chloride (MgCl2) | Sigma-Aldrich Co | M9272 | |
| HEPES | Sigma-Aldrich Co | H3784 | |
| EGTA | Sigma-Aldrich Co | E3889 | |
| BCA protein assay kit | Sigma-Aldrich Co | PI23227 | |
| Succinic Acid* | Sigma-Aldrich Co | S3674 | |
| Pyruvic acid* | Sigma-Aldrich Co | P5280 | |
| Malic acid* | Sigma-Aldrich Co | 2288 | |
| ADP(K+ salt)* | Sigma-Aldrich Co | A5285 | |
| XF Cell mito stress test kit | Seahorse Biosciences | 101706 | |
| Tween-20 | Santa Cruz Biotechnology, Inc. | SC-29113 | |
| NuPAGE 12% Bis-Tris Gel | Life Technologies (Invitrogen) | NP0343BOX | |
| Immobilin Transfer Membranes (0.45 um) | Millipore | IPVH20200 | |
| MOPS SDS Running Buffer (20X)-500 ml | Life Technologies (Invitrogen) | NP0001 | |
| NuPAGE Transfer Buffer (20X)-1 liter | Life Technologies (Invitrogen) | NP0006-1 | |
| Primary antibodies (mAB to VDAC1/Porin) | Abcam | ab14734 | |
| Primary antibodies (mAB to GAPDH) | Abcam | ab9484 | |
| Anti-Mouse IgG (Goat), HRP-labeled | PerkinElmer | NEF822E001EA | |
| Anti-Rabbit IgG (Goat), HRP-labeled | PerkinElmer | NEF812E001EA | |
| *ADP, succinic acid, pyruvic acid, and malic acid should be adjusted to pH 7.4 with KOH only |
参考文献
- Fernandez-Vizarra, E., et al. Isolation of mitochondria for biogenetical studies: An update. Mitochondrion. 10, 253-262 (2010).
- Fernandez-Vizarra, E., Lopez-Perez, M. J., Enriquez, J. A. Isolation of biogenetically competent mitochondria from mammalian tissues and cultured cells. Methods. 26, 292-297 (2002).
- Garcia-Cazarin, M. L., Snider, N. N., Andrade, F. H. Mitochondrial isolation from skeletal muscle. Journal of Visualized Experiments : JoVE. , (2011).
- Iglesias-Gonzalez, J., Sanchez-Iglesias, S., Beiras-Iglesias, A., Soto-Otero, R., Mendez-Alvarez, E. A simple method for isolating rat brain mitochondria with high metabolic activity: effects of EDTA and EGTA. Journal of Neuroscience Methods. 213, 39-42 (2013).
- Gross, V. S., et al. Isolation of functional mitochondria from rat kidney and skeletal muscle without manual homogenization. Analytical Biochemistry. 418, 213-223 (2011).
- Franko, A., et al. Efficient isolation of pure and functional mitochondria from mouse tissues using automated tissue disruption and enrichment with anti-TOM22 magnetic beads. PloS One. 8, e82392 (2013).
- Chappell, J. B., Perry, S. V. The respiratory and adenosinetriphosphatase activities of skeletal-muscle mitochondria. The Biochemical Journal. 55, 586-595 (1953).
- Tyrrell, D. J., et al. Respirometric Profiling of Muscle Mitochondria and Blood Cells Are Associated With Differences in Gait Speed Among Community-Dwelling Older Adults. J Gerontol A Biol Sci Med Sci. , (2014).
- Nicklas, B. J., et al. Relationship of physical function to vastus lateralis capillary density and metabolic enzyme activity in elderly men and women. Aging Clinical and Experimental Research. 20, 302-309 (2008).
- Bergstrom, J. Percutaneous needle biopsy of skeletal muscle in physiological and clinical research. Scandinavian Journal of Clinical and Laboratory Investigation. 35, 609-616 (1975).
- Rogers, G. W., et al. High throughput microplate respiratory measurements using minimal quantities of isolated mitochondria. PloS One. 6, e21746 (2011).
- Picard, M., et al. Mitochondrial structure and function are disrupted by standard isolation methods. PloS One. 6, e18317 (2011).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。