Method Article
Preparazione e respirometrici valutazione dei mitocondri isolati dal tessuto muscolare scheletrico Ottenuto dalla biopsia percutanea
In questo articolo
Riepilogo
Sono descritti metodi per la biopsia di vasto laterale, la preparazione dei mitocondri purificati, e profilatura respirometrico. L'uso di piccolo volume muscolare rende questa tecnica adatta per applicazioni di ricerca clinica.
Abstract
Profiling respirometrici di mitocondri isolati è comunemente utilizzato per studiare la funzione della catena di trasporto degli elettroni. Descriviamo un metodo per ottenere campioni di vasto laterale umano, isolare i mitocondri da minime quantità di tessuto muscolare scheletrico, e piastra di profiling respirometrico based utilizzando un analizzatore di flusso extracellulare (XF). Confronto di profili respirometrici ottenuti utilizzando 1,0, 2,5 e 5,0 mg di mitocondri indicano che 1,0 mg è sufficiente per misurare la respirazione e 5,0 ug fornisce risultati più coerenti basata sul confronto di errori standard. Western blot dei mitocondri isolati per marcatore mitocondriale COX IV e non mitocondriale marcatore tessuto GAPDH indicano che non vi è limitata contaminazione non mitocondriale utilizzando questo protocollo. La possibilità di studiare respirometria mitocondriale in appena 20 mg di tessuto muscolare permette agli utenti di utilizzare biopsie individuali per più endpoint di studio in clinicaprogetti di ricerca.
Introduzione
I mitocondri sono i siti di produzione di energia primaria nella cella e hanno un ruolo importante nella maturazione nonché vari disturbi legati all'età, come le malattie cardiovascolari, il morbo di Alzheimer, il diabete, il cancro, e l'obesità. Profiling respirometrici di mitocondri isolati fornisce un'analisi diretta della catena di trasporto degli elettroni funzione (ETC) ed ha contribuito in modo significativo alla nostra comprensione della biologia mitocondriale e il suo ruolo nella salute e nella malattia. Isolati mitocondri vengono utilizzati per studiare vari aspetti della bioenergetica come, trasporti substrato, l'attività ATP sintetasi, perdita protonica, ecc La metodologia descritta in questo manoscritto è stato ottimizzato per consentire l'analisi respirometrico dei mitocondri isolati da biopsie di tessuto muscolare scheletrico ottenuti da soggetti umani. Il protocollo biopsia descritto in questo manoscritto è stato utilizzato dal nostro staff per gli ultimi 12 anni. Il nostro gruppo ha eseguito oltre 700 procedure sugli adulti di varie età,fino a 90 anni, e con varie condizioni croniche di malattia senza problemi avverse sicurezza. Un aspetto fondamentale di questo protocollo è che è specificamente progettato per utilizzare minime quantità di tessuto, facilitando in tal modo il suo uso in studi clinici.
Sono stati sviluppati vari protocolli per isolare mitocondri. Fernandez-Vizarra et al. 1,2 descritto un metodo per isolare mitocondri da vari tessuti di ratto e cellule coltivate. Garcia-Cazarin et al. 3 hanno riportato un metodo per isolare mitocondri dai muscoli scheletrici di ratto e topo. Un metodo per isolare mitocondri da cervello di ratto è stata riportata anche da Iglesias-Gonzales et al. 4 Gross, et al. 5 hanno riportato un metodo per isolare mitocondri usando l'barocycler e / o il trituratore PCT. Recentemente, Franko et al. 6 ha riportato un metodo per isolare mitocondri altamente arricchito usando contro-TOM22 Sfere magnetiche.
Mentre questi protocolli producono risultati eccellenti, requisiti di dimensione tessuti sono elevati rispetto al metodo descritto in questo manoscritto. Ad esempio, Gross et al. 5 usato 1,5-1,8 g del muscolo gastrocnemio, e circa 2 g del tessuto renale. Allo stesso modo, Franco et al. 6 utilizzato 500 mg di tessuto di fegato di topo. Dalla nostra esperienza, i rendimenti tipici che si possono attendere da biopsia percutanea del muscolo scheletrico (vasto laterale) vanno da 100-200 mg. La capacità di valutare la funzione mitocondriale in 20-50 mg di tessuto muscolare usando il protocollo qui descritto consente agli utenti di eseguire più valutazioni per la biopsia e di conservare i campioni per un uso futuro in altri esperimenti di biologia molecolare. Questa è una caratteristica fondamentale nella ricerca clinica e di altri studi che richiedono l'uso diligente di campioni. Va notato che i mitocondri precedentemente congelati non sono buoni per studiare la respirazione accoppiata causa outEr danni della membrana mitocondriale e la perdita di attività del citocromo C. Il nostro metodo è stato adattato e modificato dal metodo pubblicata da Chappell e Perry 7.
Utilizzando i metodi descritti in questo manoscritto, abbiamo recentemente riportato che il profilo respirometrico dei mitocondri isolati da Vasto umana lateralis è direttamente correlata con la capacità fisica, misurata come velocità andatura 8.
Protocollo
NOTA: Il protocollo descritto è stato approvato dal Institutional Review Board di Wake Forest School of Medicine. Il consenso informato è stato ottenuto per iscritto. Tutti i partecipanti erano sani adulti più anziani (65-79 anni) di entrambi i sessi, con BMI che vanno 23-35.
1. scheletrico biopsia muscolare
- Come descritto in precedenza, 9 eseguire tutte le biopsie al mattino presto dopo un O / N veloce. Chiedete ai soggetti di non prendere l'aspirina, prescrizione e over-the-counter farmaci anti-infiammatori non steroidei, o altri composti che possono influenzare il sanguinamento, piastrine, o ecchimosi per la settimana prima della biopsia. Chiedere ai partecipanti di astenersi anche da qualsiasi attività faticose per almeno 36 ore prima della biopsia.
NOTA: Muscle è ottenuto dal vasto laterale con la tecnica biopsia percutanea con un ago percutanea in anestesia locale con lidocaina 1%. Nessun complicazioni mediche o other segnalati eventi avversi della procedura si sono verificati nella nostra unità di ricerca clinica. - NOTA: La procedura descritta biopsia è adattato da quello di Bergstrom 10.
- In breve, a livello locale amministrare 1% prendendo lidocaina attenzione a non infiltrarsi nel muscolo. Seguire questo con un periodo di attesa di 10 minuti per consentire paralizzante sufficienti.
- Prendete le biopsie dal ventre del muscolo (la regione centrale del muscolo tra inserimento e l'origine) evitando le zone sottofasciale e myotendonous.
- Utilizzare ago percutanea (un dispositivo riutilizzabile aspirazione assistita con un lato finestra e cilindro di taglio interna di taglio) e seguire un fasciale "pop" o la resistenza della fascia come guida.
- Stimare la profondità con l'ago anestesia, poi di nuovo sentire con il bisturi stretto e fare un'incisione di 4-5 mm attraverso la fascia. Avanzare l'ago attraverso l'incisione finché non viene inserito nel muscolo.
- Raccoglierecampioni multipli con finestra rivolti in direzioni diverse. Applicare aspirazione continua utilizzando una siringa da 60 cc durante l'avanzamento e ritiro campioni muscolari nell'ago percutaneo due a quattro volte in direzioni diverse. Interrompere l'aspirazione e rimuovere l'ago.
NOTA: Ogni passo (inserimento e la rimozione dell'ago) dovrebbero prendere meno di un minuto. - Avere un assistente applica con decisione per puntura sito per 5 minuti per stabilire emostasi. Scollegare ago dal tubo di aspirazione e rimuovere con cautela campioni muscolari dalla finestra e botte.
- Fare un secondo passaggio se più muscolare è necessario ripetendo la procedura sopra.
- Rimuovere eventuali coaguli di sangue visibili dal campione di muscolo usando pinze, pesare il campione, e mettere subito in una provetta contenente DPBS ghiacciate.
NOTA: La resa media utilizzando questa metodologia è di 150 ± 20 mg.
2. Isolamento mitocondriale
- Appena preparare il Chappel-Perry (CP) e mitocondriale Assay Solution (MAS) buffer (Tabella 1), il giorno dell'esperimento, o aliquota e conservare a -20 ° C. Preparare i composti in dimetilsolfossido ad una concentrazione di 2,5 mM e aliquota e conservare a -20 ° C. Utilizzare i tampone e composti aliquote conservati a -20 ° C entro 2 mesi dal giorno di preparazione.
- Rimuovere il tessuto connettivo visibile dal campione usando forbici affilate e pinzette; se un microscopio da dissezione per questo passo necessario uso. Lavare accuratamente i campioni 3-4 volte con tampone DPBS ghiacciato per rimuovere il sangue. Mantenere i campioni in DPBS e procedimenti ghiacciate al più presto possibile, facendo attenzione a non superare più di 45 minuti dalla biopsia. Prendere le precauzioni necessarie per rimuovere con attenzione eventuali tendini o tessuto adiposo dal campione muscolo.
- Tritare immediatamente il tessuto muscolare in pezzi sottili usando un paio di forbici sterili e di sospendere in 500 ml a 1 ml CPI contenente proteinase (Nagarse) ad una concentrazione di 0,2 mg / g di tessuto. Seguire questo con un 5 min di incubazione a RT e poi trasferimento a ghiaccio.
- Omogeneizzare i tessuti tritate trattati con Nagarse usando un omogeneizzatore automatizzato. Mantenere il campione in ghiaccio durante tutto il processo. Omogeneizzare ogni campione di tessuto quattro volte, ogni volta per un impulso di 2 sec, usando l'omogeneizzatore automatizzata ad una impostazione di velocità di 10.000 rpm. Lavare la sonda con il 70% di etanolo seguito da acqua distillata tra tessuti.
- Lavare il tessuto omogeneizzato con un volume uguale di CP I (500 microlitri di 1 ml) e 2x volume di CP II (1 ml a 2 ml), e raccogliere il contenuto in una provetta da centrifuga e centrifugare a 600 xg, a 4 ° C per 10 min. Passare il surnatante con un panno bagnato formaggio, raccogliere il filtrato e scartare il pellet, eliminando in tal modo la maggior parte delle frazioni non mitocondriali.
3. Lavare il mitocondri
- Centrifugare il surnatante dal passo sopra a 10,000 xg, a 4 ° C per 10 min. Sospendere il pellet in 4 ml di tampone CP II e in seguito centrifugare a 10.000 xg, a 4 ° C per 10 min.
NOTA: In rare occasioni, un sottile pellet di sangue si forma sotto il pellet mitocondriale. In tal caso, rimuovere il pellet mitocondriale aspirando delicatamente con tampone CPII. Questo passaggio può essere evitato accuratamente lavando via il sangue al passo 2. - Sospendere il pellet ottenuto in 2 ml di tampone CP I. In questa fase utilizzare una piccola aliquota di questa sospensione per la stima della proteina. Risospendere il campione rimanente in CP I tampone e centrifuga come sopra. Sospendere il pellet finale in una quantità minima (200 ml) di mitocondriale Assay Solution (MAS).
NOTA: Le proteine sono analizzati in questa fase perché tampone CP io non ha BSA, mentre MAS in cui i campioni saranno poi sospesi non ha BSA in esso.
4. Stimare il contenuto mitocondriale misurando Protein Concentrazione Utilizzando un BCA Protein Assay Kit
NOTA: utilizzare questa concentrazione per calcolare la quantità di mitocondri utilizzati per il carico su una micropiastra da 24 pozzetti per misure respirometriche, o per esperimenti Western Blot. Tenere conto del fattore di diluizione (10) per il calcolo della concentrazione proteica.5. Eseguire saggi XF come descritto da Rogers, GW, et al. 12
NOTA: Visualizzare il tasso di consumo di O 2 (OCR) in pmoli O 2 / min, o livelli assoluti di O 2 e pH nell'output dati.
- Utilizzare 1x MAS per preparare composti da iniettare. Aggiungere una concentrazione 10x dei composti alle porte AD per dare una concentrazione finale come segue: Port A, ADP [Adenosine 5 '-diphosphate, 2 mM, 50 microlitri]; port B, oligomicina (2 micron, 55 ml); port C, FCCP [cianuro 4- (trifluorometossi) fenilidrazone carbonile, 6 micron, 60 ml]; e la porta D, 2 mM antimicina-A (65 ml). Prepararevolume sufficiente di composti per il numero di pozzetti.
- Determinare la quantità ottimale di mitocondri mediante titolazione. Ad esempio, il carico 1,0 mg, 2,5 mg, e 5,0 mg di mitocondri per pozzetto in un volume di 50 ml di 1x ghiacciate MAS contenenti substrato. Per ridurre al minimo la variabilità tra i pozzi, prima diluire 10x mitocondri in freddo substrato 1x MAS +. Avanti, erogare 50 ml di questa sospensione di ogni bene (tranne i pozzi di correzione di sfondo).
- Centrifugare la piastra a 2.000 xg, 20 min a 4 ° C. Dopo centrifugazione, aggiungere delicatamente 450 microlitri di 1x MAS + succinato (10 mm) e rotenone (2 mM) (condizioni iniziali, vedi sotto) per ciascun bene. Mostra i mitocondri al microscopio per assicurare l'aderenza omogenea al pozzo prima di trasferire la piastra all'analizzatore XF.
NOTA: Le condizioni iniziali utilizzate dipenderà se la respirazione è guidato da una I o II complesso complesso ETC. Per complesso respirazione II-driven, usare succinate (10 mM) e rotenone (2 mM) come condizioni iniziali. Blocchi rotenone I e succinato complesso fornisce combustibile per il complesso II (succinato deidrogenasi). Per studiare la respirazione guidata da complesso I, utilizzare piruvato e malato, ciascuno ad una concentrazione finale di 5 mM o glutammato e malato ciascuna ad una concentrazione finale di 10 mM come condizioni iniziali. Quest'ultimo può aiutare a distinguere tra disfunzione del ciclo di Krebs e il trasporto del substrato. Per studiare la respirazione guidata da entrambi I e II complesso complesso, comprende piruvato e succinato senza rotenone o malato come condizioni iniziali. Utilizzare palmitoil carnitina come substrato per la β-ossidazione. - Sequenziale misurare la respirazione mitocondriale in tempo reale utilizzando il respirometro programmando come descritto in precedenza 12. Utilizzare le impostazioni per il respirometro previsto nella tabella 2.
NOTA: Una breve spiegazione dei vari stati respirazione mitocondriale sono i seguenti: - Stato 2 = stato accoppiato con substrato presente; Stato 3 = fosforilare la respirazione in presenza di saturare ADP; Stato 4 o = non-fosforilazione respirazione indotta da oligomicina; 3u Stato = massima respirazione disaccoppiato stimolata dalla FCCP sganciamento; Residua non mitocondriale respirazione = respirazione dopo complesso III inibizione da antimicina-A. Va inoltre sottolineato che, la lunghezza della misura OCR in combinazione con la concentrazione mitocondriale potrebbe influenzare i dati mediante deplezione ossigeno durante i periodi di misurazione.
6. Western Blot
NOTA: Determinare il marcatore mitocondriale COX IV e tutta la GAPDH tessuti mediante Western blotting per assicurare l'arricchimento dei mitocondri nel campione finale
- Separare i mitocondri isolati e l'estratto del tessuto tutto del 12% sodio dodecil solfato poliacrilammide gel.
- Trasferire le proteine su un fluoruro di polivinile (PVDF) membrana.
- Incubare con COX IV anticorpo (1: 20.000), seguita da perossidasi di rafano (HRP) -conjugated anticorpi secondari. Per la determinazione GAPDH, striscia la macchia e la sonda con un anticorpo monoclonale GAPDH (1: 2.000).
NOTA: Se le differenze di contaminazione ER sono di preoccupazione, comprendono marcatori ER quali ERp72, calnexina o calreticulina nell'analisi.
Risultati
La figura 1 illustra un diagramma di flusso dettagliato del intero protocollo.
Profili Western blot di COX IV / GAPDH (Figura 2) descrivono l'espressione della proteina mitocondriale, COX IV, e il marcatore non mitocondriale, GAPDH. Espressione di entrambi COX IV e GAPDH sono evidenti in tutta lisato muscolare. Dopo i mitocondri sono isolate utilizzando la tecnica descritta in questo protocollo, le bande COX IV sono ancora evidenti, mentre GAPDH è assente con la stessa esposizione. Esposizioni più lunghe possono rivelare una band GAPDH debole. Queste macchie indicano che i mitocondri isolati hanno minimal contaminazione non mitocondriale. Inoltre, l'espressione di COX IV in mitocondri isolati è coerente tra i campioni.
Figura 3 mostra i profili respirometrici tipici azionati da complesso II (succinato e rotenone) utilizzando 1,0 mg, 2,5 mg, 5,0 mg e dei mitocondri. Come previsto, OCR totale aumenta with maggiore quantità di mitocondri. Il rapporto di controllo respiratorio calcolato (RCR) per questo dosaggio è 7,95, che indica che la preparazione mitocondriale è di alta qualità. Inoltre, 3u stato OCR è leggermente superiore a quello dello stato 3, confermando qualità mitocondriale.
Per confrontare la coerenza dei risultati a profilare diverse quantità di mitocondri, abbiamo effettuato ANOVA (analisi della varianza) e calcolato la somma dei quadrati (SS) come valori effettivi di varianza utilizzando 1,0 mg, 2,5 mg, e 5,0 mg di mitocondri caricato per ben (Figura 4). SS è presentato per lo stato 2, stato 3, 3u Stato, antimicina A, e RCR. Per stato 2 e lo stato 3 misurazioni, un modo ANOVA era statisticamente significativa (p <0,01 e p <0.05, rispettivamente). Analogamente, una ANOVA era statisticamente significativa per antimicina e RCR (p <0,01 e p <0,0001, rispettivamente. Nessuna differenza significativa è stata osservata per 3u stato tra i gruppi. These risultati indicano che 5,0 mg di mitocondri per pozzetto dato SS basso rispetto ad altre concentrazioni ed è la quantità ottimale da utilizzare nel sistema XF 24 con popolazione di partecipanti.
Figura 5 funge da guida per indicare la quantità di proteina mitocondriale può essere previsto in base alla dimensione iniziale del campione muscolare. Come previsto vi è una forte correlazione tra la quantità di muscolo (mg) trattati e il contenuto totale di proteine mitocondriale (mg) del campione finale.
| Buffer Chappel-Perry I (CPI) | |
| Chimico | Concentrazione |
| KCl | 100 MM |
| MOPS | 50 mm |
| EDTA | 1 mM |
| MgSO4 | 5 mM |
| ATP | 1 mM |
| pH | 7.4 |
| Buffer Chappel-Perry II (CPII) | |
| Chimico | Concentrazione |
| KCl | 100 MM |
| MOPS | 50 mm |
| EDTA | 1 mM |
| MgSO4 | 5 mM |
| ATP | 0,2 mM |
| Acidi grassi liberi BSA | 0,50% |
| pH | 7.4 |
| Mitocondriale Assay Solution (MAS) (2X) | |
| Chimico | Concentrazione |
| Saccarosio | 35 mm |
| Mannitolo | 110 mm |
| KH 2 PO 4 | 2,5 mm |
| MgCl 2 | 2,5 mm |
| HEPES | 1,0 mm |
| EGTA | 0,5 mm |
| Acidi grassi liberi BSA | 0,10% |
| pH | 7.4 |
| Mitocondriale Assay Solution (MAS) con complessi II condizioni iniziali | |
| Chimico | Concentrazione |
| 1X MAS | |
| Succinate | 10 mM |
| Rotenone | 2 micron |
| pH | 7.4 |
| Mitocondriale Assay Solution (MAS) con complessi I condizioni iniziali | |
| Chimico | Concentrazione |
| 1X MAS | |
| Piruvato | 5 mM |
| Malate | 5 mM |
| pH | 7.4 |
| * I buffer da effettuare in acqua deionizzata | |
Tabella 1. Soluzione tampone e ricette.
| Protocollo Steps | ||
| StartProtocol | ||
| Comando | Time (min) | Porto |
| Calibrare | 0.00 | |
| Aspettare | 10.00 | |
| Mescolare | 1.00 | |
| Aspettare | 3.00 | |
| Mescolare | 1.00 | |
| Aspettare | 3.00 | |
| Mescolare | 0.50 | |
| Misura | 3.00 | |
| Mescolare | 1.00 | |
| Misura | 3.00 | |
| Mescolare | 0.50 | |
| Iniettare | La | |
| Mescolare | 1.00 | |
| Misura | 6.00 | |
| Mescolare | 1.00 | |
| Iniettare | B | |
| Mescolare | 1.00 | |
| Misura | 3.00 | |
| Mescolare | 1.00 | |
| Iniettare | C | |
| Mescolare | 1.00 | |
| Misura | 3.00 | |
| Mescolare | 1.00 | |
| Iniettare | D | |
| Mescolare | 1.00 | |
| Misura | 3.00 | |
| EndProtocol | ||
Tabella 2. Mix, misurare e mescolare impostazione del ciclo per il respirometro.

Figura 1. Diagramma di flusso di tutto il protocollo. Cliccate qui per vedere una versione più grande di questa figura.
/ftp_upload/52350/52350fig2highres.jpg "/>
Figura 2. Una macchia rappresentante occidentale per tutto il tessuto muscolare scheletrico e mitocondri isolati. Estratto tessuto intero così come i mitocondri isolati sono stati immunoblotted con COX IV anticorpi come marcatore mitocondriale e anticorpi GAPDH per il controllo non-mitocondriale. No banda GAPDH è stato osservato nei mitocondri isolati che indica poca o nessuna contaminazione da fonti non-mitocondriali. Cliccate qui per vedere una versione più grande di questa figura.
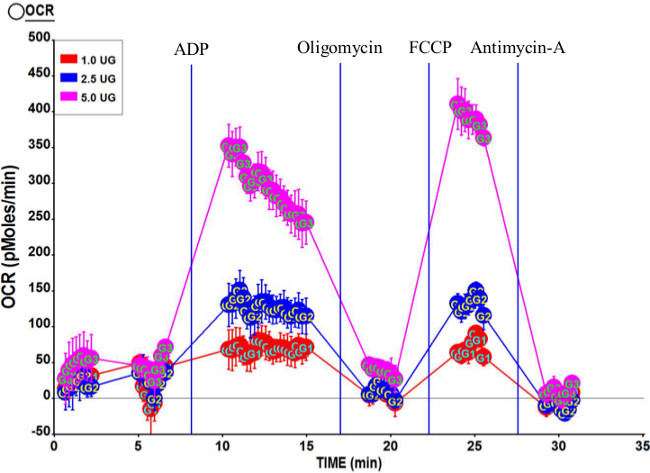
Figura 3. Profilo respirometrico Rappresentante dei mitocondri isolati da Vasto umano lateralis. Tre concentrazioni di mitocondri isolati, 5.0 mg, 2,5 mcg, e 1,0 mcg noi abituati in questo test. Concentrazioni finali di composti dopo iniezioni di porta erano 2 ADP mm (attacco A); 2 mM oligomicina (porta B); 6 micron FCCP (porta C); e 2 micron antimicina A (porta D). RCR Calcolato per questa esecuzione è stato 7,95. Clicca qui per vedere una versione più grande di questa figura.
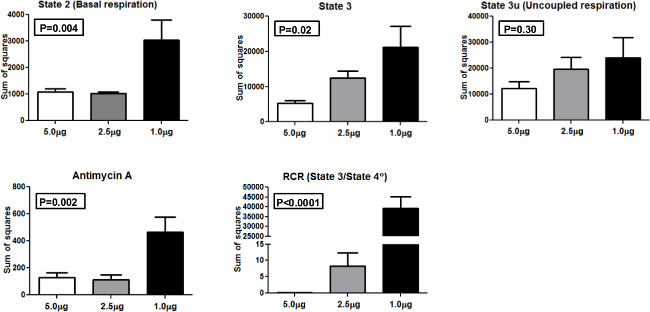
Figura 4. Somma dei quadrati. Somma dei quadrati per i diversi stati di respirazione mitocondriale e RCR con 5.0 mg, 2,5 mg, e 1,0 mg mitocondri. Cliccate qui per vedere una versione più grande di questa figura.
ig5highres.jpg "/>
Figura 5. Questo può essere usato come guida per stimare la quantità di proteina mitocondriale che può essere previsto in base al peso del muscolo del campione prima analisi di regressione:. Di quantità di muscolo (mg) e resa totale proteina mitocondriale (mg). Come previsto, vi è una correlazione positiva diretta tra la quantità di muscolo e la proteina mitocondriale totale ottenuta.
Discussione
Isolati mitocondri sono spesso utilizzati negli studi che esaminano il ruolo della funzione ETC, così come altre attività mitocondriali, compreso il trasporto di substrato e la funzione del ciclo TCA. Test respirometrici utilizzando organelli isolati consentono l'esame diretto dei processi fondamentali della fosforilazione ossidativa e le proprietà intrinseche della ETC. Profiling respirometrici di mitocondri isolati rispetto alle cellule intere o fibre muscolari permeabilizzate ha i vantaggi di relativamente facile interpretazione dei dati e l'assenza di "interferenza" da processi non-mitocondriali o modifiche mitocondriale massa / biogenesi. La normalizzazione dei dati si riferiscono al contenuto di proteina mitocondriale, consentendo così semplice confronto incrociato dei mitocondri tra campioni. Profiling respirometrici di mitocondri isolati è un approccio preferito quando l'obiettivo dello studio è quello di determinare sottostanti meccanismi e identificare gli obiettivi specifici, come componente ETCs / complessi, o meccanismi di trasporto mitocondriale.
Descritto è un protocollo per la biopsia muscolare e l'isolamento dei mitocondri funzionale da piccoli campioni di tessuto. Questo metodo fornisce risultati riproducibili tra gli utenti a causa di utilizzo di un omogeneizzatore automatizzato contro mano azionato omogeneizzatori Dounce. Isolamento dei mitocondri può essere effettuata con un minimo di 20 mg di tessuto muscolare. La quantità di mitocondri isolati che si può ottenere da questa dimensione del campione è sufficiente per eseguire Seahorse respirometria basato piastra lasciando mitocondri surplus per altri esperimenti e deposito per ulteriori analisi molecolari. Si può osservare che questo metodo può essere tradotto al XF 96, dove anche piccole quantità di mitocondri possono essere utilizzati (1-2 mg per pozzetto).
Diversi protocolli per mitocondri isolamento si basano su omogeneizzatori Dounce per disgregazione del tessuto iniziale. Un inconveniente di questo metodo è mani-sulla natura del tessuto inizialeomogeneizzazione. La forza e la velocità del pestello in omogeneizzatore possono variare significativamente tra operatori 6. Ciò può comportare esperimento a esperimento variazione, nonché variazioni laboratorio a laboratorio, e porta a difficoltà di comparazione dei dati tra esperimenti. Questo è particolarmente preoccupante in studi di intervento sull'uomo quando i dati da parte dei partecipanti sono raccolti in momenti diversi, di solito prima e dopo il trattamento, e potenzialmente a più siti. Usiamo un omogeneizzatore automatico per un approccio più coerente che produce risultati più riproducibili con variazione limitata da persona a persona. La velocità di elaborazione rende questo metodo adatto per la gestione di più campioni contemporaneamente. Tipicamente, fino a tre esperimenti possono essere eseguiti in un solo giorno.
Potenziali limitazioni della tecnica qui descritta derivano dall'uso di organelli isolati e l'uso di un formato basato piastra. Ad esempio, Picard et al. avere demonestrare che i mitocondri isolati possiedono caratteristiche funzionali che differiscono sostanzialmente da quelle dei mitocondri intatti in miofibre permeabilizzate. Hanno proposto che le tecniche di isolamento mitocondriali provocano alterata funzione bioenergetica, come significativamente aumentata RCR rispetto myofibers permeabilizzate accompagnati da una maggiore produzione di specie reattive dell'ossigeno 13. Rispetto alle fibre muscolari permeabilizzate, isolamento di mitocondri non richiede tempo di preparazione più lungo. Inoltre, la perdita di contenuto cellulare diminuisce rilevanza fisiologica, qualcosa che viene trattenuto nelle cellule intere e fibre anche permeabilizzate. L'uso di respirometria basato piastra con i permessi tecnica descritta replicare piste per campione. Tuttavia, mitocondri devono aderire al fondo di ciascun pozzetto. Questa configurazione è diverso dal loro ambiente normale e può influenzare le caratteristiche funzionali. Inoltre, va notato che l'utilizzo di questo protocollo per l'isolamento mitocondriale, there può essere ancora contaminazione dal reticolo endoplasmatico (ER) nella preparazione mitocondriale. Le differenze di contaminazione ER possono influenzare la determinazione del rendimento e di influenzare i risultati mitocondriali.
In conclusione, questo studio presenta dati che conferma che i mitocondri isolati da tessuti utilizzando questa procedura sono funzionalmente attivi e possono essere utilizzati per gli studi / applicazioni che richiedono mitocondri isolati alta qualità delle quantità minima di campioni di muscolo scheletrico. Il vantaggio di questo metodo è che: i) è possibile isolare mitocondri da quantità minime di muscolo scheletrico, ii) la procedura è veloce, iii) con la tecnologia piastra di base, è possibile eseguire più campioni contemporaneamente, e iv) c'è abbastanza tessuto in eccesso e mitocondri isolati dopo il test bioenergetico di conservare il campione e di altri esami di biologia molecolare.
Divulgazioni
The author, George Rogers, is an employee of Seahorse Bioscience that produces the instrument used in this article. Open Access fees were supported by Seahorse Biosciences.
Riconoscimenti
We would like to thank Dr. Marc Liesa, Boston University School of Medicine, helpful discussions; Ms. Karin Murphy, Ms. Heather Gregory, and Mr. John Stone, all from Wake Forest School of Medicine, for helpful technical assistance in the development of this protocol.
Materiali
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Homogenizer Bio-Gen PRO200 | BioExpress | ||
| Eppendorf Centrifuge 5804 R | Fisher Scientific | ||
| Deepwell late Rotor | Fisher Scientific | ||
| 6 mm University College Hospital Needle | Cadence | ||
| 60 cc syringe | Fisher Scientific | ||
| 96-well plate reader | Tecan (Genios-basic) | ||
| Seahorse XF 24-3 analyzer | Seahorse Biosciences, Inc. | ||
| Protein gel system | Life Technologies (Invitrogen) | ||
| Kodak Gel Logic 112 | Carestream Health, Inc | ||
| Kodak camera assembly | Carestream Health, Inc | ||
| Consumables | |||
| XF24 V7 Cell Culture Microplate and XF24 sensor cartridge | Seahorse Bioscience | 100850-001 | |
| 100867-100 | |||
| Potassium hydroxide (KOH) | Sigma-Aldrich Co | 221473 | |
| Hydrochloric acid (HCl) | Acros | 12421-0010 | |
| Dulbecco's Phosphate buffered saline | Lonza | 17-512F | |
| Potassium chloride (KCl) | Fisher Scientific | P333 | |
| MOPS | Fisher Scientific | BP308 | |
| EDTA | Fisher Scientific | BP118 | |
| Magnesium sulfate (MgSO4) | Sigma-Aldrich Co | M7506 | |
| ATP | Sigma-Aldrich Co | A9187 | |
| Fatty acid-free BSA | Calbiochem | 126575 | |
| Sucrose | Sigma-Aldrich Co | S0389 | |
| Bacterial proteinase | Sigma-Aldrich Co | P-8038 | |
| D-Mannitol | Sigma-Aldrich Co | M9546 | |
| KH2PO4 | Fisher Scientific | P284 | |
| Magnesium chloride (MgCl2) | Sigma-Aldrich Co | M9272 | |
| HEPES | Sigma-Aldrich Co | H3784 | |
| EGTA | Sigma-Aldrich Co | E3889 | |
| BCA protein assay kit | Sigma-Aldrich Co | PI23227 | |
| Succinic Acid* | Sigma-Aldrich Co | S3674 | |
| Pyruvic acid* | Sigma-Aldrich Co | P5280 | |
| Malic acid* | Sigma-Aldrich Co | 2288 | |
| ADP(K+ salt)* | Sigma-Aldrich Co | A5285 | |
| XF Cell mito stress test kit | Seahorse Biosciences | 101706 | |
| Tween-20 | Santa Cruz Biotechnology, Inc. | SC-29113 | |
| NuPAGE 12% Bis-Tris Gel | Life Technologies (Invitrogen) | NP0343BOX | |
| Immobilin Transfer Membranes (0.45 um) | Millipore | IPVH20200 | |
| MOPS SDS Running Buffer (20X)-500 ml | Life Technologies (Invitrogen) | NP0001 | |
| NuPAGE Transfer Buffer (20X)-1 liter | Life Technologies (Invitrogen) | NP0006-1 | |
| Primary antibodies (mAB to VDAC1/Porin) | Abcam | ab14734 | |
| Primary antibodies (mAB to GAPDH) | Abcam | ab9484 | |
| Anti-Mouse IgG (Goat), HRP-labeled | PerkinElmer | NEF822E001EA | |
| Anti-Rabbit IgG (Goat), HRP-labeled | PerkinElmer | NEF812E001EA | |
| *ADP, succinic acid, pyruvic acid, and malic acid should be adjusted to pH 7.4 with KOH only |
Riferimenti
- Fernandez-Vizarra, E., et al. Isolation of mitochondria for biogenetical studies: An update. Mitochondrion. 10, 253-262 (2010).
- Fernandez-Vizarra, E., Lopez-Perez, M. J., Enriquez, J. A. Isolation of biogenetically competent mitochondria from mammalian tissues and cultured cells. Methods. 26, 292-297 (2002).
- Garcia-Cazarin, M. L., Snider, N. N., Andrade, F. H. Mitochondrial isolation from skeletal muscle. Journal of Visualized Experiments : JoVE. , (2011).
- Iglesias-Gonzalez, J., Sanchez-Iglesias, S., Beiras-Iglesias, A., Soto-Otero, R., Mendez-Alvarez, E. A simple method for isolating rat brain mitochondria with high metabolic activity: effects of EDTA and EGTA. Journal of Neuroscience Methods. 213, 39-42 (2013).
- Gross, V. S., et al. Isolation of functional mitochondria from rat kidney and skeletal muscle without manual homogenization. Analytical Biochemistry. 418, 213-223 (2011).
- Franko, A., et al. Efficient isolation of pure and functional mitochondria from mouse tissues using automated tissue disruption and enrichment with anti-TOM22 magnetic beads. PloS One. 8, e82392 (2013).
- Chappell, J. B., Perry, S. V. The respiratory and adenosinetriphosphatase activities of skeletal-muscle mitochondria. The Biochemical Journal. 55, 586-595 (1953).
- Tyrrell, D. J., et al. Respirometric Profiling of Muscle Mitochondria and Blood Cells Are Associated With Differences in Gait Speed Among Community-Dwelling Older Adults. J Gerontol A Biol Sci Med Sci. , (2014).
- Nicklas, B. J., et al. Relationship of physical function to vastus lateralis capillary density and metabolic enzyme activity in elderly men and women. Aging Clinical and Experimental Research. 20, 302-309 (2008).
- Bergstrom, J. Percutaneous needle biopsy of skeletal muscle in physiological and clinical research. Scandinavian Journal of Clinical and Laboratory Investigation. 35, 609-616 (1975).
- Rogers, G. W., et al. High throughput microplate respiratory measurements using minimal quantities of isolated mitochondria. PloS One. 6, e21746 (2011).
- Picard, M., et al. Mitochondrial structure and function are disrupted by standard isolation methods. PloS One. 6, e18317 (2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon