Method Article
Подготовка и Respirometric Оценка митохондрий, изолированных от скелетной мышечной ткани, полученные чрескожной пункционной биопсии
В этой статье
Резюме
Методы биопсии латеральной широкой, подготовки очищенной митохондрий, и respirometric профилирования описаны. Использование небольшого объема мышц делает этот метод подходит для клинических исследований применения.
Аннотация
Respirometric профилирование изолированными митохондриями обычно используется для изучения электронного функцию транспортной цепи. Мы опишем метод получения образцов человека латеральной широкой мышцы бедра, изолируя митохондрии от минимальных количествах скелетной мышечной ткани, и толстого листа на основе respirometric профилирование с помощью внеклеточного поток (XF) анализатор. Сравнение respirometric профилей, полученных с помощью 1,0, 2,5 и 5,0 мкг митохондрий показывают, что 1,0 мкг достаточно измерить дыхание и 5,0 мкг обеспечивает наиболее стабильные результаты на основе сравнения стандартных ошибок. Вестерн-блот анализ изолированных митохондриях митохондриальных маркеров ЦОГ IV и без митохондриальной ткани маркера GAPDH показывают, что существует ограниченное, не митохондриальная загрязнение с помощью этого протокола. Способность к обучению митохондрий респирометрии в качестве лишь 20 мг мышечной ткани позволяет пользователям использовать отдельные биопсии для нескольких конечных точек исследования в клиническойнаучно-исследовательские проекты.
Введение
Митохондрии являются основными производственные участки энергии в клетке и играют важную роль в старении, а также различные нарушения, связанных с возрастом, таких как сердечно-сосудистые заболевания, болезни Альцгеймера, сахарного диабета, рака и ожирения. Respirometric профилирование изолированными митохондриями обеспечивает прямой анализ (ETC) функции электрон-транспортной цепи и внес значительный вклад в наше понимание митохондриальной биологии и его роль в здоровье и болезни. Изолированные митохондрии используются для изучения различных аспектов биоэнергетики, как, подложки транспорта, АТФ-синтазы, утечки протонов и т.д. методика, описанная в этой рукописи был оптимизирован для обеспечения respirometric анализ митохондрий, выделенных из скелетных биопсии мышечной ткани, полученных из человеческих субъектов. Протокол биопсия описано в этой рукописи была использована наших сотрудников за последние 12 лет. Наша группа выступала более 700 процедур на взрослых разного возраста,до 90 лет, и с различными условиями хронические болезни без каких-либо побочных вопросам безопасности. Ключевым аспектом этого протокола является то, что он разработан специально для использования в минимальных количествах ткани, способствуя тем самым ее использования в клинической исследований.
Различные протоколы были разработаны для выделения митохондрий. Фернандес-Vizarra др. 1,2 описан способ выделения митохондрии из различных тканей крыс, а также культивируемых клеток. Garcia-Cazarin др. 3 сообщают способ выделения митохондрии из скелетных мышц крысы и мыши. Способ выделения митохондрии из головного мозга крысы была также сообщает Iglesias-Gonzales и др., 4 Gross и др. 5 описан способ выделения митохондрии с помощью barocycler и / или измельчитель РСТ. В последнее время Франко и др. 6 описан способ выделения высоко обогащенного митохондрии с использованием анти-TOM22 Магнитные шарики.
В то время как эти протоколы дают превосходные результаты, требования к размеру ткани являются высокими по сравнению со способом, описанным в этой рукописи. Например, Гросс и др. 5 используется 1,5-1,8 г икроножной мышцы, и около 2 г в почечной ткани. Кроме того, Франко и др. 6 используется 500 мг печени мыши ткани. Исходя из нашего опыта, типичные выходы можно ожидать от чрескожной биопсии скелетных мышц (латеральной широкой) в диапазоне от 100-200 мг. Способность оценивать функции митохондрий в 20-50 мг мышечной ткани, используя протокол, описанный здесь позволяет пользователям выполнять несколько оценок в биопсии и хранения образцов для дальнейшего использования в других опытах молекулярной биологии. Это важная особенность, в клинических исследованиях и других исследований, которые требуют надлежащее использование образцов. Следует отметить, что предварительно замороженные митохондрии не подходят для изучения в сочетании дыхания вследствие Outeг повреждение митохондрий мембраны и потери цитохрома С деятельностью. Наш метод был адаптирован и изменен с методом, опубликованной Chappell и Перри 7.
Используя методы, описанные в этой рукописи, мы недавно сообщили, что respirometric профиль митохондрий, выделенный из человеческой латеральной широкой непосредственно коррелирует с физической способностью, измеряемой как скорость походки 8.
протокол
ПРИМЕЧАНИЕ: протокол, описанный была одобрена Institutional Review Board Уэйк Форест в Школе медицины в. Информированное согласие было получено в письменной форме. Все участники были здоровые пожилые люди (65-79 лет) обоего пола, с ИМТ от 23-35.
1. скелетных мышц Биопсия
- Как было описано ранее, 9 выполнять все биопсии в рано утром после того, как O / N быстро. Спросите субъектов воздерживаться от приема аспирина, отпускаемых по рецептам и без рецепта нестероидные противовоспалительные препараты или другие соединения, которые могут повлиять на кровотечение, тромбоциты или кровоподтеки, на неделю до биопсии. Попросите участников воздерживаться также от любых физических нагрузок в течение по крайней мере 36 часа до биопсии.
ПРИМЕЧАНИЕ: Мышцы получают из латеральной широкой помощи чрескожной техники биопсия с чрескожной иглы под местной анестезией с 1% лидокаина. Нет медицинские осложнения или ОTher побочными эффектами от процедуры имели место в нашей клинической единицы исследования. - ПРИМЕЧАНИЕ: процедура биопсии описано приспособлен от таковой Бергстром 10.
- Короче говоря, для локального управления 1% помощь лидокаин добычи, не проникнуть в мышцы. Следуйте за этим с периодом ожидания 10 мин, чтобы обеспечить достаточную онемение.
- Возьмите биопсии от живота мышцы (средняя область мышцы между вставкой и происхождения), избегая субфасциальная и myotendonous области.
- Используйте чрескожной иглы (всасывания помощь многоразового использования устройства с боковым окном и внутренней режущей цилиндр резки) и следовать фасциальную "поп" или сопротивление фасции в качестве ориентира.
- Оцените глубину с анестезией иглой, а затем вновь почувствовать его с узким клинком скальпеля и сделать 4-5 мм разрез через фасции. Advance иглу через разрез, пока не будет вставлен в мышце.
- Собиратьнесколько образцов с окном оказалось в разных направлениях. Применить постоянное всасывание с помощью 60 мл шприц, продвигая и отбор проб мышц в чрескожной иглы 3:58 раз в разных направлениях. Прекратите всасывания и снимите иглу.
ПРИМЕЧАНИЕ: Каждый проход (вставка и удаление иглы) должно занять меньше чем за минуту. - Есть применять помощник сильное давление, чтобы проколоть сайт для 5 мин, чтобы установить гемостаза. Отключите иглу из всасывающей трубки и осторожно удалите образцы мышц из окна и баррель.
- Сделать второй проход, если больше мышц необходим, повторяя описанную выше процедуру.
- Удалите все видимые сгустки крови из образца мышц с применением щипцов, взвесить образец, и сразу же поместить в пробирку, содержащую ледяные DPBS.
ПРИМЕЧАНИЕ: средняя урожайность с помощью этой методики составляет 150 ± 20 мг.
2. Митохондриальная Изоляция
<ол>3. Стиральная Митохондрии
- Центрифуга супернатант из указанной выше стадии, в 10,000 мкг, 4 ° С в течение 10 мин. Приостановка осадок в 4 мл СР II буфера и дальнейшей центрифуге при 10000 х г, 4 ° С в течение 10 мин.
Примечание: В редких случаях, тонкие гранулы крови образуется ниже митохондриальной гранул. В этом случае удалите митохондриальную таблетку, осторожно стремление с CPII буфера. Этот шаг можно избежать, тщательно смыв кровь на этапе 2. - Приостановка Осадок, полученный в 2 мл буфера I СР. На этом этапе использовать небольшую аликвоту из этой суспензии для оценки белка. Ресуспендируют оставшейся выборки в СР я буфера и центрифуги, как описано выше. Приостановить конечный осадок в минимальном количестве (200 мкл) митохондриальной пробирной решения (MAS).
ПРИМЕЧАНИЕ: Белок анализировали на этом этапе, потому что CP я буфере не BSA, в то время как MAS, в котором образцы будут позже приостановлено действительно есть BSA в нем.
4. Оценка Митохондриальная Содержимое путем измерения концентрации белка Использование BCA анализа белка Kit
Примечание: Используйте эту концентрацию, чтобы вычислить количество митохондрий, используемых для погрузки на микропланшет 24-а для respirometric измерений, или для западных экспериментов клякс. Примите во внимание коэффициент разбавления (10) для расчета концентрации белка.5. Выполните анализов XF, как описано Роджерс, GW, и др. 12
ПРИМЕЧАНИЕ: Визуализация скорость вывода 2 потребления (OCR) в пмоль О 2 / мин, или абсолютные уровни O 2 и рН в выходных данных.
- Использование 1x MAS для получения соединений, который будет введен. Добавить концентрацию соединений с портами AD 10x, чтобы получить конечную концентрацию следующим образом: Порт A, АДФ [аденозин 5'--diphosphate, 2 мм, 50 мкл]; Порт B, олигомицин (2 мкМ, 55 мкл); Порт C, FCCP [карбонил цианид 4- (трифторметокси) фенилгидразон, 6 мкМ, 60 мкл]; и порт D, 2 мкМ антимицину-(65 мкл). Подготовитьдостаточный объем соединений для необходимого количества скважин.
- Определить оптимальное количество митохондрий титрованием. Например, нагрузка 1,0 мкг, 2,5 мкг и 5,0 мкг на лунку митохондрий в объеме 50 мкл охлажденного льдом 1x MAS, содержащих субстрат. Чтобы свести к минимуму изменчивость между скважинами, в первую разбавить 10x митохондрии в холодной 1x MAS + субстрата. Далее, поставить 50 мкл этой суспензии в каждую лунку (за исключением коррекции фона скважин).
- Центрифуга пластины при 2000 х г, 20 мин при 4 ° С. После центрифугирования, осторожно добавить 450 мкл 1x MAS + сукцината (10 мм) и ротенона (2 мкм) (начальных условий, см ниже) в каждую лунку. Просмотр митохондрии под микроскопом, чтобы обеспечить однородную приверженность задолго до передачи пластину анализатора XF.
Примечание: Начальные условия будут зависеть от того, дыхание управляться или ETC комплекса I или комплекса II. Для комплексного II-приводом дыхания, использовать суccinate (10 мМ) и ротенон (2 мкМ) в качестве начальных условий. Ротенон блоки комплекс I и янтарной обеспечивает подачу топлива для сложных II (сукцинатдегидрогеназы). Для изучения дыхания, приводимый в комплексе I, использовать или пирувата и малат, каждый в конечной концентрации 5 мМ или глутамата и малата каждого в конечной концентрации 10 мМ в качестве начальных условий. Последнее может помочь в различении дисфункции у цикла трикарбоновых кислот и подложки транспорта. Для изучения дыхания, приводимый в обоих комплекса I и комплекса II, включают пирувата и сукцинат без ротенона или малат в качестве начальных условий. Использование пальмитоил карнитин в качестве субстрата для β-окисления. - Последовательно измеряют дыхание митохондрий в режиме реального времени, используя респирометре путем программирования его, как описано выше 12. Используйте настройки для респирометре, представленной в таблице 2.
ПРИМЕЧАНИЕ: краткое описание различных митохондриального дыхания государств заключаются в следующем: - Государство 2 = соединенном состоянии с настоящим подложки; Государство 3 = фосфорилирующие дыхание в присутствии насыщения ADP; Состояние 4 O = не фосфорилирования дыхание индуцированных олигомицином; Государственный 3U = максимальная отцепили дыхание стимулируется разобщающий FCCP; Остаточная без дыхания митохондрий = дыхания после комплексного III ингибирования антимицином-A. Следует также отметить, что длина измерения OCR в сочетании с митохондриальной концентрации может повлиять на данные по истощению кислорода в периоды измерений.
6. Вестерн-блот
ПРИМЕЧАНИЕ: Определить митохондрий маркер ЦОГ IV и цельной ткани GAPDH помощью вестерн-блоттинга, чтобы гарантировать обогащение митохондрий в конечном образце
- Отделите изолированные митохондрии и экстракт цельной ткани на 12% додецилсульфата натрия гелей в полиакриламидном.
- Передача белков на поливинилиденфторид (ПВДФ) мембраны.
- Инкубируйте с СОХ IV антитела (1: 20000), а затем пероксидазой хрена (HRP) вторичные антитела. Для определения GAPDH, полосы пятно и зонд с GAPDH моноклональных антител (1: 2000).
Примечание: Если разница в контаминации ER представляют интерес, включают ER маркеры, такие как ERp72, калнексину или калретикулин в анализе.
Результаты
Рисунок 1 изображает подробную блок-схему всей протокола.
Вестерн-блот профили ЦОГ IV / GAPDH (рис 2) изобразить выражение белка митохондрий, Кокс IV, и без митохондриальной маркера, GAPDH. Выражение как СОХ IV и GAPDH очевидны во всей мышечной лизата. После митохондрии выделяют по методике, описанной в данном протоколе, COX IV группы все еще очевидны, а GAPDH отсутствует в той же экспозиции. Длительном воздействии может выявить слабые GAPDH группу. Эти пятна показывают, что изолированные митохондрии имеют минимальный, не митохондрий загрязнения. Кроме того, COX IV выражение в изолированных митохондриях соответствует между образцами.
Рисунок 3 показывает типичные respirometric профили обусловлен комплексом II (сукцината и ротенона), используя 1,0 мкг, 2,5 мкг и 5,0 мкг митохондрий. Как и ожидалось, в целом распознавания увеличивается масIth более высокие количества митохондрий. Расчетное соотношение дыхательных управления (РКП) для этого анализа является 7,95, что указывает на митохондриальный препарат имеет высокое качество. Кроме того, государство 3U OCR немного выше, чем у государства 3, подтверждая митохондрий качество.
Для того чтобы сравнить консистенцию результатов при профилировании различные количества митохондрий, мы провели ANOVA (дисперсионный анализ), и рассчитывается сумму квадратов (SS), как фактических значений дисперсии с использованием 1,0 мкг, 2,5 мкг и 5,0 мкг митохондрий загружен в и (фиг.4). SS представлена для состояния 2, состояние 3, государственного 3U, антимицином А, и RCR. Для государственной 2 и состояние 3 измерений, один из способов ANOVA было статистически значимым (р <0,01 и р <0,05 соответственно). Кроме того, одним из способов ANOVA было статистически значимым для антимицином и RCR (р <0,01 и р <0,0001 соответственно. Никаких существенных различий не наблюдалось для государственной 3U между группами. ThESE результаты показывают, что 5,0 мкг на лунку митохондрий дал самый низкий SS по сравнению с другими концентраций и оптимальное количество для использования в системе XF 24 с нашим населением участников.
Рисунок 5 служит в качестве руководства для указания, сколько белка митохондрий можно ожидать на основе первоначального размера выборки мышц. Как и ожидалось существует сильная корреляция между количеством мышечной (мг) обрабатываются и общей митохондриальной содержанием белка (мг) конечного образца.
| Chappel-Перри буфера I (CPI) | |
| Химическая | Концентрация |
| KCl | 100 мМ |
| МОПС | 50 мм |
| ЭДТА | 1 мм |
| MgSO 4 | 5 мм |
| ATP | 1 мм |
| pH | 7,4 |
| Chappel-Перри буфера II (CPII) | |
| Химическая | Концентрация |
| KCl | 100 мМ |
| МОПС | 50 мм |
| ЭДТА | 1 мм |
| MgSO 4 | 5 мм |
| ATP | 0,2 мм |
| Жирные кислоты БСА | 0,50% |
| pH | 7,4 |
| Анализ митохондриальной Решение (МАС) (2X) | |
| Химическая | Концентрация |
| Сахароза | 35 мм |
| Маннитол | 110 мм |
| KH 2 PO 4 | 2,5 мм |
| MgCl 2 | 2,5 мм |
| HEPES | 1,0 мМ |
| ЭГТА | 0,5 мм |
| Жирные кислоты БСА | 0,10% |
| pH | 7,4 |
| Митохондриальная Анализ Solution (MAS) с комплексными II начальных условий | |
| Химическая | Концентрация |
| 1X MAS | |
| Сукцинат | 10 мм |
| Ротенон | 2 мкМ |
| pH | 7,4 |
| Митохондриальная Анализ Solution (MAS) с комплексными I начальных условий | |
| Химическая | Концентрация |
| 1X MAS | |
| Pyruvate | 5 мм |
| Малат | 5 мм |
| pH | 7,4 |
| * Все буферы должны быть сделаны в деионизированной воде | |
Таблица 1. Решение и буферные рецепты.
| Шаги протокола | ||
| StartProtocol | ||
| Команда | Время (мин) | Порт |
| Калибровать | 0,00 | |
| Подожди | 10.00 | |
| Смешивать | 1.00 | |
| Подожди | 3.00 | |
| Смешивать | 1.00 | |
| Подожди | 3.00 | |
| Смешивать | 0,50 | |
| Мера | 3.00 | |
| Смешивать | 1.00 | |
| Мера | 3.00 | |
| Смешивать | 0,50 | |
| Вводить | ||
| Смешивать | 1.00 | |
| Мера | 6.00 | |
| Смешивать | 1.00 | |
| Вводить | В | |
| Смешивать | 1.00 | |
| Мера | 3.00 | |
| Смешивать | 1.00 | |
| Вводить | C | |
| Смешивать | 1.00 | |
| Мера | 3.00 | |
| Смешивать | 1.00 | |
| Вводить | D | |
| Смешивать | 1.00 | |
| Мера | 3.00 | |
| EndProtocol | ||
Таблица 2. Смешать, измерить и смешивать настройку цикла для респирометре.

Рисунок 1. Блок-схема всего протокола. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.
/ftp_upload/52350/52350fig2highres.jpg "/>
Рисунок 2. Представитель Вестерн-блот для всей скелетной мышечной ткани, а также изолированные митохондрии. Экстракт цельной ткани, а также изолированные митохондрии иммуноблоттинг с СОХ IV антитела в качестве митохондриального маркера и GAPDH антитела для не-митохондриальной управления. Нет GAPDH группа не наблюдалось в изолированном митохондрий с указанием мало или вообще не загрязнение от не-митохондриальных источников. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.
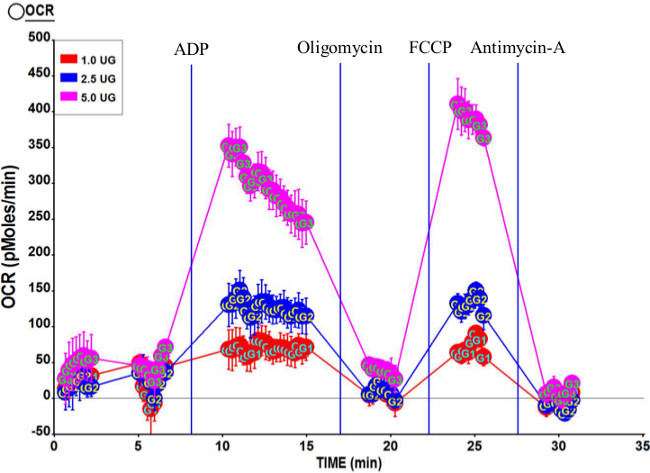
Рисунок 3. Представитель respirometric профиль митохондрий, выделенный из человеческой латеральной широкой. Три концентрации изолированными митохондриями, 5,0 мкг, 2,5 мкг и 1,0 мкг мы повторно использованы в этом анализе. Конечные концентрации соединений после портовых инъекции 2 мМ ADP (порт А); 2 мкМ олигомицин (порт B); 6 мкМ FCCP (порт С); и 2 мкМ антимицин А (порт D). Расчетное RCR для этого пробега 7,95. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.
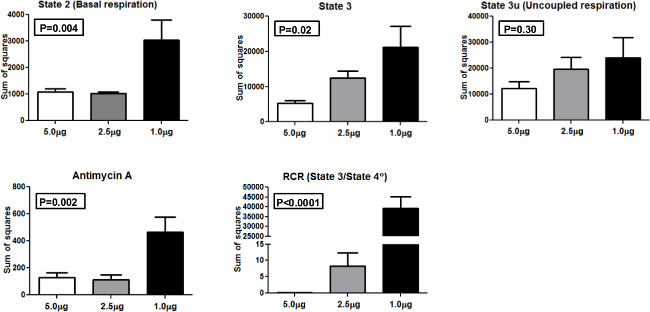
Рисунок 4. Сумма квадратов. Сумма квадратов для различных митохондриального дыхания государств и RCR, использующих 5,0 мкг, 2,5 мкг и 1,0 мкг митохондрии. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.
ig5highres.jpg "/>
Рисунок 5. Это может быть использован в качестве руководства, чтобы оценить количество белка митохондрий, что можно ожидать на основе начального мышцы образца весом регрессионного анализа.: Суммы мышцы (мг) и общей митохондриальной выходом белка (мг). Как и следовало ожидать, существует прямая положительная корреляция между количеством мышц и общего белка митохондрий, полученного.
Обсуждение
Изолированные митохондрии часто используются в исследованиях, посвященных изучению роли функции и т.д., а также другие митохондриальные деятельности, в том числе подложки транспорта и функции ЦТК. Respirometric анализ с использованием изолированных органелл позволяют прямое изучение основных процессов окислительного фосфорилирования и внутренних свойств Т.Д. Respirometric профилирование изолированными митохондриями по сравнению с целыми клетками или проницаемыми мышечных волокон имеет преимущества относительно простой интерпретации данных и отсутствие «вмешательства» из не-митохондриальных процессов или изменений в митохондриальной массы / биогенеза. Нормализация данных на основе митохондриальной содержание белка, тем самым позволяя простой поперечное сравнение между образцами митохондрий. Respirometric профилирование изолированной митохондрии предпочтительный подход, когда Целью исследования является определение основных механизмов и определения конкретных целей, таких как ETC компонентаS / комплексы, или митохондриальных транспортных механизмов.
Описывается протокол для биопсии мышц и изоляции функциональной митохондрий маленькие образцы ткани. Этот метод дает воспроизводимые результаты между пользователями из-за использования автоматизированной гомогенизатор против ручные DOUNCE гомогенизаторы. Выделение митохондрий может быть выполнена с всего лишь 20 мг мышечной ткани. Количество изолированных митохондрий, которые могут быть получены из этого размер выборки является достаточным для запуска Seahorse пластины на основе респирометрии, оставляя излишков митохондрии для других экспериментов и хранения для дальнейших анализов молекул. Следует отметить, что этот метод может быть переведен в XF 96, где даже небольшие количества митохондрий может быть использован (1-2 мкг на лунку).
Несколько протоколов для выделения митохондрий полагаться на DOUNCE Гомогенизаторы для разрушения исходной ткани. Недостатком этого способа является то практический природы исходного тканигомогенизации. Сила и скорость пестиком в гомогенизаторе может значительно варьироваться в зависимости от операторов 6. Это может привести к опыта к эксперименте изменения, а также лаборатория-к-лаборатории изменения, и приводит к затруднению в сравнения данных между экспериментами. Это вызывает особую озабоченность в исследованиях человеческого вмешательства, когда данные из участников собираются на отдельных временных точках, как правило, до и после лечения, и, возможно, на нескольких площадках. Мы используем автоматизированные гомогенизатора для более последовательного подхода, который дает более воспроизводимые результаты с ограниченной вариации от человека к человеку. Скорость подготовки также делает этот подход, подходящий для обработки нескольких образцов одновременно. Как правило, до трех экспериментах может быть выполнена в течение одного дня.
Потенциальные ограничения методике, описанной здесь возникают из-за использования отдельных органелл и использование формата пластины основе. Например, Picard и др. есть демонstrated, что изолированные митохондрии обладают функциональными характеристиками, принципиально отличающиеся от интактных митохондрий в пермеабилизированных мышечных волокон. Они предположили, что митохондриальные методы изоляции привести к изменению биоэнергетического функции, такие как значительно увеличился RCR по сравнению с проницаемыми мышечных волокон сопровождается продукцией видов больше активного кислорода 13. По сравнению с проницаемыми мышечных волокон, изоляция митохондрий требует больше времени на подготовку. Кроме того, потеря сотовой содержанием уменьшается физиологическое значение, то, что остается в целых клетках и даже проницаемыми волокон. Использование пластины на основе респирометрии с описанными разрешений техники воспроизвести трасс в образце. Тем не менее, митохондрии должен присоединиться к нижней части каждой лунки. Эта конфигурация отличается от их нормальной окружающей среды и может повлиять на функциональные характеристики. Кроме того, следует отметить, что при использовании этого протокола для митохондриальной изоляции, Therе все еще может быть загрязнение от эндоплазматического ретикулума (ER) в митохондриальной препарата. Различия в загрязнение ER может повлиять на определение митохондриальной доходности и повлиять на результаты.
В заключение следует отметить, что это исследование представляет данные, которые подтверждают, что митохондрии, выделенные из тканей с использованием этой процедуры являются функционально активными и могут быть использованы для исследований / приложений, которые требуют высокого качества изолированные митохондрии из минимального количества скелетных мышц образцов. Преимущество этого метода состоит в том, что: I) можно выделить митохондрии от минимальных количеств скелетных мышц, II) процедура является быстрым, III) с технологией пластины основе, можно использовать несколько образцов в то же время, и IV) существует достаточно излишек ткани и изолированные митохондрии после биоэнергетического анализа для хранения образцов и других молекулярно-биологических исследований.
Раскрытие информации
The author, George Rogers, is an employee of Seahorse Bioscience that produces the instrument used in this article. Open Access fees were supported by Seahorse Biosciences.
Благодарности
We would like to thank Dr. Marc Liesa, Boston University School of Medicine, helpful discussions; Ms. Karin Murphy, Ms. Heather Gregory, and Mr. John Stone, all from Wake Forest School of Medicine, for helpful technical assistance in the development of this protocol.
Материалы
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Homogenizer Bio-Gen PRO200 | BioExpress | ||
| Eppendorf Centrifuge 5804 R | Fisher Scientific | ||
| Deepwell late Rotor | Fisher Scientific | ||
| 6 mm University College Hospital Needle | Cadence | ||
| 60 cc syringe | Fisher Scientific | ||
| 96-well plate reader | Tecan (Genios-basic) | ||
| Seahorse XF 24-3 analyzer | Seahorse Biosciences, Inc. | ||
| Protein gel system | Life Technologies (Invitrogen) | ||
| Kodak Gel Logic 112 | Carestream Health, Inc | ||
| Kodak camera assembly | Carestream Health, Inc | ||
| Consumables | |||
| XF24 V7 Cell Culture Microplate and XF24 sensor cartridge | Seahorse Bioscience | 100850-001 | |
| 100867-100 | |||
| Potassium hydroxide (KOH) | Sigma-Aldrich Co | 221473 | |
| Hydrochloric acid (HCl) | Acros | 12421-0010 | |
| Dulbecco's Phosphate buffered saline | Lonza | 17-512F | |
| Potassium chloride (KCl) | Fisher Scientific | P333 | |
| MOPS | Fisher Scientific | BP308 | |
| EDTA | Fisher Scientific | BP118 | |
| Magnesium sulfate (MgSO4) | Sigma-Aldrich Co | M7506 | |
| ATP | Sigma-Aldrich Co | A9187 | |
| Fatty acid-free BSA | Calbiochem | 126575 | |
| Sucrose | Sigma-Aldrich Co | S0389 | |
| Bacterial proteinase | Sigma-Aldrich Co | P-8038 | |
| D-Mannitol | Sigma-Aldrich Co | M9546 | |
| KH2PO4 | Fisher Scientific | P284 | |
| Magnesium chloride (MgCl2) | Sigma-Aldrich Co | M9272 | |
| HEPES | Sigma-Aldrich Co | H3784 | |
| EGTA | Sigma-Aldrich Co | E3889 | |
| BCA protein assay kit | Sigma-Aldrich Co | PI23227 | |
| Succinic Acid* | Sigma-Aldrich Co | S3674 | |
| Pyruvic acid* | Sigma-Aldrich Co | P5280 | |
| Malic acid* | Sigma-Aldrich Co | 2288 | |
| ADP(K+ salt)* | Sigma-Aldrich Co | A5285 | |
| XF Cell mito stress test kit | Seahorse Biosciences | 101706 | |
| Tween-20 | Santa Cruz Biotechnology, Inc. | SC-29113 | |
| NuPAGE 12% Bis-Tris Gel | Life Technologies (Invitrogen) | NP0343BOX | |
| Immobilin Transfer Membranes (0.45 um) | Millipore | IPVH20200 | |
| MOPS SDS Running Buffer (20X)-500 ml | Life Technologies (Invitrogen) | NP0001 | |
| NuPAGE Transfer Buffer (20X)-1 liter | Life Technologies (Invitrogen) | NP0006-1 | |
| Primary antibodies (mAB to VDAC1/Porin) | Abcam | ab14734 | |
| Primary antibodies (mAB to GAPDH) | Abcam | ab9484 | |
| Anti-Mouse IgG (Goat), HRP-labeled | PerkinElmer | NEF822E001EA | |
| Anti-Rabbit IgG (Goat), HRP-labeled | PerkinElmer | NEF812E001EA | |
| *ADP, succinic acid, pyruvic acid, and malic acid should be adjusted to pH 7.4 with KOH only |
Ссылки
- Fernandez-Vizarra, E., et al. Isolation of mitochondria for biogenetical studies: An update. Mitochondrion. 10, 253-262 (2010).
- Fernandez-Vizarra, E., Lopez-Perez, M. J., Enriquez, J. A. Isolation of biogenetically competent mitochondria from mammalian tissues and cultured cells. Methods. 26, 292-297 (2002).
- Garcia-Cazarin, M. L., Snider, N. N., Andrade, F. H. Mitochondrial isolation from skeletal muscle. Journal of Visualized Experiments : JoVE. , (2011).
- Iglesias-Gonzalez, J., Sanchez-Iglesias, S., Beiras-Iglesias, A., Soto-Otero, R., Mendez-Alvarez, E. A simple method for isolating rat brain mitochondria with high metabolic activity: effects of EDTA and EGTA. Journal of Neuroscience Methods. 213, 39-42 (2013).
- Gross, V. S., et al. Isolation of functional mitochondria from rat kidney and skeletal muscle without manual homogenization. Analytical Biochemistry. 418, 213-223 (2011).
- Franko, A., et al. Efficient isolation of pure and functional mitochondria from mouse tissues using automated tissue disruption and enrichment with anti-TOM22 magnetic beads. PloS One. 8, e82392 (2013).
- Chappell, J. B., Perry, S. V. The respiratory and adenosinetriphosphatase activities of skeletal-muscle mitochondria. The Biochemical Journal. 55, 586-595 (1953).
- Tyrrell, D. J., et al. Respirometric Profiling of Muscle Mitochondria and Blood Cells Are Associated With Differences in Gait Speed Among Community-Dwelling Older Adults. J Gerontol A Biol Sci Med Sci. , (2014).
- Nicklas, B. J., et al. Relationship of physical function to vastus lateralis capillary density and metabolic enzyme activity in elderly men and women. Aging Clinical and Experimental Research. 20, 302-309 (2008).
- Bergstrom, J. Percutaneous needle biopsy of skeletal muscle in physiological and clinical research. Scandinavian Journal of Clinical and Laboratory Investigation. 35, 609-616 (1975).
- Rogers, G. W., et al. High throughput microplate respiratory measurements using minimal quantities of isolated mitochondria. PloS One. 6, e21746 (2011).
- Picard, M., et al. Mitochondrial structure and function are disrupted by standard isolation methods. PloS One. 6, e18317 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены