Method Article
Evaluación de Preparación y respirometría de mitocondrias aisladas de tejido músculo esquelético Obtenidos percutánea Biopsia con aguja
En este artículo
Resumen
Se describen los métodos de biopsia de músculo vasto lateral, la preparación de las mitocondrias purificada, y perfilado respirométrico. El uso de volumen muscular pequeña hace que esta técnica adecuada para aplicaciones de investigación clínica.
Resumen
Perfiles de respirometría de mitocondrias aisladas se utiliza comúnmente para investigar la función de la cadena de transporte de electrones. Se describe un método para obtener muestras de vasto lateral humanos, aislar las mitocondrias a partir de cantidades mínimas de tejido de músculo esquelético, y la placa de perfiles respirométrico basado utilizando un flujo extracelular (XF) analizador. Comparación de los perfiles respirométricas obtenidos utilizando 1,0, 2,5 y 5,0 g de mitocondrias indican que 1,0 mg es suficiente para medir la respiración y que 5,0 g proporciona resultados más consistentes basado en la comparación de los errores estándar. Western blot de las mitocondrias aisladas de marcador mitocondrial de la COX IV y no mitocondrial GAPDH marcador de tejido indican que existe contaminación transitoria mitocondrial limitado el uso de este protocolo. La capacidad para estudiar respirometría mitocondrial en tan poco como 20 mg de tejido muscular permite a los usuarios utilizar biopsias individuales para múltiples puntos finales del estudio en clínicaproyectos de investigación.
Introducción
Las mitocondrias son los centros de producción de energía primaria en el celular y tienen un papel importante en el envejecimiento, así como diversos trastornos relacionados con la edad, como la enfermedad cardiovascular, enfermedad de Alzheimer, la diabetes, el cáncer y la obesidad. Perfiles de respirometría de mitocondrias aisladas proporciona análisis directo de la función de la cadena de transporte de electrones (ETC) y ha contribuido significativamente a nuestra comprensión de la biología mitocondrial y su papel en la salud y la enfermedad. Mitocondrias aisladas se utilizan para estudiar diversos aspectos de la bioenergética como, el transporte de sustrato, la actividad de la ATP sintasa, fuga de protones, etc. La metodología descrita en este manuscrito se ha optimizado para permitir el análisis respirométrico de mitocondrias aisladas de biopsias de tejido de músculo esquelético obtenidos a partir de sujetos humanos. El protocolo de biopsia se describe en este manuscrito ha sido utilizada por nuestro personal durante los últimos 12 años. Nuestro grupo ha realizado más de 700 procedimientos en los adultos de diversas edades,hasta 90 años, y con diversas patologías crónicas, sin ningún problema de seguridad adversas. Un aspecto clave de este protocolo es que está diseñado específicamente para utilizar cantidades mínimas de tejido, lo que facilita su uso en estudios de investigación clínica.
Varios protocolos se han desarrollado para el aislamiento de las mitocondrias. Fernández-Vizarra et al. 1,2 describe un método para aislar las mitocondrias a partir de diversos tejidos de rata, así como células cultivadas. Garcia-Cazarin et al. 3 han informado un método para aislar las mitocondrias a partir de los músculos esqueléticos de rata y ratón. Un método para el aislamiento de las mitocondrias de cerebro de rata también ha sido reportado por Iglesias-Gonzales et al. 4 Gross, et al. 5 informaron de un método de aislamiento de mitocondrias usando el barocycler y / o la trituradora PCT. Recientemente, Franko et al. 6 reportó un método de aislamiento de mitocondrias altamente enriquecido utilizando contra-TOM22 Perlas magnéticas.
Aunque estos protocolos producen excelentes resultados, los requisitos de tamaño del tejido son altos en comparación con el método descrito en este manuscrito. Por ejemplo, Gross et al. 5 utiliza 1.5 a 1.8 g del músculo gastrocnemio, y alrededor de 2 g del tejido renal. Del mismo modo, Franco et al. 6 utiliza 500 mg de tejido hepático de ratón. Desde nuestra experiencia, los rendimientos típicos que pueden esperarse de la biopsia percutánea con aguja de músculo esquelético (vasto externo) oscilan entre 100-200 mg. La capacidad de evaluar la función mitocondrial en 20-50 mg de tejido muscular utilizando el protocolo descrito aquí permite a los usuarios realizar múltiples evaluaciones por biopsia y almacenar las muestras para su uso futuro en otros experimentos de biología molecular. Esta es una característica crítica en la investigación clínica y otros estudios que requieren un uso diligente de las muestras. Cabe señalar que las mitocondrias previamente congelados no son buenas para el estudio de la respiración acoplado debido a TINERARIOr daño de la membrana mitocondrial y la pérdida de la actividad del citocromo C. Nuestro método ha sido adaptado y modificado a partir del método publicado por Chappell y Perry 7.
Utilizando los métodos descritos en este manuscrito, hemos informado recientemente que el perfil respirométrico de las mitocondrias aisladas de vasto lateralis humano se correlaciona directamente con la capacidad física, medida como la velocidad del paso 8.
Protocolo
NOTA: El protocolo descrito fue aprobado por la Junta de Revisión Institucional de Wake Forest School de Medicina. Se obtuvo el consentimiento por escrito. Todos los participantes eran adultos mayores sanos (65-79 años), de ambos sexos, con un IMC que van desde 23 hasta 35.
1. esquelético biopsia muscular
- Como se describió anteriormente, 9 realizan todas las biopsias en la madrugada después de una O / N rápido. Pregunte a los sujetos a que se abstengan de tomar aspirina, medicamentos recetados y de venta libre los medicamentos anti-inflamatorios no esteroideos, u otros compuestos que pueden afectar el sangrado, las plaquetas, o moretones en la semana antes de la biopsia. Pida a los participantes que se abstengan también de cualquier actividad vigorosa durante al menos 36 horas antes de la biopsia.
NOTA: El músculo se obtiene a partir del vasto externo utilizando la técnica de la biopsia percutánea con aguja con una aguja percutánea bajo anestesia local con lidocaína al 1%. No hay complicaciones médicas o oTher informaron eventos adversos de este procedimiento han ocurrido en nuestra unidad de investigación clínica. - NOTA: El procedimiento de biopsia descrito es una adaptación de la de Bergstrom 10.
- En pocas palabras, administrar localmente 1% toma lidocaína cuidado de no infiltrar el músculo. Siga esto con un período de espera de 10 minutos para permitir suficiente entumecimiento.
- Tome las biopsias del vientre del músculo (la región media del músculo entre la inserción y origen) evitando las zonas subfasciales y myotendonous.
- Utilice la aguja percutánea (un dispositivo de aspiración asistida reutilizable con un lado de la ventana y el cilindro de corte interior de corte) y seguir una fascial "pop" o la resistencia de la fascia como una guía.
- Estimar la profundidad con la aguja de anestesia, de nuevo sentirlo con la hoja de bisturí angosto y hacer una incisión de 4-5 mm a través de la fascia. Avanzar la aguja a través de la incisión hasta que se inserta en el músculo.
- Recogermúltiples muestras con la ventana convirtieron en diferentes direcciones. Aplicar succión continua usando una jeringa de 60 cc, mientras que el avance y la retirada de muestras de músculo en la aguja percutánea dos a cuatro veces en diferentes direcciones. Suspenda la succión y quitar la aguja.
NOTA: Cada pasada (inserción y extracción de la aguja) deben tener menos de un minuto. - ¿Tienes una asistente aplicar una presión firme para perforar sitio durante 5 min para establecer la hemostasia. Desconecte la aguja de la tubería de succión y retirar con cuidado las muestras de músculo de la ventana y el barril.
- Hacer una segunda pasada si se necesita más músculo repitiendo el procedimiento anterior.
- Retire cualquier coágulos sanguíneos visibles desde la muestra de músculo con fórceps, pese la muestra, e inmediatamente colocar en un tubo que contiene DPBS heladas.
NOTA: El rendimiento promedio utilizando esta metodología es de 150 ± 20 mg.
2. Aislamiento mitocondrial
- Recién preparar el Chappel-Perry (CP) y mitocondrial solución de ensayo (MAS) tampones (Tabla 1) en el día del experimento, o alícuota y almacenar a -20 ° C. Preparar los compuestos en dimetilsulfóxido a una concentración de 2,5 mM y alícuota y almacenar a -20 ° C. Utilice las alícuotas de amortiguamiento y compuestas almacenados a -20 ° C dentro de 2 meses desde el día de la preparación.
- Quitar el tejido conectivo visible de la muestra usando unas tijeras afiladas y pinzas; si es necesario el uso de un microscopio de disección para este paso. Lávese bien las muestras 3-4 veces con tampón DPBS enfriado con hielo para eliminar la sangre. Mantener las muestras en DPBS y proceso heladas tan pronto como sea posible, teniendo cuidado de no exceder más de 45 minutos de la biopsia. Tome las precauciones necesarias para eliminar cuidadosamente cualquier tendones o tejido adiposo de la muestra de músculo.
- Cortar inmediatamente el tejido muscular en trozos finos con un par de tijeras estériles y suspender en 500 l de 1 ml IPC contiene proteinase (Nagarse) a una concentración de 0,2 mg / g de tejido. Siga esto con una incubación de 5 minutos a temperatura ambiente y luego transferir al hielo.
- Homogeneizar los tejidos picados tratados con Nagarse utilizando un homogeneizador automatizado. Mantenga la muestra en hielo durante todo este proceso. Homogeneizar cada muestra de tejido cuatro veces, cada vez por un pulso de 2 segundos, usando el homogeneizador automatizado con un ajuste de velocidad de 10.000 rpm. Lavar la sonda con etanol al 70% seguido de agua destilada entre los tejidos.
- Lavar el tejido homogeneizado con un volumen igual de CP I (500 l a 1 ml) y el volumen de 2x CP II (1 ml a 2 ml), y se recoge el contenido en un tubo de centrífuga y se centrifuga a 600 xg, 4 ° C durante 10 min. Pasar el sobrenadante a través de un paño humedecido queso, recoger el filtrado y desechar el sedimento, eliminando así la mayoría de las fracciones no mitocondriales.
3. Lavado de la mitocondria
- Centrifugar el sobrenadante de la etapa anterior en 10,000 xg, 4 ° C durante 10 min. Suspender el sedimento en 4 ml de tampón CP II y más centrifugar a 10.000 xg, 4 ° C durante 10 min.
NOTA: En raras ocasiones, se forma un sedimento fino de sangre debajo de la pellet mitocondrial. En ese caso, retire el pellet mitocondrial por aspiración suave con tampón CPII. Este paso se puede evitar completamente lavando la sangre en el paso 2. - Suspender el sedimento obtenido en 2 ml de tampón CP I. En esta etapa utilizar una pequeña alícuota de esta suspensión para la estimación de proteínas. Resuspender la muestra restante en CP I buffer y centrifugar como anteriormente. Suspender el sedimento final en una cantidad mínima (200 l) de la solución de ensayo mitocondrial (MAS).
NOTA: La proteína se ensayó en esta etapa porque tampón CP I no tiene BSA, mientras que el MAS en el que las muestras serán suspendidos después no tener BSA en ella.
4. Estimar el contenido mitocondrial midiendo la concentración de proteína usando un kit de ensayo de proteína BCA
NOTA: Utilice esta concentración para calcular la cantidad de mitocondrias utilizados para su embarque en una microplaca de 24 pocillos para mediciones respirométricos, o para experimentos de Western blot. Tener en cuenta el factor de dilución (10) para el cálculo de la concentración de proteína.5. Lleve a cabo los ensayos XF según lo descrito por Rogers, GW, et al. 12
NOTA: Visualizar la tasa de consumo de O 2 (OCR) en pmoles O 2 / min, o los niveles absolutos de O 2 y pH en la salida de datos.
- Utilice 1x MAS para preparar compuestos para ser inyectado. Añadir una concentración 10x de los compuestos a los puertos de AD para dar una concentración final de la siguiente manera: Port A, ADP [-diphosphate adenosina 5 ', 2 mM, 50 l]; puerto B, oligomicina (2 M, 55 l); puerto C, FCCP [cianuro de 4- (trifluorometoxi) fenilhidrazona carbonilo, 6 M, 60 l]; y el puerto D, 2 mM antimicina-A (65 l). Prepararvolumen suficiente de compuestos para el número requerido de pocillos.
- Determinar la cantidad óptima de las mitocondrias por titulación. Por ejemplo, la carga de 1,0 g, 2,5 g, y 5,0 g de mitocondrias por pocillo en un volumen de 50 l de 1x frío de hielo que contienen MAS sustrato. Para minimizar la variabilidad entre los pozos, primero diluir 10x mitocondrias en sustrato frío 1x MAS +. A continuación, entregar 50 l de esta suspensión a cada pocillo (excepto a los pocillos de corrección de fondo).
- Centrifugar la placa a 2000 xg, 20 min a 4 ° C. Después de la centrifugación, añadir suavemente 450 l de 1x MAS + succinato (10 mM) y la rotenona (2 M) (condiciones iniciales; véase más adelante) a cada pocillo. Ver las mitocondrias en el microscopio para asegurar la adherencia homogénea al pozo antes de transferir la placa al analizador XF.
NOTA: Las condiciones iniciales utilizados dependerá de si la respiración es accionado por cualquiera de I o complejo II complejo ETC. Por complejo respiración II impulsado por usar succinate (10 mM) y rotenona (2 mM) como condiciones iniciales. Bloques rotenona I complejo y succinato proporciona combustible para el complejo II (succinato deshidrogenasa). Para estudiar la respiración impulsado por el complejo I, utilizar ya sea piruvato y malato, cada uno a una concentración final de 5 mM o glutamato y malato cada uno a una concentración final de 10 mM como condiciones iniciales. Este último puede ayudar a distinguir entre la disfunción ciclo del ácido tricarboxílico y transporte sustrato. Para estudiar la respiración impulsado por tanto complejo I y II complejo, incluir piruvato y succinato sin rotenona o malato como condiciones iniciales. Utilice carnitina palmitoil como sustrato para la β-oxidación. - Secuencialmente medir la respiración mitocondrial en tiempo real utilizando el medidor de respiración mediante la programación de la forma descrita anteriormente 12. Utilice la configuración para el medidor de respiración proporcionado en la Tabla 2.
NOTA: Una breve explicación de diversos estados de la respiración mitocondrial son los siguientes: - Estado 2 = estado acoplado con el sustrato presente; Estado 3 = fosforilantes de respiración en presencia de saturar ADP; Estado 4 o = respiración no fosforilación inducida por oligomicina; 3u Estado = máxima respiración desacoplado estimulado por el desacoplador FCCP; Residual no mitocondrial respiración = respiración después de complejo III inhibición por antimicina-A. También se debe señalar que, la longitud de la medición de OCR en combinación con la concentración mitocondrial podría influir en los datos por el agotamiento de oxígeno durante los períodos de medición.
6. Western Blot
NOTA: Determine el marcador mitocondrial de la COX IV y GAPDH tejido completo por Western Blot para asegurar el enriquecimiento de las mitocondrias en la muestra final
- Separe las mitocondrias aisladas y extracto de tejido completo en un 12% de sodio dodecil sulfato de geles de poliacrilamida.
- Transferir las proteínas a una membrana de fluoruro de polivinilideno (PVDF).
- Incubar con el anticuerpo de la COX IV (1: 20.000), seguido de peroxidasa de rábano picante (HRP) conjugado con anticuerpos secundarios. Para la determinación de GAPDH, pelar el blot y la sonda con un anticuerpo monoclonal GAPDH (1: 2.000).
NOTA: Si las diferencias en la contaminación ER son de interés, incluyen marcadores ER tales como ERp72, calnexina o calreticulina en el análisis.
Resultados
La Figura 1 representa un diagrama de flujo detallado de todo el protocolo.
Perfiles de transferencia de Western de la COX IV / GAPDH (Figura 2) muestran la expresión de la proteína mitocondrial, la COX IV, y el marcador no mitocondrial, GAPDH. La expresión de la COX IV y GAPDH son evidentes en todo el lisado muscular. Después de las mitocondrias se aislaron utilizando la técnica descrita en este protocolo, las bandas de la COX IV son todavía evidentes mientras GAPDH está ausente en la misma exposición. Exposiciones más largas pueden revelar una banda GAPDH débil. Estas manchas indicar que las mitocondrias aisladas tienen contaminación transitoria mitocondrial mínima. Además, la expresión de la COX IV en mitocondrias aisladas es consistente entre muestras.
La Figura 3 muestra los perfiles de respirométricas típicos accionados por el complejo II (succinato y rotenona) utilizando 1,0 g, 2,5 g, y 5,0 g de mitocondrias. Como era de esperar, en general OCR aumenta wITH mayores cantidades de mitocondrias. La relación del control respiratorio calculado (RCR) para este ensayo es de 7,95, lo que indica que la preparación mitocondrial es de alta calidad. Además, 3u estado OCR es ligeramente mayor que el de estado 3, lo que confirma la calidad mitocondrial.
A fin de comparar la consistencia de los resultados cuando perfiles diferentes cantidades de mitocondrias, se realizó un ANOVA (análisis de varianza) y se calculó la suma de cuadrados (SS) como valores reales de varianza utilizando 1,0 g, 2,5 g, y 5,0 g de mitocondrias cargada por así (Figura 4). SS se presenta para el estado 2, el estado 3, 3u estado, antimicina A, y RCR. Para el estado 2 y el estado 3 mediciones, una manera ANOVA fue estadísticamente significativa (p <0,01 yp <0,05, respectivamente). Del mismo modo, el ANOVA de una vía fue estadísticamente significativa para antimicina y RCR (p <0,01 yp <0.0001, respectivamente. No se observaron diferencias significativas para 3u estado entre los grupos. ThESE resultados indican que 5,0 g de mitocondrias por pocillo dio el más bajo SS en comparación con otras concentraciones y es la cantidad óptima para utilizar en el sistema XF 24 con nuestra población de participantes.
La figura 5 sirve como una guía para indicar cómo se puede esperar que la cantidad de proteína mitocondrial basada en el tamaño inicial de la muestra de músculo. Como era de esperar hay una fuerte correlación entre la cantidad de músculo (mg) procesado y el contenido total de proteína mitocondrial (mg) de la muestra final.
| Tampón Chappel-Perry I (IPC) | |
| Químico | Concentración |
| KCl | 100 mM |
| MOPS | 50 mM |
| EDTA | 1 mM |
| MgSO 4 | 5 mM |
| ATP | 1 mM |
| pH | 7.4 |
| Tampón Chappel-Perry II (CPII) | |
| Químico | Concentración |
| KCl | 100 mM |
| MOPS | 50 mM |
| EDTA | 1 mM |
| MgSO 4 | 5 mM |
| ATP | 0,2 mM |
| -Ácido graso libre BSA | 0,50% |
| pH | 7.4 |
| Mitocondrial Ensayo Solución (MAS) (2X) | |
| Químico | Concentración |
| La sacarosa | 35 mM |
| Manitol | 110 mM |
| KH 2 PO 4 | 2,5 mM |
| MgCl 2 | 2,5 mM |
| HEPES | 1,0 mM |
| EGTA | 0,5 mM |
| -Ácido graso libre BSA | 0,10% |
| pH | 7.4 |
| Mitocondrial Ensayo Solución (MAS) con complejos II condiciones iniciales | |
| Químico | Concentración |
| 1X MAS | |
| Succinato | 10 mM |
| La rotenona | 2 mM |
| pH | 7.4 |
| Mitocondrial Ensayo Solución (MAS) con complejos I condiciones iniciales | |
| Químico | Concentración |
| 1X MAS | |
| Piruvato | 5 mM |
| Malate | 5 mM |
| pH | 7.4 |
| * Todos los tampones que se hagan en agua desionizada | |
Tabla 1. Solución y recetas de amortiguamiento.
| Pasos del protocolo | ||
| StartProtocol | ||
| Comando | Tiempo (min) | Puerto |
| Calibrar | 0.00 | |
| Esperar | 10.00 | |
| Mezclar | 1.00 | |
| Esperar | 3.00 | |
| Mezclar | 1.00 | |
| Esperar | 3.00 | |
| Mezclar | 0.50 | |
| Medida | 3.00 | |
| Mezclar | 1.00 | |
| Medida | 3.00 | |
| Mezclar | 0.50 | |
| Inyectar | La | |
| Mezclar | 1.00 | |
| Medida | 6.00 | |
| Mezclar | 1.00 | |
| Inyectar | B | |
| Mezclar | 1.00 | |
| Medida | 3.00 | |
| Mezclar | 1.00 | |
| Inyectar | C | |
| Mezclar | 1.00 | |
| Medida | 3.00 | |
| Mezclar | 1.00 | |
| Inyectar | D | |
| Mezclar | 1.00 | |
| Medida | 3.00 | |
| EndProtocol | ||
Tabla 2. Mezclar, medir y mezclar ajuste de ciclo para el medidor de respiración.

Figura 1. Diagrama de flujo de todo el protocolo. Haga clic aquí para ver una versión más grande de esta figura.
/ftp_upload/52350/52350fig2highres.jpg "/>
Figura 2. Un representante de Western blot para el tejido muscular esquelético conjunto, así como las mitocondrias aisladas. Extracto de tejido conjunto, así como las mitocondrias aisladas se inmunotransfirieron con el anticuerpo de la COX IV como marcador mitocondrial y anticuerpos GAPDH para el control no mitocondrial. No se observó una banda de GAPDH en las mitocondrias aisladas que indica poca o ninguna contaminación de fuentes no mitocondriales. Haga clic aquí para ver una versión más grande de esta figura.
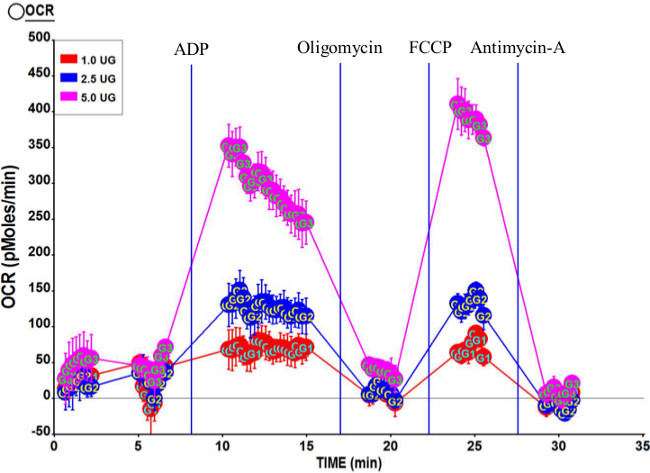
Figura 3. Perfil respirométrico Representante de las mitocondrias aisladas de vasto lateralis humana. Tres concentraciones de mitocondrias aisladas, 5,0 mg, 2,5 mg y 1,0 mg nosotros re utilizado en este ensayo. Las concentraciones finales de los compuestos después de las inyecciones de puerto fueron 2 mM ADP (puerto A); 2 mM oligomicina (puerto B); 6 micras FCCP (puerto C); y 2 mM antimicina A (puerto D). RCR Calculado para esta carrera era 7.95. Por favor, haga clic aquí para ver una versión más grande de esta figura.
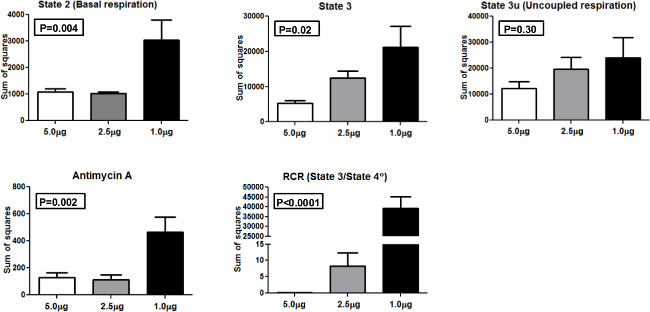
Figura 4. Suma de cuadrados. La suma de los cuadrados de los diferentes estados de la respiración mitocondrial y RCR utilizando 5,0 mg, 2,5 mg y 1,0 mg mitocondrias. Haga clic aquí para ver una versión más grande de esta figura.
ig5highres.jpg "/>
Figura 5. Esto se puede utilizar como una guía para estimar la cantidad de proteína mitocondrial que se puede esperar basado en el análisis inicial de la muestra del músculo peso de regresión:. De cantidad de músculo (mg) y rendimiento de proteína mitocondrial total (mg). Como era de esperar, hay una correlación positiva directa entre la cantidad de músculo y la proteína mitocondrial total obtenida.
Discusión
Mitocondrias aisladas se utilizan a menudo en los estudios que examinan la función de la función de ETC, así como otras actividades mitocondriales, incluyendo el transporte del sustrato y la función de ciclo del TCA. Ensayos respirométricas utilizando orgánulos aislados permiten el examen directo de los procesos básicos de la fosforilación oxidativa y las propiedades intrínsecas de la ETC. Perfiles de respirometría de mitocondrias aisladas en comparación con células enteras o las fibras musculares permeabilizadas tiene las ventajas de la interpretación de datos relativamente fácil y la ausencia de la "interferencia" de procesos no mitocondriales o los cambios en la masa mitocondrial / biogénesis. La normalización de los datos se basa en el contenido de proteína mitocondrial, permitiendo de ese modo sencillo comparación cruzada de las mitocondrias entre las muestras. Perfiles de respirometría de mitocondrias aisladas es un enfoque preferido cuando el objetivo del estudio es determinar los mecanismos subyacentes y la identificación de objetivos específicos, tales como componente ETCs / complejos, o mecanismos de transporte mitocondrial.
Se describe un protocolo para biopsia muscular y aislamiento de las mitocondrias funcional a partir de pequeñas muestras de tejido. Este método produce resultados reproducibles entre los usuarios debido a la utilización de un homogeneizador automatizado frente de funcionamiento manual homogeneizadores Dounce. Aislamiento de las mitocondrias se puede realizar con tan poco como 20 mg de tejido muscular. La cantidad de mitocondrias aisladas que pueden obtenerse a partir de este tamaño de muestra es suficiente para ejecutar Seahorse respirometría a base de placa, dejando mitocondrias excedentes para otros experimentos y de almacenamiento para otros análisis moleculares. Cabe señalar que este método puede ser traducido al XF 96, donde incluso cantidades más pequeñas de las mitocondrias se pueden utilizar (1-2 g por pocillo).
Varios protocolos para el aislamiento de las mitocondrias se basan en homogeneizadores Dounce para la interrupción inicial del tejido. Un inconveniente de este método es la práctica en la naturaleza del tejido inicialhomogeneización. La fuerza y la velocidad de la mano del mortero en el homogeneizador pueden variar significativamente entre los operadores 6. Esto puede resultar en la variación de experimento a experimento, así como la variación-laboratorio a otro, y conduce a dificultades en la comparación de los datos entre los experimentos. Esto es especialmente preocupante en los estudios de intervención en humanos cuando se recogen datos de los participantes en los puntos de tiempo separados, por lo general, antes y después del tratamiento, y potencialmente en múltiples sitios. Utilizamos un homogeneizador automatizado para un enfoque más coherente que produce resultados más reproducibles con limitada variación de persona a persona. La velocidad de la preparación también hace que este enfoque adecuado para el manejo de muestras múltiples al mismo tiempo. Típicamente, hasta tres experimentos se pueden realizar en un solo día.
Las limitaciones potenciales de la técnica descrita aquí surgen de la utilización de los orgánulos aislados y el uso de un formato basado en placa. Por ejemplo, Picard et al. tener demoniotraron que las mitocondrias aisladas poseen características funcionales que difieren fundamentalmente de las de las mitocondrias intactas dentro de las miofibrillas permeabilizadas. Propusieron que las técnicas de aislamiento mitocondriales resultan en función bioenergética alterada, tales como el aumento significativamente en comparación con las miofibras RCR permeabilizadas acompañados por la producción de especies reactivas de oxígeno mayor 13. En comparación con las fibras musculares permeabilizadas, el aislamiento de las mitocondrias requiere mayor tiempo de preparación. Además, la pérdida de contenido celular disminuye relevancia fisiológica, algo que se retiene en las células enteras y las fibras incluso permeabilizadas. El uso de respirometría basado en placa con los permisos técnica descrita replicar carreras por muestra. Sin embargo, las mitocondrias se deben adherir a la parte inferior de cada pocillo. Esta configuración es diferente de su entorno normal y puede afectar las características funcionales. Además, cabe señalar que el uso de este protocolo para el aislamiento mitocondrial Ther,e todavía puede ser la contaminación de retículo endoplásmico (ER) en la preparación mitocondrial. Las diferencias en la contaminación ER pueden afectar la determinación del rendimiento y de influir en los resultados mitocondriales.
En conclusión, este estudio presenta datos que confirman que las mitocondrias aisladas de tejidos utilizando este procedimiento son funcionalmente activos y pueden ser utilizados para estudios / aplicaciones que requieren mitocondrias aisladas de alta calidad a partir de la cantidad mínima de muestras de músculo esquelético. La ventaja de este método es que: i) es posible aislar las mitocondrias a partir de cantidades mínimas de músculo esquelético, ii) el procedimiento es rápido, iii) con la tecnología basada placa, es posible ejecutar varias muestras al mismo tiempo, y iv) no hay suficiente tejido sobrante y mitocondrias aisladas tras el ensayo bioenergética para el almacenamiento de muestras y otras investigaciones de biología molecular.
Divulgaciones
The author, George Rogers, is an employee of Seahorse Bioscience that produces the instrument used in this article. Open Access fees were supported by Seahorse Biosciences.
Agradecimientos
We would like to thank Dr. Marc Liesa, Boston University School of Medicine, helpful discussions; Ms. Karin Murphy, Ms. Heather Gregory, and Mr. John Stone, all from Wake Forest School of Medicine, for helpful technical assistance in the development of this protocol.
Materiales
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Homogenizer Bio-Gen PRO200 | BioExpress | ||
| Eppendorf Centrifuge 5804 R | Fisher Scientific | ||
| Deepwell late Rotor | Fisher Scientific | ||
| 6 mm University College Hospital Needle | Cadence | ||
| 60 cc syringe | Fisher Scientific | ||
| 96-well plate reader | Tecan (Genios-basic) | ||
| Seahorse XF 24-3 analyzer | Seahorse Biosciences, Inc. | ||
| Protein gel system | Life Technologies (Invitrogen) | ||
| Kodak Gel Logic 112 | Carestream Health, Inc | ||
| Kodak camera assembly | Carestream Health, Inc | ||
| Consumables | |||
| XF24 V7 Cell Culture Microplate and XF24 sensor cartridge | Seahorse Bioscience | 100850-001 | |
| 100867-100 | |||
| Potassium hydroxide (KOH) | Sigma-Aldrich Co | 221473 | |
| Hydrochloric acid (HCl) | Acros | 12421-0010 | |
| Dulbecco's Phosphate buffered saline | Lonza | 17-512F | |
| Potassium chloride (KCl) | Fisher Scientific | P333 | |
| MOPS | Fisher Scientific | BP308 | |
| EDTA | Fisher Scientific | BP118 | |
| Magnesium sulfate (MgSO4) | Sigma-Aldrich Co | M7506 | |
| ATP | Sigma-Aldrich Co | A9187 | |
| Fatty acid-free BSA | Calbiochem | 126575 | |
| Sucrose | Sigma-Aldrich Co | S0389 | |
| Bacterial proteinase | Sigma-Aldrich Co | P-8038 | |
| D-Mannitol | Sigma-Aldrich Co | M9546 | |
| KH2PO4 | Fisher Scientific | P284 | |
| Magnesium chloride (MgCl2) | Sigma-Aldrich Co | M9272 | |
| HEPES | Sigma-Aldrich Co | H3784 | |
| EGTA | Sigma-Aldrich Co | E3889 | |
| BCA protein assay kit | Sigma-Aldrich Co | PI23227 | |
| Succinic Acid* | Sigma-Aldrich Co | S3674 | |
| Pyruvic acid* | Sigma-Aldrich Co | P5280 | |
| Malic acid* | Sigma-Aldrich Co | 2288 | |
| ADP(K+ salt)* | Sigma-Aldrich Co | A5285 | |
| XF Cell mito stress test kit | Seahorse Biosciences | 101706 | |
| Tween-20 | Santa Cruz Biotechnology, Inc. | SC-29113 | |
| NuPAGE 12% Bis-Tris Gel | Life Technologies (Invitrogen) | NP0343BOX | |
| Immobilin Transfer Membranes (0.45 um) | Millipore | IPVH20200 | |
| MOPS SDS Running Buffer (20X)-500 ml | Life Technologies (Invitrogen) | NP0001 | |
| NuPAGE Transfer Buffer (20X)-1 liter | Life Technologies (Invitrogen) | NP0006-1 | |
| Primary antibodies (mAB to VDAC1/Porin) | Abcam | ab14734 | |
| Primary antibodies (mAB to GAPDH) | Abcam | ab9484 | |
| Anti-Mouse IgG (Goat), HRP-labeled | PerkinElmer | NEF822E001EA | |
| Anti-Rabbit IgG (Goat), HRP-labeled | PerkinElmer | NEF812E001EA | |
| *ADP, succinic acid, pyruvic acid, and malic acid should be adjusted to pH 7.4 with KOH only |
Referencias
- Fernandez-Vizarra, E., et al. Isolation of mitochondria for biogenetical studies: An update. Mitochondrion. 10, 253-262 (2010).
- Fernandez-Vizarra, E., Lopez-Perez, M. J., Enriquez, J. A. Isolation of biogenetically competent mitochondria from mammalian tissues and cultured cells. Methods. 26, 292-297 (2002).
- Garcia-Cazarin, M. L., Snider, N. N., Andrade, F. H. Mitochondrial isolation from skeletal muscle. Journal of Visualized Experiments : JoVE. , (2011).
- Iglesias-Gonzalez, J., Sanchez-Iglesias, S., Beiras-Iglesias, A., Soto-Otero, R., Mendez-Alvarez, E. A simple method for isolating rat brain mitochondria with high metabolic activity: effects of EDTA and EGTA. Journal of Neuroscience Methods. 213, 39-42 (2013).
- Gross, V. S., et al. Isolation of functional mitochondria from rat kidney and skeletal muscle without manual homogenization. Analytical Biochemistry. 418, 213-223 (2011).
- Franko, A., et al. Efficient isolation of pure and functional mitochondria from mouse tissues using automated tissue disruption and enrichment with anti-TOM22 magnetic beads. PloS One. 8, e82392 (2013).
- Chappell, J. B., Perry, S. V. The respiratory and adenosinetriphosphatase activities of skeletal-muscle mitochondria. The Biochemical Journal. 55, 586-595 (1953).
- Tyrrell, D. J., et al. Respirometric Profiling of Muscle Mitochondria and Blood Cells Are Associated With Differences in Gait Speed Among Community-Dwelling Older Adults. J Gerontol A Biol Sci Med Sci. , (2014).
- Nicklas, B. J., et al. Relationship of physical function to vastus lateralis capillary density and metabolic enzyme activity in elderly men and women. Aging Clinical and Experimental Research. 20, 302-309 (2008).
- Bergstrom, J. Percutaneous needle biopsy of skeletal muscle in physiological and clinical research. Scandinavian Journal of Clinical and Laboratory Investigation. 35, 609-616 (1975).
- Rogers, G. W., et al. High throughput microplate respiratory measurements using minimal quantities of isolated mitochondria. PloS One. 6, e21746 (2011).
- Picard, M., et al. Mitochondrial structure and function are disrupted by standard isolation methods. PloS One. 6, e18317 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados