Method Article
质谱途径研究蛋白质结构和相互作用的冻干粉
摘要
Here, we present detailed protocols for solid-state amide hydrogen/deuterium exchange mass spectrometry (ssHDX-MS) and solid-state photolytic labeling mass spectrometry (ssPL-MS) for proteins in solid powders. The methods provide high-resolution information on protein conformation and interactions in the amorphous solid-state, which may be useful in formulation design.
摘要
酰胺氢/氘交换(ssHDX-MS)和侧链光解标记(SSPL-MS),接着质谱分析可用于表征蛋白质治疗剂的冻干制剂有价值。标记后跟适当的蛋白水解消化允许蛋白质结构和相互作用被映射用肽级分辨率。因为蛋白质的结构元件由化学键从主链和侧链的氨基酸,原子的氨基酸残基的特定的标签提供洞察蛋白质的结构和构象的网络稳定化。与此相反,以用于研究在冷冻干燥的固体( 例如 ,FTIR),ssHDX-MS和SSPL-MS提供定量和特定于站点的信息的蛋白质的常规方法。氘掺入和动力学参数的程度可以与快速和缓慢交换酰胺池(N 高速 ,N- 慢 ),并直接反映度稀土元素蛋白质折叠和结构在冻干制剂的。稳定光解标签不经历回交换,过ssHDX-MS的优点。这里,我们提供了两种ssHDX-MS和SSPL-MS的详细方案,使用肌红蛋白(MB),为在含有任一海藻糖或山梨糖醇的冻干制剂模型蛋白。
引言
蛋白质类药物是生物制药行业中增长最快的行业,并提供了以前难治性疾病,包括荷尔蒙失调,癌症和自身免疫性疾病1有前途的新的治疗方法。在2012年,全球生物治疗市场达138十亿,预计将达到179十亿由2018年2。蛋白质是更大,比传统的小分子药物比较脆弱,因此更容易受到多种类型降解3。以确保足够的贮存寿命和稳定性,蛋白质药物通常配制为冻干( 即冷冻干燥)固体粉末。然而,蛋白质可能仍然经历降解,在固体状态下,特别是如果冻干过程4,5中,不保留其天然结构。确保该结构被保持是可行的只有,如果有,可在固态与sufficien探测蛋白质构象的分析方法吨分辨率。
核磁共振光谱6和X射线晶体7顷常用高分辨率方法在溶液和结晶固体8评估蛋白质结构。因为赋形剂和所用的加工方法的性质,冻干蛋白质制剂通常非晶态而不是晶态9。均匀性和微观顺序的缺乏使得上述技术不切实际的无定形固体的蛋白质。傅里叶变换红外光谱(FTIR)10,拉曼光谱11和近红外光谱(NIR)12已被经常使用的生物制药行业到蛋白质二级结构在冻干粉末比较于天然溶液态的结构。然而,这些方法是低的分辨率,并且可以仅提供关于二级结构的全球变化的信息。采用FTIR固态结构表征已经表明要么弱13,14或差的15的相关性的长期贮存稳定性。这些局限性强调需要合适的高分辨率的方法来识别在所述固态蛋白质结构扰动。
再加上蛋白水解和质谱分析化学标记已成为一个强大的方法,以在水溶液中监测蛋白质结构和分子间的相互作用。在药物开发,HDX-MS已经被用于表位作图在抗原-抗体相互作用16,17,映射受体药物相互作用18,并监控对蛋白质药物19的构象的翻译后修饰的影响,并比较批与批变异在显影生物仿制药20。同样,可光活化的配体已用于鉴定药物靶标,并确定结合亲和力和药物-受体相互作用21,22特异性。到eXTEND这些方法对冻干制剂中的应用,我们小组已经开发固态氢氘交换质谱(ssHDX-MS)和固态光解贴标质谱(SSPL-MS),以研究蛋白质的构象和相互作用的赋形剂的冻干样品中具有高的分辨率。
在这两种ssHDX-MS和SSPL-MS蛋白质理想的反应条件以冻干的固体下标,并且然后将样品复溶,并用质谱法具有或不具有蛋白水解消化进行分析。 ssHDX-MS提供了关于主链暴露在氘气的信息,而SSPL-MS提供( 图1)上的侧链的环境的信息。这两种方法从而可以提供关于蛋白的构象中的固体状态的补充信息。在这里,我们提供了一个一般协议,用于学习在使用ssHDX-MS和SSPL-MS的冻干的固体蛋白质( 图2),用Mb的作为模型蛋白。我们表明这两种方法的区别与两个不同的赋形剂的制剂的差异的能力。
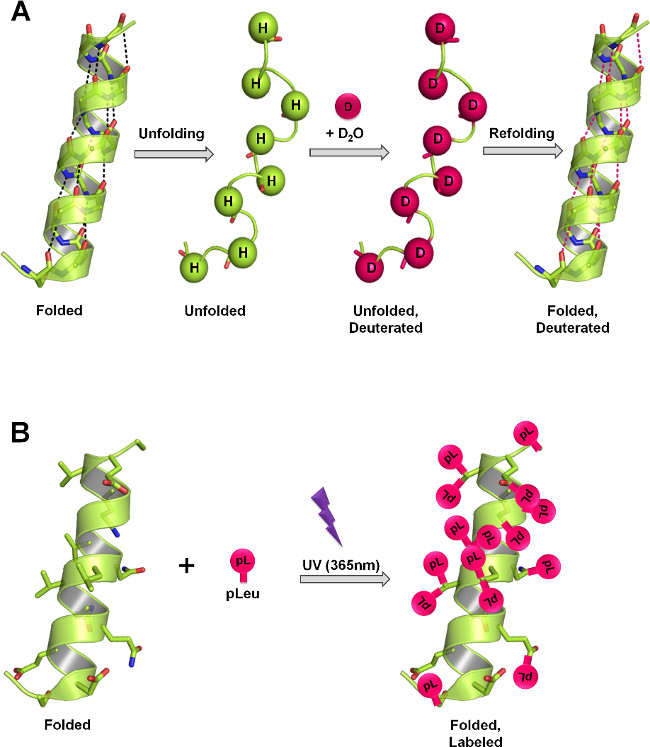
图1:ssHDX和SSPL测量蛋白质结构中,通过不同的标记机制冻干的固体(A)的在HDX,骨干酰胺氢作为蛋白质结构的函数,并且D 2 O中可用的与氘交换。在固态,速率和氘交换的程度取决于D 2 O中的吸附,蛋白质迁移率(解折叠和重折叠事件)和存在于固体基质中的赋形剂的性质的水平。 (b)在PL,紫外线照射在365nm下发起的形成的反应性卡宾从pLeu的diazirine官能团中间体和插入非特异性成任何XH键(X =任何原子),或广告跨C = C键在其附近进行引导。在固态,速率和标签的程度上取决于标记试剂的局部浓度,照射时间,蛋白质结构和存在于固体基质的赋形剂的性质。图A和B显示了可在蛋白质分别发生在主链和侧链的最大理论标签。
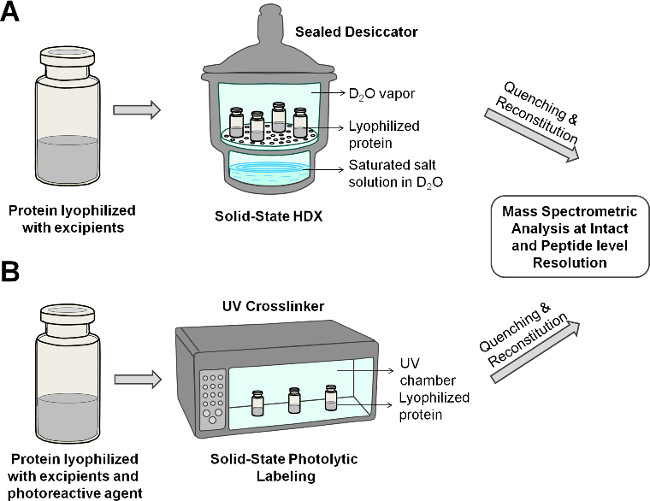
图2:示意图,显示固态HDX-MS(A)和PL-MS(B)的蛋白冻干制剂。
研究方案
1.样品制备和冻干
- 通过0.22μm的无菌过滤透析针对适当的缓冲液和过滤Mb的原液所需体积。
- 制备赋形剂和光亮氨酸的所需体积(L-2-氨基-4,4-阿紫 - 戊酸; pLeu)储备溶液在合适的缓冲液中。过滤该储备溶液通过0.22μm的无菌过滤器。
- 制备的制剂与使用储备溶液的蛋白质,赋形剂pLeu和缓冲示于表1。
- 通过0.22微米的无菌过滤器过滤样品以去除形成在步骤1.3的任何颗粒。分别填写样本为0.2毫升分为2毫升的玻璃小瓶。使用的玻璃小瓶是透明的紫外线(365纳米)的光,以激活pLeu在SSPL-MS的研究。
- 在冻干机负荷小瓶并通过设计一个合适的冻干周期启动冻干。
- 这里,冷冻样品在-40℃,随后通过在-35℃12小时和第二次干燥在25℃下12小时真空下(70毫乇)初级干燥。其它冻干循环和干燥方法( 例如 ,喷雾干燥),也可以使用。
- 回填含封盖前用氮气冻干样品的小瓶。
| 配方 | 组合物(毫克/毫升)冷冻干燥前 | ||||
| MB | 海藻糖 | 山梨糖醇 | pLeuÇ | 钾,磷酸盐,pH 7.4中 | |
| MBT 一 | 1.7 | 3.4 | - | - | 0.4 |
| MBS的 | 1.7 | - | 3.4 | - | 0.4 |
| MBT + pLeu B | 1.7 | 3.4 | - | 14.3×10 -3到1.43 | 0.4 |
| MBS + pLeu B | 1.7 | - | 3.4 | 14.3×10 -3到1.43 | 0.4 |
表1:。的冻干Mb的制剂组合物用于ssHDX-MS 研究中的制剂用于SSPL-MS 研究 B配方C L-2-氨基-4,4- azipentanoic酸或光亮氨酸(pLeu)。 pLeu在五种不同浓度(14.3×10 -3到1.43毫克/毫升)对应于1倍,10倍,20倍,50倍和100倍摩尔过量的相对于Mb的进行共冻干与MBT和MBS的制剂。
2. ssHDX-MS的完整的蛋白质
- 加入K 2 CO 3 200毫升D 2 O中previousl的饱和量(〜440克)ý置于干燥器的下部隔室。密封干燥器气密,并允许它平衡在5℃,直到〜43%达到了稳定的相对湿度(RH)。其它感兴趣的RH值可以通过选择不同的饱和盐溶液23,24来获得。
- 通过将含有在干燥器的上部隔室中的冻干蛋白不封顶的小瓶发起ssHDX反应。密封干燥器气密和孵化在5℃下,以允许HDX发生( 图2A)。
- 收集ssHDX样本在一式三份不同的时间。对于Mb的配方,收集九点的时间点1,2,4,8,16,32,56,92和144小时的样品。
- 从干燥器中排出后,立即盖上小瓶和骤冷通过快速冷冻在液氮中的小瓶的反应。存储小瓶在-80°C,直到质谱分析。
- 使用合适的高分辨率液相色谱 - 质谱spectrom分析样品etry(LC-MS)方法。设计或购买一个合适的冷藏LC系统,以最大限度地减少样品分析回交换。使用列冷冻装置的设置和LC-MS方法以前报道25。
注意:由于酰胺质子交换的速率取决于pH值和温度,在该蛋白质掺入氘核能与存在的氢在流动相("回交换")交换,从而导致信息的丢失。虽然淬火缓冲器和HPLC溶剂的酸性pH值(pH值2.5)可以最小化背交换在很大程度上,降低的温度(≤0℃)通过适当的列的制冷系统的装置可以进一步防止回交换所述蛋白质。 - 连接样品环和蛋白质陷阱,可自动控制脱盐和洗脱过程阀门。通过注入一个TOF低浓度调谐混合到质谱仪中的200-3,200的m / z范围校准质谱仪。固定化胃蛋白酶柱和分析柱不需要用于完整蛋白质的分析。
- 冷藏系统设定温度≤0℃,并等待系统达到〜0℃的稳定工作温度。
- 快速地从-80℃转移样品到液氮中用于质谱分析。使用镊子,小心地撤出液氮每个小瓶,并通过添加含有0.2%甲酸(FA)(pH为2.5)和5%甲醇的水到小瓶冰冷骤冷缓冲液中的特定体积重构样本。
- 编程一个合适的HPLC和使用控制软件质谱法。为Mb的制剂,含有20皮摩尔Mb的蛋白质中的陷阱为1.7分钟,用5%乙腈,95%水和0.1%甲酸(FA),并且洗脱使用梯度脱盐样品提高到80%乙腈,20%水和0.1 %FA在3.3分钟。收集质谱在m / z范围200-3,200。
- 以确定完整的质量蛋白质,获取用于使用步骤2.9的方法的未氘化的蛋白质样品(不经受ssHDX 即蛋白)在水溶液中的数据。
- 通过去卷积利用数据分析软件的原始光谱获取未氘化和氘化样品的质量。这里,设定的质量范围以15,000-18,000道尔顿,质量分辨率为1.0达,和峰高至90%,用于计算兆的质量。
- 通过从氘化蛋白质在每个交换时间点的质量中减去未氘化蛋白质的质量计算在完整蛋白质(此处,MB)掺入氘核的数目。
- 计算百分比氘摄取相对于理论上的最大利用下式(式1)
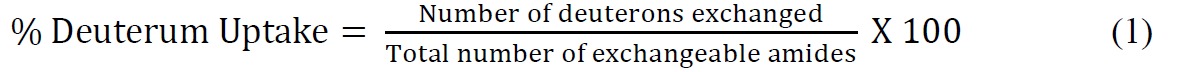
其中总数可交换酰胺=氨基酸总数 - 脯氨酸残基的数目 - 2("2"占N-末端氨基和酰胺氢那经历快速回交换)。 - 使用合适的指数方程拟合ssHDX动力学数据。甲双指数方程(方程2),通常是它提供了一个合理配合到ssHDX数据的最简单的。在这项研究中,对于MBT和MBS,适合数据为双指数模型分配氘核以"快"和"慢"交换池。
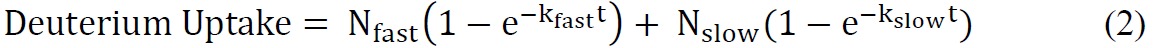
其中N 快和N 慢是可交换酰胺中的数"快"和"慢"分别交换池,和K 快速和k 慢是与两个池相关的一级速率常数。
3. ssHDX-MS用于蛋白质的肽水平
- 通过以下步骤2.1到2.8,并在步骤2.6以下修改进行ssHDX。连接固定胃蛋白酶山坳柱,并分析柱到阀如先前报道25和替换蛋白质陷阱连接到与肽陷阱阀门。通过将质荷比为100〜1700校准质谱仪。
注:在重构步骤(步骤2.8),还原剂和变性剂可以包括在淬火缓冲器,以方便与二硫键( 例如 ,单克隆抗体)的蛋白质的胃蛋白酶消化。 - 编程的适当HPLC和使用控制软件质谱法。为Mb的制剂,消化含有20皮摩尔Mb的样品在线和0.1%的FA,陷阱和脱盐肽中的肽陷阱1.7分钟,用10%乙腈,90%水和0.1%的FA。洗脱的片段上用梯度增加至60%乙腈,40%水和0.1%的FA在4.0分钟的分析柱。获得质谱在m / z范围100-1,700。
- 通过的MS / MS分析鉴定的消化性溃疡片段未氘化蛋白质样品。使用质谱软件中的自定义数据库实验群众肽片段离子进行比较,以预测群众肽片段。设置了大量的分界点( 如 10 ppm的)来确定质量低的错误。对于肽匹配,制备由(i)的肽的序列,(ⅱ)充电状态,以及(iii)保留时间的列表。
- 使用在步骤3.3中产生的列表来映射和确定每个胃蛋白酶消化片段掺入氘核的平均数。这可以通过采用合适的HDX-MS数据分析软件24来实现。
- 要计算百分比氘吸收和适应ssHDX动力学数据为每个消化性溃疡片段,按照步骤2.13和2.14。在这项研究中,HDX动力学数据为每个六个非冗余胃蛋白酶消化片段与MBT和MBS制剂装配到双指数关联模型(等式2)。
4. SSPL-MS的完整临蛋白
- 以开始光解标记反应,第一开关对紫外线交联剂并允许灯预热5分钟。确保UV源配备了波长365nm的灯以激活pLeu的diazirine基。
注意:切勿打开UV交联剂的门时,灯上。保护眼睛和皮肤暴露于UV光,如果源不是由紫外线防护玻璃门封闭。 - 开门前关闭UV交联剂。一旦灯被关闭时,开盖含有冻干制剂的小瓶,并放置在UV交联剂室的内部, 如图2B所示 。照射用UV光在样品40分钟。
- 通过以下步骤4.1到4.3(ⅰ)冻干而不pLeu和(ii)冻干以pLeu样品重新溶解在水样进行对照实验。
- 帽并储存小瓶在-20℃下直到质谱分析。
- Reconstit通过加入质谱级蒸馏水适宜量,以使浓度为2微米UTE的固体样品。
- 开始样品分析,按照步骤2.6和2.9。
注意:由于背交换不是一个问题,共价标记,SSPL-MS不需要特殊冷藏液相色谱系统。 - 为了确定蛋白质的天然质量,取得对于尚未经受SSPL通过以下步骤2.9蛋白质样品的数据。通过去卷积原始光谱如步骤2.11解释获得未标记和标记的样品的质量。
- 使用下列公式计算掺入的pLeu数:
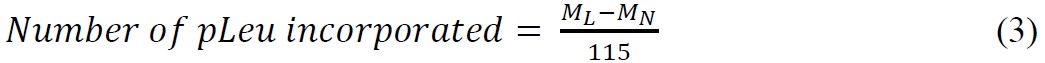
其中,M,L是标记的蛋白质的质量中,M,N是天然蛋白质的质量和115是平均质量(道尔顿)加入到天然蛋白以下单pLeu掺入。注意,标记反应发生在第Ë损失N 2(28大)。 pLeu的单一同位素质量为143.07。 - 计算蛋白质的人群的比例有不同数量的使用峰高的提取离子色谱标签。

其中,"i"表示的标签的数量,PH值i表示峰值高度为标记蛋白L I和PH值u表示未标记的蛋白质的峰高由质谱观测到的。
5. SSPL-MS蛋白质的肽水平
- 通过下面的步骤4.1至4.4执行SSPL。
- 对于肽水平分析,在重组碳酸氢铵缓冲液(100毫米,pH值8.0),固体样品。
- 重构后,混合,用胰蛋白酶标记的蛋白溶液在10:蛋白质对胰蛋白酶1的摩尔比,并培育在60℃下16小时。
- 淬灭反应,加入0.1%的FA在水中的样品,得到最终浓度为2微米的蛋白质。
- 样品环,肽阱和分析柱连接到所述阀连接到HPLC系统。
- 编程一个合适的HPLC和使用控制软件质谱法。为Mb的制剂中,1.5分钟,用5%乙腈,95%水和0.1%的FA注入20皮摩尔经消化的蛋白质的进样环,并脱盐肽中的肽陷阱,随后在与梯度分析柱的洗脱提高至55%乙腈,45%水和0.1%的FA中22分钟。收集质谱在m / z范围100-1,700。
- 准备一个理论质量列表肽pLeu使用在线工具加合物,如ExPASy 26先前从完整蛋白质分析计算pLeu的数字。包括至少4无缘分裂。注意,标记反应发生用的N 2的损失。未标记的尝试。因此,肽 - pLeu加合物的质量=质量PTIC肽+ N(pLeu的质量) - n,其中"n"是掺入pLeu的数目(N的2质量)。
注:如果完整蛋白质的质量分析表明高达蛋白3标记种群,考虑到每肽三种可能pLeu标签。对于1000大的质量肽,肽,pLeu加合物1 pLeu结合的理论质量将是1000 + 1(143) - 1(28)= 1115大。同样地,肽- pLeu的理论质量加合物2 pLeu,3 pLeu 等将是1230道尔顿,1345道尔顿, 等 ,分别。 - 使用质量分析软件,以配合在步骤5.7观察与实验群众中产生的理论质量列表。设置了大量的分界点( 如 50 ppm的)来确定质量低的错误。
- 对于肽匹配,确定使用下步4.8(公式3),其中M L和M N是标有群众公式成立pLeu的实际数量与天然肽,分别为。
结果
这里,ssHDX-MS和SSPL-MS已经被用于研究有关的冻干Mb的地层的构象和固态相互作用的赋形剂的效果。蛋白质和本研究中使用的赋形剂的浓度列于表1中 。由以下的上述协议都得到冻干兆的ssHDX-MS和SSPL-MS分析的代表性结果。
氘在摄取完整的蛋白质水平
ssHDX-MS能够在完整级别Mb的制剂之间进行区分。完整兆以下的配方MBS 144小时ssHDX的解卷积质谱表现出更大的氘摄取比配方MBT( 图3A)。上的平均,MBS表现出更大的46%的氘摄取比MBT( 表2)。
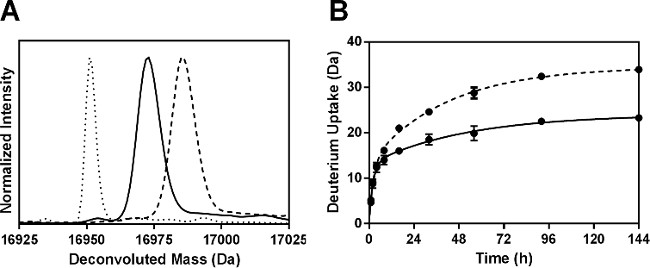
图3:ssHDX-MS的完整兆:氘代完整兆的配方(A)解卷积质谱MBT(实线)和MBS(虚线)下144小时ssHDX的。的未氘化的完整Mb的所述去卷积质谱还示出(虚线)。 (B)的 ssHDX动力学完好Mb的在配方MBT(实线)和MBS(虚线)。 ssHDX的时间过程被安装到一个方程用于使用图形垫Prism软件5.0版本(n = 3时,±SD)的两相的指数相关联。
在氘化动力学完整MBS和MBT是在早期时间点(1-4小时)相似,但MBS表现出上升时间(8-144小时)( 图3B)与增加氘交换。这表明,在较低的相对湿度和温度条件下选择较长的时间点ssHDX的重要性。此外,对D 2 O吸附和扩散过程可能会影响ssHDX率在早期婆整数。我们以前的研究已经表明,在ssHDX湿气吸附是完全在数小时的时期内,并且具有最小的贡献超出这个时间交换动力学。因此,观察到的利率和汇率的程度不是简单的D 2 O中吸附树脂27,28措施。在图3B中的小误差棒,表示来自三个独立ssHDX-MS的样品标准偏差,表明该实验是高度可重复的。
| 氘吸收(%)B | N 高速 Ç | ķ 快速的 C | ñ 慢 Ç | ķ 慢 Ç | |
| MBT 一 | 15.9±0.5 | 13.1(0.8) | 0.43(0.03) | 11.0(0.9) | 0。019(0.001) |
| MBS的 | 23.2±0.5 | 15.4(0.7) | 0.49(0.04) | 19.2(0.6) | 0.024(0.002) |
| %变化ð | 46% | 18% | 14% | 75% | 26% |
表2:在Mb的制剂ssHDX研究氘摄取的定量措施 144小时的HDX后对组合物见表1相对于理论最大值。%的B氘摄取完好Mb的在5℃,43%RH(n = 3时。 ,由ssHDX-MS的动力学数据的非线性回归来确定平均值±标准差)。13 C参数。为完整Mb的氘交换的时间过程被安装在双指数关联模型(等式2)。括号中的数值是回归参数 的标准误差d。在测量的变化百分比分别为演算ated为100×[(值从MBS - 从MBT值)/(值从MBT)。
回归参数 (N 高速 ,N- 慢 ,K 快和k 慢 )为氘摄取动力学为MBT和MBS列于表2。虽然N 高速和N 慢值对于MBS比MBT,在N 慢的差异较大值分别大于在N 快 速值的差异。具体来说,N 高速值在MBS大于MBT只有18%,而N个缓慢的值在MBS大于MBT 75%。这表明,在MBT较小Ñ 慢的值,可能是由于由赋形剂较高保留Mb的结构或保护的酰胺基的那些在MBS暴露于D 2 O中。然而,详细的机制尚不清楚。速率常数(K 快和k 慢 )为两种制剂都非常相似。
氘摄取的肽的水平
下面胃蛋白酶消化,共有52肽进行鉴定。六个对应于Mb的序列100%非冗余片段被用于这里报告的分析。附加信息可以通过使用重叠片段来获得,所报告的我们的先前组24。百分比氘摄取对每种肽进行了计算,并从144小时的样品的结果作图( 图4A)。 HDX动力学为六消化性溃疡片段表明双指数行为( 图4B),用酰胺氢的亚群进行"快"和"慢"交换相一致。
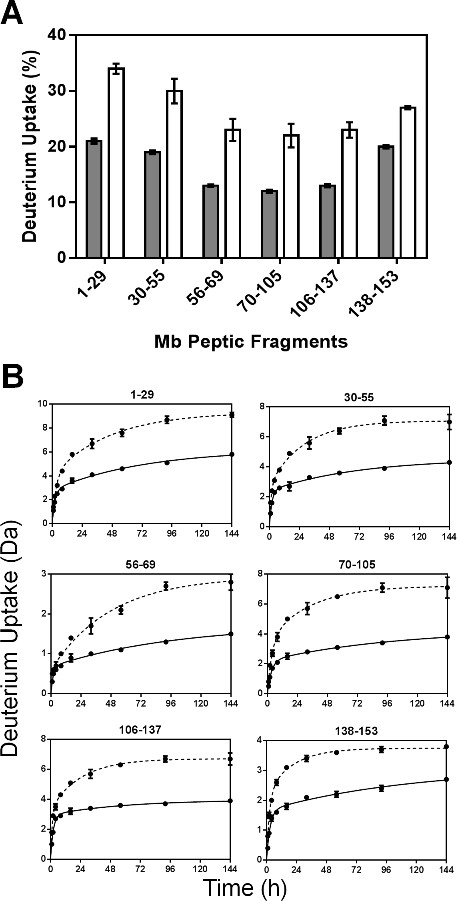
图4:ssHDX-MS甲基溴的肽的水平:(A)百分比氘摄取6非热度从MB的配方ndant消化性溃疡片段MBT(灰色)和MBS(白色)以下的144小时HDX的。 (B)的 ssHDX动力学从Mb的在配方6非冗余消化性溃疡片段MBT(实线)和MBS(虚线)。 ssHDX的时间过程被安装到一个方程用于使用图形垫Prism软件5.0版本(n = 3时,±SD)的两相的指数相关联。
回归参数 对于非冗余的肽示于图5中 ,作为拟合的速率常数的肽片段是不平均速率常数为个别酰胺,所观察到的速率常数为消化性溃疡片段不能被线性相关的那些方法的完整蛋白质。对于大部分的消化性溃疡片段(除了片段56-69)在制剂MBS的N- 快速值均较MBT( 图5A)稍大。同样,第k 快速值一般呈配方设计中区别不大纳秒并在Mb的分子( 图5B)的不同区域。然而,N个慢和k 慢值MBS是显著更大比MBT( 图5C和5D)中的所有片段。于N 缓慢和k为MBS 缓慢的相当大的增加可能反映酰胺基团的更大的流动性,在"慢"交换池。
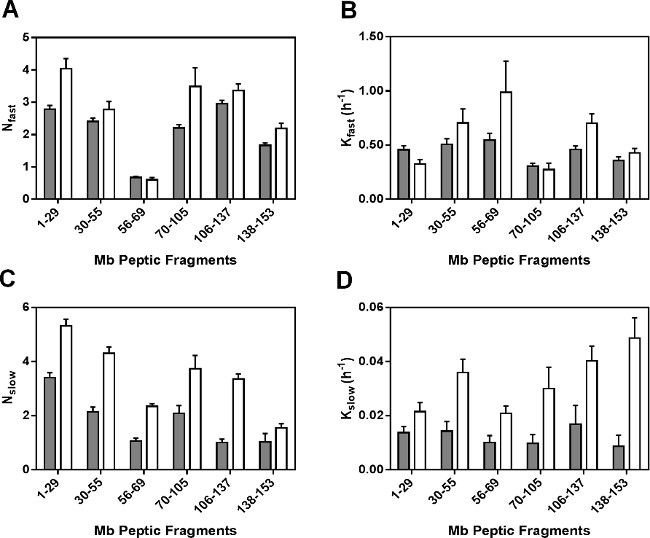
图5:ssHDX动力学参数兆消化道肽:N 快 (A)中,K 快速 (B)中 ,N 慢 (C)和在制剂ķ从ssHDX-MS的动力学数据的非线性回归获得慢 (D)的值从Mb的六个非冗余消化性溃疡肽MBT(灰色)和MBS(白)(N = 3,±SE)。
在完整的蛋白水平光解标签
MB照射的20倍过量pLeu存在下形成的多个兆-pLeu加合物,通过LC-MS( 图6A)所检测。解卷积谱MBT照射40分钟,用20×pLeu表明高达3标签用加入了115,230和345大,以未标记Mb的质量。 MBS与20X照射类似pLeu表现出较少pLeu摄取在完好的级别上,通过LC-MS检测到的最多2标记的种群。
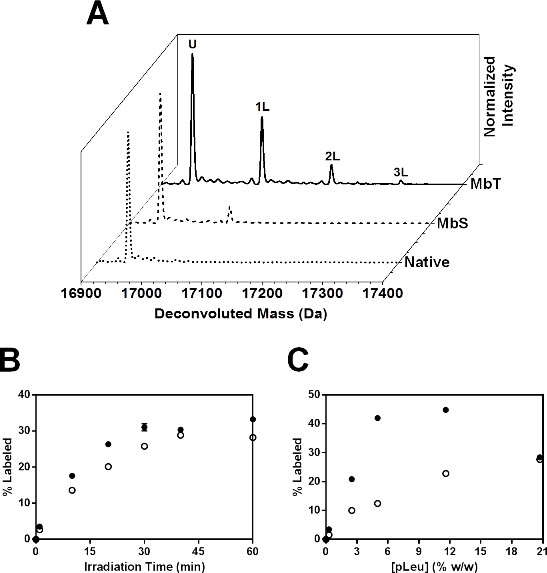
图6:SSPL-MS为完好Mb的:为MBT(实线)和MBS(虚线)标有20倍过量(A) 的解卷积质谱(5%W / W)pLeu。天然MB(兆冻干并照射在没有pLeu的)的解卷积质谱被示为虚线:U 表示蛋白质剩下的照射后未标记的人口。被蛋白携带1,2和3 pLeu标签群分别表示为1L,2L和3L。 (B)的 SSPL-MS的动力学完好Mb的在配方MBT(实心圆)和MBS(空心圆),为pLeu浓度的函数。所有样品均照射40分钟。误差线是符号中。 (C)的 SSPL-MS的动力学完好Mb的在配方MBT(实心圆)和MBS(空心圆),冷冻干燥,照射在100倍过量pLeu存在下(20.7%W / W)作为照射时间的函数。误差线是符号中。
在动力学研究中,标记的蛋白质的百分比成倍增加为MBT和MBS随照射时间( 图6B)。 MBS表现出了较少pLeu摄取比MBT在每个照射时间。这两种制剂出现在40分钟,达到平台期。因此,动力学研究可我们 eful确定需要获得完整pLeu活化照射的持续时间。标记动力学也进行了研究作为pLeu浓度( 图6C)的函数。标记蛋白的百分比随pLeu浓度为MBT和MBS。但是,在20.7%w / w的pLeu,MBT表明在pLeu摄取的减少。这可能是由于排除pLeu从蛋白表面在高pLeu浓度。因此,应该执行具有不同pLeu的浓度的研究,以选择合适的pLeu浓度,允许跨越该蛋白质表面足够标记没有表面排斥。在这项研究中,20倍的超额pLeu被选定为进一步肽层面的研究。
整体下降标签观察MBS表明差侧链无障碍含pLeu矩阵。这是与在山梨糖醇的存在导致降低的标签的构象变化是一致的。
内容">在肽一级光解标签基于完整蛋白质标记研究,20倍过量pLeu被选定在肽水平进行比较MBT和MBS。标记的样品用胰蛋白酶消化,并通过LC-MS进行分析。总共相当于Mb的序列100%40肽检测的主战坦克和MBS的样本。在一些情况下,胰蛋白酶消化可以提供有限的蛋白序列覆盖率如果Lys和/或Arg残基重标记。以提高序列覆盖率,胰蛋白酶和糜蛋白酶的混合物可以用于消化的标记蛋白。
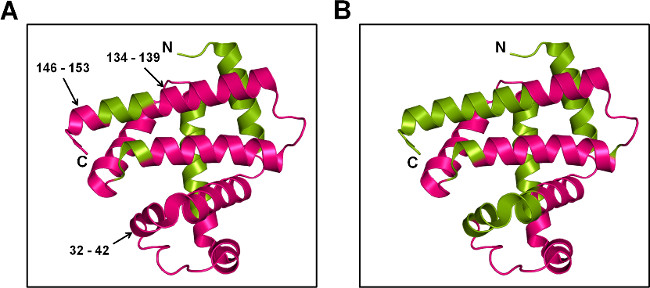
图7:SSPL-MS甲基溴的肽的水平:MB的卡通代表与20倍的超额pLeu(5%W / W)的海藻糖(A)和山梨糖醇(B)的存在标记。所述标记的蛋白质被消化trypsin和标记的肽被映射到Mb的晶体结构(PDB ID 1WLA)。标记和未标记的区域是彩色洋红和绿色分别。
SSPL-MS与胰蛋白酶的消化提供了定性信息有关的肽被标记。定在完整级别的不同标记的种群,pLeu标签和在标记和未标记的肽的电离效率差异的混杂机构时,难以消化后,得到定量的度量SSPL-MS分析。然而,定性信息仍然可以提供洞察肽蛋白水平的构象变化。在这项研究中,既MBT和MBS制剂表现出在大多数蛋白质表面的pLeu摄取。相比,MBS,肽片段32-42,134-139和146-153从MBT表明pLeu标记( 图7)。这表明,侧链这些氨基酸暴露于pLeu,如在这些区域选择性的螺旋NS都完好无损,在MBT矩阵。与此相反,从保护在MBS矩阵pLeu标记是与在这些区域结构扰动一致。
总体上,从ssHDX-MS和SSPL-MS进行的研究结果表明,该方法可以提供有关骨干(ssHDX-MS)和侧链(SSPL-MS)以冻干蛋白质制剂暴露和赋形剂效果互补高分辨率肽级信息。
讨论
一些研究表明,在局部环境冻干样品中影响蛋白质降解5,29,30。但是,建立在固态蛋白质结构和稳定性之间的直接关系一直没有可行由于缺乏高分辨率分析方法。现有的高分辨率的方法,如HDX和PL以冻干粉的应用程序需要的解决方案,细致的数据解释的修改。 HDX-MS和PL-MS相继通过监测蛋白质构象中的固体状态。结果这里提出和其他地方27,28,31-33已经证明这些方法来监测蛋白质构象具有高分辨率的固体环境的能力。虽然在数据分析中的关键步骤不从标记变化在溶液34-36,实验装置和数据解释期间重要的考虑所需的固态CHEMICAL标志。
选择标记试剂必须基于大小和标签的机制。氘的小尺寸允许肽骨架能够容易地探测,而pLeu的相对较大尺寸限制了标签的侧链。既ssHDX和SSPL显示没有偏爱的任何氨基酸,以便标签仅取决于主链和侧链暴露于基质。以有效地探测蛋白质的构象中的固态,影响了标号处理的外部因素,必须仔细控制。总量和标记试剂的冻干固体的空间分布是从水溶液中不同。
在ssHDX,D 2 O中,在固体基质的量可以影响蛋白质的折叠的速率(或部分解折叠),重折叠和氘交换。这是不与溶液的HDX,其中蛋白质样品通常与D 2 O的充足体积稀释的情况下水化对ssHDX率的影响,认真筛选可以告知理想的RH条件的选择。以控制水分吸附的速率和避免粉末在含有吸湿的赋形剂( 例如蔗糖和海藻糖)的制剂塌陷,ssHDX可能在冷藏条件下进行(2-8℃)。我们对水化作用先前的研究显示增加汇率和程度与水分含量增加,符合市场预期。在多我们的工作中,有43%的中间RH下在5℃下的已被证明是理想的,以区分制剂在合理的时间24。该反应通常进行至达到平稳状态。这可确保水分的吸附和扩散到固体不控制在HDX速率。使用小型固体样品的尺寸与≤2毫升预冻干量也有助于确保使D 2 O蒸汽吸附基本完成,在交流期间的早期。虽然ssHDX-MS提供蛋白质在固态的构象的定量信息,在有些情况下数据的解释不能完全基于ssHDX研究单独一定的条件。这可能是一个样品(当与对照相比)中,由于较高的保留的蛋白质结构或显著量蛋白质聚集物存在于样品中的表达减少氘摄取观察到的可能。在这种情况下,ssHDX数据解释需要来自其他互补的方法的结果。在氘化质谱峰宽观察到几MB配方27,28。这可能是由于多种因素,例如部分地折叠蛋白人口,空间异质性的样品中存在,或者在D 2 O中的浓度的空间梯度。但是,这些因素并没有区分在ssHDX-MS,需要进一步调查。
由于SSPL-MS是比较新的,相比其他方法,不断学习AB其应用和限制是必需的。在SSPL,光交叉连接体被冻干的蛋白质。湿气的缺乏限制了组分的流动性的固体基质中,并与在ssHDX水分吸附可能发生的局部结构弛豫现象并非在SSPL。这在SSPL限制标记到光交叉连接体的附近。然而,与HDX-MS的共价标记的蛋白质可提供残级的结构信息的MS / MS分析。由于SSPL标记是共价,不可逆的,背交换不会发生,并且可将样品制备并无需关心标签的损失进行分析。为了方便标记剂的扩散,并提高在固体基质标记效率,SSPL可以与增加%RH下进行。 pLeu摄取,也可以通过增加光反应剂的浓度提高。蛋白与pLeu的摩尔比可以根据需要变化。在一般情况下,一个100倍摩尔过量pLeu的亲蛋白会确保有足够的标签。然而,高pLeu浓度可能导致蛋白质三级结构中的固体基质的损失。因此,除了标识动力学和制剂的组合物,选择pLeu浓度也必须基于维持蛋白质的结构完整性。作为非选择性pLeu标签XH(其中X = C,N,O)基团,它是可能的赋形剂具有类似标记位点能极大地影响蛋白质标记的水平。在pLeu用于蛋白质标记的可用性赋形剂的干扰仍未被表征。已知的是从diazirine活化产生的卡宾不残留特异性,但是一项研究报告偏向天冬氨酸和谷氨酸36。虽然这是很好的了解残余特异性相互作用,肽级信息,也是有用的,并且可以用来设计赋形剂阻断区域与在固体状态下具有高基质曝光。然而,SSPL-MS提供了详细的定性信息,定量数据需要获得和健壮的指标需要开发以分析在各种冷冻干燥系统的制剂的差异。
使用结合MS / MS分析残余物特异性标签可以进一步增强的分辨率的氨基酸的水平。标记试剂如2,3-丁二酮标记精氨酸,对于半胱氨酸赖氨酸和 N -alkylmaleimide衍生物N-羟基衍生物可以用来精确地映射在冻干粉末分子间的相互作用。然而,这些试剂是pH依赖性和反应可能不如良好控制作为固态光解标识。另一种方法是将光致交联剂与使用营养缺陷型细胞系中,位点定向诱变或侧链衍生的蛋白质序列。
我们以前ssHDX-MS和SSPL-MS研究表明蛋白的标记取决于赋形剂的性质和量使用24,27,28,31-33,37,38。兆的ssHDX-MS的共同冻 干用盐酸胍(Gdn.HCl)表现出更大的氘摄取比Mb的共同冻 干的低分子量糖32。在一个单独的SSPL-MS的研究,MB共同冻 干与Gdn.HCl显示,从比兆光解的标签更好的保护与蔗糖33。另外,从ssHDX-MS定量测量已经高度在长期贮存28相关蛋白质的稳定性。这些研究表明,ssHDX蛋白或SSPL反映在冻干粉末中的蛋白质的结构保持的程度。我们认为,二级结构在冻干粉末的保留提供侧链标记与pLeu和从氘交换保护酰胺氢的有利环境。然而,需要来自这些方法的信息内容的详细的比较将在未来进行。虽然建立ssHDX-MS和SSPL-MS的效用作为制剂的筛选工具最终将需要它适用于许多蛋白质,从我们最近的研究结果支持其更广泛地采用。随着进一步的发展,这些方法预期可用于在生物制药行业表征固态蛋白质制剂广泛有用的。
披露声明
The authors declare that they have no competing financial interests.
致谢
The authors gratefully acknowledge financial support from NIH R01 GM085293 (PI: E. M. Topp) and from the College of Pharmacy at Purdue University.
材料
| Name | Company | Catalog Number | Comments |
| Equine myoglobin | Sigma-Aldrich | M0630-5G | |
| D-(+)-Trehalose dihydrate | Sigma Aldrich | #T9531 | |
| D-Sorbitol | Sigma Aldrich | #240850 | |
| L-Photo-leucine | Thermo Scientific | #22610 | |
| Potassium phosphate monobasic | Sigma-Aldrich | #P0662 | |
| Potassium phosphate dibasic | Sigma-Aldrich | #P3786 | |
| Deuterium Oxide | Cambridge Isotope Laboratories | #DLM-4-PK | Alternate (Cat. No.: 151882, Sigma-Aldrich) |
| Immobilized pepsin | Applied Biosystems | #2-3132-00 | |
| Trypsin | Promega | #V511A | Chymotrypsin (Cat. No.: #V1062, Promega) can be additionally used |
| Water, Optima LC/MS grade | Fisher Chemical | #7732-18-5 | |
| Acetonitrile | Sigma-Aldrich | #34998 | |
| Formic acid | Thermo Scientific | #28905 | |
| ESI-TOF Calibrant | Agilent Technologies | #G1969-85000 | Highly flammable liquid |
| Protein microtrap | Michrom Bioresources | TR1/25108/03 | |
| Peptide microtrap | Michrom Bioresources | TR1/25109/02 | |
| Analytical column | Agilent Technologies | Zorbax 300SB-C18 | |
| Freeze dryer | VirTis AdVantage Plus | ||
| Stratalinker equipped with five 365 nm lamps | Stratagene Corp. | Stratalinker 2400 | |
| HPLC | Agilent Technologies | 1200 series LC | Refrigerated LC system for HDX-MS |
| ESI-qTOF MS | Agilent Technologies | 6520 qTOF | |
| HDExaminer (HDX-MS data analysis software) | Sierra Analytics | http://www.massspec.com/HDExaminer.html |
参考文献
- Lawrence, S. Billion dollar babies--biotech drugs as blockbusters. Nat. Biotechnol. 25 (4), 380-382 (2007).
- Global Markets and Manufacturing Technologies for Protein Drugs. , BCC Research. BIO021D(2013).
- Lai, M. C., Topp, E. M. Solid-state chemical stability of proteins and peptides. J. Pharm. Sci. 88 (5), 489-500 (1999).
- Carpenter, J. F., Pikal, M. J., Chang, B. S., Randolph, T. W. Rational design of stable lyophilized protein formulations: some practical advice. Pharm. Res. 14 (8), 969-975 (1997).
- Carpenter, J. F., Chang, B. S., Garzon-Rodriguez, W., Randolph, T. W. Rational design of stable lyophilized protein formulations: theory and practice. Pharm. Biotechnol. 13, 109-133 (2002).
- Wüthrich, K. Protein structure determination in solution by NMR spectroscopy. J. Biol. Chem. 265 (36), 22059-22062 (1990).
- Ilari, A., Savino, C. Protein structure determination by x-ray crystallography. Methods. Mol. Biol. 452, 63-87 (2008).
- Brunger, A. T. X-ray crystallography and NMR reveal complementary views of structure and dynamics. Nat. Struct. Biol. 4, 862-865 (1997).
- Yu, L. Amorphous pharmaceutical solids: preparation, characterization and stabilization. Adv Drug. Deliv. Rev. 48 (1), 27-42 (2001).
- Manning, M. C. Use of infrared spectroscopy to monitor protein structure and stability. Expert. Rev. Proteomics. 2 (5), 731-743 (2005).
- Grohganz, H., Gildemyn, D., Skibsted, E., Flink, J. M., Rantanen, J. Rapid solid-state analysis of freeze-dried protein formulations using NIR and Raman spectroscopies. J. Pharm. Sci. 100 (7), 2871-2875 (2011).
- Bai, S., Nayar, R., Carpenter, J. F., Manning, M. C. Noninvasive determination of protein conformation in the solid state using near infrared (NIR) spectroscopy. J. Pharm. Sci. 94 (9), 2030-2038 (2005).
- Pikal, M. J., et al. Solid state chemistry of proteins: II. The correlation of storage stability of freeze-dried human growth hormone (hGH) with structure and dynamics in the glassy solid. J. Pharm. Sci. 97 (12), 5106-5121 (2008).
- Wang, B., Tchessalov, S., Cicerone, M. T., Warne, N. W., Pikal, M. J. Impact of sucrose level on storage stability of proteins in freeze-dried solids: II. Correlation of aggregation rate with protein structure and molecular mobility. J. Pharm. Sci. 98 (9), 3145-3166 (2009).
- Schule, S., Friess, W., Bechtold-Peters, K., Garidel, P. Conformational analysis of protein secondary structure during spray-drying of antibody/mannitol formulations. Eur. J. Pharm. Biopharm. 65 (1), 1-9 (2007).
- Baerga-Ortiz, A., Hughes, C. A., Mandell, J. G., Komives, E. A. Epitope mapping of a monoclonal antibody against human thrombin by H/D-exchange mass spectrometry reveals selection of a diverse sequence in a highly conserved protein. Protein. Sci. 11 (6), 1300-1308 (2002).
- Coales, S. J., Tuske, S. J., Tomasso, J. C., Hamuro, Y. Epitope mapping by amide hydrogen/deuterium exchange coupled with immobilization of antibody, on-line proteolysis, liquid chromatography and mass spectrometry. Rapid. Commun. Mass. Spectrom. 23 (5), 639-647 (2009).
- Pacholarz, K. J., Garlish, R. A., Taylor, R. J., Barran, P. E. Mass spectrometry based tools to investigate protein-ligand interactions for drug discovery. Chem. Soc. Rev. 41 (11), 4335-4355 (2012).
- Houde, D., Peng, Y., Berkowitz, S. A., Engen, J. R. Post-translational modifications differentially affect IgG1 conformation and receptor binding. Mol. Cell. Proteomics. 9 (8), 1716-1728 (2010).
- Houde, D., Berkowitz, S. A., Engen, J. R. The utility of hydrogen/deuterium exchange mass spectrometry in biopharmaceutical comparability studies. J. Pharm. Sci. 100 (6), 2071-2086 (2011).
- Dorman, G., Prestwich, G. D. Using photolabile ligands in drug discovery and development. Trends. Biotechnol. 18 (2), 64-77 (2000).
- Robinette, D., Neamati, N., Tomer, K. B., Borchers, C. H. Photoaffinity labeling combined with mass spectrometric approaches as a tool for structural proteomics. Expert. Rev. Proteomics. 3 (4), 399-408 (2006).
- Greenspan, L. Humidity fixed points of binary saturated aqueous solutions. Journal of Research of the National Bureau of Standards. 81A (1), 8(1977).
- Sophocleous, A. M., Zhang, J., Topp, E. M. Localized hydration in lyophilized myoglobin by hydrogen-deuterium exchange mass spectrometry. 1. Exchange mapping. Mol. Pharm. 9 (4), 718-726 (2012).
- Keppel, T. R., Jacques, M. E., Young, R. W., Ratzlaff, K. L., Weis, D. D. An efficient and inexpensive refrigerated LC system for H/D exchange mass spectrometry. J. Am. Soc. Mass. Spectrom. 22 (8), 1472-1476 (2011).
- Gasteiger, E., et al. ExPASy: The proteomics server for in-depth protein knowledge and analysis. Nucleic. Acids. Res. 31 (13), 3784-3788 (2003).
- Sophocleous, A. M., Topp, E. M. Localized hydration in lyophilized myoglobin by hydrogen-deuterium exchange mass spectrometry. 2. Exchange kinetics. Mol. Pharm. 9 (4), 727-733 (2012).
- Moorthy, B. S., Schultz, S. G., Kim, S. G., Topp, E. M. Predicting Protein Aggregation during Storage in Lyophilized Solids Using Solid State Amide Hydrogen/Deuterium Exchange with Mass Spectrometric Analysis (ssHDX-MS). Mol. Pharm. 11 (6), 1869-1879 (2014).
- Wang, W. Lyophilization and development of solid protein pharmaceuticals. Int. J. Pharm. 203 (1-2), 1-60 (2000).
- Sarciaux, J. M., Mansour, S., Hageman, M. J., Nail, S. L. Effects of buffer composition and processing conditions on aggregation of bovine IgG during freeze-drying. J. Pharm. Sci. 88 (12), 1354-1361 (1999).
- Li, Y., Williams, T. D., Schowen, R. L., Topp, E. M. Characterizing protein structure in amorphous solids using hydrogen/deuterium exchange with mass spectrometry. Anal. Biochem. 366 (1), 18-28 (2007).
- Sinha, S., Li, Y., Williams, T. D., Topp, E. M. Protein conformation in amorphous solids by FTIR and by hydrogen/deuterium exchange with mass spectrometry. Biophys. J. 95 (12), 5951-5961 (2008).
- Iyer, L. K., Moorthy, B. S., Topp, E. M. Photolytic labeling to probe molecular interactions in lyophilized powders. Mol. Pharm. 10 (12), 4629-4639 (2013).
- Hentze, N., Mayer, M. P. Analyzing protein dynamics using hydrogen exchange mass spectrometry. J. Vis. Exp. (81), e50839(2013).
- Kaltashov, I. A., Bobst, C. E., Abzalimov, R. R. H/D exchange and mass spectrometry in the studies of protein conformation and dynamics: is there a need for a top-down approach. Anal. Chem. 81 (19), 7892-7899 (2009).
- Jumper, C. C., Schriemer, D. C. Mass spectrometry of laser-initiated carbene reactions for protein topographic analysis. Anal. Chem. 83 (8), 2913-2920 (2011).
- Li, Y., Williams, T. D., Topp, E. M. Effects of excipients on protein conformation in lyophilized solids by hydrogen/deuterium exchange mass spectrometry. Pharm. Res. 25 (2), 259-267 (2008).
- Li, Y., Williams, T. D., Schowen, R. L., Topp, E. M. Trehalose and calcium exert site-specific effects on calmodulin conformation in amorphous solids. Biotechnol. Bioeng. 97 (6), 1650-1653 (2007).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。