Method Article
Mass Spectrometric Abordagens para estudar a estrutura das proteínas e interacções em liofilizados Pós
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Here, we present detailed protocols for solid-state amide hydrogen/deuterium exchange mass spectrometry (ssHDX-MS) and solid-state photolytic labeling mass spectrometry (ssPL-MS) for proteins in solid powders. The methods provide high-resolution information on protein conformation and interactions in the amorphous solid-state, which may be useful in formulation design.
Resumo
Amida de hidrogénio / troca de deutério (ssHDX-MS) e da cadeia lateral fotolítica rotulagem (SSPL-MS) seguido de análise por espectrometria de massa pode ser valiosa para a caracterização de formulações liofilizadas de proteínas terapêuticas. Labeling seguido de digestão proteolítica adequado permite que a estrutura das proteínas e interacções a ser mapeada com resolução de nível peptídeo. Uma vez que a proteína de elementos estruturais são estabilizados por uma rede de ligações químicas entre as cadeias principais e cadeias laterais de aminoácidos, de marcação específica dos átomos nos resíduos de aminoácidos fornece informações sobre a estrutura e a conformação da proteína. Em contraste com os métodos de rotina usados para estudar as proteínas liofilizadas em sólidos (por exemplo, FTIR), ssHDX-MS-MS e SSPL fornecer informação quantitativa e específica de sítio. A extensão da incorporação de deutério e parâmetros cinéticos pode ser relacionado com a troca rápida e lentamente piscinas amida (N rápido, lento N) e reflecte directamente os grausree de dobramento de proteínas e estrutura em formulações liofilizadas. Rotulagem photolytic Estável não sofre back-troca, uma vantagem sobre ssHDX-MS. Aqui, nós fornecemos protocolos detalhados para ambos ssHDX-MS e SSPL-MS, utilizando mioglobina (Mb) como uma proteína modelo em formulações liofilizadas contendo trealose ou sorbitol.
Introdução
Drogas de proteína são o setor que mais cresce na indústria biofarmacêutica e oferecer novos tratamentos promissores para doenças antes incuráveis, incluindo distúrbios hormonais, câncer e doenças auto-imunes 1. Em 2012, o mercado mundial biotherapeutics atingiu 138.000 milhões dólar e deve chegar a 179 bilião dólares até o ano de 2018 2. As proteínas são maiores e mais frágil do que convencionais drogas de pequenas moléculas e por isso são mais suscetíveis a muitos tipos de degradação 3. Para assegurar a vida de prateleira e estabilidade adequadas, fármacos de proteína são muitas vezes formuladas como liofilizada (isto é, seco por congelação) pós sólidos. No entanto, uma proteína pode ainda sofrer degradação no estado sólido, particularmente se a sua estrutura nativa não é preservada durante o processo de liofilização 4,5. Assegurando que a estrutura foi mantida só é viável se houver métodos analíticos que podem sondar conformação da proteína no estado sólido com sufficienresolução t.
Espectroscopia de RMN 6 e cristalografia de raios X 7 são os métodos de alta resolução vulgarmente utilizados na avaliação da estrutura da proteína na solução e sólidos cristalinos 8. Devido à natureza dos excipientes e os métodos de processamento utilizadas, formulações de proteínas liofilizadas são geralmente amorfo cristalino em vez de 9. A falta de homogeneidade e de ordem microscópica faz com que as técnicas acima mencionadas impraticável para proteínas em sólidos amorfos. Espectroscopia de infravermelho com transformada de Fourier (FTIR) de 10, a espectroscopia de Raman 11 e espectroscopia de infravermelho próximo (NIR) 12 ter sido regularmente utilizadas pela indústria biofarmacêutica comparar a estrutura secundária da proteína de pós liofilizados para que a estrutura de solução de estado nativo. No entanto, estes métodos são de baixa resolução e só pode fornecer informações sobre as mudanças globais na estrutura secundária. Caracterização estrutural de estado sólido usando FTIRtem mostrado tanto fraco 13,14 ou pobre 15 correlação com a estabilidade de armazenamento a longo prazo. Estas limitações destacam a necessidade de métodos de alta resolução apropriada para identificar perturbações estruturais de proteína no estado sólido.
Marcação química acoplado à proteólise e análise de espectrometria de massa emergiu como uma abordagem poderosa para monitorar a estrutura das proteínas e interacções moleculares em solução aquosa. No desenvolvimento farmacêutico, HDX-MS foi utilizada para o mapeamento de epitopo de interacções antigénio-anticorpo 16,17, para mapear as interacções receptor-fármaco 18, para monitorizar os efeitos de modificações pós-traducionais sobre a conformação da proteína drogas 19, e para comparar variação no desenvolvimento biosimilars 20 de lote para lote. Do mesmo modo, os ligandos fotoactiv�eis têm sido utilizados para identificar alvos de drogas e para determinar a afinidade de ligação e especificidade de interacções receptor-fármaco 21,22. Dedo do péde estado sólido espectrometria xtend a aplicação destes métodos para formulações liofilizadas, o nosso grupo tem desenvolvido massa troca de deutério de hidrogênio (ssHDX-MS) e de estado sólido espectrometria de massa rotulagem photolytic (SSPL-MS) para estudar conformações de proteína e interações do excipiente em amostras liofilizadas com alta resolução.
Em ambos ssHDX-MS-MS e SSPL, a proteína é marcada em condições de reacção ideais em sólidos liofilizados, e as amostras são então reconstituídas e analisados por espectrometria de massa, com ou sem digestão proteolítica. ssHDX-MS fornece informações sobre a exposição da cadeia principal de vapor deutério, enquanto SSPL-MS fornece informações sobre o ambiente de cadeias laterais (Figura 1). Os dois métodos, portanto, pode fornecer informação complementar sobre a conformação da proteína no estado sólido. Aqui, nós fornecemos um protocolo geral para o estudo de proteínas em sólidos liofilizados utilizando ssHDX-MS-MS e SSPL (Figura 2), utilizando como Mbuma proteína modelo. Mostramos a capacidade dos dois métodos para distinguir diferenças em duas formulações com excipientes diferentes.
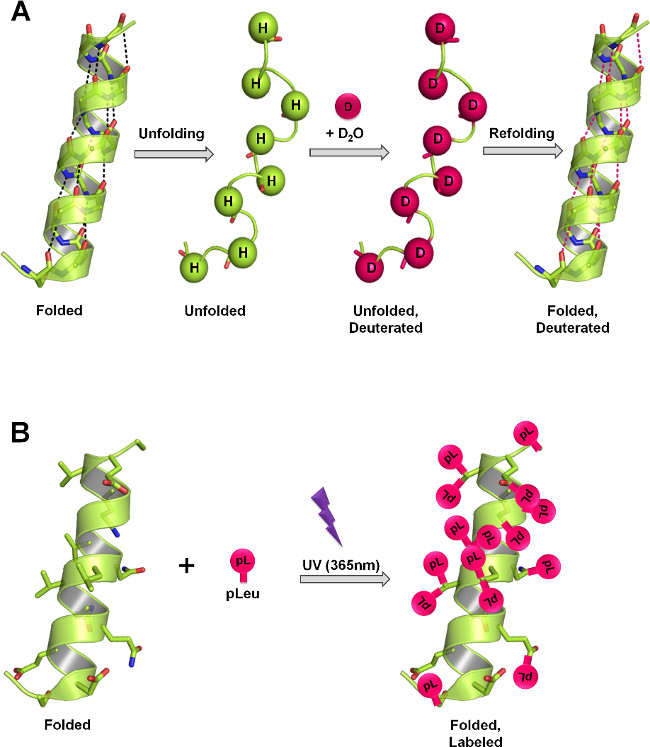
Figura 1:. SsHDX e SSPL estrutura proteica medida em sólidos liofilizados por meio de diferentes mecanismos de rotulagem (A) Em HDX, a espinha dorsal de amida hidrogénios troca com deutério como uma função da estrutura da proteína e D 2 O acessibilidade. No estado sólido, a taxa e extensão de troca de deutério depender do nível de D 2 O sorção, a mobilidade da proteína (desdobramento e redobragem eventos) e da natureza dos excipientes presentes na matriz sólida. (B) Em PL, irradiação UV a 365 nm, inicia a formação de um intermediário reactivo de carbeno do grupo funcional de diazirina pleu e está inserido de forma não específica em qualquer ligação de XH (X = qualquer átomo), ou added através de uma ligação C = C na sua vizinhança imediata. No estado sólido, a velocidade e extensão da marcação depende da concentração local do agente de marcação, o tempo de irradiação, a estrutura da proteína e da natureza dos excipientes presentes na matriz sólida. Os painéis A e B mostram a marcação máxima teórica que pode ocorrer na espinha dorsal e cadeias laterais, respectivamente, na proteína.
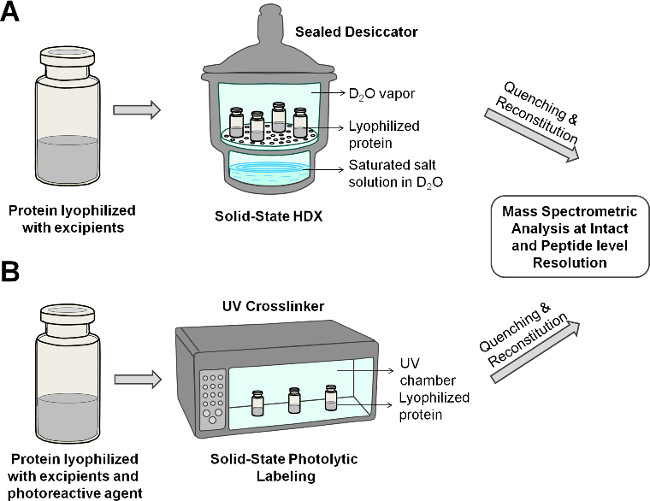
Figura 2: Diagrama esquemático mostrando em estado sólido HDX-MS (A) e PL-MS (B) para a proteína na formulação liofilizada.
Protocolo
1. Preparação da Amostra e liofilização
- Dialisar o volume necessário de uma solução de estoque Mb e contra um tampão apropriado através de um filtro de 0,22 um filtro estéril.
- Preparar o volume necessário de excipientes e foto-leucina (ácido L-2-amino-4,4-azi-pentanóico; pleu) soluções de reserva em tampão adequado. Filtrar as soluções de reserva, através de um filtro estéril de 0,22 um.
- Preparar formulações como mostrado na Tabela 1 utilizando as soluções estoque de proteína, excipientes, pleu, e tampão.
- Amostras de filtrar através de um filtro estéril de 0,22 um para remover as partículas formadas no passo 1.3. Encha as amostras separadamente como 0,2 mL em frascos de vidro de 2 ml. Use frascos de vidro que são transparentes para UV (365 nm) da luz, a fim de ativar pleu nos estudos SSPL-MS.
- Frascos de Carga em um liofilizador e iniciar liofilização através da concepção de um ciclo de liofilização apropriado.
- Aqui, congelar as amostras a -40 ° C, seguidopor secagem primária, sob vácuo (70 mTorr) a -35 ° C durante 12 horas e secagem secundária a 25 ° C durante 12 h. Ciclos de liofilização e de secagem Outros métodos (por exemplo, secagem por pulverização) podem também ser utilizados.
- Backfill os frascos contendo amostras liofilizadas com nitrogênio antes de nivelamento.
| Formulações | Composição (mg / ml) antes da liofilização | ||||
| Mb | A trealose | Sorbitol | pleu c | Potássio, Fosfato, pH 7,4 | |
| MbT um | 1,7 | 3.4 | - | - | 0,4 |
| MBS um | 1,7 | - | 3.4 | - | 0,4 |
| MbT + pleu b | 1,7 | 3.4 | - | 14,3 x 10 -3 a 1,43 | 0,4 |
| MBS + pleu b | 1,7 | - | 3.4 | 14,3 x 10 -3 a 1,43 | 0,4 |
Tabela 1:... Composição de formulações liofilizadas Mb de formulações utilizadas para o estudo ssHDX-MS b Formulações utilizadas para o estudo SSPL-MS c L-2-amino-4,4-azipentanoic ácido ou foto-leucina (pleu). pleu em cinco diferentes concentrações (14,3 x 10 -3 a 1,43 mg / ml) correspondentes a 1x, 10x, 20x, 50x e 100x molar excesso em relação ao Mb foram co-liofilizado com formulações MBT e MBS.
2. ssHDX-MS para proteína intacta
- Adicionar uma quantidade de saturação (~ 440 g) de K 2 CO 3 a 200 ml de D 2 O previously colocados no compartimento inferior de um exsicador. Selar o hermético exsicador e permitir que se equilibre a 5 ° C até uma humidade relativa estável (RH) de ~ 43% é atingido. Outros valores RH de interesse pode ser obtido por selecção de diferentes soluções salinas saturadas 23,24.
- Iniciar reacções ssHDX colocando os frascos não niveladas contendo a proteína liofilizada no compartimento superior do exsicador. Fecha-se o exsicador de ar estanque e incuba-se a 5 ° C para permitir a ocorrência de HDX (Figura 2A).
- Coletar amostras ssHDX em vários momentos, em triplicado. Para formulações Mb, coletar amostras em nove pontos de tempo 1, 2, 4, 8, 16, 32, 56, 92 e 144 h.
- Tapar os frascos imediatamente após a retirada da exsicador e saciar as reações pelo flash de congelamento dos tubos, e em nitrogênio líquido. Armazenar os frascos a -80 ° C até à análise por espectrometria de massa.
- Analisar amostras usando um líquido de alta resolução cromatografia em Mass Spectrom adequadométodo etry (LC-MS). Desenho ou comprar um sistema LC refrigerado adequado para minimizar back-troca durante a análise da amostra. Use a configuração da unidade de coluna de refrigeração e método LC-MS relatado anteriormente 25.
Observação: Uma vez que a taxa de permuta do protão da amida é dependente do pH e da temperatura, dêuterons incorporados na proteína pode trocar com hidrogénio presente na fase móvel ("troca de volta"), provocando uma perda de informação. Apesar de um pH ácido (pH 2,5) de solução tampão de têmpera e solventes de HPLC pode minimizar volta de troca, em grande medida, a redução da temperatura (≤0 ° C) por meio de um sistema de coluna de refrigeração adequado pode proteger ainda mais a proteína de volta de troca . - Ligue o circuito de amostra e de proteína armadilha para a válvula que controla automaticamente o processo de dessalinização e de eluição. Calibra-se o espectrómetro de massa por injecção de uma baixa concentração de sintonização TOF mistura para o espectrómetro de massa na gama de m / z de 200-3,200. A imobilizadacoluna de pepsina e coluna analítica não são necessários para a análise de proteínas intactas.
- Definir a temperatura no sistema de refrigeração para ≤0 ° C e esperar para que o sistema atinja uma temperatura de funcionamento estável de ~ 0 ° C.
- Transferir rapidamente as amostras a partir de -80 ° C em azoto líquido para análise por espectrometria de massa. Usando fórceps, retirar cuidadosamente cada frasco a partir de azoto líquido e reconstituir a amostra por adição de um volume específico de têmpera tampão gelada contendo 0,2% de ácido fórmico (FA) (pH 2,5) e 5% de metanol em água para o frasco.
- Programar uma HPLC adequado e método de espectrometria de massa utilizando o software de controle. Para formulações em Mb, desalt amostra contendo 20 pmol de Mb na armadilha proteína para 1,7 min com 5% de acetonitrilo, 95% de água e 0,1% de ácido fórmico (FA), e eluir utilizando um gradiente de aumento de 80% de acetonitrilo, 20% de água e 0,1 % FA em 3,3 min. Recolha espectros de massa ao longo do intervalo m / z 200-3,200.
- Para determinar a massa de intactaproteína, aquisição de dados para uma amostra undeuterated proteína (isto é, proteína não submetido a ssHDX) em solução aquosa, utilizando o método do passo 2.9.
- Obter as massas de amostras undeuterated e deuteradas por deconvoluting os espectros de matérias-usando software de análise de dados. Aqui, defina o intervalo de massa para 15,000-18,000 Da, a resolução de massa para 1,0 Da, e a altura do pico de 90% para o cálculo da massa de Mb.
- Calcula-se o número de dêuterons incorporados na proteína intacta (aqui, Mb) subtraindo a massa de proteína undeuterated a partir da massa de proteína deuterado em cada ponto de tempo de troca.
- Calcula-se a absorção por cento de deutério em relação à máxima teórica usando a seguinte equação (Equação 1)
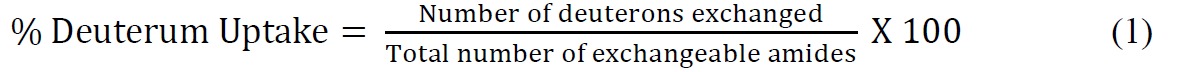
onde número total de amidos trocáveis = número total de aminoácidos - número de resíduos de prolina - 2 ("2" contas do N-grupo terminal amino e amida de hidrogênio que passar por uma rápida volta de câmbio). - Coloque os dados cinéticos ssHDX usando uma equação exponencial adequado. Uma equação bi-exponencial (Equação 2) é geralmente o mais simples que proporciona um ajuste razoável para os dados ssHDX. Neste estudo, para MbT e MBS, ajustar os dados a um modelo bi-exponencial que atribui deuterons para "rápido" e "lento" troca de piscinas.
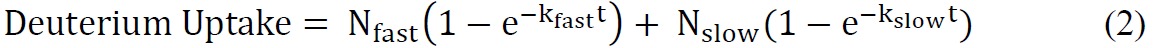
onde N rápido e lento N é o número de amidas permutáveis no "rápido" e "lento" troca de piscinas, respectivamente, e k e k lento rápido são as constantes de velocidade de primeira ordem associada com as duas piscinas.
3. ssHDX-MS para a Proteína Péptido Nível
- Realizar ssHDX seguindo os passos 2.1 a 2.8, com as seguintes modificações na etapa 2.6. Conecte o col pepsina imobilizadaumn coluna analítica e à válvula 25 conforme relatado anteriormente e substituir a armadilha proteína ligada à válvula com uma armadilha de péptido. Calibra-se o espectrómetro de massa, definindo a razão massa por carga que varia de 100 a 1.700.
NOTA: Durante o passo de reconstituição (passo 2.8), um agente redutor e agente desnaturante pode ser incluído no tampão de têmpera para facilitar a digestão da pepsina de proteínas com ligações dissulfureto (por exemplo, anticorpos monoclonais). - Programar um HPLC apropriado e método de espectrometria de massa utilizando o software de controle. Para formulações em Mb, digerir as amostras contendo 20 pmol de Mb em linha com 0,1% FA, interceptar e dessalinizar péptidos para 1,7 min com 10% de acetonitrilo, 90% de água e 0,1% de FA em uma armadilha péptido. Elui-se os fragmentos sobre a coluna analítica com um gradiente de aumento de 60% de acetonitrilo, 40% de água e 0,1% de FA em 4,0 min. Adquirir espectros de massa ao longo do intervalo m / z 100-1,700.
- Identificar os fragmentos pépticas por análise por MS / MS de umundeuterated amostra de proteína. Use software espectrometria de massa para comparar massas experimentais de iões do fragmento péptido às massas previstas de fragmentos peptídicos numa base de dados personalizada. Defina um ponto de massa de corte (por exemplo, 10 ppm) para identificar massas com baixo erro. Para péptidos combinados, preparar uma lista composta por (i) sequência peptídica, (ii) do estado de carga, e (iii) tempo de retenção.
- Use a lista gerada no passo 3.3 para mapear e determinar o número médio de deuterons incorporadas para cada pepsina digerem fragmento. Isto pode ser conseguido empregando HDX-MS software de análise de dados adequado 24.
- Para calcular a porcentagem de deutério absorção e para ajustar os dados cinéticos ssHDX para cada um dos fragmentos pépticas, siga os passos de 2.13 e 2.14. Neste estudo, HDX dados cinéticos para cada um dos seis pepsina não redundante digerir fragmentos a partir de formulações MBT e MBS foram ajustados a um modelo de associação biexponencial (Equação 2).
4. SSPL-MS para Pro Intacttein
- Para iniciar a reacção de marcação photolytic, primeiro ligue o crosslinker UV e permitir que as lâmpadas se aquecer por 5 min. Certifique-se que a fonte de UV está equipado com lâmpadas de comprimento de onda de 365 nm para activar o grupo diazirina de pleu.
CUIDADO: Nunca abra a porta do crosslinker UV quando as luzes estão acesas. Proteja os olhos e pele da exposição à luz UV, se a fonte não é delimitada por uma porta de vidro UV-protetora. - Desligue o crosslinker UV antes de abrir a porta. Uma vez que as lâmpadas estão desligadas, uncap os frascos contendo a formulação liofilizada e colocá-los no interior da câmara de reticulador de UV, como mostrado na Figura 2B. Irradiam-se as amostras com luz UV durante 40 min.
- Realizar experimentos de controle, seguindo passo 4.1 a 4.3 para (i) amostras liofilizadas sem pleu e (ii) amostras liofilizadas com pleu reconstituída em água.
- Cap e armazenar os tubos a -20 ° C até à análise por espectrometria de massa.
- ReconstitUte as amostras sólidas através da adição de um volume adequado de grau espectrometria de massa de água destilada para levar a concentração de 2 uM.
- Para começar a análise da amostra, siga os passos 2.6 e 2.9.
NOTA: Como back-troca não é um problema com a rotulagem covalente, SSPL-MS não requer um sistema especial LC refrigerado. - Para determinar a massa da proteína nativa, aquisição de dados para uma amostra de proteína que não tenha sido submetido a SSPL pelo seguinte passo 2.9. Obter as massas de amostras não marcadas e rotuladas por deconvoluting os espectros cru conforme explicado na etapa 2.11.
- Calcula-se o número de pleu incorporaram com a seguinte fórmula:
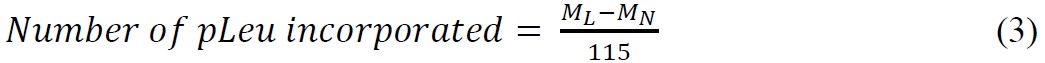
L onde M é a massa de proteína marcada, H N é a massa de proteína nativa e 115 é a média de massa (Da) adicionado a proteína nativa na sequência única incorporação pleu. Note-se que a reacção de marcação ocorre com the perda de N2 (28 Da). A massa monoisotópico de pleu é 143,07. - Calcular as percentagens de populações de proteína com diferentes números de etiquetas utilizando as alturas dos picos a partir dos cromatogramas iónicos extraídos.

onde "i" indica o número de etiquetas, PH i indica a altura do pico de proteína marcada G i e u PH indica a altura do pico da proteína não marcada como observado por espectrometria de massa.
5. SSPL-MS para proteínas ao nível Peptide
- Execute SSPL seguindo os passos 4.1 a 4.4.
- Para a análise de níveis de peptídeo, reconstituir amostras sólidas em tampão de bicarbonato de amónio (100 mM, pH 8,0).
- Após a reconstituição, misturar a solução de proteína marcada com tripsina a 10: 1 razão molar de proteínas de tripsina e incubar a 60 ° C durante 16 horas.
- Extingue-se a reacção por adição de 0,1% de FAem água à amostra para se obter uma concentração final de proteína de 2 uM.
- Ligue o circuito de amostra, armadilha péptido e a coluna analítica a válvula ligada ao sistema HPLC.
- Programar uma HPLC adequado e método de espectrometria de massa utilizando o software de controle. Para formulações em Mb, injectar 20 pmol da proteína digerida no circuito de amostra, e dessalinizar os péptidos em uma armadilha de péptido durante 1,5 min com 5% de acetonitrilo, 95% de água e 0,1% de FA, seguido por uma eluição na coluna analítica com gradiente aumentar para 55% de acetonitrilo, 45% de água e 0,1% de FA em 22 min. Recolha espectros de massa ao longo do intervalo m / z 100-1,700.
- Prepare uma lista massa teórica para peptídeo-pleu adutos usando uma ferramenta online como ExPASy 26 com números de pleu anteriormente calculados a partir da análise de proteínas intactas. Inclua pelo menos 4 perdeu clivagens. Note-se que a reacção de marcação ocorre com a perda de N 2. Por conseguinte, a massa do péptido-pleu aducto = massa da tentativa não marcadopéptido ptic + n (massa de pleu) - n (em massa de N 2), em que "n" é o número de pleu incorporado.
NOTA: Se a análise de massa de proteína intacta apareceu para três populações rotulados de proteína, considere-se a três possíveis rótulos pleu por peptídeo. Para um péptido com a massa de 1,000 Da, a massa teórica de péptido-pleu aducto com 1 pleu incorporação seria 1.000 + 1 (143) - 1 (28) = 1.115 Da. Do mesmo modo, as massas teóricas de péptido-pleu adutos com pleu 2, 3 pleu, etc. seria 1.230 Da, 1.345 Da, etc, respectivamente. - Use o software de análise de massa para coincidir com a lista de massa teórica gerado na etapa 5.7 com as massas observados experimentalmente. Defina um ponto de massa de corte (por exemplo, 50 ppm) para identificar massas com baixo erro.
- Para péptidos combinados, determinar o número real de pleu incorporados utilizando a fórmula abaixo do passo 4.8 (Equação 3), em que M e M L N são as massas de rotuladoe péptido nativo, respectivamente.
Resultados
Aqui, ssHDX-MS e SSPL-MS foram utilizados para estudar o efeito dos excipientes sobre a conformação de estado sólido e interacções de formações Mb liofilizadas. As concentrações de proteína e excipientes utilizados neste estudo são apresentados na Tabela 1. Os resultados representativos das análises de Mb liofilizados obtidos seguindo os protocolos acima são apresentados ssHDX-MS-MS e SSPL.
Captação de deutério a nível proteína intacta
ssHDX-MS é capaz de distinguir entre formulações Mb a nível intacto. Os espectros de massa deconvoluídos de Mb intactas seguintes 144 hr de ssHDX dos MBS formulação mostrou uma maior absorção de deutério de formulação MbT (Figura 3A). Em média, MBS mostrou 46% maior absorção de deutério do que MbT (Tabela 2).
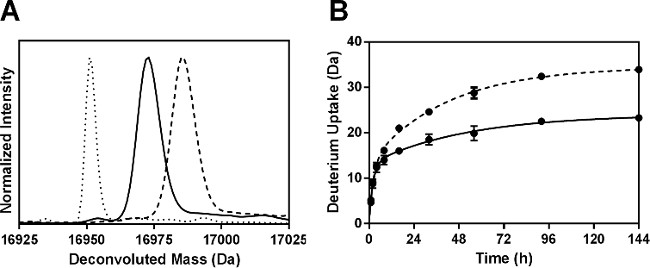
Figura 3: ssHDX-MS para Mb intactas: (A) espectro de massa deconvoluídos de Mb intactas deuteradas de formulações MbT (linha sólida) e MBS (linha tracejada) seguinte 144 hr de ssHDX. O espectro de massa deconvoluídos de Mb intactas undeuterated também é mostrado (linha pontilhada). (B) cinética ssHDX para Mb intactas em formulações MbT (linha sólida) e MBS (linha tracejada). O curso de tempo de ssHDX foi montado a uma equação de duas fases para associação exponencial utilizando o software Graph Pad Prism versão 5 (n = 3, ± DP).
A cinética deuterização para MBS intactas e MbT são semelhantes em momentos iniciais (1-4 h), mas MBS mostraram aumento da troca de deutério com aumento no tempo (8-144 hr) (Figura 3B). Isto sugere a importância de selecionar pontos mais longos de tempo para ssHDX em condições de baixa umidade relativa e temperatura. Além disso, o processo de sorção e a difusão D 2 O podem afectar a taxa de ssHDX no momento po precoceints. Os nossos estudos anteriores mostraram que a adsorção de humidade em ssHDX é completa num período de horas, e tem contribuição mínima para trocar cinética além deste tempo. A taxa observada e medida de troca, por conseguinte, não são simplesmente medidas de adsorção D 2 O 27,28. As pequenas barras de erro na Figura 3B, que indicam os desvios padrão de três amostras independentes ssHDX-MS, mostram que a experiência é altamente reprodutível.
| O deutério Captação (%) b | N rápido c | k rápido c | N lento c | k lento c | |
| MbT um | 15,9 ± 0,5 | 13,1 (0,8) | 0,43 (0,03) | 11,0 (0,9) | 0.019 (0,001) |
| MBS um | 23,2 ± 0,5 | 15,4 (0,7) | 0,49 (0,04) | 19,2 (0,6) | 0,024 (0,002) |
| % Mudança d | 46% | 18% | 14% | 75% | 26% |
Tabela 2:. As medidas quantitativas da absorção de deutério em estudos de formulações ssHDX Mb um Ver Tabela 1 para a composição b Percentagem de deutério em relação a absorção máxima teórica por Mb intactas após 144 horas de HDX a 5 ° C, 43% RH (n = 3. , Parâmetros média ± DP). c determinada por regressão não linear de ssHDX-MS dados cinéticos. Curso de tempo de troca de deutério para Mb intacto foi ajustado para um modelo de associação biexponencial (Eq. 2). Os valores entre parênteses são os erros-padrão dos parâmetros de regressão. A mudança de d por cento em medições foram calculated como 100 x [(valor dos MBS - valor de MbT) / (valor de MbT)].
Os parâmetros de regressão (N rápido, lento N, K rápido e lento k) para cinética do consumo de deutério para MbT e MBS são apresentados na Tabela 2. Embora o n valores rápidas e lentas N são maiores do que para MBS MbT, diferenças na N lento valores foram maiores do que as diferenças nos valores rápidos N. Especificamente, o valor rápido N é apenas 18% maior em MBS do que em MbT, enquanto o valor lento N é 75% maior do que em MBs em MbT. Isto sugere que os valores mais pequenos de N lentas em MbT pode ser devido a uma maior retenção de estrutura ou protecção de grupos amida Mb por excipientes que são expostos a D 2 O em MBS. No entanto, os mecanismos detalhados não são claramente compreendidas. As constantes de velocidade (K rápido e K lento) para ambas as formulações são muito semelhantes.
captação deutério no nível peptídeo
Após a digestão pepsina, foram identificados um total de 52 peptídeos. Seis fragmentos não redundantes correspondentes a 100% da sequência Mb foram utilizados para a análise aqui relatada. Informações adicionais podem ser obtidas através da utilização fragmentos sobrepostos, como relatado anteriormente pelo nosso grupo 24. A absorção por cento deutério para cada péptido foi calculada e os resultados de 144 amostras hr plotados (Figura 4A). Cinética HDX para os seis fragmentos pépticas apresentaram comportamento bi-exponencial (Figura 4B), em consonância com as subpopulações de hidrogênios amida submetidos "rápido" e "lento" de câmbio.
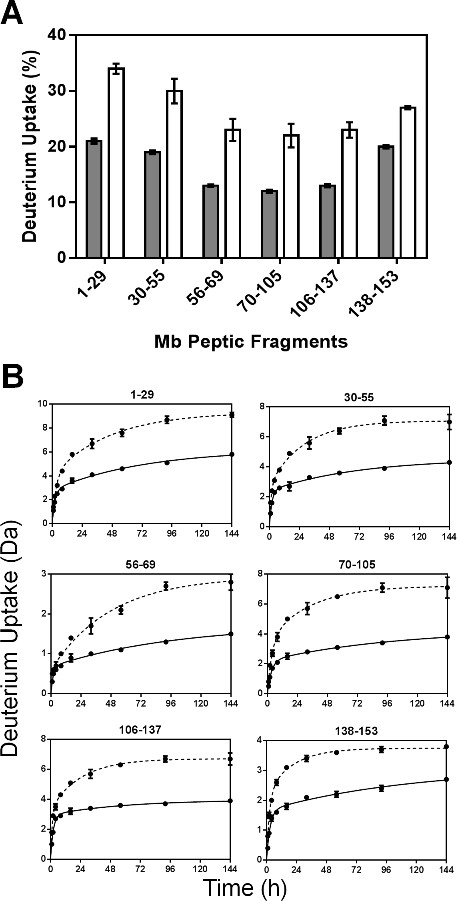
Figura 4: ssHDX-MS para Mb péptido ao nível: (A) A absorção de deutério para 6 por cento não redufragmentos pépticas ndant de Mb em formulações MbT (cinza) e MBS (branco), após 144 horas de HDX. cinética (B) ssHDX para seis fragmentos pépticas não redundantes de Mb em formulações MbT (linha sólida) e MBS (linha pontilhada). O curso de tempo de ssHDX foi montado a uma equação de duas fases para associação exponencial utilizando o software Graph Pad Prism versão 5 (n = 3, ± DP).
Os parâmetros de regressão para os péptidos não redundantes são apresentados na Figura 5. Tal como as constantes de velocidade equipadas para fragmentos peptídicos não são a constante de taxa média para as amidas individuais, as constantes de velocidade observadas para os fragmentos pépticas podem não ser linearmente relacionado com aqueles para a proteína intacta. Os valores de N para a mais rápida dos fragmentos pépticas (excepto fragmento 56-69) em formulações MBS foram ligeiramente maiores do que aqueles em MbT (Figura 5A). Da mesma forma, os valores de k rápidas geralmente mostrou pouca diferença entre formulations e em diferentes regiões da molécula Mb (Figura 5B). No entanto, os valores de k e lentas lentas N para MBS são significativamente maiores do que em todos os fragmentos de MbT (Figura 5C e 5D). O aumento considerável de N k lento e lento para MBS pode refletir uma maior mobilidade dos grupos amida nos "lentos" trocando piscinas.
Figura 5: parâmetros cinéticos ssHDX para MB peptídeos pépticas: N rápido (A), k rápido (B), N lenta (C) e os valores de k lentas (D) obtido a partir de regressão não-linear de ssHDX-MS dados cinéticos para seis péptidos pépticas não redundantes de Mb em formulações MbT (cinzento) e MBS ( branco) (n = 3, ± SE).
Rotulagem fotolítica a nível proteína intacta
Mb irradiada na presença de excesso de 20x pleu formado múltiplos Mb-pleu aductos, conforme detectado por LC-MS (Figura 6A). Os espectros deconvoluídos para MbT irradiado por 40 min com 20x pleu mostrou até 3 etiquetas com a adição de 115, 230 e 345 Da à massa de Mb não marcados. MBS irradiados de forma semelhante com 20x pleu apresentaram menor absorção pleu ao nível intacto, com até 2 populações marcadas detectadas por LC-MS.
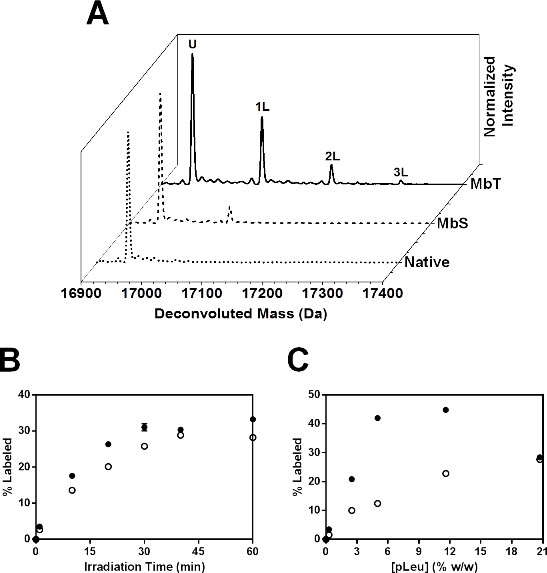
Figura 6: SSPL-MS para Mb intactos: (A) os espectros de massa para deconvoluídos MbT (linha sólida) e MBS (linha a tracejado) marcadas com excesso de 20x (5% w / w) pleu. Espectro de massa de deconvoluídos Mb nativa (Mb liofilizada e irradiada na ausência de pleu) é mostrado como a linha pontilhada. U indica a uma população de proteínas que permanece não marcado após a irradiação. Populações de proteína de transporte 1, 2 e 3 rótulos pleu são representados como 1L, 2L e 3L respectivamente. cinética (B) SSPL-MS para Mb intactas em formulações MbT (círculos fechados) e MBS (círculos abertos) em função da concentração pleu. Todas as amostras foram irradiadas durante 40 min. As barras de erro estão dentro dos símbolos. (C) uma cinética SSPL-MS para Mb intactas em formulações MbT (círculos fechados) e MBS (círculos abertos), liofilizadas e irradiadas na presença de excesso de 100x pleu (20,7% w / w), como uma função do tempo de irradiação. As barras de erro estão dentro dos símbolos.
Em estudos cinéticos, a percentagem de proteína rotulada aumentou exponencialmente para ambos MbT MBS e com o aumento do tempo de irradiação (Figura 6B). MBS apresentaram menor absorção pleu que MbT em cada tempo de irradiação. Ambas as formulações apareceu para chegar a um platô a 40 min. Assim, um estudo cinético pode ser nós eful para determinar a duração da irradiação necessário para se obter a activação completa pleu. Cinética de rotulagem também foram estudados como uma função da concentração de pleu (Figura 6C). A porcentagem de proteína marcada aumentou com a concentração pleu tanto para MbT e MBS. No entanto, a 20,7% w / w pleu, MbT mostraram uma diminuição na absorção de pleu. Isto pode ser devido à exclusão de pleu a partir da superfície da proteína a uma concentração elevada pleu. Assim, um estudo com variação de concentração de pleu deve ser realizado para seleccionar a concentração pleu adequado para permitir que suficiente para rotulagem através da superfície da proteína, sem a exclusão de superfície. Neste estudo, o excesso de 20x pleu foi seleccionado para estudos posteriores de nível de péptido.
O total diminuiu rotulagem observado para MBS sugere má acessibilidade de cadeia lateral para a matriz contendo pleu. Isto é consistente com uma mudança conformacional na presença de sorbitol que resulta em reduzida rotulagem.
content "> rotulagem fotolíticas ao nível peptídeoCom base nos estudos de marcação de proteínas intactas, 20x excesso pleu foi seleccionado para comparar MbT e MBS ao nível péptido. As amostras marcadas foram digeridos com tripsina e analisada por LC-MS. Um total de 40 péptidos correspondentes a 100% da sequência Mb foram detectadas por amostras MBT e MBS. Em alguns casos, a digestão tríptica pode fornecer cobertura sequência de proteína se limitado Lys e / ou os resíduos Arg estão fortemente marcado. Para melhorar a cobertura da sequência, uma mistura de tripsina e quimotripsina pode ser utilizado para digerir a proteína marcada.
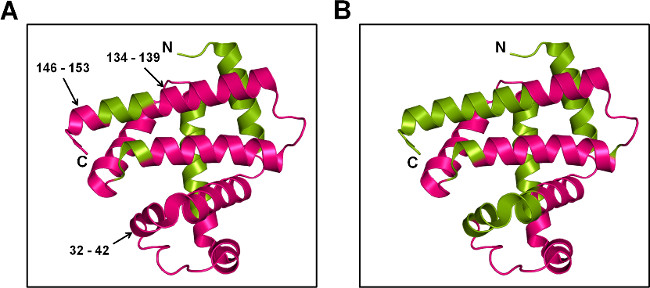
Figura 7: SSPL-MS para Mb a nível péptido: representação dos desenhos animados de Mb marcado com excesso de 20x pleu (5% w / w) na presença de trealose (A) e sorbitol (B). A proteína marcada foi digerido com trypsin e peptídeos marcados foram mapeadas para a estrutura de cristal de Mb (PDB ID 1WLA). As regiões marcadas e não marcadas são de cor magenta e verde, respectivamente.
SSPL-MS com a digestão de tripsina fornece informações qualitativas sobre os peptídeos ser rotulado. Tendo em conta as diferentes populações marcadas a nível intacta, o mecanismo promíscuo de rotulagem e diferenças na eficiência de ionização de peptídeos marcados e não marcados pleu, é difícil obter uma medida quantitativa para SSPL-MS após digestão. No entanto, a informação qualitativa ainda pode fornecer informações sobre mudanças de conformação de proteínas a nível peptídeo. Neste estudo, as formulações tanto MBT e MBS mostrou pleu captação em quase toda a superfície da proteína. Quando comparado com MBS, fragmentos de péptidos 32-42, 134-139 e 146-153 a partir MbT mostrou marcação pleu (Figura 7). Isto sugere que as cadeias laterais destes aminoácidos são expostas a pleu, como as hélices nestes regions estão intactos na matriz MbT. Em contraste, a protecção de rotulagem pleu na matriz MBS é consistente com perturbações estruturais nestas regiões.
No geral, os resultados de ssHDX-MS-MS e SSPL sugerem que os métodos podem proporcionar informação complementar de alta resolução, sobre os níveis de peptídeo espinha dorsal (ssHDX-MS) e da cadeia lateral (SSPL-MS) e exposição do excipiente efeitos em formulações de proteínas liofilizadas .
Discussão
Vários estudos têm sugerido que o ambiente local em amostras liofilizadas afecta a degradação da proteína 5,29,30. No entanto, o estabelecimento de uma relação directa entre a estrutura da proteína e estabilidade no estado sólido não tem sido possível, devido à falta de métodos analíticos de alta resolução. A aplicação de métodos de alta resolução já existentes, como HDX e PL para pós liofilizados requer a modificação de protocolos de solução e interpretação de dados cuidadosa. HDX-MS e PL-MS foram sucessivamente adoptadas para monitorar conformações de proteínas no estado sólido. Os resultados apresentados aqui e noutros lugares 27,28,31-33 demonstraram a capacidade destes métodos para controlar a conformação da proteína com alta resolução no ambiente sólido. Embora as etapas críticas na análise de dados não variam de rotulagem em solução 34-36, considerações importantes durante a configuração experimental e interpretação dos dados são necessários para o químico de estado sólidorotulagem cal.
A selecção do reagente de marcação deve ser baseada no tamanho e mecanismo de rotulagem. O pequeno tamanho de deutério permite que o esqueleto peptídico a ser sondado facilmente, ao passo que o tamanho relativamente maior de pleu limita rotulagem para as cadeias laterais. Ambos ssHDX SSPL e não mostram nenhuma preferência por qualquer aminoácido, de modo que a rotulagem depende apenas da espinha dorsal e cadeias laterais de exposição à matriz. Para sondar efetivamente conformações de proteínas em estado sólido, os fatores externos que afetam o processo de rotulagem deve ser cuidadosamente controlada. O montante total e da distribuição espacial de agente de marcação em sólidos liofilizados é diferente a partir de soluções aquosas.
Em ssHDX, a quantidade de D 2 O na matriz sólida pode afectar a taxa de desdobramento da proteína (ou desdobramento parcial), redobragem, e troca de deutério. Este não é o caso com solução HDX, em que a amostra de proteína é normalmente diluída com um amplo volume de D 2 O.Rastreio cuidadoso dos efeitos de hidratação na taxa ssHDX pode informar a selecção das condições ideais RH. Para controlar a taxa de humidade de sorção e evitar o colapso do pó em formulações contendo excipientes higroscópicas (por exemplo sacarose e trealose), ssHDX pode ser realizado sob condições de refrigeração (2-8 ° C). Nosso estudo anterior sobre os efeitos de hidratação mostrou velocidade e extensão da troca aumentou com o aumento do teor de umidade, como esperado. Em grande parte do nosso trabalho, um RH intermediário de 43% a 5 ° C provou ser ideal para distinguir formulações em um tempo razoável 24. A reacção é geralmente levada a cabo até um patamar é atingido. Isso garante que a sorção de umidade e difusão para o sólido não controlam a taxa HDX. A utilização de tamanhos de amostra pequenos sólidos com um volume pré-liofilização de ≤2 ml também ajuda a assegurar que a D 2 O sorção de vapor é essencialmente completa no início do período de intercâmbio. Embora ssHDX-MS ofereceInformação quantitativa sobre a conformação da proteína no estado sólido, há certas condições em que a interpretação de dados não podem ser inteiramente feitos apenas com o estudo ssHDX. É possível que a absorção de deutério diminuição observada em uma amostra (quando comparado com o controlo), pode ser devido a uma maior retenção de estrutura de proteína ou a montante significativo de agregados de proteínas presentes na amostra. Em tal caso, a interpretação de dados ssHDX requer resultados de outros métodos complementares. Ampliação Peak no espectro de massa deuterado foi observado para várias formulações Mb 27,28. Isto pode ser devido a vários factores, tais como a presença da população de proteína parcialmente desdobrada, a heterogeneidade espacial na amostra, ou os gradientes espaciais na concentração de D 2 O. No entanto, esses fatores não foram distinguidos em ssHDX-MS e precisa de uma investigação mais aprofundada.
Como SSPL-MS é relativamente novo, quando comparado com outros métodos, a aprendizagem contínua abas suas aplicações e limitações é necessário. Em SSPL, o foto-reticulante é liofilizada com a proteína. A falta de humidade limita a mobilidade dos componentes no interior da matriz sólida, e a relaxação estrutural parcial que pode ocorrer com a adsorção de humidade em ssHDX não é um fenómeno em SSPL. Isso limita a rotulagem em SSPL à vizinhança imediata da foto-cross-ligante. No entanto, ao contrário de HDX-MS, análise por MS / MS da proteína covalentemente marcada pode fornecer informações sobre a estrutura de nível resíduo. Desde rotulagem SSPL é covalente e irreversível, de volta de câmbio não ocorre e as amostras podem ser preparadas e analisadas sem se preocupar com a perda de rótulo. Para facilitar a difusão do agente de marcação e melhorar a eficiência de marcação em forma sólida de matriz, SSPL pode ser realizada com o aumento da% de HR. pleu captação também pode ser melhorada aumentando a concentração do agente fotor reactivo. A razão molar da proteína de pleu pode ser variada como desejado. Em geral, um excesso molar de 100 vezes de pró pleutein irá garantir uma rotulagem adequada. No entanto, de alta concentração pleu pode resultar em perda da estrutura terciária de proteína na matriz sólida. Assim, em adição à cinética de rotulagem e composição das formulações, a selecção de pleu concentração deve basear-se também a manutenção da integridade estrutural da proteína. Como pleu não selectiva etiquetas XH (em que X = C, N, O), é possível que os excipientes semelhantes com sítios de rotulagem podem afectar grandemente o grau de marcação da proteína. A interferência dos excipientes na disponibilidade de pleu para marcação de proteínas é ainda a ser caracterizado. Sabe-se que o gerado a partir de carbeno activação diazirina resíduo não é específica, no entanto, um estudo relata tendência para Asp e Glu 36. Embora seja bom para aprender sobre interacções específicas de resíduos, as informações-péptido nível também é útil e pode ser utilizado para desenhar excipientes para bloquear regiões com elevada exposição a matriz no estado sólido. SSPL-MS fornece informação qualitativa detalhada, porémquantitativa dos dados tem de ser obtido e métricas robustos precisa ser desenvolvido para analisar as diferenças de formulação através de uma variedade de sistemas liofilizados.
O uso de uma etiqueta específica do resíduo combinado com análise por MS / MS pode aumentar ainda mais a resolução ao nível de aminoácidos. Reagentes de marcação, tais como 2,3-butanodiona para rotular Arg, derivados de N-hidroxissuccinimida e N para Lys derivados -alkylmaleimide para Cys pode ser utilizado para mapear precisamente interacções moleculares em pó liofilizada. No entanto, estes reagentes são dependentes do pH e as reacções podem não ser tão bem controlado como rotulagem fotolítica no estado sólido. Uma abordagem alternativa consiste em incorporar o foto-reticulante para a sequência de proteína com a utilização de linhas de células auxotróficas, mutagénese dirigida ao local ou cadeia lateral de derivatização.
Nossos estudos anteriores ssHDX-MS e SSPL-MS mostraram que a marcação da proteína depende da natureza e quantidade de excipientesusado 24,27,28,31-33,37,38. ssHDX-MS de Mb co-liofilizado com guanidina (Gdn.HCl) mostrou uma maior absorção de deutério do que Mb co-liofilizado com baixo peso molecular 32 açúcares. Em um estudo SSPL-MS separado, Mb co-liofilizado com Gdn.HCl apresentaram maior proteção contra rotulagem photolytic que Mb com sacarose 33. Além disso, medições quantitativas de ssHDX-MS foram altamente correlacionada com a estabilidade da proteína durante a armazenagem de longo prazo 28. Estes estudos sugerem que ssHDX ou SSPL de proteína reflete a extensão da retenção estrutural da proteína em pó liofilizada. Acreditamos que a manutenção da estrutura secundária em pó liofilizado fornece ambiente favorável para a rotulagem cadeia lateral com pleu e proteção de amida de hidrogênio a partir de troca de deutério. No entanto, a comparação detalhada do conteúdo informativo a partir destes métodos tem de ser realizado no futuro. Embora institui a utilidade de ssHDX-MS e SSPL-MScomo ferramenta de triagem formulação acabará por exigir que ele seja aplicado a muitas proteínas, os resultados de nossos estudos recentes apoia a sua adoção mais ampla. Com a continuação do desenvolvimento, estes métodos deverão ser amplamente útil para a caracterização de formulações de proteínas de estado sólido na indústria biofarmacêutica.
Divulgações
The authors declare that they have no competing financial interests.
Agradecimentos
The authors gratefully acknowledge financial support from NIH R01 GM085293 (PI: E. M. Topp) and from the College of Pharmacy at Purdue University.
Materiais
| Name | Company | Catalog Number | Comments |
| Equine myoglobin | Sigma-Aldrich | M0630-5G | |
| D-(+)-Trehalose dihydrate | Sigma Aldrich | #T9531 | |
| D-Sorbitol | Sigma Aldrich | #240850 | |
| L-Photo-leucine | Thermo Scientific | #22610 | |
| Potassium phosphate monobasic | Sigma-Aldrich | #P0662 | |
| Potassium phosphate dibasic | Sigma-Aldrich | #P3786 | |
| Deuterium Oxide | Cambridge Isotope Laboratories | #DLM-4-PK | Alternate (Cat. No.: 151882, Sigma-Aldrich) |
| Immobilized pepsin | Applied Biosystems | #2-3132-00 | |
| Trypsin | Promega | #V511A | Chymotrypsin (Cat. No.: #V1062, Promega) can be additionally used |
| Water, Optima LC/MS grade | Fisher Chemical | #7732-18-5 | |
| Acetonitrile | Sigma-Aldrich | #34998 | |
| Formic acid | Thermo Scientific | #28905 | |
| ESI-TOF Calibrant | Agilent Technologies | #G1969-85000 | Highly flammable liquid |
| Protein microtrap | Michrom Bioresources | TR1/25108/03 | |
| Peptide microtrap | Michrom Bioresources | TR1/25109/02 | |
| Analytical column | Agilent Technologies | Zorbax 300SB-C18 | |
| Freeze dryer | VirTis AdVantage Plus | ||
| Stratalinker equipped with five 365 nm lamps | Stratagene Corp. | Stratalinker 2400 | |
| HPLC | Agilent Technologies | 1200 series LC | Refrigerated LC system for HDX-MS |
| ESI-qTOF MS | Agilent Technologies | 6520 qTOF | |
| HDExaminer (HDX-MS data analysis software) | Sierra Analytics | http://www.massspec.com/HDExaminer.html |
Referências
- Lawrence, S. Billion dollar babies--biotech drugs as blockbusters. Nat. Biotechnol. 25 (4), 380-382 (2007).
- Global Markets and Manufacturing Technologies for Protein Drugs. , BCC Research. BIO021D(2013).
- Lai, M. C., Topp, E. M. Solid-state chemical stability of proteins and peptides. J. Pharm. Sci. 88 (5), 489-500 (1999).
- Carpenter, J. F., Pikal, M. J., Chang, B. S., Randolph, T. W. Rational design of stable lyophilized protein formulations: some practical advice. Pharm. Res. 14 (8), 969-975 (1997).
- Carpenter, J. F., Chang, B. S., Garzon-Rodriguez, W., Randolph, T. W. Rational design of stable lyophilized protein formulations: theory and practice. Pharm. Biotechnol. 13, 109-133 (2002).
- Wüthrich, K. Protein structure determination in solution by NMR spectroscopy. J. Biol. Chem. 265 (36), 22059-22062 (1990).
- Ilari, A., Savino, C. Protein structure determination by x-ray crystallography. Methods. Mol. Biol. 452, 63-87 (2008).
- Brunger, A. T. X-ray crystallography and NMR reveal complementary views of structure and dynamics. Nat. Struct. Biol. 4, 862-865 (1997).
- Yu, L. Amorphous pharmaceutical solids: preparation, characterization and stabilization. Adv Drug. Deliv. Rev. 48 (1), 27-42 (2001).
- Manning, M. C. Use of infrared spectroscopy to monitor protein structure and stability. Expert. Rev. Proteomics. 2 (5), 731-743 (2005).
- Grohganz, H., Gildemyn, D., Skibsted, E., Flink, J. M., Rantanen, J. Rapid solid-state analysis of freeze-dried protein formulations using NIR and Raman spectroscopies. J. Pharm. Sci. 100 (7), 2871-2875 (2011).
- Bai, S., Nayar, R., Carpenter, J. F., Manning, M. C. Noninvasive determination of protein conformation in the solid state using near infrared (NIR) spectroscopy. J. Pharm. Sci. 94 (9), 2030-2038 (2005).
- Pikal, M. J., et al. Solid state chemistry of proteins: II. The correlation of storage stability of freeze-dried human growth hormone (hGH) with structure and dynamics in the glassy solid. J. Pharm. Sci. 97 (12), 5106-5121 (2008).
- Wang, B., Tchessalov, S., Cicerone, M. T., Warne, N. W., Pikal, M. J. Impact of sucrose level on storage stability of proteins in freeze-dried solids: II. Correlation of aggregation rate with protein structure and molecular mobility. J. Pharm. Sci. 98 (9), 3145-3166 (2009).
- Schule, S., Friess, W., Bechtold-Peters, K., Garidel, P. Conformational analysis of protein secondary structure during spray-drying of antibody/mannitol formulations. Eur. J. Pharm. Biopharm. 65 (1), 1-9 (2007).
- Baerga-Ortiz, A., Hughes, C. A., Mandell, J. G., Komives, E. A. Epitope mapping of a monoclonal antibody against human thrombin by H/D-exchange mass spectrometry reveals selection of a diverse sequence in a highly conserved protein. Protein. Sci. 11 (6), 1300-1308 (2002).
- Coales, S. J., Tuske, S. J., Tomasso, J. C., Hamuro, Y. Epitope mapping by amide hydrogen/deuterium exchange coupled with immobilization of antibody, on-line proteolysis, liquid chromatography and mass spectrometry. Rapid. Commun. Mass. Spectrom. 23 (5), 639-647 (2009).
- Pacholarz, K. J., Garlish, R. A., Taylor, R. J., Barran, P. E. Mass spectrometry based tools to investigate protein-ligand interactions for drug discovery. Chem. Soc. Rev. 41 (11), 4335-4355 (2012).
- Houde, D., Peng, Y., Berkowitz, S. A., Engen, J. R. Post-translational modifications differentially affect IgG1 conformation and receptor binding. Mol. Cell. Proteomics. 9 (8), 1716-1728 (2010).
- Houde, D., Berkowitz, S. A., Engen, J. R. The utility of hydrogen/deuterium exchange mass spectrometry in biopharmaceutical comparability studies. J. Pharm. Sci. 100 (6), 2071-2086 (2011).
- Dorman, G., Prestwich, G. D. Using photolabile ligands in drug discovery and development. Trends. Biotechnol. 18 (2), 64-77 (2000).
- Robinette, D., Neamati, N., Tomer, K. B., Borchers, C. H. Photoaffinity labeling combined with mass spectrometric approaches as a tool for structural proteomics. Expert. Rev. Proteomics. 3 (4), 399-408 (2006).
- Greenspan, L. Humidity fixed points of binary saturated aqueous solutions. Journal of Research of the National Bureau of Standards. 81A (1), 8(1977).
- Sophocleous, A. M., Zhang, J., Topp, E. M. Localized hydration in lyophilized myoglobin by hydrogen-deuterium exchange mass spectrometry. 1. Exchange mapping. Mol. Pharm. 9 (4), 718-726 (2012).
- Keppel, T. R., Jacques, M. E., Young, R. W., Ratzlaff, K. L., Weis, D. D. An efficient and inexpensive refrigerated LC system for H/D exchange mass spectrometry. J. Am. Soc. Mass. Spectrom. 22 (8), 1472-1476 (2011).
- Gasteiger, E., et al. ExPASy: The proteomics server for in-depth protein knowledge and analysis. Nucleic. Acids. Res. 31 (13), 3784-3788 (2003).
- Sophocleous, A. M., Topp, E. M. Localized hydration in lyophilized myoglobin by hydrogen-deuterium exchange mass spectrometry. 2. Exchange kinetics. Mol. Pharm. 9 (4), 727-733 (2012).
- Moorthy, B. S., Schultz, S. G., Kim, S. G., Topp, E. M. Predicting Protein Aggregation during Storage in Lyophilized Solids Using Solid State Amide Hydrogen/Deuterium Exchange with Mass Spectrometric Analysis (ssHDX-MS). Mol. Pharm. 11 (6), 1869-1879 (2014).
- Wang, W. Lyophilization and development of solid protein pharmaceuticals. Int. J. Pharm. 203 (1-2), 1-60 (2000).
- Sarciaux, J. M., Mansour, S., Hageman, M. J., Nail, S. L. Effects of buffer composition and processing conditions on aggregation of bovine IgG during freeze-drying. J. Pharm. Sci. 88 (12), 1354-1361 (1999).
- Li, Y., Williams, T. D., Schowen, R. L., Topp, E. M. Characterizing protein structure in amorphous solids using hydrogen/deuterium exchange with mass spectrometry. Anal. Biochem. 366 (1), 18-28 (2007).
- Sinha, S., Li, Y., Williams, T. D., Topp, E. M. Protein conformation in amorphous solids by FTIR and by hydrogen/deuterium exchange with mass spectrometry. Biophys. J. 95 (12), 5951-5961 (2008).
- Iyer, L. K., Moorthy, B. S., Topp, E. M. Photolytic labeling to probe molecular interactions in lyophilized powders. Mol. Pharm. 10 (12), 4629-4639 (2013).
- Hentze, N., Mayer, M. P. Analyzing protein dynamics using hydrogen exchange mass spectrometry. J. Vis. Exp. (81), e50839(2013).
- Kaltashov, I. A., Bobst, C. E., Abzalimov, R. R. H/D exchange and mass spectrometry in the studies of protein conformation and dynamics: is there a need for a top-down approach. Anal. Chem. 81 (19), 7892-7899 (2009).
- Jumper, C. C., Schriemer, D. C. Mass spectrometry of laser-initiated carbene reactions for protein topographic analysis. Anal. Chem. 83 (8), 2913-2920 (2011).
- Li, Y., Williams, T. D., Topp, E. M. Effects of excipients on protein conformation in lyophilized solids by hydrogen/deuterium exchange mass spectrometry. Pharm. Res. 25 (2), 259-267 (2008).
- Li, Y., Williams, T. D., Schowen, R. L., Topp, E. M. Trehalose and calcium exert site-specific effects on calmodulin conformation in amorphous solids. Biotechnol. Bioeng. 97 (6), 1650-1653 (2007).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados